Влияние оксидов 3d-элементов на фазовое превращение анатаз - рутил
Автор: Белая Елена Александровна, Викторов Валерий Викторович, Жеребцов Дмитрий Анатольевич, Колмогорцев Алексей Михайлович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 1 т.10, 2018 года.
Бесплатный доступ
Изучено влияние оксидов 3d-элементов на фазовые превращения анатаза в рутил. Показано, что добавки соответствующих оксидов являются рутилирующими, независимо от способа синтеза исходного диоксида титана анатазной модификации. Оксид никеля эффективнее снижает начальную температуру фазообразования и оказывает более сильный рутилирующий эффект, чем оксид хрома. Температура полиморфного превращения зависит от предыстории как оксида никеля (II), так и оксида титана (IV).
Фазовые превращения, твердые растворы, диоксид титана, анатаз, рутил, оксид хрома, оксид никеля
Короткий адрес: https://sciup.org/147160419
IDR: 147160419 | УДК: 546.865+547.53.024+548.312.5 | DOI: 10.14529/chem180101
Текст научной статьи Влияние оксидов 3d-элементов на фазовое превращение анатаз - рутил
Несмотря на многочисленные работы, посвященные фазовому переходу в диоксиде титана, интерес к этой системе не ослабевает до сих пор. Диоксид титана находит очень широкое применение, благодаря своим уникальным физико-химическим свойствам. Он используется в производстве пигментов, оптических материалов, фотокатализаторов, диэлектрической керамики и т. д. [1, 2].
Как правило, чаще используется рутильная модификация ТiO 2 , получаемая длительным прокаливанием анатаза. Хотя установлено, что при заданном соотношении анатазной и рутильной составляющей отмечается повышенная фотокаталитическая активность титаноксидного материала по сравнению с материалом, состоящим только из одной кристаллической фазы [3].
Известно, что фазовое превращение анатаз в рутил существенно зависит от условий синтеза, чистоты исходных компонентов и сопутствующих примесей, а также типа подложки в случае синтеза пленки TiO 2 [4, 5]. Однако различные примеси могут сыграть как отрицательную, так и положительную роль. Хорошо известно, что свойства фотокатализатора диоксида титана могут быть изменены путем введения небольших количеств примесей в его структуру [6, 7].
Все металлы или их оксиды по степени влияния на фазовый переход анатаз – рутил можно условно разделить на две группы: рутилирующие и, в противоположность им, ингибирующие фазовый переход анатаз-рутил . Так, трансформация анатаза в рутил ускорялась при содержании Nb, Cr, Si и Fe в TiO 2 . Установлено, что 1,0 мол. % NiO, CoO, MnO 2 , Fe 2 O 3 или CuO способствует превращению анатаза в рутил и росту зерен TiO 2 . Фазовая трансформация анатаза в рутил ускорялась также в зависимости от содержания хрома (> 10 ммоль %), железа, кремния и особенно смеси ниобия и хрома [8].
Оксид хрома один из хромофорных легирующих добавок к керамическому пигменту ТiO 2 , которые используются для улучшения его фотокаталитических характеристик [9, 10]. Поскольку ионный радиус Cr3+ (0,755 нм) немного больше, чем у Ti4+ (0,745 нм), ионы Cr3+ могут быть легко включены в решетку TiO2 и такое легирование не оказывает заметного влияния на кристаллические размеры анатаза и рутила [11]. Диоксид титана с оксидом хрома может образовывать твер-
Неорганическая химия дые растворы до 5 масс. % [12, 13], хотя в [6] сообщалось, что растворимость хрома в TiO2 возрастает с увеличением давления синтеза. TiO2 способен вмещать до 15,3 масс. % Cr2O3 при 3 GPa и 1300 ºC по сравнению с 5,7 масс. % при атмосферном давлении при той же температуре.
Легирование Cr3+ может эффективно способствовать образованию рутила и одновременно сдерживать образование анатаза, а также для регулирования отношения анатаза к рутилу [11].
Однако повышение соотношения титан – хром до 1:10 приводит к стабилизации анатазной модификации, как сообщают авторы, путем включения ионов Cr3+ в решетку ТiO2, что подтверждается уменьшением размеров кристаллитов. Такая стабилизация формы анатаза значима с точки зрения катализа, так как известно, что анатазная модификация каталитически более активна, чем рутильная [14].
Как и оксид хрома, оксид никеля усиливает кристаллографическую перегруппировку в TiO 2 и способствует понижению температуры фазового перехода анатаз – рутил [9 , 15, 16] .
Несмотря на большой объем информации, посвященной легированию диоксида титана различными металлами и их влиянию на фазовый переход, встречается много противоречий о влиянии тех или иных добавок. Чаще всего сравнивать данную информацию сложно из-за различных методов синтеза диоксида титана, в одних работах это керамический способ получения, в других золь-гель синтез и т. д. [8, 17–19].
Целью данной работы является исследование влияния ионов хрома и никеля на фазовый переход анатаз – рутил, а также изучение влияния предыстории получения исходных оксидов TiO 2 , NiO и Cr 2 O 3 на этот фазовый переход.
Экспериментальная часть
Для проведения исследования в качестве исходных препаратов брали диоксид титана анатазной и рутильной модификации, Cr 2 O 3 , NiCO 3 и NiNO 3 ⋅ 6H 2 O марки ч. д. а.
Оксид титана (IV), анатазной модификации получали двумя способами:
-
1. Синтез 1 : прокаливанием гидролизного оксида титана (ГДТ) при 600 °С в течение 2 часов. В свою очередь, ГДТ получали термическим гидролизом растворов сульфатных соединений Ti (IV). Гидролиз проводили в присутствии анатазных зародышей, которые являлись центрами образования первичных частиц ГДТ в процессе его гидролиза;
-
2. Синтез 2 : путем гидролиза TiCl 4 , детально описанным в [20];
Рутильную модификацию TiO2 получали путем прокаливания анатазной модификации при 1000 °С в течение 3 часов.
Химический анализ диоксида титана на примеси проводили на спектрометре PGS 2. Результаты анализа оксида титана представлены в табл. 1.
Таблица 1
Химический состав оксида титана, синтезированного из ГДТ и TiCl 4
|
Способ получения TiO2 (анатаз) |
Анализируемые элементы, масс. % |
||||||
|
As |
Bi |
Cu |
Pb |
Sb |
Sn |
Fe* |
|
|
ГДТ |
0,0057 |
0,0002 |
0,00023 |
0,0001 |
0,0005 |
0,0003 |
0,057 |
|
TiCl 4 |
0,0043 |
0,0002 |
0,00013 |
0,0001 |
0,0005 |
0,0002 |
0,011 |
* – данный показатель контролировался атомно-эмиссионным методом на ARL 3410.
Оксид никеля получали термолизом основного карбоната и 6-водного нитрата никеля. Выбор основного карбоната и нитрата в качестве прекурсора оксида никеля был основан на примерно одинаковой температуре разложения этих солей (t разл ~380 °C) и однородности распределения размеров частиц при термолизе соли. Синтез оксида никеля из нитрата и основного карбоната никеля проводили при 800 °С в течение 3 ч.
Чистоту веществ контролировали на спектрометре PGS 2 и рентгеноспектральном анализаторе СРМ 25. Результаты анализа оксида никеля представлены в табл. 2.
Исходные механические смеси соответствующих оксидов готовили тщательным перемешиванием предварительно синтезированного оксида титана (IV) и оксида хрома (III) или оксида ни- келя в агатовой ступке до получения порошков однородного цвета, которые затем исследовали различными физико-химическими методами.
Таблица 2
Химический состав оксида никеля, синтезированного из основного карбоната и нитрата никеля
|
Способ получения NiO |
Анализируемые элементы, масс. % |
|||||
|
As |
Bi |
Cd |
Co* |
Cu* |
P |
|
|
NiCO 3 |
0,000229 |
0,000165 |
0,000323 |
0,0167 |
0,00786 |
0,000765 |
|
NiNO 3 ⋅ 6H 2 O |
0,000300 |
0,000062 |
0,000474 |
0,0234 |
0,00451 |
0,000895 |
|
Анализируемые элементы, масс. % |
||||||
|
Sb |
Sn |
Zn |
Fe* |
Mg |
Si |
|
|
NiCO 3 |
0,00016 |
0,000085 |
0,000273 |
0,00062 |
0,00079 |
0,00752 |
|
NiNO 3 ⋅ 6H 2 O |
0,00018 |
0,000068 |
0,00161 |
0,00213 |
0,00203 |
0,01980 |
* – данные показатели контролировались на PGS-2 и СРМ-25.
Смеси оксидов системы TiO 2 – Cr 2 O 3 с содержанием 5 масс. % прокаливали в фарфоровых тиглях в интервале температур 600–1200 °С в течение 1–2 часов.
Для системы TiO2 – NiO было приготовлено 4 смеси:
Cмесь I : 95 масс. % TiO 2 (синтез 1) – NiO (5 масс. %), полученный из Ni(NO 3 ) 2 ,
Cмесь II : 95 масс. % TiO 2 (синтез 1) NiO (5 масс. %), синтезированный из основного карбоната.
Смесь III: 95 масс. % TiO 2 (синтез 2) –NiO (5 масс. %), полученный из Ni(NO 3 ) 2 ,
Cмесь IV : 95 масс. % TiO 2 (синтез 2) NiO (5 масс. %), синтезированный из основного карбоната.
Прокаливание вели аналогично смеси TiO 2 и Cr 2 O 3 .
Фазовый состав и средний размер кристалликов ( d ), рассчитанный из микроскопических данных и по ширине рентгеновских дифракционных максимумов, составлял для NiO d ≈ 20 нм; для α-Cr2О3 d ≈ 70 нм; для TiO2 анатазной и рутильной модификаций d ≈ 20 нм и d ≈ 60 нм соответственно.
Химический анализ исходных смесей проводили на атомно-эмиссионном спектрометре ARL 3410, рентгеноспектральном анализаторе СРМ 25 и спектрометре PGS 2 по стандартным методикам. Количественный и качественный фазовый анализ образцов проводили на дифрактро-метре ДРОН–3М с Kα-излучением меди. Спектры-ИК исследуемых образцов регистрировали на ИК-спектрометре TENSOR фирмы Bruker в области волновых чисел 400–4000 см–1. Термический анализ (ТГ-ДСК) проводили на термоанализаторе Netzch 449С Jupiter со скоростью нагрева 10 °C/мин до 1100 ºC в корундовых тиглях в токе аргона.
Обсуждение результатов
На рис. 1–3 представлены термоаналитические кривые анатаза, полученного из различных предшественников.
Как видно из рис. 1, относительное изменение массы ГДТ в интервале температур 20– 1100 °С составляет 21,0 %. На кривой ДСК фиксируются два широких эндоэффекта с максимумами при 150 и 625 °С, сопровождающиеся уменьшением массы, причем тепловым эффектам соответствует потеря массы с максимальной скоростью, согласно данным дифференциальной термогравиметрии, при 137 и 620 °С. На кривой ДСК также имеется экзоэффект при 950 °С.
Первый из эндоэффектов обусловлен процессом дегидратации, а второй – процессом разложения сульфат-ионов. Экзоэффект при 950 °С, обусловлен переходом анатаза в рутил.
Согласно данным термического анализа анатаза, полученного из ГДТ, в интервале температур 32–200 °С фиксируется небольшой эндоэффект, который обусловлен удалением воды (рис. 2). Изменение массы в указанном температурном интервале составляет 1,00 %.
Неорганическая химия
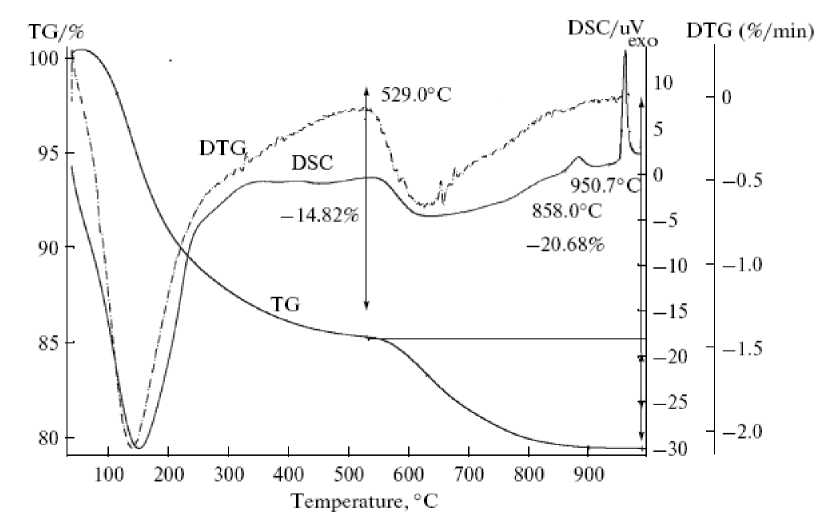
Рис. 1. Результаты термического анализа образца ГДТ
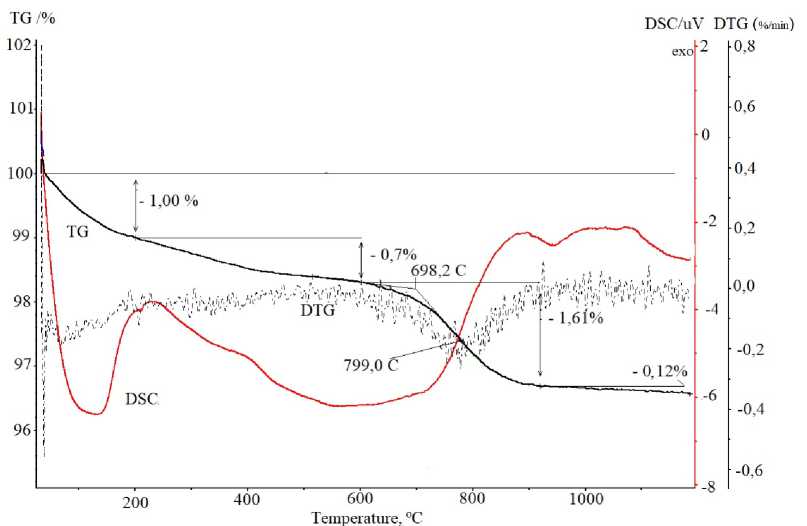
Рис. 2. Результаты термического анализа образца анатаза, полученного из ГДТ
В интервале температур 200–600 °C не наблюдаются каких-либо эндо- или экзоэффектов. Потеря массы в указанном температурном интервале составляет 0,70 %. Активная десульфатиза-ция образцов начинается при температуре порядка 700–710 °С и достигает максимальной скорости при 780 °С. Слабый экзоэффект при температуре ≈850 ºC может быть отнесен к началу полиморфного превращения анатаза в рутил.
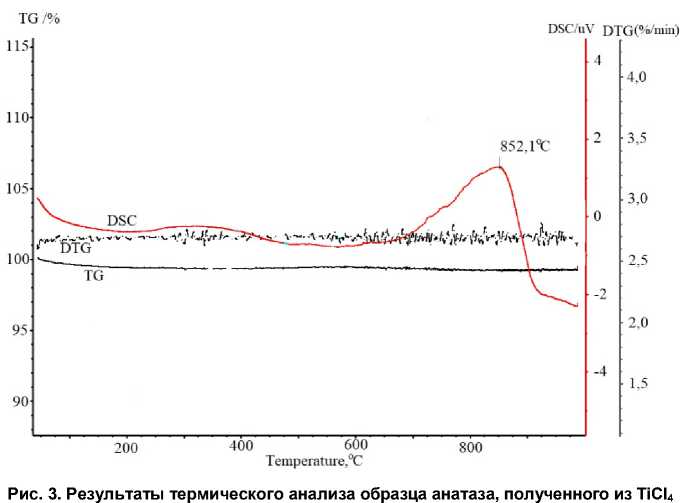
Для анатаза, полученного термолизом TiCl 4 (рис. 3), каких-либо экзоэффектов, связанных с десорбцией, не обнаружено. Экзоэффект в области 852 ºC, по-видимому, связан с началом фазового перехода анатаз – рутил.
Согласно данным рентгенофазового анализа, фазовый переход для чистых оксидов титана различен и зависит от предыстории их получения. Так, для TiO 2 (ГДТ) фазовый переход начинается при температуре 850 °C и заканчивается при 950 и 900 ºC в течение 1 часа и 3 часов, тогда как фазовый переход анатаз – рутил TiO 2 (TiCl 4 ) заканчивается при температуре на 100 °C выше (рис. 4).
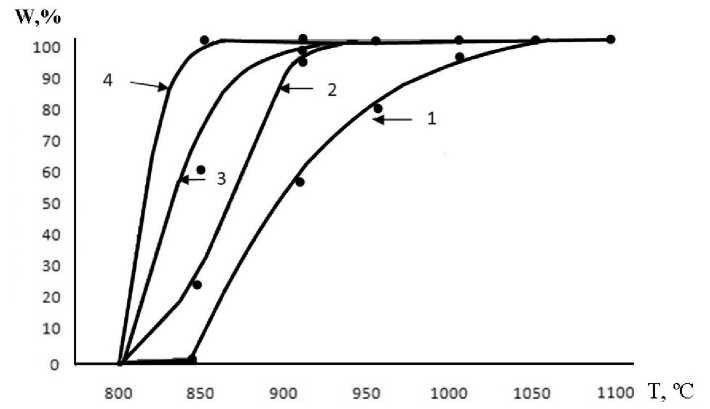
Рис. 4. Массовая доля рутила, образующегося при изотермической выдержке из исходных оксидов:
1 – TiO 2 (синтез 2) после 1 ч прокаливания; 2 – TiO 2 (синтез 1) после 1 ч прокаливания;
3 – TiO 2 (синтез 2) после 3 ч прокаливания; 4 – TiO 2 (синтез 1) после 3 ч прокаливания
Проведенные исследования полученных смесей показывают, что термоаналитические кривые смесей I–IV для системы TiO2 – NiO и соответствующего чистого анатаза практически идентичны. Разница заключается в эндоэффектах в температурном интервале 200 – 400 °C, связанных с разложением нитрата, либо основного карбоната никеля. На рис. 5 для примера приведены термоаналитические кривые для смеси II.
На термоаналитических кривых образца, содержащего 5 масс. % Cr 2 O 3 и 95 масс. % TiO 2 (рис. 6), экзоэффект, соответствующий фазовому переходу анатаз – рутил, осуществляется в широком температурном интервале, а зародыши рутила образуются при более низких температурах, чем в чистом анатазе.
Неорганическая химия
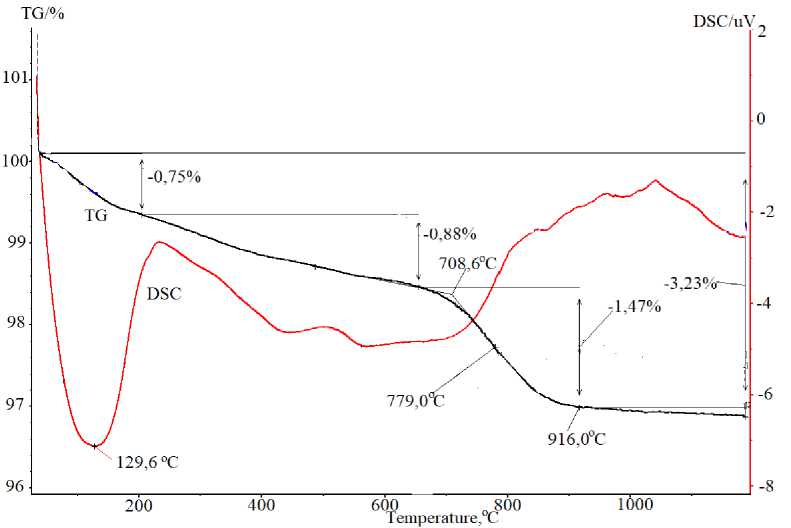
Рис. 5. Результаты термического анализа смеси 95 масс. % TiO 2 – 5 масс. % NiO (смесь II)
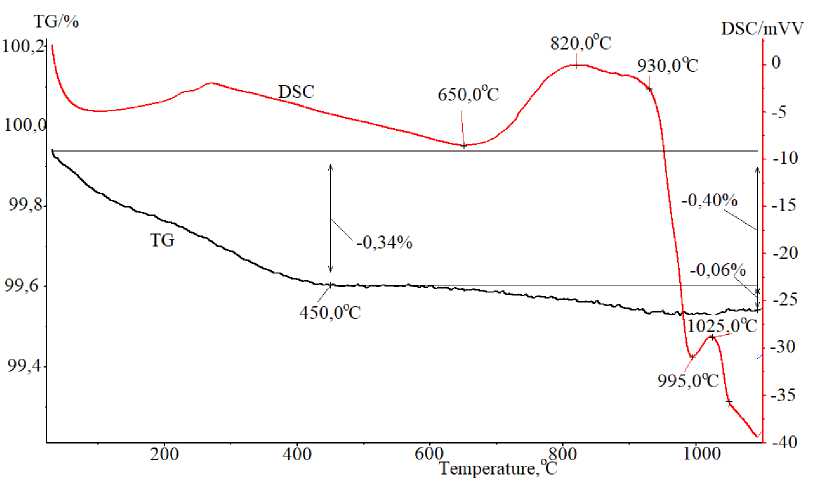
Рис. 6. Результаты термического анализа смеси 95 масс. % TiO 2 – 5 масс. % Cr 2 O 3
Исследование ИК-спект р о в исх о дны х и про кал енных обр аз цо в в интервале волновых чисел 400 – 4000 см–1 , п ред с т а в ле н н ы х н а рис. 7, показало, что в ИК-спектре исходного TiO2 присутствуют п ол ос ы п о гло щ е н и я с в о лн ов ыми чи с ла ми 5 50, 1 630 с м –1, которые соответствуют колебаниям связей Ti-O-Ti и Ti-OH-Ti.
Исследуя ИК- сп е к тры, м ожно сделать вывод, что после прокаливания м е х а н и че с к а я с месь TiO2–NiO име ют п одоб ные ИК -спектры, вид которых сохраняется вне зависимости от способа получения оксида никеля , и с п ол ьз ов а н н ого д л я и х п ри готов ле н и я.
В спектре Cr 2 O 3 ре гис трир уются полосы в области волновых чисел 65 0 (к о ле б а н и я Cr-O) и 2400 (колебания ОН–- г рупп ) с м–1 (рис. 8). Однако при совместном прокаливании оксидов почти п ол н ос тью и с че за е т п оло с а п ог лощ е н и я с волновым числом 2400 см–1, что указывает на участие связи Ме–ОН– в о в за и мод е й с тв и и .
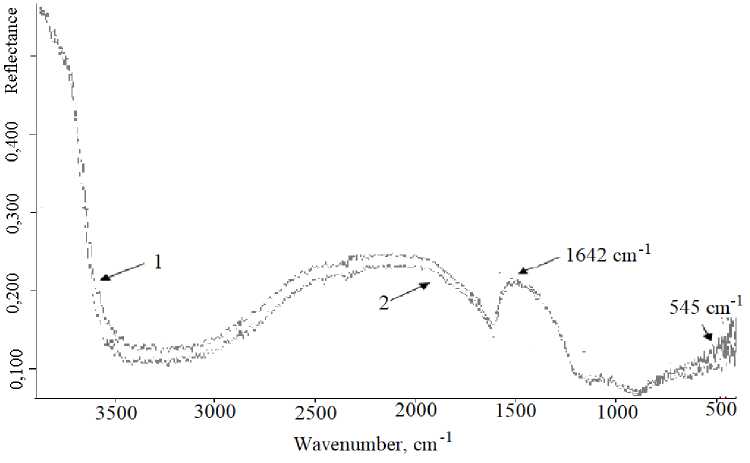
Рис. 7. ИК-спектры: 1 – исходного TiO 2 (синтез 1);
2 – механической смеси 95 масс. % TiO 2 (синтез 1) – 5 масс. % NiO
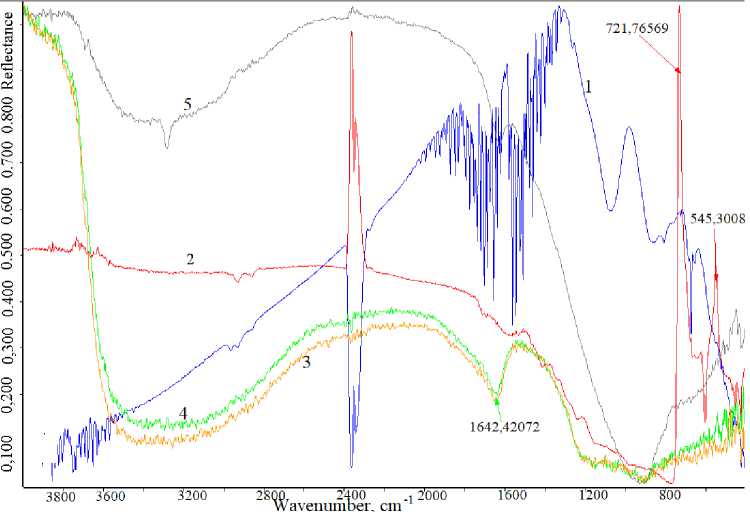
Рис. 8. ИК-спектры образцов TiO 2 и Cr 2 O 3 :
1 – фон; 2 – Cr 2 O 3 ,; 3 – TiO 2 (синтез 1); 4 – механическая смесь 95 масс. % TiO 2 (синтез 1) – 5 масс. % Cr 2 O 3 ,;
5 – смесь 95 масс. % TiO 2 (синтез 1) – 5 масс. % Cr 2 O 3 после прокаливания при 850 °С
Анатаз и механическая смесь TiO 2 –Cr 2 O 3 имеют подобные ИК-спектры, вид которых сохраняется до температуры 500 ºС. При прокаливании смеси TiO2–Cr2O3 в интервале температур от 600 до 850 ºС появляется линия с волновым числом 3568 см–, интенсивность которой с увеличением температуры прокаливания возрастает почти на два порядка. При дальнейшей термообработке интенсивность линии 3568 см–1 резко уменьшается и становится мало заметной для образца, прокаленного при 1000 ºС , спектр которого подобен ИК-спектру рутила.
В ходе экспериментов установили, что Cr 2 O 3 не образует твердые растворы с анатазом, независимо от способа его получения, до тех пор, пока не произойдет полиморфное превращение анатаза в рутил.
Неорганическая химия
Методом ренгенофазового анализа установили, что на начальных стадиях процесса с добавлением и без добавления NiO и Cr2O3 идут процессы формирования кристалликов анатаза и их рост. Интенсивное растворение оксида хрома и формирование титаната никеля начинается только при появлении рутильной фазы.
Следует отметить, что добавки оксида хрома и оксида никеля существенно влияют на временной и температурный интервал фазового перехода анатаза в рутил.
Для примера на рис. 9–10 приведены зависимости степени превращения анатаз–рутил для чистого оксида TiO2 (синтез 1) и для смесей диоксида титана с оксидом хрома или оксидами никеля.
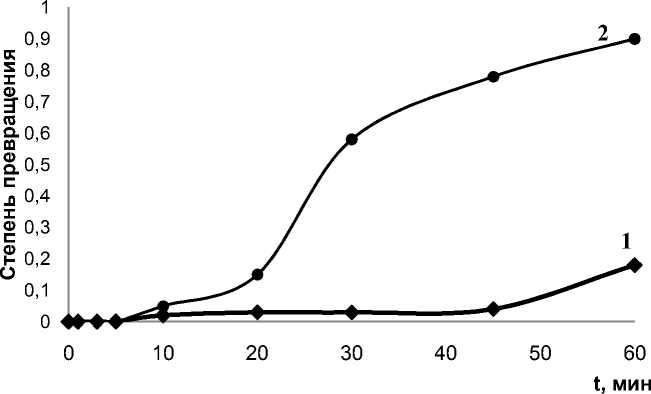
Рис. 9. Фазовый переход анатаза в рутил при изотермической выдержке 850 °C: 1 – TiO 2 (рутил) без добавки Cr 2 O 3 ; 2 – TiO 2 (рутил) c добавкой Cr 2 O 3
Появление рутильной фазы в чистом анатазе, полученном при синтезе 1, наблюдается на 40-й минуте прокаливания при температуре 850 °C, а с добавками Cr 2 O 3 формирование рутильной фазы наблюдали на 20 минут раньше при той же температуре (рис. 9) и на 10 мин раньше при 900 °С.
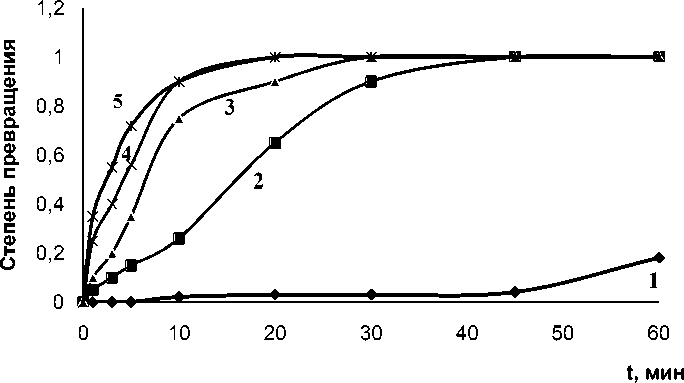
Рис. 10. Фазовый переход анатаза в рутил при изотермической выдержке 850 °C: 1 – TiO 2 (рутил) без добавки NiO; 2 – смесь II; 3 – смесь I; 4 – смесь IV; 5 – смесь III
При добавках оксида никеля рутилирующий эффект более заметен. Так при температуре 850 °С (рис. 10) формирование рутильной фазы наблюдали на 40 минут раньше. Кроме того, в случае добавок NiO температурный и временной сдвиг фазового превращения анатаз-рутил су- щественно зависит от предистории синтеза оксида никеля. Так для NiO, полученного из нитрата никеля, рутильная фаза появляется раньше, чем с NiO, синтезированного из основного карбоната. Самое эффективное снижение наблюдается для смеси III.
Таким образом, оксид никеля и оксид хрома являются добавками, стимулирующими образование рутильной фазы, причем ионы никеля понижают начальную температуру эффективнее и оказывают более сильный рутилирующий эффект, чем ионы хрома.
Заключение
Методами рентгенофазового и термического (ТГ–ДСК) анализов исследовано влияние NiO и Cr 2 O 3 на фазовый переход анатаза в рутил.
Оксиды никеля и хрома являются рутилирующими добавками и уменьшают температуру фазового перехода анатаза в рутил. Причем оксид никеля эффективнее снижает начальную температуру фазообразования и оказывает более сильный рутилирующий эффект, чем оксид хрома.
Температура полиморфного превращения зависит от предыстории получения как оксида никеля (II), так и оксида титана (IV). Титанат никеля NiTiO 3 в температурном интервале 700–850 °C образуется только из анатаза, при этом анатаз полностью переходит в рутил.
Твердый раствор Cr 2 O 3 в TiO 2 образуется только на основе рутильной модификации.
Список литературы Влияние оксидов 3d-элементов на фазовое превращение анатаз - рутил
- Викторов, В.В. Фазовые превращения в системе TiO2 -NiO/В.В. Викторов, Е.А. Белая, А.С. Сериков//Неорганические материалы. -2012.-Т. 48, № 5. -С. 570-575.
- Шабанова, Н.А. Химия и технология нанодисперсных оксидов/Н.А. Шабанова, В.В. Попов, П.Д. Саркисов. -М.: ИКЦ «Академкнига», 2006. -309 с.
- Артемьев, Ю.М. Введение в гетерогенный фотокатализ/Ю.М. Артемьев, В.К. Рябчук.-СПб.: Изд-во С.-Петерб. ун-та, 1999. -340 с.
- Термически стимулированные превращения дисперсного диоксида титана/А.С. Чернов, Ю.М. Коштял, А.А. Малков и др.//Изв. Санкт-Петербургского государственного технологического института. -2012. -№ 15. -С. 47-50.
- Miszczak, S. Anatase-rutile transformation of TiO2 sol-gel coat-ings deposited on different substrates/S. Miszczak, В. Pietrzyk//Ceram. International. -2015. -V. 41. -Р. 7461-7465.
- Escudero, А. Chromium incorporation into TiO2 at high pressure/А. Escudero, F. Langenhorst//Journal of Solid State Chemistry. -2012. -V. 190. -P. 61-67.
- Enhancement of photocatalytic properties of Cr2O3-TiO2 mixed oxides prepared by sol-gel method/J. Young-Soo, K. Kyung-Hwa, J. Tae-Young//Current Applied Physics. -2011. -V.11. -P. 358-361 DOI: 10.1016/j.cap.2010.08.001
- Karvinen, S. The effects of trace elements on the crystal properties of TiO2/S. Karvinen//Solid State Sciences. -2003. -V. 5 -P. 811-819.
- The role of counterions (Mo, Nb, Sb, W) in Cr-, Mn-, Ni-and V-doped rutile ceramic pigments. Part 1. Crystal structure and phase transformations/F. Matteucci, G. Cruciani, M. Dondi//Ceram. International. -2006. -V. 32. -P. 385-392 DOI: 10.1016/j.ceramint.2005.03.014
- An aqueous sol-gel synthesis of chromium (III) doped mesoporous titanium dioxide for visible light photocatalysis./B. Kanakkanmavudi, S. Ghosh, S. Sankar.//Material Research Bulletin. -2011. -V. 46. -P. 914-921 DOI: 10.1016/j.materresbull.2011.02.030
- Baozhu, T. One-step preparation, characterization and visible-light photocatalytic activity of Cr-doped TiO2 with anatase and rutile bicrystalline phases/T. Baozhu, L. Chunzhong, Z. Jinlong. Journal of Chemistry Engineering. -2012.-V. 191. -P. 402-409.
- Florke, O.W. Andersson Phasen, dichteste Packing und Wadsley Defekte im System Ti-Cr-О./O.W. Florke, C.W. Lee//Journal Solid State Chem. -1970. -V. l, № 3-4. -P. 445-453.
- Бережной, А.С. Многокомпонентные системы оксидов/А.С. Бережной. -Киев: Наукова думка, 1970. -544 c.
- Khaleel, A. Structural and textural characterization of sol-gel prepared nanoscale titanium-chromium mixed oxides/A. Khaleel, I. Shehadi, A. Mariam//Journal of Non-Crystalline Solids.-2010. -V. 356.-P. 1282-1287 DOI: 10.1016/j.jnoncrysol.2010.04.031
- Riyas, S. Rutilation in nickel oxide-doped titania prepared by different methods/S. Riyas, G. Krishnan, Das P.N. Mohan//Ceram. International. -2006. -V. 32. -P. 593-598 DOI: 10.1016/j.ceramint.2005.04.016
- Young, Ku. Characterization of coupled NiO/TiO2 photocatalyst for the photocatalytic reduction of Cr (VI) in aqueous solution/Ku Young, Lin Chia-Nan, Hou Wei-Ming//Journal of Molecular Catalysis A: Chemical. -2011. -V. 349. -Р. 20-27 DOI: 10.1016/j.molcata.2011.08.006
- Study of the TiO2-Cr2O3 system for photoelectrolytic decomposition of water/M. Radecka, K. Zakrzewska, M. Wierzbicka//Solid State Ionics. -2003. -V. 157. -P. 379-386 DOI: 10.1016/S0167-2738(02)00236-9
- Sol-gel route to synthesize titania-silica nano precursors for photoactive particulates and coatings/V.S. Smitha, K.A. Manjumol, K.V. Baiju//Journal of sol-gel Science and Technology. -2010. -V. 5. -P. 203-211 DOI: 10.1007/s10971-010-2178-9
- Control of micropore size in supermicroporous titania-chromia system TiO2-Cr2O3/W. Delouis, M. Sanchez, B. Shpeizer//Inorganic Chemistry Communications. -2006. -V. 9. -P. 1136-1140 DOI: 10.1016/j.inoche.2006.07.031
- Пат. 2049066 Российская Федерация, C01G23/04; С1. Способ получения гидроксида титана/Э.Е. Мовсесов, Л.П. Седова, Т.Н. Гришина и др.; заявитель и патентообладатель АО «Соликамский магниевый завод». -№ 92006375/26; заявл. 16.11.92; опубл. 27.11.95, Бюл. № 7. -4 с.


