Влияние оксопроизводных азотсодержащих гетероциклов CBR-384 и CBR-386 на дыхательную активность и уровень внеклеточных серосодержащих соединений у бактерий Escherichia coli
Автор: Триандафилова Г.А., Тюленев А.В., Музыка Н.Г., Смирнова Г.В., Октябрьский О.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2023 года.
Бесплатный доступ
Изучена биологическая активность двух представителей оксопроизводных азотсодержащих гетероциклов CBR-384 и CBR-386, планируемых к использованию в качестве лекарственных препаратов, на растущие аэробно грамотрицательные бактерии Escherichia coli. Соединение CBR-384 полностью ингибировало скорость роста и накопление биомассы, оцениваемое по измерению оптической плотности (OD600). Непрерывная регистрация растворенного кислорода (dO2) электродом Кларка прямо в растущей культуре показало, что CBR-384 вызывал быстрое и необратимое повышение уровня кислорода в среде, что свидетельствовало о снижении дыхательной активности клеток. По времени, фаза быстрого падения дыхания совпадала с фазой снижения скорости роста. В аэробных культурах E. coli дыхательная активность тесно связана с генерацией мембранного потенциала. Однако при действии CBR-384 было обнаружено лишь небольшое, но статистически значимое снижение мембранного потенциала, измеряемого с помощью флуоресцентного красителя DiBAC4(3). Известно, что в аэробных культурах E. coli, растущих на сульфате, как источнике серы, стресс-индуцируемое ингибирование роста сопровождается увеличением экстраклеточного глутатиона (GSH) и экспортом H2S. Использование сульфид-специфического электрода выявило, что при остановке роста E. coli при действии CBR-384 также наблюдается экспорт сульфида в среду. В этих условиях отмечено также увеличение внеклеточного GSH. Влияние CBR-386 на E. coli, оцениваемое по четырем указанным параметрам, было выражено слабее. Различия в биологической активности CBR-384 и CBR-386 могут быть связаны с различиями их структур.
Escherichia coli, дыхание, мембранный потенциал, глутатион, h2s
Короткий адрес: https://sciup.org/147242770
IDR: 147242770 | УДК: 579.22 | DOI: 10.17072/1994-9952-2023-4-367-374
Текст научной статьи Влияние оксопроизводных азотсодержащих гетероциклов CBR-384 и CBR-386 на дыхательную активность и уровень внеклеточных серосодержащих соединений у бактерий Escherichia coli
Несмотря на большое разнообразие лекарственных веществ, присутствующих на мировом рынке, поиск и создание новых препаратов остается актуальной задачей. В первую очередь это связано с поиском более безопасных для организма человека веществ, обладающих пониженным общетоксическим действием и отсутствием побочных эффектов. В этой связи все большее внимание уделяется исследованию влияния лекарственных препаратов на микробиом человека [Marchesi, Ravel, 2015]. Активность микроорганизмов, входящих в микробиом, играет важную роль в пищеварении, секреции полезных метаболитов, в том числе витамина К и витаминов группы В. Изменения в составе микробиома коррелируют с заболеваниями желудочно-кишечного тракта (ЖКТ) и нервной системы [Kho, Lal, 2018; Rowland et al., 2018]. При пероральном применении лекарственного вещества происходит его взаимодействие с представителями кишечной микрофлоры, которое с одной стороны, может привести к изменению микробио-много состава. С другой стороны, бактерии способны к биотрансформации лекарственных препаратов, изменяя их фармакокинетические и фармакодинамические свойства. Возможно усиление токсичности препарата, либо, наоборот, его трансформация в активную молекулу [Enright et al., 2016]. В связи со сложностью культивирования in vitro отдельных представителей микробиома, первым шагом в прогнозировании взаимодействия лекарственного препарата с микробиомом может стать исследование влияния испытуемого соединения на таких хорошо изученных обитателей желудочно-кишечного тракта (ЖКТ), как Escherichia coli . Эта бактерия является симбионтом ЖКТ; в то же время известны патогенные штаммы E. coli , вызывающие ряд инфекционных заболеваний [White et al., 2011].
Цель настоящей работы – изучение влияния двух представителей оксопроизводных азотсодержащих гетероциклов (ОАГ), планируемых к использованию в качестве лекарственных препаратов, на ростовые параметры, дыхательную активность, мембранный потенциал и уровень двух внеклеточных серосодержащих соединений: глутатиона и сульфид-иона. Представители ОАГ, содержащие енаминоновый фрагмент (N–C=C–C=O), рассматриваются как универсальные блоки для создания новых биологически активных молекул. Среди представителей этой группы были обнаружены вещества, обладающие противо-микробной, анальгетической, противовоспалительной, противосудорожной, противораковой активностью [Boteva et al., 2019; J. Gao et al., 2023; Jiang et al., 2020].
Материалы и методы исследования
Штаммы бактерий и условия культивирования. В качестве объектов исследований использовали штаммы Escherichia coli BW25113 полученные из E. coli Genetic Stock Center (CGSC) и NM3021 (коллекция ЛФГМ). Бактерии выращивали в аэробных условиях на синтетической минимальной среде М9 (Na2HPO4 · 12H2O – 15.13 г/л; KH2PO4 – 3 г/л; NH4Cl – 1 г/л; NaCl – 0.5 г/л; MgSO4·7H2O – 0.246 г/л; CaCl2 – 0.011 г/л) [Miller, 1972] с добавлением 0.15%-ной глюкозы. После центрифугирования клетки из ночной культуры ресуспендировали в 100 мл свежей среды до значения оптической плотности при 600 нм OD600 = 0.05–0.07 и далее выращивали при 37ºС в колбах объемом 250 мл на качалках (ИБП РАН, Пущино) при частоте вращения 150 об/мин. Далее часть культуры пересевали в колбы на 250 мл и выращивали в условиях, описанных выше. За ростом бактерий следили по изменению OD600, измеряемому на фотометре КФК-3.
Удельную скорость роста культуры (μ) рассчитывали по формуле ln OD600 (t2 ) - ln OD600 (t1 )
ц = , t2 - t1
где OD 600 ( t 2 ) и OD 600 ( t 1 ) – оптическая плотность культуры, измеренная при длине волны 600 нм, во время t и t .
Изменения мембранного потенциала исследовали по методу [Wickens et al., 2000]. Бактериальную культуру (180 мкл) смешивали с 20 мкл раствора DiBAC 4 (3) с концентрацией 100 мкг/мл и выдерживали в темноте при 37°С в течение 10 мин. Затем 10 мкл образца наносили на предметное стекло с 1%-ной агарозой и исследовали с помощью флуоресцентного микроскопа Leica DM2000 (фильтр-система I3). Общее количество клеток подсчитывали в проходящем свете. Для каждого образца анализировали не менее 800 клеток.
Измерение парциального давления кислорода и уровня внеклеточного сульфид-иона. Уровень растворенного кислорода (dO 2 ) в культурах E. coli непрерывно измеряли непосредственно в колбах с помощью кислородного электрода Clarke InPro 6800 (Mettler Toledo). Для записи данных использовали контроллер dO 2 /pH ферментера BioFlo 110 (New Brunswick Scientific Co., США).
Концентрацию экстраклеточного сульфид-иона определяли с помощью сульфид-специфичного ионоселективного электрода ХС-S2--001 (Сенсорные Системы, Россия) и электрода сравнения и компьютерного pH/иономера cpX-2 (ИБП Пущино, Россия). Концентрацию сульфидов в среде рассчитывали по стандартной кривой, построенной с известными количествами Na 2 S [Tyulenev et al., 2018].
Определение концентрации внеклеточного глутатиона выполняли с помощью модифицированного метода Титца [Tietze, 1969; Smirnova, Oktyabrsky, 2012]. Суспензию клеток отбирали по 1.5 мл и пропускали через мембранный фильтр с размером пор 0.45 мкм. Измерение проводили с помощью метода рециркуляции 5,5'-дитиобис-(2-нитробензойной кислоты) (DTNB) – глутатионредуктазы. 240 мкл пробы добавляли к смеси 820 мкл буфера фосфата натрия (рН 7.5), 120 мкл DTNB и 6 мкл глутатионредуктазы. Анализ начинали добавлением 12 мкл HADPH на спектрофотометре Shimadzu UV-1700. Изменение OD 412 за 6-минутный период использовали для расчета общего глутатиона по калибровочным кривым, построенным по стандартным растворам глутатиона.
Статистическую обработку экспериментальных данных осуществляли с помощью пакета программ Microsoft Excell и Statistica 6.0, вычисляя среднее значение, стандартную ошибку и доверительный интервал. Каждый результат показан как среднее значение не менее трех независимых экспериментов ± стандартная ошибка среднего.
Результаты и их обсуждение
Слежение за изменениями оптической плотности (OD 600 ) и удельной скорости роста (μ) показало, что в описываемых условиях СBR-384 через 15 мин. после добавления к растущим E. coli полностью и необратимо ингибировал рост бактерий. Ингибирующее действие СBR-386 на рост E. coli было выражено в меньшей степени. В конце инкубации оптическая плотность и скорость роста культуры, обработанной этим соединением, составляли 56 и 35% соответственно от значения в контроле (Р < 0.05). Выявляются две фазы изменения скорости роста при действии СBR-386 и в контроле, при этом, в первом случае, фазовые изменения выражены в большей степени (рис. 1).
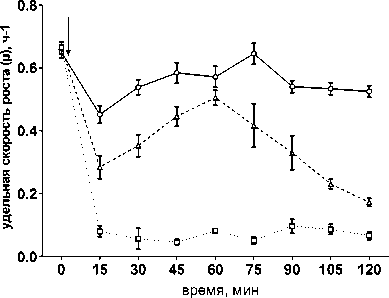
Для изучения влияния CBR-384 и CBR-386 на дыхание бактерий было прослежено изменение содержания растворенного кислорода в растущей культуре E. coli 25113 при действии этих веществ, в концентрациях равных минимальной ингибирующей концентрации (МИК). В культурах без добавления испытуемых соединений накопление биомассы в растущих E. coli сопровождалось постепенным снижением растворенного кислорода (dO 2 ), связанным с его потреблением в процессе дыхания. Добавление CBR-384 приводило к быстрому и необратимому повышению уровня кислорода в среде (рис. 2), что свидетельствовало о снижении дыхательной активности клеток. По времени, фаза быстрого падения dO 2 совпадала с фазой снижения скорости роста (рис. 1Б).
В течение первых 15 мин. после добавления СBR-386 в растущую культуру E. coli уровень кислорода возрастал, свидетельствуя о снижении дыхательной активности. Затем бактерии возобновляли дыхание с той же скоростью, как в контрольной культуре, и через 60 мин. наблюдалось новое кратковременное ингибирование дыхания, после чего клетки вновь его восстанавливали (рис. 2). Примечательно, что временной активации дыхания через 15 мин. после добавления CBR-386, соответствовало такое же по времени увеличение скорости роста (рис. 1Б). В целом, наблюдаемые изменения dO2 указывают на то, что действие CBR-386 также сопровождалось снижением дыхательной активности E. coli, хотя и в меньшей степени, чем в случае с CBR-384. Это соответствует и меньшей бактериостатической активности CBR-386 по сравнению с CBR-384 (рис. 1).
А
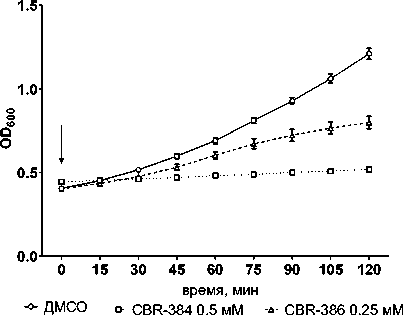
Рис. 1. Влияние CBR-384 и CBR-386 на накопление биомассы (А) и скорость роста (Б) бактерий E. coli BW25113
Б
ДМСО п- CBR-384 0.5 мМ CBR-386 0.25 мМ
[Effect of CBR-384 and CBR-386 on biomass accumulation (A) and growth rate (B) of E. coli BW25113 bacteria]
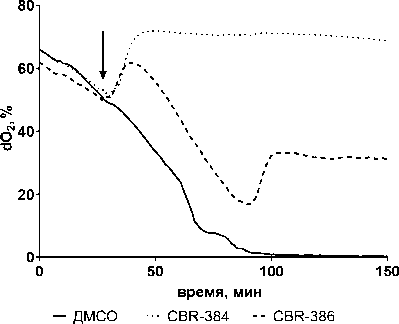
Рис. 2. Влияние CBR-384 и CBR-386 в концентрации, равной МИК, на содержание растворенного кислорода в растущей культуре E. coli BW25113
[Effect of CBR-384 and CBR-386 at the MIC concentration on the content of dissolved oxygen in a growing culture of E. coli BW25113]
Цитоплазматическая мембрана бактерий выполняет ряд важных функций, включая транспорт веществ и поддержание электрохимического градиента протонов. Диссипация мембранного потенциала может рассматриваться как один из показателей вредного действия факторов внешней среды. Изменение мембранного потенциала при действии соединений CBR-384 и CBR-386 в концентрациях, равных ½ МИК, оценивали с помощью потенциал-чувствительного флуоресцентного красителя DiBAC 4 (3). Отрицательно заряженный DiBAC 4 (3) не может проникнуть в активные клетки из-за своего внутреннего отрицательного заряда. Клетки, окрашенные DiBAC 4 (3), считаются деполяризованными клетками.
В отсутствие какой-либо обработки доля флуоресцирующих клеток в культуре E. coli BW25113 составляла не более 2% и не менялась в процессе роста в периодической культуре. Наблюдалось небольшое, но статистически достоверное увеличение доли флуоресцирующих клеток (эквивалентное снижению мембранного потенциала) через 60 и 120 мин. соответственно после добавления CBR-384 и CBR-386 (рис. 3).
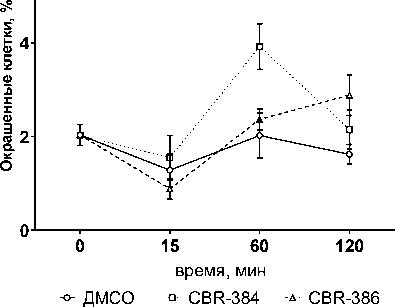
Рис. 3. Изменение мембранного потенциала при действии CBR-384 и CBR-386 на E. coli BW25113 [Changes in membrane potential under the action of CBR-384 and CBR-386 on E. coli BW25113]
В аэробных условиях генерация мембранного потенциала бактериями E. coli осуществляется, главным образом, за счет работы дыхательной цепи. В этой связи, обращает внимание тот факт, что при действии CBR-384 одновременно наблюдается увеличение числа клеток, потерявших мембранный потенциал, и значительное снижение дыхательной активности (см. рис. 2).
У E. coli , как и у других грамотрицательных бактерий, глутатион (GSH) выполняет роль главного редокс-буфера [Smirnova, Oktyabrsky, 2005]. Было показано, что при некоторых стрессовых воздействиях, сопровождающихся ингибированием роста, в культурах E. coli наблюдается значительное повышение внутри- и внеклеточного глутатиона [Smirnova et al., 2015]. Представляло интерес проверить этот эффект при действии CBR-384 и CBR-386.
В наших условиях, CBR-384 и CBR-386 также увеличивали уровень внеклеточного глутатиона. Наибольшее и статистически достоверное (Р < 0.05) увеличение внеклеточного глутатиона по сравнению с контролем наблюдалось в фазе быстрого ингибирования роста (рис. 4).
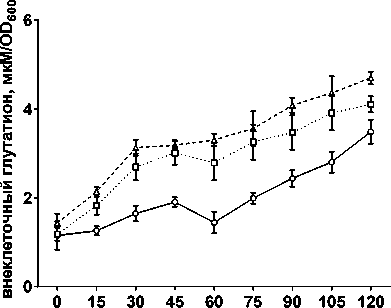
время, мин
ДМСО □ CBR-384 -Д. CBR-386
Рис. 4. Влияние CBR-384 и CBR-386 в концентрации, равной ½ МИК, на уровень внеклеточного глутатиона в растущей культуре E. coli BW25113
[Effect of CBR-384 and CBR-386 at ½ MIC concentration on the level of extracellular glutathione in a growing culture of E. coli BW25113]
Известно, что при росте E. coli на минимальных средах с глюкозой и сульфатом в качестве источника серы стресс-индуцируемые остановки роста сопровождаются увеличением в среде не только глутатиона, но и сульфид-ионов [Tyulenev et al., 2018].
При действии CBR-384 на растущую культуру E. coli BW2511 наблюдалось значительное изменение потенциала сульфид-специфичного электрода, свидетельствующее об увеличении уровня внеклеточного сульфида, и совпадающее по времени с моментом снижения скорости роста (см. рис. 1). Согласно пока- заниям электрода, примерно через 30 мин. после добавления CBR-384 уровень сульфида снижался до контрольного значения (рис. 5).
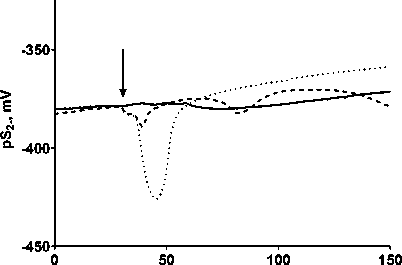
время, мин
ДМСО CBR-384 CBR-386
Рис. 5. Обработка растущих E. coli BW25113 соединениями CBR-384 и CBR-386 приводит к увеличению внеклеточного сульфид-иона
[Treatment of growing E. coli BW25113 with compounds CBR-384 and CBR-386 leads to an increase in extracellular sulfide ion]
При действии CBR-386 наблюдался значительно меньший двухфазный выброс сульфида, чем при действии CBR-384, что соответствовало более низкому бактериостатическому действию первого вещества (см. рис. 1).
Заключение
В настоящей работе изучалась биологическая активность в отношении бактерий Escherichia coli двух представителей оксопроизводных азотсодержащих гетероциклов CBR-384 и CBR-386, планируемых к использованию в качестве лекарственных препаратов. Не рассматривалось их использование как антимикробных агентов. В этой связи предполагается, что указанные соединения будут иметь минимум побочных эффектов, в том числе они не должны влиять на активность представителей микробиома человека, примером которых является E. coli . Наши исследования показали, что оба соединения оказывают заметное негативное влияние на такие важные физиологические функции этих бактерий, как рост, дыхание, поддержание мембранного потенциала и уровня внеклеточных серосодержащих соединений. Полученные результаты позволят дать более полную характеристику CBR-384 и CBR-386. Следует отметить, что часто для характеристики антимикробного действия препаратов, не предназначенных для использования в качестве антибиотиков, указывается только значение минимальной ингибирующей концентрации (МИК). В связи с возрастанием данных о разностороннем влиянии микробиома на здоровье человека, выявляется необходимость более детального изучения действия на микробиом не только вновь синтезируемых медпрепаратов, но и широко используемых в настоящее время. Актуально выявление наиболее оптимального набора подходов и методов в этой области исследований. Настоящая работа вносит вклад в решение указанной проблемы.
Список литературы Влияние оксопроизводных азотсодержащих гетероциклов CBR-384 и CBR-386 на дыхательную активность и уровень внеклеточных серосодержащих соединений у бактерий Escherichia coli
- Boteva A.A. et al. Synthesis and analgesic activity of [b]-annelated 4-quinolones // Pharmaceutical Chemistry Journal. 2019. Vol. 53. P. 616–619. DOI: 10.1007/s11094-019-02048-2
- Enright E.F. et al. The impact of the gut microbiota on drug metabolism and clinical outcome // Yale Journal of Biology and Medicine. 2016. Vol. 89. P. 375–382.
- Gao J., Hou H., Gao F. Current scenario of quinolone hybrids with potential antibacterial activity against ESKAPE pathogens // European Journal of Medicinal Chemistry. 2023. Vol. 247. № 115026. DOI: 10.1016/j.ejmech.2022.115026
- Jiang S. et al. Anti-cancer activity of benzoxazinone derivatives via targeting c-Myc G-quadruplex struc-ture // Life Sciences. 2020. V. 258. № 118252. DOI: 10.1016/j.lfs.2020.118252
- Kho Z.Y., Lal S.K. The human gut microbiome - a potential controller of wellness and disease // Frontiers in Microbiology. 2018. Vol. 9. № 1835. DOI: 10.3389/fmicb.2018.01835
- Marchesi J.R., Ravel J. The vocabulary of microbiome research: a proposal // Microbiome. 2015. Vol. 3. № 31. DOI: 10.1186/s40168-015-0094-5
- Miller J.H. Experiments in molecular genetics // New York: Cold Spring Harbor Laboratory Press. 1972. 466 p.
- Rowland I. et al. Gut microbiota functions: metabolism of nutrients and other food components // Euro-pean Journal of Nutrition. 2018. Vol. 57. P. 1–24. DOI: 10.1007/s00394-017-1445-8
- Smirnova G.V., Oktyabrsky O.N. Glutathione in bacteria // Biochemistry (Moscow). 2005. Vol. 70. P. 1199–1211. DOI: 10.1007/s10541-005-0248-3
- Smirnova G., Muzyka N., Oktyabrsky O. Transmembrane glutathione cycling in growing Escherichia coli cells // Microbiological Research. 2012. Vol. 167. P. 166-172. DOI: 10.1016/j.micres.2011.05.005
- Smirnova G.V. et al. Extracellular superoxide provokes glutathione efflux from Escherichia coli cells // Research in Microbiology. 2015. V. 166. P. 609–617. DOI: 10.1016/j.resmic.2015.07.007
- Tietze F. Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione: applications to mammalian blood and other tissues // Analytical Biochemistry. 1969. Vol. 27. P. 502-522. DOI: 10.1016/0003-2697(69)90064-5
- Tyulenev A.V. et al. The role of sulfides in stress-induced changes of Eh in Escherichia coli cultures // Bioelectrochemistry. 2018. Vol. 121. P. 11–17. DOI: 10.1016/j.bioelechem.2017.12.012
- White A.P. et al. Intergenic sequence comparison of Escherichia coli isolates reveals lifestyle adapta-tions but not host specificity // Applied Environmental Microbiology. 2011. Vol. 77. P. 7620–7632. DOI: 10.1128/AEM.05909-11
- Wickens H.J. et al. Flow cytometric investigation of filamentation, membrane patency and membrane potential in Escherichia coli following ciprofloxacin exposure // Antimicrobial Agents and Chemotherapy. 2000. Vol. 44. P. 682–687. DOI: 10.1128/AAC.44.3.682-687.2000
- Wilson I.D., Nicholson J.K. Gut microbiome interactions with drug metabolism, efficacy, and toxicity // Translational Research. 2017. V. 179. P. 204–222. DOI: 10.1016/j.trsl.2016.08.002


