Влияние оппортунистической инфекции на показатели иммунного статуса больных с лимфопролиферативными заболеваниями
Автор: Булиева Наталья Борисовна, Пащенко И.Г., Визе-Хрипунова Марина Анатольевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Внутренние болезни
Статья в выпуске: 4, 2012 года.
Бесплатный доступ
Статья посвящена оценке влияния оппортунистической инфекции на показатели клеточного и гуморального иммунитета у больных лимфомами, хроническим лимфолейкозом, множественной миеломой. Показано усугубляющее влияние оппортунистической инфекции на иммунный статус и отсутствие зависимости изменений его показателей от вида инфекций.
Оппортунистическая инфекция, лимфопролиферативные заболевания, иммунный статус
Короткий адрес: https://sciup.org/14112855
IDR: 14112855 | УДК: 616.423-097-022.1
Текст научной статьи Влияние оппортунистической инфекции на показатели иммунного статуса больных с лимфопролиферативными заболеваниями
Введение. Злокачественные новообразования лимфатической и кроветворной ткани входят в число наиболее распространенных опухолей и являются одной из актуальных медико-социальных проблем современной онкологии (World health statistics, 2010). По ущербу, наносимому обществу (исчисляется по общей утрате населением трудоспособных лет жизни), лимфопролиферативные заболевания (ЛПЗ) в экономически развитых странах занимают 2-е место после рака легкого, поскольку среди новообразований являются наиболее частой причиной смерти в молодом возрасте [3, 4]. Заболеваемость ЛПЗ в среднем по России составляет 14,8 на 100 тыс. населения среди мужчин и 11,0 – среди женщин со значительным разбросом в различных регионах и постоянным ростом данного показателя [2, 6, 7]. Поэтому приоритетными задачами организации онкологической помощи являются тщательный анализ эпидемиологической ситуации в конкретных регионах проживания, выяснение факторов риска возникновения заболеваний и прогнозирование уровня заболеваемости для рационального планирования специализированной помощи.
Известно, что онкологические больные являются группой риска в отношении развития инфекционных заболеваний. Гнойно-воспалительные осложнения у них развиваются значительно чаще, чем у пациентов, не стра- дающих опухолевыми заболеваниями [11]. Оппортунистическая инфекция (ОИ) может быть представлена широким спектром бактерий, вирусов, грибов и простейших, способных проявлять свои патогенные свойства на фоне нарушенных механизмов иммунореактивности [5]. Они не имеют строго выраженного органного тропизма, поэтому один и тот же вид может вызвать различные нозологические формы (пневмонии, бронхит, менингит, пиелонефрит и др.). В свою очередь, одна и та же нозологическая форма заболевания (пневмония, остеомиелит, сепсис и др.) может быть вызвана любым условно-патогенным микроорганизмом [9]. ОИ являются клинически неблагоприятным фактором, плохо поддаются специфической терапии и имеют тенденцию к частым рецидивам из-за отсутствия у организма специфического иммунного ответа на данные инфекции [9, 12].
В то же время имеющиеся в литературе сведения не раскрывают в полной мере сущности развития инфекционных осложнений у онкологических больных [13–15].
Таким образом, у онкологических больных имеются все необходимые условия для развития ОИ: дефицит иммунореактивности и воздействие иммунодепрессивных методов лечения [10].
Научные исследования в аспекте данной работы проводились в условиях северного ре- гиона страны – в Ханты-Мансийском автономном округе – Югра, на территории которого проживает более 1,5 млн взрослого населения.
По данным регионального ракового регистра, количество больных лимфопролиферативными заболеваниями в данном регионе Севера имеет тенденцию к росту (в 2006 г. было зарегистрировано 833 больных ЛПЗ, а в 2010 г. – уже 950). То же самое касается и количества впервые зарегистрированных больных (в 2006 г. – 146, в 2010 г. – 163 чел.).
В целом, заболеваемость ЛПЗ среди населения Ханты-Мансийского автономного округа – Югры несколько превышает общероссийский показатель (соответственно 54,6 и 46,3 на 100 000 тыс. населения).
С учетом вышеприведенных статистических показателей, недостаточной изученности этой проблемы в северном регионе, частого развития инфекционных осложнений у больных ЛПЗ возникла необходимость изучить состояние иммунитета у больных с подобными заболеваниями в условиях комор-бидности с оппортунистической инфекцией.
Цель исследования. Дать сравнительную характеристику изменений показателей клеточного и гуморального иммунитета в зависимости от клинико-морфологической формы лимфопролиферативного заболевания и вида оппортунистической инфекции.
Материалы и методы. Проведены исследования 260 больных, находившихся на стационарном лечении в гематологическом отделении Ханты-Мансийской окружной клинической больницы (мужчин – 167 (64,2 %), женщин – 93 (35,8 %)). Средний возраст – 42,2±7,6 года. По диагнозу основного заболевания исследованные больные распределились следующим образом: неходжкинские лимфомы (НХЛ) – 80 (30,7 %) чел., ходжкин-ские лимфомы (ХЛ) – 44 (16,9 %), хронический лимфолейкоз (ХЛЛ) – 75 (14,5 %), множественная миелома (ММ) – 61 (24,5 %).
Из общего числа наблюдаемых больных инфекционные заболевания верхних и нижних дыхательных путей были диагностированы у 109 (41,8 %) чел., заболевания мочеполовой системы – у 76 (29,2 %), желудочнокишечного тракта – у 54 (21 %), вирусный гепатит В – у 21 (8,0 %).
Кроме того, исследованные больные были разделены на 2 подгруппы. В одну из них вошли пациенты, у которых был выделен один или несколько видов микрофлоры, в другую – те больные, у которых тот или иной вид инфекции выделен не был.
Критериями включения в проспективное исследование являлись: информированное согласие пациентов; возраст до 65 лет; установленный диагноз НХЛ в соответствии с клинической классификацией Ann Arbor, ЛХ – по одноименной клинической классификации, а также гистологической классификации R. Lukes, ММ – верификация по Международной системе стадирования, ХЛЛ – стади-рование, рекомендованное Международной рабочей группой по ХЛЛ; наличие сопутствующих инфекционных осложнений.
Критериями исключения являлись: несогласие пациентов, возраст старше 65 лет, наличие других заболеваний крови. Так как изначально проспективное наблюдение планировалось проводить в течение 5 лет, не включались также больные с рядом заболеваний других органов и систем: хронической сердечной недостаточностью II–III стадий (по классификации Стражеско-Василенко), нарушениями ритма и проводимости сердца, нестабильной стенокардией, инфарктом миокарда в анамнезе, декомпенсированным сахарным диабетом, циррозом печени в стадии декомпенсации, тяжелыми психическими нарушениями, кахексией, активным туберкулезом легких.
Клиническое обследование включало проведение клинического анализа крови и мочи, а также биохимических исследований крови (общий белок, глюкоза, билирубин, мочевина, креатинин, трансаминазы, протромбиновый индекс (ПТИ), активированное частичное тромбопластиновое время (АЧТВ), фибриноген) по общепринятым методикам.
В качестве биологических материалов на наличие инфекции исследовали периферическую кровь, костный мозг, сыворотку крови, смывы из рото- и носоглотки, смывы из катетеров, бронхиальные аспираты. Исследование цитокинов проводили у всех 260 пациентов, включенных в исследование. Из показателей цитокинового статуса изучали уровень
ФНО-α, ИФ-γ, ИЛ-1β, ИЛ-4, ИЛ-6 в сыворотке крови пациентов, определяли количество циркулирующих иммунных комплексов (ЦИК), содержание IgA, IgG, IgM. Качественное и полуколичественное определение С-реактивного протеина (СРП) проводили методом латекс-агглютинации (Ольвекс-Диагностикум). Определение концентрации ФНО-α в плазме крови проводили методом ИФА с использованием реактивов производства BIOSOURCE, концентрация IgA, IgM, IgG изучалась по G. Manchini в модификации Я.В. Стефани с использованием наборов «Вектор-Бест» на аппарате TDx (Abbott, США). Функциональная активность С3- и С4-компонентов комплемента определялась модифицированным методом по Л.В. Козлову с использованием ИФА. Фагоцитарную активность (ФА) нейтрофилов и моноцитов оценивали методом проточной цитометрии (FACScan, Becton Dickinson, США).
Иммунофенотипирование выполняли на проточном цитометре FACScan (Becton Dickinson, США). Использовали панель диагностических моноклональных антител, включающую CD45, CD19, CD 20, CD23, CD5, CD10, CD11с, CD103, CD79, CD38, CD25, CD22, FMC7, Ig D, HLA – DR, CD3, CD4, CD8, CD7, CD(16+56) (Becton Diskinson и Becman Coulter, США).
Макроскопическое и микробиологическое исследования мокроты и бронхиальных смывов проводили с целью определения видов микроорганизмов и их чувствительности к антибиотикам согласно методическим рекомендациям по применению унифицированных микробиологических методов исследования. Идентификацию выделенных культур при микробиологическом исследовании проводили на микробиологическом анализаторе Sceptor (Becton Dickinson, США) коммерческими тест-системам фирмы BioMerieux (Франция). Микологическое исследование дополняли методом селективной изоляции дрожжей с использованием среды Candiselect 4 и твердофазным ИФА с определением сывороточных антител IgG. Определение галактоманнана осуществляли с помощью тест-системы PLATELIA® Asprgillus (BIO – RAD Laboratories, США). Верификация инфекци- онных осложнений вирусной этиологии осуществлялась методом ПЦР с использованием коммерческих наборов «ДНК-сорб» («Интер-лабсервис», Россия). Для количественного определения антител иммуноглобулинов IgG к герпес-вирусам применяли коммерческие тест-системы фирмы «Вектор-Бест» (Россия).
После клинического обследования всем больным проводился ряд дополнительных исследований, уточняющих характер и степень распространения заболевания, а также характер инфекционных осложнений: УЗИ органов брюшной полости; рентгенологическое исследование органов грудной клетки; по показаниям выполнялись: эзофагогастродуоденоскопия, фиброколоноскопия, бронхоскопия, компьютерная томография (КТ) и/или магнитно-резонансная томография (МРТ) брюшной полости, грудной клетки, малого таза и головного мозга.
Для верификации диагноза НХЛ (109 чел.) и ЛХ (30 чел.) был проведен комплекс обязательных исследований, уточняющих степень распространения заболевания в соответствии с классификацией Ann Arbor с дополнениями в Costwald.
У больных ММ (51 чел.) проводились следующие исследования: рентгенография костей скелета (череп, кости таза, ребра, лопатки, все отделы позвоночника, проксимальные отделы плечевых и бедренных костей); определение общего белка сыворотки крови; определение концентрационной способности почек по методу Зимницкого; исследование уровня иммуноглобулинов в сыворотке крови; определение количества и типа парапротеина (М-компонент) в сыворотке крови и суточной моче.
Все наблюдаемые больные (260 чел.) проходили исследования для выявления маркеров вирусных гепатитов (HВV, HCV). В качестве скрининг-диагностики проводилось исследование на наличие суммарных антител к вирусу гепатита С (анти-HBC) и поверхностного антигена вируса гепатита В (HBsAg) с помощью ИФА. При выявлении вирусных маркеров больным, помимо серологического обследования, проводилось исследование сыворотки крови с помощью ПЦР-диагностики: качественное и количественное определение ДНК ВГВ и РНК ВГС.
Общее клиническое обследование, специальные и иммунологические исследования проводились в порядке диспансерного наблюдения при каждом визите больного к гематологу в среднем в течение 12±2,3 мес. В общей сложности взятые в исследование больные находились под наблюдением гематолога в течение 5 лет. Стационарно и амбулаторно больные получали комплексное лечение, направленное на стабилизацию (регрессию) основного заболевания и устранение инфекционных заболеваний.
Результаты и обсуждение. Анализ полученных результатов исследований показал, что у больных с ЛПЗ, проявляющимися оппортунистической инфекцией, микрофлора представлена широким спектром патогенных и условно-патогенных видов.
Hemophilis inf., Micoplasma pn. наиболее часто выделялись у больных со всеми формами ЛПЗ (рис. 1). В то же время различные штаммы стрептококка и стафилококка высевались заметно реже.
Частота выделения грамотрицательной микрофлоры была несколько ниже, чем грамположительной. Выявлена тенденция к преобладанию представителей штаммов Escherichia coli (НХЛ – 10,1 %, ЛХ – 6,7 %, ХЛЛ – 11,6 %, ММ – 7,8 %), Acinetobacter (НХЛ – 10,1 %, ЛХ – 6,7 %, ХЛЛ – 10,1 %, ММ – 5,9 %), Enterococcus (НХЛ – 8,3 %, ЛХ – 3,3 %, ХЛЛ – 14,5 %, ММ – 7,8 %), Klebsiella (НХЛ – 4,6 %, ЛХ – 3,3 %, ХЛЛ – 11,6 %, ММ – 5,9 %), pn. Pseudomonas (НХЛ – 5,5 %, ЛХ – 3,3 %, ХЛЛ – 11,6 %, ММ – 7,8 %).
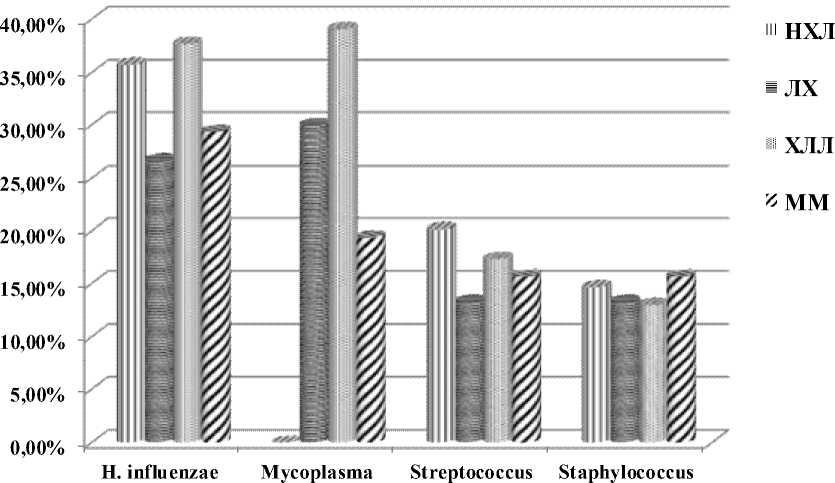
Рис. 1. Частота высевания бактериальной микрофлоры в зависимости от формы лимфопролиферативного заболевания
При анализе распространенности грибковых инфекций у больных ЛПЗ отмечена тенденция к более частой выявляе-мости Candida albicans.
Результаты исследований также показали, что у больных ЛПЗ, особенно при НХЛ и ХЛЛ, наиболее частыми были положительные результаты серологических исследований на Epstein-Barr Virus (НХЛ – 65,1 %, ХЛЛ – 76,8 %, в то время как при ЛХ и ММ – соответственно 10 и 5,9 %).
Другие представители вирусной инфекции (Cytomegalovirus, H. virus) встречались реже. Случаи положительных результатов на H. simplex virus составили 9,2 (НХЛ), 4,3 % (ХЛЛ), 3,9 % (ММ); H. zoster – 3,7 % (НХЛ), 3,3 % (ЛХ).
Весьма важным для нас был также вопрос о том, как влияет тот или иной представитель микрофлоры, выделенный у больных ЛПЗ, на показатели иммунитета. В табл. 1–4 представлены данные об изменении показателей иммунитета в зависимости от вида микрофлоры.
Таблица 1
|
Показатели иммунитета |
Streptococcus spp. |
Staphylococcus spp. |
Enterococcus spp. |
|||
|
нет n=214 |
есть n=46 |
нет n=223 |
есть n=37 |
нет n=236 |
есть n=24 |
|
|
ФНО-α, пг/мл |
45,5±2,24 |
71,1±6,89 p<0,001 |
48,4±38,5 |
59,5±22,4 p>0,05 |
48,3±37,0 |
66,9±30,2 p<0,05 |
|
Интерферон-γ, ЕД/мл |
2,42±0,97 |
2,0±1,0 p<0,01 |
2,37±0,99 |
2,20±1,04 p>0,05 |
2,39±0,98 |
1,93±1,07 p<0,05 |
|
Интерлейкин-1β, пг/мл |
7,12±3,54 |
4,48±3,67 p<0,001 |
6,73±3,68 |
6,14±3,8 p>0,05 |
6,79±3,7 |
5,29±3,5 p>0,05 |
|
Интерлейкин-4, пг/мл |
13,8±8,9 |
10,6±10,1 p<0,05 |
13,0±9,23 |
14,2±9,1 p>0,05 |
13,7±9,0 |
8,03±9,5 p<0,01 |
|
Интерлейкин-6, пг/мл |
26,9±16,9 |
22,1±17,2 p>0,05 |
25,2±16,9 |
31,4±17,0 p<0,05 |
27,5±16,5 |
11,7±16,3 p<0,001 |
|
Ig A, мг/дл |
58,4±19,3 |
36,8±25,1 p<0,001 |
55,5±38,4 |
49,1±29,2 p>0,05 |
57,1±55,2 |
30,3±28,9 p<0,05 |
|
Ig G, мг/дл |
56,9±3,2 |
39,8±1,83 p<0,001 |
54,9±3,27 |
47,2±2,18 p>0,05 |
54,4±2,63 |
48,6±4,52 p>0,05 |
|
Ig M, мг/дл |
102,8±74,3 |
91,9±51,5 p>0,05 |
101,8±73 |
95,5±54,1 p>0,05 |
101,9±72 |
90,4±48,0 p>0,05 |
|
C-реактивный протеин, мг/л |
11,6±10,2 |
20,8±16,7 p<0,001 |
12,9±6,17 |
13,3±12,8 p>0,05 |
12,2±11,3 |
23,2±15,1 p<0,001 |
|
C3-компонент комплемента, г/л |
0,96±0,51 |
0,62±0,41 p<0,001 |
0,93±0,53 |
0,69±0,33 p<0,01 |
0,94±0,51 |
0,50±0,37 p<0,001 |
|
C4-компонент комплемента, г/л |
0,55±0,19 |
0,17±0,09 p<0,001 |
0,53±0,50 |
0,19±0,09 p<0,001 |
0,51±0,49 |
0,18±0,10 p<0,01 |
|
ЦИК, ЕД/мл |
64,5±31,8 |
95,5±32,4 p<0,001 |
67,3±35,8 |
85,8±9,7 p<0,01 |
67,3±33,4 |
96,3±28,3 p<0,001 |
|
ФАН, % |
41,7±12,3 |
32,4±9,1 p<0,001 |
40,9±12,8 |
34,9±7,4 p<0,01 |
41,1±12,2 |
29,1±8,0 p<0,001 |
|
ФАМ, % |
38,1±12,7 |
28,4±7,6 p<0,001 |
37,3±13,1 |
30,9±6,0 p<0,01 |
37,6±12,4 |
25,1±6,27 p<0,001 |
|
CD4+/CD8+-лимфоциты |
1,72±0,36 |
1,37±0,27 p<0,001 |
1,68±0,38 |
1,50±0,19 p<0,01 |
1,69±0,37 |
1,37±0,21 p<0,001 |
|
Нейтрофилы, абс.×109/л |
2,38±0,83 |
1,91±0,87 p<0,001 |
2,32±0,89 |
2,12±0,62 p>0,05 |
2,35±0,86 |
1,75±0,67 p<0,01 |
Примечание. р – достоверность разницы показателей по критерию Стьюдента одностороннему.
Таблица 2
|
Показатели иммунитета |
Pseudomonas aeru. |
Klebsiella pn. |
Escherichia coli |
|||
|
нет n=242 |
есть n=18 |
нет n=243 |
есть n=17 |
нет n=236 |
есть n=24 |
|
|
ФНО-α, пг/мл |
48,1±35,8 |
75,3±41,4 p<0,01 |
47,9±35,4 |
79,3±44,2 p<0,001 |
48,7±36,9 |
62,8±33,4 p>0,05 |
|
Интерферон-γ, ЕД/мл |
2,36±0,98 |
2,09±1,17 p>0,05 |
2,37±0,97 |
2,06±1,31 p>0,05 |
2,34±0,96 |
2,39±1,30 p>0,05 |
|
Интерлейкин-1β, пг/мл |
6,75±3,66 |
5,31±4,09 p>0,05 |
6,74±3,67 |
5,38±3,93 p>0,05 |
6,78±3,64 |
5,37±4,08 p>0,05 |
|
Интерлейкин-4, пг/мл |
13,7±9,09 |
6,01±5,74 p<0,001 |
13,6±9,08 |
6,90±5,91 p<0,01 |
13,8±8,99 |
7,09±6,92 p<0,001 |
|
Интерлейкин-6, пг/мл |
26,8±16,6 |
15,7±14,9 p<0,01 |
27,5±16,6 |
5,44±5,31 p<0,001 |
27,5±16,4 |
11,9±10,7 p<0,001 |
|
Ig A, мг/дл |
56,1±45,8 |
34,9±33,9 p>0,05 |
56,0±54,7 |
34,6±33,7 p>0,05 |
57,2±66,4 |
28,7±27,8 p<0,05 |
|
Ig G, мг/дл |
54,0±2,61 |
51,7±4,94 p>0,05 |
54,8±3,19 |
39,7±2,04 p>0,05 |
55,7±3,21 |
35,0±1,40 p<0,01 |
|
Ig M, мг/дл |
101,7±72,4 |
89,9±44,5 p>0,05 |
100,9±72 |
100,2±44,9 p>0,05 |
103,5±72 |
75,8±41,6 p>0,05 |
|
C-реактивный протеин, мг/л |
12,5±11,7 |
23,5±12,8 p<0,001 |
12,4±10,8 |
25,6±20,6 p<0,001 |
12,4±11,6 |
21,1±14,4 p<0,001 |
|
C3-компонент комплемента, г/л |
0,93±0,51 |
0,42±0,34 p<0,001 |
0,93±0,50 |
0,39±0,35 p<0,001 |
0,95±0,51 |
0,43±0,32 p<0,001 |
|
C4-компонент комплемента, г/л |
0,50±0,49 |
0,21±0,09 p<0,05 |
0,51±0,48 |
0,14±0,08 p<0,01 |
0,51±0,49 |
0,18±0,09 p<0,01 |
|
ЦИК, ЕД/мл |
68,0±33,7 |
96,0 ±27,3 p<0,001 |
67,2±31,9 |
109,3±39,5 p<0,001 |
67,4±34,0 |
94,9±21,7 p<0,001 |
|
ФАН, % |
40,8±12,2 |
29,6±8,21 p<0,001 |
40,9±12,0 |
27,7±11,2 p<0,001 |
40,8±12,4 |
32,7±9,45 p<0,01 |
|
ФАМ, % |
37,2±12,4 |
25,7±7,29 p<0,001 |
37,3±12,3 |
23,2±5,32 p<0,001 |
37,2±12,6 |
28,8±7,66 p<0,01 |
|
CD4+/CD8+-лимфоциты |
1,68±0,37 |
1,36±0,24 p<0,001 |
1,68±0,36 |
1,29±0,30 p<0,001 |
1,68±0,37 |
1,45±0,25 p<0,01 |
|
Нейтрофилы, абс.×109/л |
2,33±0,86 |
1,75±0,59 p<0,01 |
2,34±0,85 |
1,59±0,70 p<0,001 |
2,38±0,84 |
1,44±0,45 p<0,001 |
Примечание. р – достоверность разницы показателей по критерию Стьюдента одностороннему.
Таблица 3
Изменения иммунологических показателей у больных ЛПЗ при оппортунистических инфекциях, обусловленных Hemophilis influenzae, Micoplasma pneumoniae и Acinetobacter (M±σ)
|
Показатели иммунитета |
H. influenzae |
M. pneumoniae |
Acinetobacter |
|||
|
нет n=172 |
есть n=88 |
нет n=182 |
есть n=78 |
нет n=236 |
есть n=24 |
|
|
ФНО-α, пг/мл |
41,0±30,1 |
67,6±42,1 p<0,001 |
40,7±28,7 |
71,7±44,1 p<0,001 |
48,3±36,6 |
67,0±35,0 p<0,05 |
|
Интерферон-γ, ЕД/мл |
2,44±0,94 |
2,17±1,09 p<0,05 |
2,40±0,94 |
2,21±1,12 p>0,05 |
2,35±0,97 |
2,26±1,28 p>0,05 |
|
Интерлейкин-1β, пг/мл |
7,21±3,64 |
5,54±3,58 p<0,001 |
7,14±3,44 |
5,51±4,04 p<0,001 |
6,85±3,66 |
4,64±3,55 p<0,01 |
|
Интерлейкин-4, пг/мл |
14,1±8,90 |
11,4±9,57 p<0,001 |
14,0±9,08 |
11,2±9,25 p<0,05 |
14,1±9,03 |
4,52±5,77 p<0,001 |
|
Интерлейкин-6, пг/мл |
27,8±16,6 |
22,7±17,5 p<0,05 |
26,6±16,4 |
24,9±18,4 p>0,05 |
27,8±16,5 |
8,99±12,9 p<0,001 |
|
Ig A, мг/дл |
55,1±6,61 |
53,6±51,0 p>0,05 |
59,1±54,1 |
44,0±28,9 p<0,05 |
57,6±56,3 |
25,2±24,2 p<0,01 |
|
Ig G, мг/дл |
54,3±2,88 |
52,9±3,63 p>0,05 |
56,7±3,51 |
47,1±1,89 p<0,05 |
54,6±2,63 |
45,9±6,33 p>0,05 |
|
Ig M, мг/дл |
101,1±8,0 |
100,6±48,6 p>0,05 |
103,6±78 |
94,7±49,1 p>0,05 |
102,2±72 |
88,6±50,6 p>0,05 |
|
C-реактивный протеин, мг/л |
10,9±11,2 |
17,6±12,7 p<0,001 |
10,9±9,92 |
18,7±13,1 p<0,001 |
12,7±12,0 |
18,8±11,7 p<0,05 |
|
C3-компонент комплемента, г/л |
1,04±0,51 |
0,63±0,42 p<0,001 |
1,01±0,52 |
0,63±0,38 p<0,001 |
0,94±0,51 |
0,50±0,41 p<0,001 |
|
C4-компонент комплемента, г/л |
0,63±0,53 |
0,19±0,08 p<0,001 |
0,61±0,52 |
0,18±0,08 p<0,001 |
0,51±0,49 |
0,19±0,09 p<0,01 |
|
ЦИК, ЕД/мл |
59,8±3,39 |
89,8±23,9 p<0,001 |
61,4±33,4 |
89,9±26,2 p<0,001 |
67,6±34,2 |
93,0±20,3 p<0,001 |
|
ФАН, % |
42,8±12,7 |
34,5±9,62 p<0,001 |
42,7±12,8 |
33,8±8,62 p<0,001 |
40,8±12,4 |
32,7±8,75 p<0,01 |
|
ФАМ, % |
39,7±13,5 |
29,9±6,58 p<0,001 |
39,4±13,1 |
29,4±7,0 p<0,001 |
37,4±12,5 |
26,6±6,22 p<0,001 |
|
CD4+/CD8+-лимфоциты |
1,75±0,38 |
1,47±0,27 p<0,001 |
1,76±0,37 |
1,42±0,23 p<0,001 |
1,68±0,37 |
1,42±0,24 p<0,001 |
|
Нейтрофилы, абс.×109/л |
2,49±0,84 |
1,91±0,77 p<0,001 |
2,50±0,83 |
1,82±0,74 p<0,001 |
2,35±0,86 |
1,69±0,61 p<0,001 |
Примечание. р – достоверность разницы показателей по критерию Стьюдента одностороннему.
Таблица 4
|
Показатели иммунитета |
Aspergillus spp. |
Candida spp. |
||
|
нет n=247 |
есть n=13 |
нет n=225 |
есть n=35 |
|
|
ФНО-α, пг/мл |
47,6±34,0 |
96,3±55,3 p<0,001 |
47,9±36,8 |
63,6±34,4 p<0,05 |
|
Интерферон-γ, ЕД/мл |
2,37±0,98 |
1,95±1,16 p>0,05 |
2,39±0,97 |
2,05±1,13 p>0,05 |
|
Интерлейкин-1β, пг/мл |
6,83±3,61 |
3,26±3,03 p<0,001 |
6,79±3,58 |
5,68±4,30 p>0,05 |
|
Интерлейкин-4, пг/мл |
13,6±9,12 |
5,19±5,08 p<0,01 |
13,9±9,06 |
8,86±9,04 p<0,01 |
|
Интерлейкин-6, пг/мл |
26,9±16,9 |
10,5±9,08 p<0,001 |
27,9±16,4 |
14,1±13,9 p<0,001 |
|
Ig A, мг/дл |
55,7±52,4 |
34,6±30,4 p>0,05 |
57,3±55,8 |
37,1±29,2 p<0,05 |
|
Ig G, мг/дл |
54,9±3,17 |
34,2±1,82 p<0,05 |
56,2±3,25 |
38,3±1,70 p<0,01 |
|
Ig M, мг/дл |
101,4±71,5 |
92,3±58,8 p>0,05 |
104,5±73,3 |
78,1±47,0 p<0,05 |
|
C-реактивный протеин, мг/л |
12,1±9,91 |
35,7±2,43 p<0,001 |
12,1±11,0 |
20,0±1,63 p<0,001 |
|
C3-компонент комплемента, г/л |
0,92±0,50 |
0,43±0,39 p<0,001 |
0,95±0,51 |
0,57±0,44 p<0,001 |
|
C4-компонент комплемента, г/л |
0,50±0,18 |
0,15±0,11 p<0,001 |
0,53±0,50 |
0,19±0,09 p<0,001 |
|
ЦИК, ЕД/мл |
67,3±31,4 |
119,6±42,9 p<0,001 |
66,1±33,4 |
94,6±26,9 p<0,001 |
|
ФА нейтрофилов, % |
40,7±12,1 |
27,2±10,0 p<0,001 |
41,1±12,5 |
32,9±8,48 p<0,001 |
|
ФА моноцитов, % |
37,0±12,4 |
24,8±8,45 p<0,001 |
37,6±12,7 |
29,1±7,53 p<0,001 |
|
CD4+/CD8+-лимфоциты |
1,68±0,36 |
1,21±0,30 p<0,001 |
1,69±0,37 |
1,46±0,29 p<0,001 |
|
Нейтрофилы, абс.×109/л |
2,35±0,84 |
1,15±0,19 p<0,001 |
2,40±0,85 |
1,60±0,53 p<0,001 |
Примечание. р – достоверность разницы показателей по критерию Стьюдента одностороннему.
Изменения иммунологических показателей у больных ЛПЗ при стафилококковой, стрептококковой и энтерококковой инфекциях (M±σ)
Изменения иммунологических показателей у больных ЛПЗ при оппортунистических инфекциях, обусловленных Pseudomonas aeruginosa, Klebsiella pn. и Escherichia Coli (M±σ)
Изменения иммунологических показателей у больных ЛПЗ при оппортунистической грибковой инфекции (M±σ)
Таким образом, анализ результатов исследований показал, что у больных ЛПЗ, независимо от клинико-морфологической формы и вида оппортунистической инфекции, в той или иной степени выраженности нарушается иммунный статус и в большинстве слу- чаев в сторону снижения, что, естественно, не может не отражаться на клиническом течении основной патологии и ее осложнений.
Сопоставив результаты исследований иммунного статуса у больных с ЛПЗ в зависимости от вида выделенной микрофлоры, правомерно было прийти к заключению, что при бактериальной, грамположительной, грамотрицательной и грибковой инфекциях состояние клеточного и гуморального иммунитета изменяется неоднозначно.
Практически при всех видах выделенной микрофлоры у больных ЛПЗ отмечалось увеличение концентрации ФНО- α .
Стабильно при всех видах выделенной микрофлоры концентрации С 4 - и С 3 -компо-нентов комплемента, ФАН и ФАМ, отношение СД4/СД8-лимфоцитов, абсолютное количество нейтрофилов в крови снижались.
Концентрация ИФ- α статистически достоверно снижалась при всех видах бактериальной инфекции, а также при H. influenzae. При других видах инфекции его концентрация уменьшалась статистически недостоверно.
Содержание в крови ИЛ-1β снижается статистически достоверно при стрептококковой инфекции, а также при H. influenzae, M. pneu-moniaе, Acinetobacter, HBV, Aspergilius spp.
Концентрация в крови ИЛ-4 снижается статистически достоверно при Н. influenzae, Micoplasma pn., Аcinetobacter, а также при стрептококковой и грибковой инфекциях.
Концентрация в крови ИЛ-6 достаточно отчетливо снижается при H. influenzae, Aci-netobacter, Pseudomonas aeruginosa, Klebsiella pn., Escherichia coli, грибковой инфекции.
Резюмируя результаты исследований показателей цитокинового звена гуморального иммунитета, следует отметить, что при большинстве видов инфекции эти показатели снижаются, хотя и не всегда статистически достоверно.
Из вышеприведенных таблиц также видно, что содержание в крови иммуноглобулинов A, G, M у всех исследованных больных существенно снижено, а присоединение оппортунистической инфекции нередко приводит к еще большему снижению.
Так, при выделенной стрептококковой инфекции существенно снижено содержание IgA и IgG, менее отчетливо – при грибковой инфекции, а при всех других видах инфекций достоверного изменения концентрации иммуноглобулинов не наблюдалось (р > 0,05).
Практически при всех видах оппортунистической инфекции концентрация СРБ была существенно увеличена.
Осложнение ЛПЗ оппортунистической инфекцией вирусной этиологии (H. virus, Cytomegalovirus, Epstein-Barr virus) сопровождалось изменениями показателей клеточного и гуморального иммунитета. Это выражалось в достоверном снижении содержания ИФ-γ (Epstein-Barr virus, p<0,05), ИЛ-1β (H. virus, Epstein-Barr virus, p<0,05 и р<0,01 соответственно), компонентов С3 (H. virus, Epstein-Barr virus, p<0,001) и С4 комплемента (H. virus, Cytomegalovirus, Epstein-Barr virus, p<0,05), повышении уровня ЦИК (Cytomegalovirus, Epstein-Barr virus, p<0,05), снижении ФА моноцитов (Epstein-Barr virus, p<0,01), а также в нейтропении (H. Virus, p<0,05; Epstein-Barr virus, p<0,001).
При персистенции вируса гепатита В у больных ЛПЗ уровень ИФ-γ был снижен (p<0,001). Из показателей гуморального иммунитета подобное следует отметить для ИЛ-1β (p<0,001), С4-компонента комплемента (p<0,05). Из параметров клеточного иммунитета при инфицировании HBV отмечается снижение ФА моноцитов и выраженная нейтропения (p<0,05).
Таким образом, результаты проведенных исследований дают основание считать, что у больных ЛПЗ отмечается глубокая супрессия иммунного статуса, обусловленная прежде всего основной патологией и проводимой химио- и лучевой терапией. Безусловно, это приводит к ослаблению сопротивляемости ко всем типам инфекций, развитию инфекционных осложнений со стороны верхних и нижних дыхательных путей, мочеполовой системы, желудочно-кишечного тракта и др.
Неслучайно поэтому, что только у 45 больных (17,3 %) за период наблюдения не было выявлено клинически манифестных инфекционных осложнений.
О снижении иммунного статуса у наблюдаемых больных ЛПЗ свидетельствует факт выделения у них нозокомиальной инфекции, которая, как известно, высевается из биологических сред при ослаблении макроорганизма, его неспецифической и иммунной сопротивляемости.
Из 260 больных ЛПЗ у 13 (5 %) был диагностирован сепсис различной этиологии. У этих больных с фатальным исходом кон- центрация ФНО-α составляла 153,3±55 пг/мл; ИФ-α – 1,58±1,14 ЕД/мл; ИЛ-1β – 2,96±1,29 пг/мл; ИЛ-4 – 1,15±0,55 пг/мл; ИЛ-6 – 6,95±1,5 пг/мл; IgA – 27,7±1/59 мг/дл; IgG – 24,9±1,59 мг/дл; IgM – 1,1±19,6 мг/дл; СРБ – 53,8±13,5 мг/л; С3-компонент комплемента – 0,11±0,09 г/л; С4-компонент комплемента – 0,13±0,09 г/л; ЦИК – 140,6±40 ЕД/мл; ФАН – 17,3±3,32 %; ФАМ – 16,9±1,54 %, отношение СД4/СД8-лимфоциты – 0,92±0,07; нейтрофилы крови – 1,15±0,30∙109/л.
Вышеприведенные результаты исследований свидетельствуют о глубоком угнетении показателей клеточного и гуморального иммунитета при сепсисе.
Таким образом, оппортунистическая инфекция вносит существенный негативный вклад в иммунный статус больных ЛПЗ.
Выводы:
-
1. У больных лимфопролиферативными заболеваниями из грамположительной инфекции наиболее часто выделялись Haemophilus inf., Mycoplasma pn., реже выделялись различные штаммы стрептококка и стафилококка. Из грамотрицательной микрофлоры, особенно часто при неходжкинских лимфомах и хроническом лимфолейкозе, выделялись Escherichia coli, Acinetobacter, Enterococcus, Klebsiella pn., Psevdomonas aeruginosa.
-
2. Нарушение клеточного компонента иммунного статуса у исследованных больных проявлялось снижением соотношения СД4 / СД8-лимфоцитов, фагоцитарной активности нейтрофилов и моноцитов, уменьшением количества нейтрофилов в периферической крови.
-
3. При всех нозологических формах лимфопролиферативных заболеваний и видах оппортунистической инфекции отмечалось повышение концентрации ФНО- α и циркулирующих иммунных комплексов, а концентрации ИЛ-1β, ИЛ-4, ИЛ-6, С3- и С4-ком-понентов комплемента, иммуноглобулинов A, M, G, хотя не всегда статистически достоверно, снижались.
-
4. У больных с неходжкинскими лимфомами и хроническим лимфолейкозом в большинстве случаев отмечались положительные результаты серологических реакций на вирус Эпштейна-Барра.
-
1. Аксель Е. М. Злокачественные новообразования у детей // Тез. II съезда детских онкологов и гематологов России. Детская онкология. М., 2001. С. 22–23.
-
2. Бакиров Б. А., Варшавский А. В., Каримов Д. О. Клинико-патогенетическая характеристика и факторы прогноза течения хронического лимфолейкоза // Бюллетень Федерального центра сердца, крови и эндокринологии им. В. А. Алмазова : тез. Всероссийской науч.-практич. конф. с международным участием «Высокотехнологичные методы диагностики и лечения заболеваний сердца, крови и эндокринных органов». 2010. № 2. С. 18–19.
-
3. Волкова М. А. Клиническая онкогематология. 2-е изд., перераб и доп. М. : Медицина, 2007. 1144 с.
-
4. Воробьев А. И., Кременцкая А. М. Атлас. Опухоли лимфатической системы. М. : Ньюдиа-мед, 2007. 294 с.
-
5. Гармаева Т. Ц., Куликов С. М., Карякин А. В. Мониторирование факторов риска и индикаторов инфицированности вирусами гепатитов В и С гематологических больных // Гематология и трансфузиология. 2006. Т. 51, № 1. С. 23–27.
-
6. Гемобластозы на территории России: распространенность и смертность (1999–2007 гг.) / И. А. Бондаренко [и др.] // Вестник гематологии. 2010. Т. 6, № 2. С. 18–19.
-
7. Давыдов М. И., Аксель Е. М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2006 г. // Вестник РОНЦ им. Н. Н. Блохина РАМН. 2008. № 2 (прил. 1). С. 52–57.
-
8. Долгих М. С. Герпесвирусные инфекции у иммунодефицитных пациентов // Тер. архив. 2001. № 11. С. 59–65.
-
9. Долгих Т. И. Лабораторная диагностика – основа информационного обеспечения диагностического процесса при оппортунистических инфекциях // Клин. лаб. диагностика. 2008. № 1. С. 49–51.
-
10. Захарова А. И., Обухова Т. Н. Молекулярно-генетические маркеры как факторы прогноза при хроническом В-клеточном лимфолейкозе // Онкогематология. 2007. № 1. С. 17–23.
-
11. Петрова Н. А., Клясова Г. А. Возможные источники инфицирования аспергиллами в гематологическом стационаре // Тер. архив. 2005. № 7. С. 71–77.
-
12. Функциональное состояние лейкоцитов крови при различных видах воспалительной реакции / М. С. Камнев [и др.] // Материалы XII межрегиональной науч.-практич. конф. Пенза, 2006. С. 114–116 .
-
13. Bacigalupo A. Antithymocyte globuline for prevention of graft-versus-host disease // Curr. Opin. Hematol. 2005. Vol. 12. P. 457–462.
-
14. Bell J. M. Development of a Disk Diffusion Method for Testing Moraxella catarrhalis Suscepti-
bility Using Clinical and Laboratory Standards Institute Methods: a SENTRY Antimicrobial Surveillance Program Report // J. of Clinical Microbiology. 2009. Vol. 47, № 7. P. 2187–2193.
-
15. Chen М., Hsiao L., Chiou Т. High prevalence of occult hepatitis В virus infection in patients with В-cell non-Hodgkin's lymphoma // Ann. Hematol. 2008. Vol. 87 (6). Р. 475–480.
EFFECT OF OPPORTUNISTIC INFECTION ON THE IMMUNE STATUS OF PATIENTS WITH LYMPHOPROLIFERATIVE DISEASES
N.B. Bulieva1, I.G. Pashchenko2, M.A. Vise-Hripunova2
Список литературы Влияние оппортунистической инфекции на показатели иммунного статуса больных с лимфопролиферативными заболеваниями
- Аксель Е. М. Злокачественные новообразования у детей//Тез. II съезда детских онкологов и гематологов России. Детская онкология. М., 2001. С. 22-23.
- Бакиров Б. А., Варшавский А. В., Кари-мов Д. О. Клинико-патогенетическая характеристика и факторы прогноза течения хронического лимфолейкоза//Бюллетень Федерального центра сердца, крови и эндокринологии им. В. А. Алмазова: тез. Всероссийской науч.-практич. конф. с международным участием «Высокотехнологичные методы диагностики и лечения заболеваний сердца, крови и эндокринных органов». 2010. № 2. С. 18-19.
- Волкова М. А. Клиническая онкогематология. 2-е изд., перераб и доп. М.: Медицина, 2007. 1144 с.
- Воробьев А. И., Кременцкая А. М. Атлас. Опухоли лимфатической системы. М.: Ньюдиамед, 2007. 294 с.
- Гармаева Т. Ц., Куликов С. М., Карякин А. В. Мониторирование факторов риска и индикаторов инфицированности вирусами гепатитов В и С гематологических больных//Гематология и трансфузиология. 2006. Т. 51, № 1. С. 23-27.
- Гемобластозы на территории России: распространенность и смертность (1999-2007 гг.)/И. А. Бондаренко [и др.]//Вестник гематологии. 2010. Т. 6, № 2. С. 18-19.
- Давыдов М. И., Аксель Е. М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2006 г.//Вестник РОНЦ им. Н. Н. Блохина РАМН. 2008. № 2 (прил. 1). С. 52-57.
- Долгих М. С. Герпесвирусные инфекции у иммунодефицитных пациентов//Тер. архив. 2001. № 11. С. 59-65.
- Долгих Т. И. Лабораторная диагностика -основа информационного обеспечения диагностического процесса при оппортунистических инфекциях//Клин. лаб. диагностика. 2008. № 1. С. 49-51.
- Захарова А. И., Обухова Т. Н. Молекулярно-генетические маркеры как факторы прогноза при хроническом В-клеточном лимфолейкозе//Онкогематология. 2007. № 1. С. 17-23.
- Петрова Н. А., Клясова Г. А. Возможные источники инфицирования аспергиллами в гематологическом стационаре//Тер. архив. 2005. № 7. С. 71-77.
- Функциональное состояние лейкоцитов крови при различных видах воспалительной реакции/М. С. Камнев [и др.]//Материалы XII межрегиональной науч.-практич. конф. Пенза, 2006. С. 114-116.
- Bacigalupo A. Antithymocyte globuline for prevention of graft-versus-host disease//Curr. Opin. Hematol. 2005. Vol. 12. P. 457-462.
- Bell J. M. Development of a Disk Diffusion Method for Testing Moraxella catarrhalis Suscepti-bility Using Clinical and Laboratory Standards Institute Methods: a SENTRY Antimicrobial Surveillance Program Report//J. of Clinical Microbiology. 2009. Vol. 47, № 7. P. 2187-2193.
- Chen М., Hsiao L., Chiou Т. High preva-lence of occult hepatitis В virus infection in patients with В-cell non-Hodgkin's lymphoma//Ann. Hematol. 2008. Vol. 87 (6). Р. 475-480.


