Влияние пептидного токсина mu-agatoxin-Aa1a на экспрессию генов, регулирующих ишемически-реперфузионное повреждение клеток
Автор: Погодина Е.С., Расторгуева Е.В., Юрова Е.В., Сугак Д.Е., Викторов Д.А., Саенко Ю.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 3, 2025 года.
Бесплатный доступ
Поиск диагностических процедур, позволяющих оценить риск развития сердечно-сосудистых заболеваний, является актуальной задачей современной медицины. Помимо внешних воздействий и сопутствующих заболеваний, ишемическое повреждение обусловлено и генетическими факторами. Несмотря на активное использование в терапии препаратов, нацеленных на рецепторы-мишени, получено незначительное количество данных об оказании ими негативного влияния. Для решения проблемы предлагается использовать пептидные токсины членистоногих, обладающие избирательностью к ионным каналам клетки, химической, термической и биологической стабильностью, а также устойчивостью к протеазам. Цель. Изучение влияния токсина mu-agatoxin-Aa1a на профиль экспрессии генов Scn5a, Scn4a, Cacna1c, Plce1, Elavl1, Senp, Parp1, Xiap и Orail1 в условиях модели ишемии/реперфузии. Материалы и методы. Использовалась клеточная культура H9C2. Модель ишемически-реперфузионного повреждения воспроизводилась путем инкубации клеток в среде с дефицитом глюкозы, сыворотки и кислорода (18 ч) и последующей инкубации в полной питательной среде (2 ч). Токсин вносили на начальном этапе реперфузии. Для его получения использовался твердофазный пептидный синтез. Экспрессия генов определялась с помощью ПЦР в реальном времени. Последовательность праймеров подбиралась в банке данных нуклеотидных последовательностей NCBI. Статистическая обработка осуществлялась в программе OriginPro 2018. Результаты. Токсин mu-agatoxin-Aa1a в концентрации 50 нМ в клеточной культуре H9C2 в условиях ишемии/реперфузии способствовал подавлению экспрессии генов Scn4a, Cacna1c, Plce1, Orail1 и Scn5a и усилению экспрессии генов Elavl1 и Xiap. Выводы. Полученные результаты дают новое представление о внутриклеточных молекулярных механизмах, которые инициированы ишемически-реперфузионным повреждением. Токсин muagatoxinAa1a, оказывающий влияние на модуляцию экспрессии генов Scn5a, Scn4a, Cacna1c, Plce1, Elavl1, Senp, Parp1, Xiap и Orail1, может быть использован для целенаправленной регуляции основных звеньев патологической реакции.
Гены, уровень экспрессии генов, ишемия, реперфузия, пептидный токсин
Короткий адрес: https://sciup.org/14133872
IDR: 14133872 | УДК: 57.053.2 | DOI: 10.34014/2227-1848-2025-3-140-153
Текст научной статьи Влияние пептидного токсина mu-agatoxin-Aa1a на экспрессию генов, регулирующих ишемически-реперфузионное повреждение клеток
Введение. Несмотря на профилактику и лечение сердечно-сосудистых заболеваний (ССЗ) уровень смертности от них продолжает увеличиваться [1]. В связи с этим поиск новых диагностических процедур, позволяющих оценить риск появления и предотвратить развитие ССЗ, является одной из актуальных задач современной медицины.
Часто терапия ССЗ приводит к развитию ишемически-реперфузионного повреждения (ИРП), для которого характерна совокупность патологических процессов: возникновение окси-дативного стресса, увеличение содержания внутриклеточного натрия, нарушение работы митохондрий и развитие апоптоза [2–4]. Появляется все больше данных о том, что исход ИРП в большинстве случаев обусловлен генетическими факторами. Например, активация внутриклеточных сигнальных путей ERK1/2, JAK2/STAT3 и Akt/eNOS позволяет ингибировать оксидатив-ный стресс и реперфузионный синдром миокарда [5, 6]. Внутриклеточный сигнальный путь NF-κB, центральным компонентом которого является транскрипционный фактор NF-κB, ингибирует путь Nrf2 ARE, способствующий развитию некроза, вызванного оксидативным стрессом и реперфузионным синдромом миокарда [7]. PHLDA3 ингибирует воспалительные реакции посредством влияния на сигнальный путь Akt/Nrf2 [8]. LRP6 предотвращает негативные последствия реперфузионного синдрома миокарда за счет взаимодействия с продуктами генов HSF1 и GSK3β [9]. На основании вышеизложенного перспективным способом борьбы с патологическими состояниями, которые инициированы ишемически-реперфузионным повреждением, является целенаправленная регуляция основных звеньев патологической реакции.
Изменения на разных уровнях (тканевом, клеточном, молекулярном), к которым относятся процесс некроза клеток, окcидативный стресс, воспаление, а также нейрогуморальная активация, являются ключевыми для ИРП. Как правило, при терапии ССЗ используют средства, направленные на регуляцию одного рецептора или молекулы [10]. Например, дофамин направлен на активацию адренорецептора (АР), а атенолол блокирует бета-2 адренорецептор (β-АР). Такие антиаритмические препараты, как верапамил, дипиридамол, позволяют блокировать ионные каналы. Дигоксин способствует ингибированию Na+, K+-АТФазы [11–14]. На внутриклеточные рецепторы воздействуют милринон и амри-нон, которые ингибируют фосфодиэстеразы. Левосимендан и пимомендан, ингибирующие фосфодиэстеразу V, оказывают влияние на чувствительность миофибрилл миокарда к Са2+ [14].
Несмотря на активное использование указанных средств в терапии имеются сведения, которые подтверждают развитие их негативного влияния на рецепторы-мишени и сигнальные пути, в которых они задействованы [10, 15–17]. Для предотвращения подобных последствий можно использовать пептидные токсины членистоногих, особенностью которых является избирательность по отношению к одному из нескольких классов ионных каналов клетки [18]. Они обладают химической, термической и биологической стабильностью, а также устойчивостью к протеазам.
Цель исследования. Изучение влияния токсина mu-agatoxin-Aa1a на профиль экспрессии генов Scn5a, Scn4a, Cacna1c, Plce1, Elavl1, Senp, Parp1, Xiap и Orail1 в условиях модели ишемии/реперфузии.
Материалы и методы. В экспериментах использовали клеточную линию кардиомиоцитов крысы Н9с2. Культура клеток Н9с2 (CRL-1446) получена из American Type Culture
Collection. При подборе биоматериала было исключено влияние человеческого фактора. В соответствии с российским законодательством применение биоматериалов клеточных линий, необходимых для проведения научных исследований, согласования не требует.
Эксперименты проводили с культурами в логарифмической фазе роста. За 48 ч до эксперимента клетки культивировали в 6-луночных планшетах («ПанЭко», Россия) со средой ДМЕМ («ПанЭко», Россия), содержащей L-глутамин, 10 % эмбриональной бычьей сыворотки и 5 мкг/мл гентамицина, в концентрации 210 тыс. клеток на лунку. Инкубирование осуществляли при стандартных условиях (37 °С, 5 % СО 2 и 98 % влажности) в СО 2 -инкубаторе МСО-18AIC (Helicon, Япония).
Для проведения эксперимента планшеты с клетками поделены на 4 группы. В 1-й и 2-й группах клетки инкубировали при стандартных условиях. Во 2-ю группу добавлен токсин в конечной концентрации 50 нМ. Его добавляли за 2 ч до начала выделения нуклеиновых кислот. В 3-й и 4-й группах клетки инкубировали в условиях ишемии/реперфузии. Их помещали на 18 ч в СО 2 -инкубатор CB-53 (Binder, Германия) при атмосфере 5 % СО 2 и 1 % O 2 в среде ДМЕМ с 1 % эмбриональной бычьей сывороткой и глюкозой в концентрации 1 г/л (ишемия). Следующие 2 ч клетки инкубировались при атмосфере 5 % СО 2 и 18,6 % O 2 в среде ДМЕМ с 10 % эмбриональной бычьей сывороткой и глюкозой в концентрации 4,5 г/л (реперфузия). При этом в 4-ю группу добавлен токсин в конечной концентрации 50 нМ.
Для определения апоптоза использовали красители Yo-Pro 1 (1 мкМ), некроза – йодистый пропидий (1 мкМ), концентрации ионов натрия – ION NATRUIM Green AM. Красители добавляли к клеткам и инкубировали в течение 20 мин при 37 °С. Результаты фиксировали с помощью флуоресцентного микроскопа Nikon Ti S (Nikon, Япония) и обрабатывали в программе ImageJ. Полученные данные представляли в виде относительных флуоресцентных единиц.
Для поиска аминокислотной последовательности токсина mu-agatoxin-Aa1a использовали базу данных UniProt . Для его получения применяли твердофазный пептидный синтез, который осуществляли на пептидном синтезаторе ResPep SL (Intavis, Германия) по стандартному протоколу. Полученные пептиды анализировали с помощью высокоэффективной жидкостной хроматографии на хроматографической системе LC-20AD XR (Shimadzu, Япония), оборудованной спектрофотометрическим детектором SPD-20A. Для проведения масс-спектрометрического анализа использовали масс-спектрометр AUTOFLEX с модификацией MICROFLEX (Bruker Daltonics GmbH, Германия).
Выделение РНК из кардиомиоцитов H9с2 осуществляли методом гуанидин-тиоцианат-фенол-хлороформной экстракции [19] с применением реагента ExtractRNA («Евроген»,
Россия) согласно протоколу производителя. Синтез кДНК проводили с использованием фермента MMLV-ревертазы (обратная транскриптаза вируса лейкемии мышей), random hexamer (случайные праймеры) и набора MMLV RT Kit («Евроген», Россия) согласно протоколу производителя. Для проведения реакции обратной транскрипции использовали ам-плификатор нуклеиновых кислот QuantStudio 5 (Thermo Fisher Scientific, Сингапур).
Последовательность праймеров, представленная в табл. 1, подобрана в банке данных нуклеотидных последовательностей Американского национального центра биотехнологической информации (NCBI, .
Таблица 1
Table 1
Нуклеотидные последовательности 16 праймеров, необходимых для изучения уровня экспрессии генов Scn5a, Scn4a, Cacna1c, Plce1, Elavl1, Senp, Parp1, Xiap и Orail1
Nucleotide sequences of 16 primers required to study the expression levels of Scn5a, Scn4a, Cacna1c, Plce1, Elavl1, Senp, Parp1, Xiap and Orail1 genes
|
Ген Gene |
Последовательность праймера Primer sequence |
|
Scn5a, Sodium voltage-gated channel Alpha Subunit 5 |
F – CCTATACCAGCAGACCCT GAG R – CCTGATGGTGAGAGCCTCGT Z – /6-FAM/CCTGGCTGTGGTGGCCATGG /BHQ-1/ |
|
Scn4a, Sodium Voltage-Gated Channel Alpha Subunit 4 |
F – TGCTCATTCACGCGCTGTT R – ATAGATCCCCGTGAAGGTGTACT Z – /6-FAM/CCGCCTTCTTGGTCCAAACACGT/BHQ-1/ |
|
Cacna1c , Calcium voltage-gated channel Subunit Alpha1 C |
F – GTGTCTGGAGTCCCAAGTCTC R – CGCTGGAACATCTATTATGCCCT Z – /6-FAM/CATGGTGCCCCTGTGCACA/BHQ-1/ |
|
Plce1, Phospholipase C Epsilon 1 |
F – AAGGGGGATCCTCTGTGGAG R – TGGCTTCCACCACTTCCTTGAA Z – /6-FAM/AGCTGGACTGCTGGGATGGA/BHQ-1/ |
|
Elavl1, ELAV Like RNA Binding Protein 1 |
F –CGGGATAAAGTTGCAGGACACAG R – GCTTGGGCGAGCATATGATACCT Z – /6-FAM/GCACACTGAACGGCTTGAGGCT/BHQ-1/ |
|
Senp1, SUMO Specific Peptidase 1 |
F - GTGACCTGTGTGCAGAGTATC R – GCTGTAGTACCAGACTCTTCCTG Z – /6-FAM/AGCCTCATCCCCCTCAGCACT/BHQ-1/ |
|
Parp1, Poly [ADP-ribose] polymerase 1 |
F – GAGGCGTGGCAGGCAAA R – CAGGCGCAT CTGACCCTT Z – /6-FAM/TGGGCGACTTTGCGGCAGAG/BHQ-1/ |
|
Xiap, X-Linked Inhibitor Of Apoptosis |
F – TGGATTTTATGCTTTAGGTGAAGG R – ATCCAATAGATATTTACACCCTGGA Z – /6-FAM/ACTGTGGAGGAGGGCTCACGG/BHQ-1/ |
|
Orail1, ORAI Calcium Release-Activated Calcium Modulator 1 |
F – CGGCTTCGCCATGGTAGC R – TGATCATGAGGGCGAACAGG Z – /6-FAM/CGTCTTCAGCGCCTGCACCA/BHQ-1/ |
Примечание. F – прямой праймер, R – обратный праймер, Z – зонд.
Note. F – forward primer, R – reverse primer, Z – probe.
Синтез праймеров проводила российская биотехнологическая компания «Евроген» . Качество синтеза контролируется с помощью аналитического электрофореза в полиакриламидном геле и масс-спек-трального анализа. Полученные праймеры были обессолены и лиофилизированы.
ПЦР в режиме реального времени осуществляли с помощью готовой смеси qPCRmix-HS HighROX («Евроген», Россия), которая содержит HS Taq ДНК-полимеразу, референсный краситель ROX, смесь дезоксинуклеозидтрифосфатов, Mg2+ и реакционный буфер. В смесь добавляли праймеры (с зондом), матрицу ДНК и воду. При постановке реакции использовали по 2 повтора для каждого гена.
В работе применялся амплификатор QuantStudio 5 (Thermo Fisher Scientific, Сингапур). При реализации амплификации использовали программу, которая включает 1 цикл продолжительностью 5 мин при температуре 95 °С, а также 49 циклов по 10 с при 95 °С и по 30 с при 62 °С.
Для нормализации полученных данных применяли референтный ген со стабильной экспрессией – succinate dehydrogenase complex flavoprotein ( SDHA ). Динамику экспрессии исследуемых генов нормализовали по отношению к экспрессии SDHA .
Статистическую обработку данных проводили в программе OriginPro 2018 (Originlab corporation, США). Для каждого гена во всех группах рассчитывали среднее арифметическое и среднюю квадратичную ошибку. Значимость различий оценивали с помощью критерия Манна – Уитни; корреляционную связь между параметрами – с помощью коэффициента Спирмена. Различия считали статистически значимыми при р≤0,05.
Результаты. С помощью твердофазного пептидного синтеза получен токсин mu-agatoxin-Aa1a с чистотой более 95 % (рис. 1).
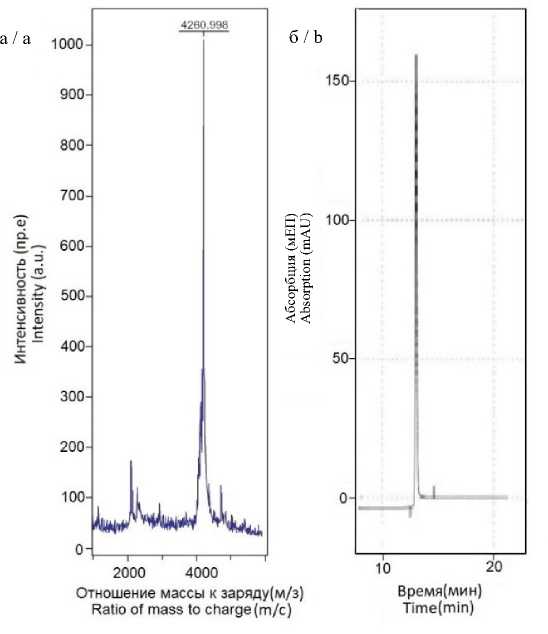
Рис. 1. Масс-спектрограмма (а) и хроматограмма (б) токсина mu-agatoxin-Aa1a (пр.е. – произвольная единица; мEП – миллиединицы поглощения)
Fig. 1. Mass spectrogram (a) and chromatogram (b) of the mu-agatoxin-Aa1a toxin (a.u. – arbitrary unit; mAU – milliabsorption units)
В эксперименте изучено влияние токсина mu-agatoxin-Aa1a в концентрации 50 нМ на развитие апоптоза в клетках кардиомиоцитов (рис. 2). Смоделированные условия ИРП про- воцировали запуск апоптоза в клетках Н9с2. Однако его уровень в клетках кардиомиоцитов, которые инкубировались с токсином, был значительно ниже, чем в клетках без токсина.
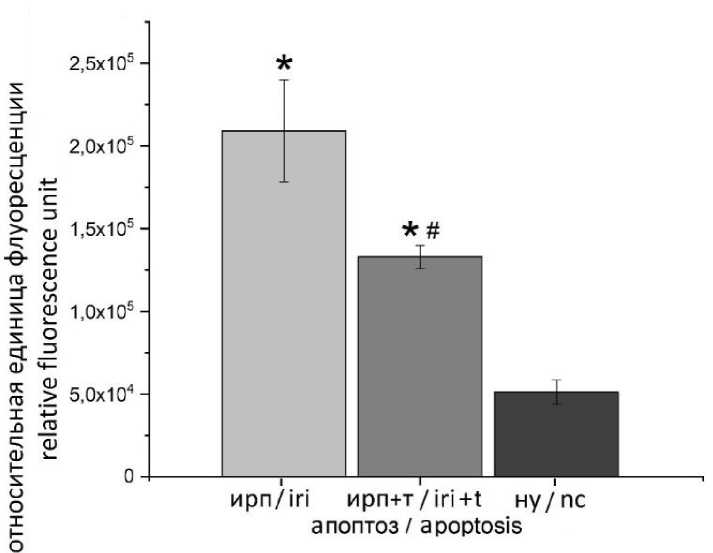
Рис. 2. Влияние токсина mu-agatoxin-Aa1a на уровень апоптоза через 2 ч реперфузии после ишемии (различия статистически значимы по сравнению с: * – нормальными условиями; # – группой без токсина, ИРП – условия ишемически-реперфузионного повреждения; ИРП + Т – условия ишемически-реперфузионного повреждения с токсином; НУ – нормальные условия)
Fig. 2. Effect of mu-agatoxin-Aa1a toxin at a concentration of 50 nM on the apoptosis level 2 hours after ischemia-reperfusion injury; * – the differences are statistically significant compared with the normal conditions; # – the differences are statistically significant compared with the group without toxin; IRI – ischemia-reperfusion injury; IRI + T – ischemia-reperfusion injury with toxin; NC – normal conditions)
Подобная ситуация отмечена и при изучении влияния токсина mu-agatoxin-Aa1a в концентрации 50 нМ на развитие некроза (рис. 3). Использование УЗИ, КТ или МРТ для предварительного построения 3D-модели органов таза и последующая операционная навигация способствуют улучшению диагностики заболеваний.
На графике видно, что токсин mu-agatoxin-Aa1a оказывает воздействие на развитие некроза, именно поэтому его уровень в группе, которая инкубировалась без токсина, существенно выше.
Смоделированные условия ИРП запускают программу клеточной гибели в Н9с2. Как правило, апоптоз и некроз сопровождаются ростом концентрации ионов натрия в клетках (рис. 4). Их высокое содержание наблюдается в клетках кардиомиоцитов без токсина, тогда как наличие mu-agatoxin-Aa1a позволяет удерживать количество натрия в клетке на уровне нормальных условий.
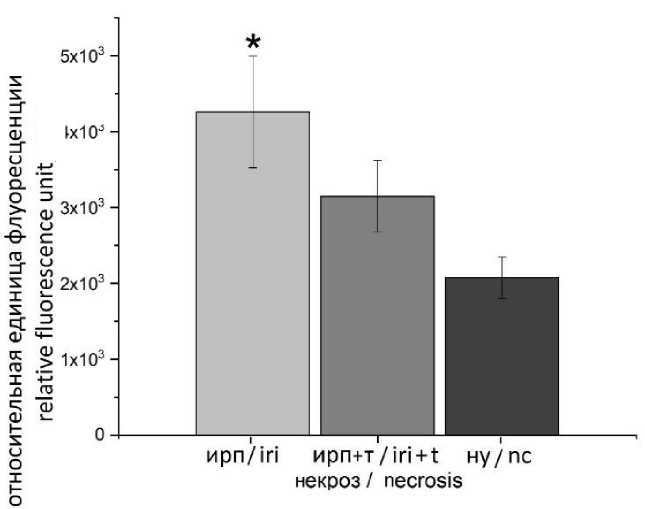
Рис. 3. Влияние токсина mu-agatoxin-Aa1a на уровень некроза через 2 ч реперфузии после ишемии (* – различия статистически значимы по сравнению с нормальными условиями)
Fig. 3. Effect of mu-agatoxin-Aa1a toxin on the necrosis level 2 hours after ischemia-reperfusion injury (* – the differences are statistically significant compared with the normal conditions
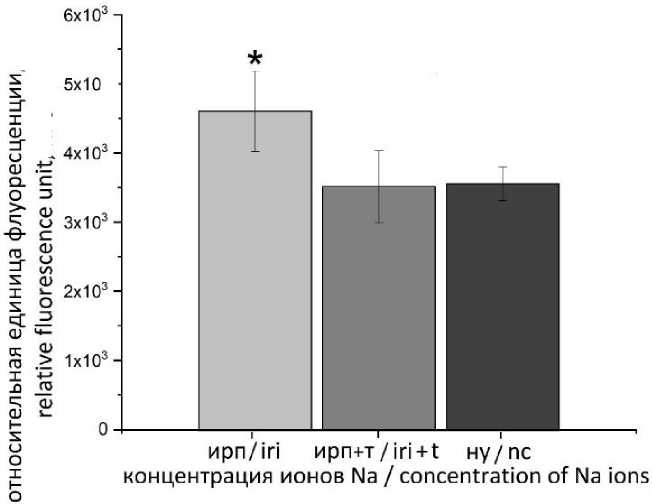
Рис. 4. Влияние токсина mu-agatoxin-Aa1a на концентрацию ионов натрия через 2 ч реперфузии после ишемии (* – различия статистически значимы по сравнению с нормальными условиями)
Fig. 4. Effect of mu-agatoxin-Aa1a toxin on the level of sodium ion concentration 2 hours after ischemia-reperfusion injury (* – the differences are statistically significant compared with the normal conditions)
Поскольку исход ИРП обусловлен генетическими факторами, то они представляют
собой важный аспект, который необходимо учитывать при проведении профилактики и терапии. На основе анализа литературы отобраны гены Scn5a, Scn4a, Cacna1c, Plce1, Elavl1, Senp, Parp1, Xiap и Orail1 [20–28], изменение экспрессии которых играет ключевую роль при развитии ишемической болезни сердца (ИБС).
Экспрессия отобранных генов изучена методом ПЦР в режиме реального времени. Ее уровень фиксировали через 20 ч после начала эксперимента. Полученные профили представлены на рис. 5.
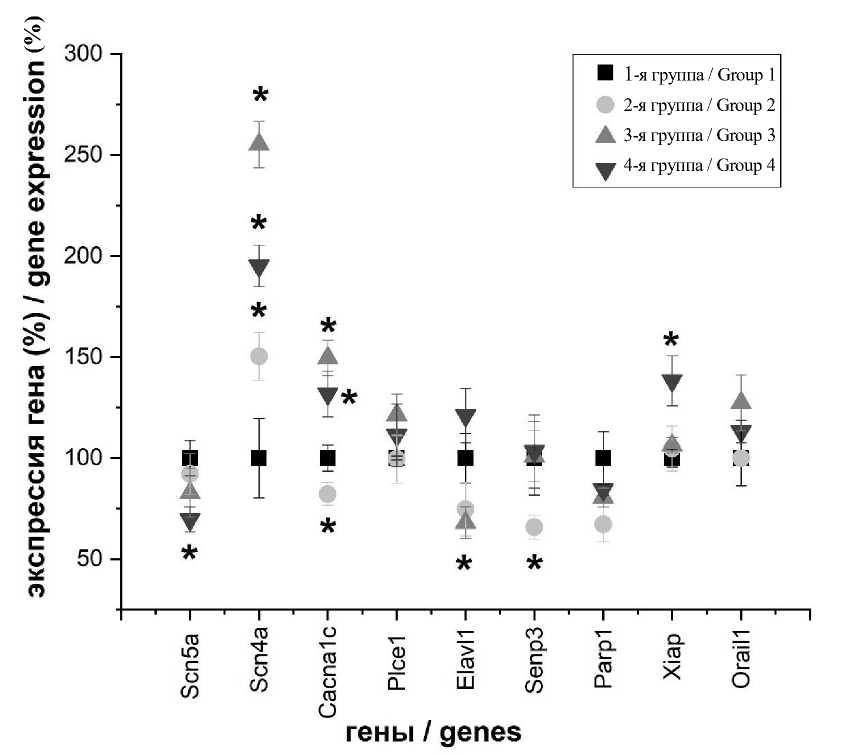
Рис. 5 . Профили экспрессии исследуемых генов в клеточной культуре Н9с2: 1-я группа – клетки инкубировали при стандартных условиях; 2-я группа – клетки инкубировали при стандартных условиях с добавлением токсина mu-agatoxin-Aa1a; 3-я группа – клетки инкубировали в условиях ишемии/реперфузии; 4-я группа – клетки инкубировали в условиях ишемии/реперфузии с добавлением токсина mu-agatoxin-Aa1a (* – различия статистически значимы по сравнению с 1-й группой)
Fig. 5. Expression profiles of the studied genes in the H9c2 cell culture: Group 1 – cells were incubated under standard conditions; Group 2 – cells were incubated under standard conditions with mu-agatoxin-Aa1a toxin; Group 3 – cells were incubated under ischemia-reperfusion injury; Group 4 – cells were incubated under ischemia-reperfusion injury with mu-agatoxin-Aa1a toxin (* – the differences are statistically significant compared with Group 1)
Высокий уровень экспрессии генов Scn4a, Cacna1c, Plce1 и Orail1 установлен в клетках, находившихся в условиях ишемии/реперфу-зии, но инкубация с токсином mu-agatoxin-Aa1a способствовала его снижению. У генов
Senp и Parp1 отмечен одинаковый уровень экспрессии в группе клеток, которые инкубировались в условиях ишемии/реперфузии и в группе, клеток, которые инкубировались в условиях ишемии/реперфузии с токсином.
Низкий уровень экспрессии генов Elavl1 и Xiap зафиксирован в клетках 3-й группы. Добавление токсина mu-agatoxin-Aa1a увеличивало его (4-я группа). Незначительное снижение уровня экспрессии гена Scn5a отмечено в клетках Н9с2 3-й группы, в присутствии токсина показатели снижались значительно (4-я группа). Таким образом, полученные данные подтверждают, что токсин mu-agatoxin-Aa1a в условиях ишемии/реперфузии оказывает влияние на модуляцию уровня экспрессии генов Scn5a, Scn4a, Cacna1c, Plce1, Elavl1, Senp, Parp1, Xiap и Orail1 , связанных с ИБС.
Обсуждение. На основе полученных данных можно предположить, что токсин mu-aga-toxin-Aa1a оказывает влияние на систему внутриклеточной сигнализации, которая способствует передаче сигналов при рецептор-за-висимой активации функций клеток. Установлено, что исследуемый токсин изменяет уровень экспрессии гена Calcium voltage-gated channel subunit alpha1 C ( CACNA1C ), который сопряжен с синдромом Бругада (наследственная каналопатия), синдромом удлиненного интервала QT (8-го типа), а также с синдромом Тимоти [29]. Вышеперечисленные синдромы выступают в качестве основы для развития внезапной сердечной смерти [30]. Экспрессия генов Phospholipase C epsilon1 ( Plce1 ) и ORAI calcium release-activated calcium modulator 1 ( Orail1 ) усиливается при ишемически-реперфузионном повреждении [23, 28]. Однако под влиянием токсина mu-agatoxin-Aa1a в условиях ишемии/репефузии ее уровень снижается . Подобное воздействие токсин оказывает и на ген Sodium Voltage-Gated Channel Alpha Subunit 4 (SCN4A) , неисправное функционирование которого способствует развитию гиперкалиемического периодического паралича [31]. Экспрессия генов SENP3 и Parp1 под воздействием изучаемого токсина не меняется. Ее интенсивность в условиях ишемии/реперфузии без токсина и с ним имеет схожие значения. Известно, что ген SENP3 кодирует SUMO-специфическую пептидазу 3 (SUMO-specific peptidase 3) и регулирует внутриклеточные процессы, которые способствуют гибели клеток после ишемии [32]. Установлено, что нокдаун гена SENP3
предотвращает запуск процесса апоптоза [33]. Ген Poly-(ADP-ribose) polymerase 1 ( Parp1) кодирует поли(АДФ-рибоза)-полимеразу 1 (PARP1) – фермент, который играет ключевую роль в репарации повреждений ДНК и процессах транскрипции. Показано, что ингибирование PARP1 защищает кардиомиоциты от ишемии-реперфузии миокарда [34]. Изменение профиля экспрессии отмечено у генов ELAVL1 и XIAP : ее уровень растет под воздействием mu-agatoxin-Aa1a в условиях ише-мии/реперфузии. Доказано, что ген ELAVL1 кодирует белок HuR (Human antigen R), относящийся к семейству ELAVL-like РНК-связы-вающих белков. Его нокдаун предотвращает повреждение миокарда при ишемии/реперфу-зии [34]. Ген XIAP ( BIRC4 , baculoviral IAP repeat-containing protein 4) кодирует белок, который играет важную роль в регуляции иммунного ответа и апоптоза, предотвращая гибель клеток. Его сверхэкспрессия ингибирует апоптоз, вызванный ИРП [35]. Исследуемый токсин при ишемии/реперфузии понижает экспрессию гена Sodium voltage-gated channel alpha subunit 5 (SCN5A). Ранее доказано, что сердечная аритмия и внезапная сердечная смерть являются следствием его генетических вариантов. Он оказывает влияние на активность натриевого канала Na V 1.5. Нарушения в работе гена SCN5A , которые связаны с уменьшением активности Na V 1.5, приводят к снижению I Na . Это способствует развитию синдрома Бругада (BrS), синдрома слабости синусового узла, фибрилляции предсердий и другим заболеваниям [36].
Заключение. Таким образом, полученные данные дают новое представление о внутриклеточных молекулярных механизмах, которые инициированы ишемически- реперфузионным повреждением. Токсин mu-agatoxin-Aa1a в условиях ишемии/реперфузии оказывает влияние на модуляцию уровня экспрессии генов Scn5a, Scn4a, Cacna1c, Plce1, Elavl1 , Senp, Parp1, Xiap и Orail1 , играющих ключевую роль в развитии ишемической болезни сердца. Свойства токсина и анализ изменения экспрессии отобранных генов могут послужить основой для разработки новых терапевтических препаратов и тест-систем.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект № FEUF-2023-0004).


