Влияние пептидов на постлучевое восстановление гемопоэза
Автор: Горячева А.С., Лузянина А.А., Изместьева О.С., Жаворонков Л.П., Дейгин В.И., Саенко А.С.
Рубрика: Научные статьи
Статья в выпуске: 4 т.21, 2012 года.
Бесплатный доступ
В работе исследована возможность ослабления повреждающего действия ионизирующей радиации на кроветворную систему мышей с помощью ряда низкомолекулярных линейных и циклических пептидов. Полученные результаты свидетельствуют о том, что двукратное внутрибрюшинное введение препаратов после облучения приводит к практически полному восстановлению клеточности костного мозга и селезёнки у подопытных мышей, облучённых в дозе 4 Гр, уже к 8-м суткам. Отмечены признаки ускоренного восстановления гемопоэза и в периферической крови (ретикулоцитоз). При облучении животных в более высокой дозе (6 Гр) отмечается положительное влияние препаратов по критериям клеточности костного мозга и селезёнки, однако эффект проявлялся слабее, чем при лечении мышей, облучённых в дозе 4 Гр.
Гемопоэз, пептиды, ионизирующее излучение, мыши
Короткий адрес: https://sciup.org/170170085
IDR: 170170085
Текст научной статьи Влияние пептидов на постлучевое восстановление гемопоэза
Система кроветворения (гемопоэза), обеспечивающая созревание и выход в гемоциркуляцию всех видов клеток крови, является критической радиопоражаемой физиологической системой организма высших животных и человека, повреждение которой при ионизирующем излучении в сублетальных и минимальных летальных поглощённых дозах определяет клиническую картину и, в конечном счёте, исход острой лучевой болезни [7, 9]. Известно, что причиной нарушений является гибель значительной части кроветворных клеток, относящихся к компартмен-там стволовых и пролиферирующих клеток. Более радиорезистентные неделящиеся (созревающие и зрелые) клеточные элементы костного мозга обеспечивают поддержание клеточно-сти крови в течение определённого времени – от нескольких суток до 1-1,5 недель. Решающим моментом для положительного исхода лучевой болезни является скорость восстановления су-прессированного кроветворения, зависящая от глубины первичного опустошения указанных популяций, эффективности систем репарации индуцированных радиацией повреждений в клетках, длительности так называемого пострадиационного блока митозов, а также срока начала фазы логарифмического роста популяции стволовых клеток, в результате которого в крови могут появиться вновь образованные функционально активные клетки.
Принципиально сходный механизм повреждения гемопоэза отмечается и при локальных, но достаточно высокодозных воздействиях во время сеансов лучевой терапии опухолей, а также в процессе широко применяемой в настоящее время цитостатической терапии злокачественных новообразований.
Разработка способов ускоренного постлучевого восстановления гемопоэза является по-прежнему актуальной задачей радиобиологии и радиационной медицины [1, 2, 6, 10]. Одним из Горячева А . С . *– аспирант ; Лузянина А . А . – научн . сотр .; Изместьева О . С . – вед . научн . сотр ., к . б . н .; Жаворонков Л . П . – зав . лаб ., д . б . н .; Саенко А . С . – зам . директора по научн . работе , д . б . н ., профессор . ФГБУ МРНЦ Минздрава России . Дейгин В . И . – научн . сотр ., д . б . н ., профессор . ИБХ РАН .
подходов, активно реализуемых в настоящее время, является поиск и создание фармакологических гемостимулирующих средств. Способность к гемостимуляции обнаружена у некоторых соединений класса синтетических пептидов, причём у некоторых из них гемотропная активность сочетается с иммуномодулирующими свойствами [4, 5, 8]. Синтез и биологические испытания новых пептидных соединений направлены, с одной стороны, на поиск наиболее активных из них, а с другой – на изучение зависимостей структура-действие, в частности – сохранение нужного эффекта при создании циклических структур, позволяющих не только парентеральное, но пероральное введение препаратов в организм [3].
Целью настоящей работы является изучение влияния ряда низкомолекулярных линейных и циклических пептидов на постлучевое восстановление кроветворения и выявление среди них соединений, обладающих гемостимулирующим действием.
Материалы и методы
В работе использованы соединение пептидной природы: трипептиды dAla-γdGlu-dTrp (a-{ew}), dLeu-γdGlu-dTrp (l-{ew}), и их циклические аналоги Cyclo-{(dAla-dGlu)-dTrp} (Cyclo-{(ae)-w}), Cyclo-{(dLeu-dGlu)-dTrp} (Cyclo-{(le)-w}). Препараты синтезированы в ООО «Пептос Фарма» (Москва). Конечные продукты очищали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) в градиенте 0,1 % АсОН/этанольного буфера (5-30 %). Чистоту и структуру пептидов подтверждали данными тонкослойной хроматографии, ВЭЖХ, масс- и ЯМР-спектроско-пии высокого разрешения.
Эксперименты проводились на 2-3-месячных мышах-самках (CBAxC57Bl/6)F1, с массой тела 22-24 г, полученных из питомника РАН «Столбовая» и содержавшихся в стандартных условиях и на стандартном рационе. В каждой экспериментальной группе было по 13-15 животных. Перед опытами мыши находились на карантине в течение 2 недель.
Мышей подвергали действию гамма-лучей 60Co на установке «Луч» (Россия) в дозах 4 или 6 Гр (мощность дозы 48 сГр/мин).
При исследовании влияния указанных выше соединений на процесс постлучевого восстановления гемопоэза, растворы препаратов вводили мышам внутрибрюшинно в разовой дозе 100 мкг/кг в 0,2 мл среды 199 через 24 и 48 часов после облучения. Состояние системы кроветворения анализировали через 3 и 8-9 суток после облучения по комплексу параметров – содержанию форменных элементов в периферической крови, количеству миелокариоцитов в бедренной кости, содержанию спленоцитов, а также по выходу селезёночных эндоколоний (на 9 сутки после 6,0 Гр). Содержание лейкоцитов, тромбоцитов и ретикулоцитов в периферической крови, взятой из хвостовой вены, определяли при помощи гемоцитометра. Для определения общей клеточности костного мозга взвесь миелокариоцитов, полученную путём вымывания средой 199 из бедренной кости, суспендировали с помощью шприцевания в 5 %-й уксусной кислоте, а затем определяли число клеток на гемоцитометре и подсчитывали содержание миело-кариоцитов в бедренной кости с учётом объема просчитанной взвеси и разведения. Клеточ-ность селезёнки определяли по содержанию спленоцитов в гомогенизате.
Содержание стволовых кроветворных клеток определяли по тесту селезёночных эндоколоний (Till и McCulloch) [11]. На 9 сутки после облучения мышей умерщвляли дислокацией шей- ных позвонков, селезёнки извлекали, фиксировали в растворе Буэна, а затем подсчитывали число макроскопически видимых на поверхности селезёнки колоний.
Для всех данных были подсчитаны средние арифметические значения и их стандартные ошибки. Для определения значимости межгрупповых различий были использованы параметрические критерии (t-критерий Стьюдента, F-критерий Фишера) и непараметрические (Вилкоксо-на-Манна-Уитни, Вардена, медианный критерий кси-квадрат). Статистический анализ проводился с помощью программы Origin 6.0 («MicroCal Software» США).
Результаты исследования
На рисунках 1 и 2 представлены данные, характеризующие состояние системы кроветворения у мышей на 3 и 8 сутки после облучения в дозе 4,0 Гр на фоне применения исследуемых пептидных соединений. Показано, что их введение сопровождается статистически значимым повышением содержания миелокариоцитов в бедренной кости уже на 8 сутки. При этом абсолютные значения соответствующих показателей при применении низкомолекулярных трипептидов и их циклических аналогов составили в среднем 19,4-23,4·106 клеток в костном мозге бедренной кости (облучённый контроль – 15,6·106). Как видно из данных, приведённых на рисунке 1, в период максимального опустошения костного мозга (3 суток после радиационного воздействия) показатели контрольной и опытных групп животных (нормированные на данные интактного контроля) практически не различаются (25 % и 24-31 %, соответственно). Однако к 8 суткам (логарифмическая фаза роста популяции) клеточность костного мозга у мышей опытных групп в 1,5 раза превышает показатели облучённого контроля, достигая уровня содержания миелокариоцитов в бедренной кости интактных животных. Следует отметить, что клеточность селезёнки (рис. 2) мышей уже через 3 суток статистически значимо выше в группах, в которых мыши получали dLeu-γdGlu-dTrp и Cyclo-{(dLeu-dGlu)-dTrp}, а к 8 суткам после облучения количество спленоцитов в 1,6 раза превышает показатели облучённого контроля. При введении линейных и циклических пептидов содержание спленоцитов составляет 50,6-56,8·106 (облучённый контроль – 33,3·106).
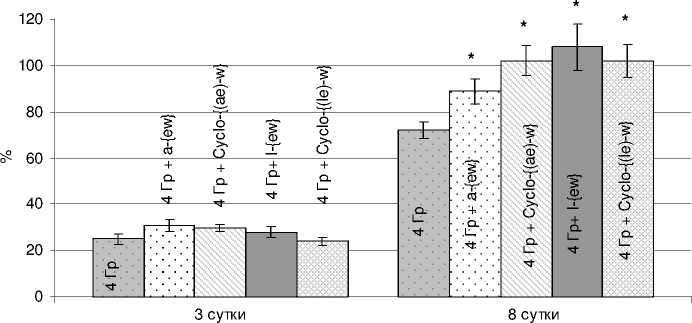
Рис . 1. Влияние пептидов на постлучевое восстановление клеток костного у мышей, облучённых в дозе 4 Гр (M±m).
* – значимость различий (р<0,05) рассчитана по отношению к группе «Облучённый контроль 4 Гр»; по оси ординат – общая клеточность костного мозга в бедренной кости в % к показателю интактного контроля; по оси абсцисс – сутки после облучения.
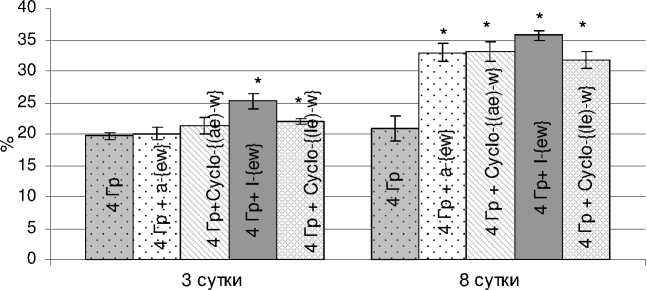
Рис . 2. Влияния пептидов на постлучевое восстановление клеточности селезёнки у мышей, облучённых в дозе 4 Гр (M±m).
* – значимость различий (р<0,02 – 3 сутки, р<0,0002 – 8 сутки) рассчитана по отношению к группе «Облучённый контроль 4 Гр»; по оси ординат – содержание спленоцитов в % к показателю интактного контроля; по оси абсцисс – сутки после облучения.
В таблице 1 представлены данные о содержании лейкоцитов, тромбоцитов и ретикулоцитов в крови животных опытных групп (получавших после облучения пептиды) и контрольной группы, облучённой в дозе 4 Гр, а также показатели интактных животных. Из анализа результатов следует, что через 3 суток после радиационного воздействия в крови регистрируется выраженная лейкопения при незначительном (на 10 %) снижении содержания тромбоцитов. С учётом необходимости восстановления пула стволовых клеток костного мозга и известных временных промежутков, необходимых для созревания вновь образованных гемопоэтических клеток, вполне ожидаемым представляется отсутствие существенных различий с облучённым контролем через 3 суток после облучения. Однако активация восстановления супрессированного облучением гемопоэза чётко проявляется через 8 суток не только по клеточности кроветворных органов, но и по содержанию тромбоцитов, примерно в 2 раза превышающему уровень контроля. Факт ускоренного выхода клеток из мест гемопоэза в кровь демонстрирует существенное, в 2-3 раза, увеличение в крови количества ретикулоцитов – предшественников эритроцитов.
Таблица 1
Влияние пептидов на содержание клеточных элементов в периферической крови мышей после облучения в дозе 4 Гр
|
Группа |
Сутки после облучения |
Кол-во лейкоцитов (109/л) M±m |
Кол-во тромбоцитов (109/л) M±m |
Кол-во ретикулоцитов (109/л) M±m |
|
Интактный контроль |
3 8 |
10,1±0,85 7,23±0,45 |
1277±87,2 1000±36,0 |
54±6 88,4±11,4 |
|
Облученный контроль (4 Гр) |
3 8 |
0,69±0,09 1,89±0,48 |
1077±44,7 288±36,1 |
1,14±0,6 74±11,4 |
|
4 Гр + a-{ew} |
3 8 |
0,8±0,14 1,36±0,09 |
1277±79,2 617±56,2* |
1,14±0,4 227,2±28,6* |
|
4 Гр + Cyclo-{(ae)-w} |
3 8 |
0,8±0,05 1,61±0,2 |
1116±92,5 606±40,5* |
0,86±0,4 245,8±19* |
|
4 Гр + l-{ew} |
3 8 |
0,71±0,07 1,46±0,2 |
1139±76,9 513±62,1* |
1,14±0,4 188,6±20* |
|
4 Гр + Cyclo-{(le)-w} |
3 8 |
0,54±0,06 1,22±0,12 |
1116±46,8 578±32,2* |
1,72±0,6 172,5±41* |
– значимость различий (р<0,02) по отношению к показателям группы облучённого контроля 4 Гр.
При облучении животных в более высокой дозе (6 Гр) отмечается положительное влияние препаратов по критериям клеточности костного мозга и селезёнки. Как можно видеть из данных, представленных на рисунке 3, на 3 сутки после радиационного воздействия во всех опытных группах клеточность костного мозга хотя и резко снижена, но статистически значимо выше, чем в группе «облучённый контроль 6 Гр». Однако к 9 суткам абсолютное значение этого показателя при введении пептидов a-{ew} и Cyclo-{(le)-w} статистически значимо выше (р<0,05) и составляет 10,5·106 (облучённый контроль – 7,96·106), в то же время при введении пептидов l-{ew} и Cyclo-{(ae)-w} клеточность костного мозга не отличается от уровня облучённого контроля и составляет около 8,7·106 и 7,1·106, соответственно. На рисунке 4 представлена клеточ-ность селезёнки мышей на 3 сутки. Все исследуемые пептиды статистически значимо увеличивали этот показатель. Абсолютные значения составляют 15,7-18,9·106 клеток селезёнки (облучённый контроль – 10,65·106).
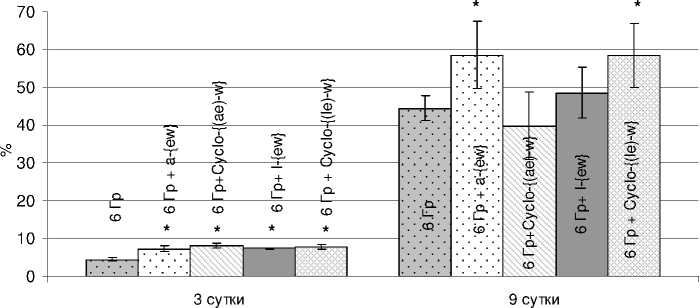
Рис . 3 Влияние пептидов на постлучевое восстановление клеток костного мозга у мышей, облучённых в дозе 6 Гр (M±m).
* – значимость различий (р<0,05) рассчитана по отношению к группе «Облучённый контроль 6 Гр»; по оси ординат – общая клеточность костного мозга в бедренной кости в % к показателю интактного контроля; по оси абсцисс – сутки после облучения.
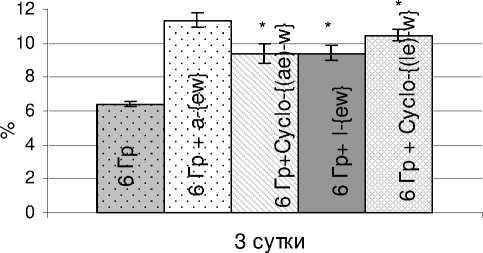
Рис . 4. Влияния пептидов, введённых облучённым в дозе 6 Гр мышам на восстановление клеточности селезёнки (M±m).
* – значимость различий (р<0,001) рассчитана по отношению к группе «Облучённый контроль 6 Гр»; по оси ординат – содержание спленоцитов в % к показателю интактного контроля; по оси абсцисс – сутки после облучения.
Таблица 2
Влияние пептидов на содержание клеточных элементов в периферической крови мышей после облучения дозе 6 Гр
|
Группа |
Сутки после облучения |
Кол-во лейкоцитов (109/л) M±m |
Кол-во тромбоцитов (109/л) M±m |
Кол-во ретикулоцитов (109/л) M±m |
Число эндоколоний на селезёнку M±m |
|
Интактный контроль |
3 9 |
7,06±0,4 9,08±0,8 |
1086±49,6 1280±56 |
64±5,1 |
|
|
Облученный контроль (6 Гр) |
3 9 |
0,28±0,05 0,65±0,12 |
947±27,6 287±31,1 |
82,8±17,2 |
1,7±0,4 |
|
6 Гр + a-{ew} |
3 9 |
0,41±0,07 0,59±0,08 |
857±56,7 421±30,5 |
130±17,8 |
2,3±0,4 |
|
6 Гр + Cyclo-{(ae)-w} |
3 9 |
0,4±0,02 0,58±0,04 |
1057±54 264±13,1 |
95,8±16 |
2,4±0,7 |
|
6 Гр + l-{ew} |
3 9 |
0,28±0,04 0,73±0,09 |
1008±59,5 321±29,9 |
98,6±16 |
1,7±0,6 |
|
6 Гр + Cyclo-{(le)-w} |
3 9 |
0,29±0,05 0,71±0,08 |
1150±18,4* 314±36 |
128,6±33,2 |
5,0±1,4* |
– значимость различий (р<0,05) по отношению к показателям группы облучённого контроля 6 Гр.
В таблице 2 представлены результаты влияния пептидов на содержание клеточных элементов в периферической крови мышей после облучения в большей дозе – 6 Гр. Из анализа результатов следует, что через 3 суток после облучения животных в крови также регистрируется выраженная лейкопения при незначительном снижении содержания тромбоцитов. Однако чёткой активации (как после облучения в дозе 4 Гр) восстановления форменных элементов периферической крови мышей в изученные сроки не наблюдается. Содержание тромбоцитов при применении исследуемых пептидов составляет 264-421·109/л (облучённый контроль 6 Гр – 287·109/л), ретикулоцитов в периферической крови опытных групп – 96-130·109/л (облучённый контроль 6 Гр – 83·109/л).
Заключение
Проблема быстрого восстановления гемопоэза, супрессированного воздействием ионизирующей радиации в достаточно высоких (сублетальных и минимальных летальных) дозах является сложной для решения, поскольку в ближайшие сроки после облучения неизбежна гибель большей части стволовых и пролиферирующих клеток. Скорость восстановления кроветворения, в основном, лимитируется длительностью клеточного цикла, поэтому теоретически стимуляция гемопоэза после свершившегося облучения возможна за счёт повышения эффективности репарационных процессов, а также укорочения временного промежутка от облучения до начала интенсивной пролиферации выживших клеточных элементов.
Полученные данные свидетельствуют о том, что в сублетальном диапазоне доз реально существует возможность ускорения восстановления гемопоэза, поскольку некоторые синтетические пептиды, применяемые в ближайшие сутки после облучения, проявляют достоверную гемостимулирующую активность.
Представляет интерес тот факт, что статистически значимые различия с облучённым контролем выявляются, например, по клеточности селезёнки уже в ближайшие сроки (через 3 суток после облучения). Это позволяет предположить положительную роль препаратов в репарационных процессах, поскольку в эти сроки ожидать образования новых клеток не приходится. Ускоренный выход в кровь новых клеточных элементов подтверждается на 8-9 сутки увеличением клеточности кроветворных органов, выходом селезёночных эндоколоний, а также относительным ретикулоцитозом в периферической крови.
Хотя выявленные эффекты существенно слабее проявляются при большей дозе облучения (6 Гр), установленные закономерности позволяют рассчитывать на то, что гемостимуляция синтетическими пептидами может, наряду с другими подходами, занять своё место в комплексной терапии последствий действия ионизирующих излучений и, вероятно, химиотерапевтических препаратов.
Эффект стимуляции линейными и циклическими пептидами dAla-γdGlu-dTrp, dLeu-γdGlu-dTrp, Cyclo-{(dAla-dGlu)-dTrp} и Cyclo-{(dLeu-dGlu)-dTrp} повреждённого кроветворения был продемонстрирован и в других независимых экспериментах, при других вариантах лучевого воздействия и применения препаратов (фракционированное облучение, лечебное, профилактическое, смешанное применение пептидов (данные не приводятся)).
Работа выполнена в рамках НИОКР «Структурно-функциональные исследования биологически активных пептидов и пептидомиметиков, влияющих на систему кроветворения интактных и облучённых животных», а также при частичной финансовой поддержке Минобрнауки РФ, госконтракт № 14.740.11.0116. Работа отмечена почётным знаком им. Е.Р. Дашковой II степени (постановление губернатора Калужской области от 28.11.2011 г.).
Список литературы Влияние пептидов на постлучевое восстановление гемопоэза
- Баранов А.Е., Рождественский Л.М. Аналитический обзор схем лечения острой лучевой болезни, используемых в эксперименте и клинике//Радиационная биология. Радиоэкология. 2008. Т. 48, № 3. С. 287-302.
- Гребенюк А.Н., Зацепин В.В., Аксенова Н.В. и др. Влияние последовательного применения препарата Б-190 и интерлейкина-1β на выживаемость и костномозговое кроветворение облучённых//Радиационная биология. Радиоэкология. 2010. Т. 50, № 6. С. 475-480.
- Дейгин В.И., Саенко А.С., Сёмин Ю.А. и др. Изучение влияния пептидных производных дикетопиперазинов на стволовые кроветворные клетки нормального организма и облучённые in vitro клетки костного мозга//Радиационная биология. Радиоэкология. 2011. Т. 51, № 5. С. 39-43.
- Замулаева И.А., Саенко А.С., Сёмина О.В. и др. Влияние оптических изомеров синтетического пептида iEW на колониеобразующую способность костного мозга in vivo//Бюллетень экспериментальной биологии и медицины. 2005. № 9. С. 335-338.
- Лузянина А.А., Горячева А.С., Сёмин Ю.А. и др. Изучение влияния синтетических трипептидов на стволовые гемопоэтические клетки в норме и при гамма-облучении//Радиационная биология. Радиоэкология. 2012. Т. 52, № 3. С. 257-260.
- Мороз Б.Б., Дешевой Ю.Б., Сукоян Г.В. и др. Влияние мексидола на пострадиационное восстановление кроветворной системы//Радиационная биология. Радиоэкология. 2009. Т. 49, № 1. С. 90-96.
- Муксинова К.Н., Мушкачева Г.С. Клеточные и молекулярные основы перестройки кроветворения при длительном радиационном воздействии. М.: Энергоатомиздат, 1990. 160 с.
- Поверенный А.М., Виноградова Ю.Е., Дейгин В.И. Геморегуляторные синтетические пептиды//Терапевтический архив. 2000. № 7. С. 74-76.
- Поровский Я.В. Изменение локальной регуляции кроветворения при хроническом воздействии ионизирующего излучения//Бюллетень сибирской медицины. 2009. Т. 8, № 4. С. 52-59.
- Цыб А.Ф. Активация кроветворения и радиорезистентность организма//Тезисы докладов научной конференции. Обнинск: Изд-во НИИМР АМН СССР, 1990. 97 с.
- Till J.E., McCulloch E.A. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells//Radiat. Res. 1961. V. 14. P. 213-222.


