Влияние питьевого поведения на содержание альфа-амилазы ротовой жидкости у студентов с предиктором воспаления и без них на фоне учебного стресса
Автор: Баишева Г.М., Мельник К.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Физиология
Статья в выпуске: 1 т.15, 2019 года.
Бесплатный доступ
Цель: изучить содержание а-амилазы (sAA) в ротовой жидкости у здоровых молодых людей в зависимости от наличия предиктора воспалительных заболеваний полости рта при физиологически откорректированном питьевом поведении на фоне учебного стресса. Материал и методы. В течение трех месяцев изучали три группы: основную (30 чел.), в которой употребляли воду, обработанную электромагнитным аппаратом ОАО «Аква-Система», из расчета 30-35 мл на 1 кг массы тела; плацебо-группу (30 чел.), в которой употребляли воду, обработанную плацебо-прибором, не имеющим внутри корпуса электромагнитного устройства, из расчета 30-35 мл на 1 кг массы тела; контрольную (25 чел.), в которой сохранялось индивидуальное питьевое поведение исследуемых. Для выявления особенностей колебаний sAA группы разделены на субпопуляции с предиктором воспалительных заболеваний полости рта (ИЛ-1(3>212 пг/мл) и без такового (ИЛ-1(3
Амилаза, интерлейкин-1р, питьевое поведение, ротовая жидкость, стресс
Короткий адрес: https://sciup.org/149135272
IDR: 149135272 | УДК: 612.013.1
Текст научной статьи Влияние питьевого поведения на содержание альфа-амилазы ротовой жидкости у студентов с предиктором воспаления и без них на фоне учебного стресса
1 Введение. Все более пристальное внимание исследователей привлекает взаимодействие нейроэндокринной и иммунной систем, что нашло свое выражение в появлении термина «психоиммунология» [1]. Одним из связующих звеньев между автономной нервной и иммунной системами служит альфа-амилаза. Результаты исследований у человека и животных демонстрируют, что автономная нервная система принимает значимое участие в секреции альфа-амилазы ротовой жидкости (sAA) с вкладом как альфа-адренергических, так и бета-адренергических механизмов, в связи с этим sAA может рассматриваться как косвенный показатель ее активации [2]. Саливадиагностика помогает определить стресс двух типов: хронический, ассоциированный с увеличением количества кортизола в слюне и снижением IgA и лизоцима; острый, связанный с повышение активности альфа-амилазы [3]. Кроме того, в модулировании различных аспектов социального и эмоционального поведения играют роль цитокины [4]. Так, ИЛ-1β, помимо ключевой роли медиатора воспаления при периодонтите [5], тесно коррелирует с состоянием гнева [4]. Каждый из этих критериев ротовой жидкости имеет свои сильные и слабые стороны, учитывая недостаточное количество данных, имеющееся на настоящий момент [6].
Существует корреляция между уровнем кортизола слюны и активностью альфа-амилазы, в синтезе которой участвует автономная нервная система с преобладанием влияния симпатического отдела через запуск вторичных посредников, в том числе кальция [7]. Стресс-индуцированные состояния способствуют хронической активации симпатической системы и гипоталамо-гипофизарно-надпочечнико-вой оси, что ведет к развитию хронических воспалительных заболеваний, в том числе полости рта [8– 12]. В противоположность этому, физиологическая коррекция питьевого поведения, согласно данным L. Priumboom et al. [13], приводит к уменьшению активности гипоталамо-гипофизарно-надпочечниковой оси (HPA), уменьшает стрессочувствительность, регулирует симпатическую / парасимпатическую активность [14].
Цель: изучить содержание α-амилазы в ротовой жидкости у здоровых молодых людей в зависимости от наличия предиктора воспалительных заболеваний полости рта при физиологически откорректированном питьевом поведении на фоне учебного стресса.
Задачи:
-
1. Измерить концентрацию ИЛ-1β ротовой жидкости у здоровых молодых добровольцев.
-
2. Определить уровень активности секреторной альфа-амилазы на фоне коррекции питьевого поведения.
-
3. Выяснить уровень симпатикотонии участников в условиях учебного стресса.
Материал и методы. В исследовании приняли участие 85 человек обоего пола (средний возраст 18 лет) из 193 желающих. Проведено открытое, сравнительное, контролируемое в параллельных группах исследование, проходившие в три этапа: первичный сбор данных, или первый этап (20.09.2014), второй этап (08.11.2014), третий этап (20.12.2014). Сформированы три репрезентативные группы:
основная (30 человек, употребляли 30–35 мл воды на 1 кг массы тела, обработанной электромагнитным аппаратом ОАО «Аква-Система» (Москва));
плацебо-группа (30 человек, употребляли 30– 35 мл воды на 1 кг массы тела, обработанной плацебо-прибором, не имеющим внутри корпуса электромагнитного устройства);
контрольная (25 человек, не меняющих свое питьевое поведение).
Участники использовали в приборах (модель «аквадиск-кувшин») предварительно очищенную с помощью бытовых фильтров воду из централизованных источников, а также бутилированную воду. Электромагнитное воздействие устройства (согласно инструкции) приводит к преобразованию структуры воды (технология TWS — патент РФ №2192902 «Способ передачи и записи энергоинформационных потоков на вещество или комбинацию веществ»), что сокращает избыточное содержание вредных примесей: согласно заключению аналитического центра химического факультета МГУ им. М. В. Ломоносова (протокол №4145 от 23.04.2002), концентрация железа уменьшается в 3–5 раз, азота аммонийного в 3 раза, хлора активного и сероводорода в 2 раза html).
Критерии включения в исследование: клинически здоровые студенты-добровольцы разных полов (18– 20 лет). Критерии исключения: неконтролируемая гипертензия, сахарный диабет, заболевания сердца, легких и почек; прием медикаментов, которые влияют на аппетит или вес тела; онкологические заболевания.
Формирование групп проходило случайным способом (рандомизацией) после получения постановления о соответствии исследования этическим нормам и информированного письменного согласия от участников (протокол №124 от 10.10.2012 комитета по биоэтике при СамГМУ).
Содержание альфа-амилазы ротовой жидкости определяли колориметрическим методом на автоматизированном оборудовании Cobas C111 (Roche) и коммерческих тест-системах этой же компании. Пробы хранили при –20°С до момента исследования (не дольше двух недель), после полного размораживания их тщательно перемешивали, осадок отделяли центрифугированием 15 минут при 1500 g. В течение получаса перед началом измерений пробы находились при комнатной температуре. Далее материал разводился физиологическим раствором (в эмпирически подобранном титре 1:100).
Таблица 1
Содержание альфа-амилазы в ротовой жидкости студентов всех групп на 1–3-м этапах исследования
|
sAA, МЕ/л |
Основная группа (1), Ме (25%; 75%) |
Плацебо-группа (2), Ме (25%; 75%) |
Контрольная группа (3), Ме (25%; 75%) |
р, ККУ |
р, КМУВ (1)-(2) |
р, КМУВ (1)-(3) |
р, КМУВ (2)-(3) |
|
1-й этап |
272,2 (125,8–426,9) |
371,2 (116,1–714,6) |
395,5 (137,1–889,5) |
0,547 |
0,331 |
0,381 |
0,735 |
|
2-й этап |
167,9 (35,0–308,4) |
259,9 (70,1–401,2) |
112,0 (42,0–662,7) |
0,263 |
0,095 |
0,348 |
0,892 |
|
3-й этап |
249,9 (112,0–475,1) |
292,5 (121,1–529,9) |
565,9 (122,4–852,5) |
0,184 |
0,313 |
0,068 |
0,379 |
П р и м еч а н и е : sAA — альфа-амилаза; ККУ — критерий Краскела-Уоллиса; КМУВ — критерий Манна-Уитни-Вилкоксона.
Таблица 2
Содержание альфа-амилазы ротовой жидкости в субпопуляциях без предиктов воспаления (с ИЛ-1β≤212 пг/мл) на 1–3-м этапах исследования
|
sAA, МЕ/л |
Основная группа (1), Ме (25%; 75%) |
Плацебо -группа (2), Ме (25%; 75%) |
Контрольная группа (3), Ме (25%; 75%) |
р, ККУ |
р, КМУВ (1) — (2) |
р, КМУВ (1) — (3) |
р, КМУВ (2) — (3) |
|
1-й этап |
266,0 (68,1–386,5) |
556,3 (118,6–878,1) |
395,5 (154,3–910,8) |
0,105 |
0,038 |
0,140 |
0,894 |
|
2-й этап |
167,9 (64,6–333,5) |
274,5 (67,6–564,9) |
475,6 (62,2–951,2) |
0,206 |
0,157 |
0,126 |
0,585 |
|
3-й этап |
245,4 (81,7–578,5) |
264,5 (108,9–529,9) |
620,8 (264,9–941,6) |
0,05 |
0,405 |
0,019 |
0,095 |
Примечание: sAA — альфа-амилаза; ИЛ-1β — интерлейкин-1β; ККУ — критерий Краскела-Уоллиса; КМУВ — критерий Манна-Уитни-Вилкоксона.
Концентрацию интерлейкина-1β определяли методом иммуноферментного анализа (ИФА) на фотометре Infinity F50 (Tecan) коммерческими тест-системами фирмы ВектоБест (Новосибирск). В качестве материала использовали супернатант ротовой жидкости, полученный центрифугированием проб в пробирках типа эппендорф на 1,5 мл в течение 15 минут при 10000 g и температуре 4°С [15].
Состояние автономной нервной системы оценивали путем вычисления вегетативного индекса Кердо по формуле Index=100* (1-ДА/Пульс), где ДА — диастолическое давление в мм рт.ст. [16].
Статистическая обработка включала проверку вариационных рядов на нормальность распределения по критерию Шапиро — Уилка. В дальнейшем использовали непараметрический дисперсионный анализ Краскела — Уоллиса (ККУ), а также попарные сравнения групп по непараметрическому критерию Манна — Уитни — Вилкоксона в случае получения статистически значимых различий в дисперсионном анализе. Числовые значения биохимических показателей приведены в виде медианы и квартилей (25% и 75%). Различия между вариационными рядами считали статистически значимыми при p<0,05.
Результаты. На первом, докоррекционном, этапе концентрация альфа-амилазы ротовой жидкости различалась незначительно и составила 272,2 (125,8– 426,9) МЕ/л для основной группы, 371,2 (116,1–714,6) МЕ/л для плацебо-группы и 395,5 (137,1–889,5) МЕ/л в контроле. На втором этапе исследования проявилась тенденция к снижению содержания sAA ротовой жидкости во всех группах; по завершении — к понижению, при этом уровень альфа-амилазы был ниже исходных значений в основной и плацебо- группах, в контроле он превысил исходные показатели (все данные не отличаются статистической значимостью) (табл. 1).
Для выявления особенностей колебаний sAA все группы разделены на субпопуляции с предиктором воспалительных заболеваний полости рта (ИЛ-1β>212 пг/мл) и без таковых явлений (ИЛ-1β ≤ 212 пг/мл).
В субпопуляции с предиктором воспалительных стоматологических заболеваний (ИЛ-1β>212 пг/мл) не было статистически значимых изменений между подгруппами, тем не менее прослеживалась тенденция к снижению содержания альфа-амилазы в основной группе к завершению исследования (1-й этап: 331,2 (167,2–1099,7) МЕ/л; 3-й этап: 269,3 (128,1–451,1) МЕ/л, в отличие от групп плацебо (1-й этап: 173,8 (72,6–362,5) МЕ/л; 3-й этап: 380,6 (123,4– 1045,3) МЕ/л) и контроля (1-й этап: 467,6 (105,3– 892,1) МЕ/л; 3-й этап: 568,9 (255,7–568,9) МЕ/л).
В субпопуляциях без предиктора воспалительных процессов полости рта обнаружены статистически значимые изменения в основной и контрольной группах на третьем этапе. Они отражали снижение уровня фермента в основной и его увеличение в контрольной группе, уменьшение концентрации альфа-амилазы в плацебо-группе оказалось статистически незначимым (табл. 2).
При попарном сравнении групп статистически достоверные изменения зафиксированы и в плацебо-группе: субпопуляция плацебо-группы без предиктора воспалительных заболеваний полости рта (ИЛ1β≤212 пг/мл) на втором этапе исследования демонстрирует более выраженное снижение уровня данного фермента в ротовой жидкости на 25,85% (р<0,05) по сравнению с аналогичным периодом субпопуляции плацебо-группы (ИЛ1β>212 пг/мл) c предиктором воспалительных заболеваний, где снижение содержания составляет 21,97% (р=0,031). Обе субпопуляции группы плацебо демонстрируют снижение концентрации альфа-амилазы в данный
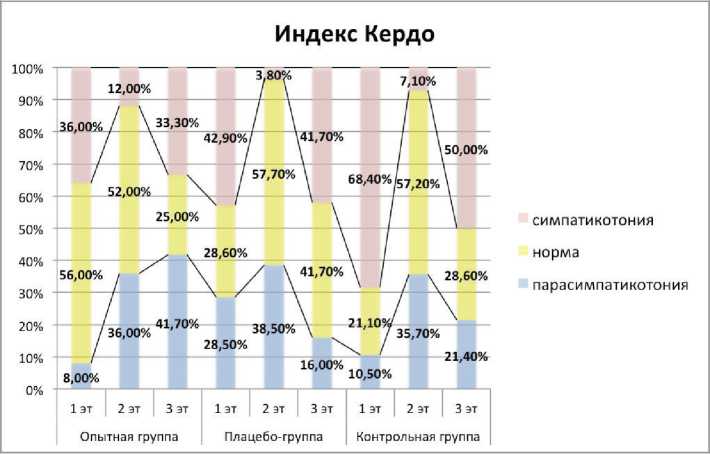
Динамика индекса Кердо в группах студентов на 1–3-м этапах исследования
период. Сходная тенденция наблюдалась в парных тестах на втором этапе в основной группе как в субпопуляции ИЛ1β≤212, где снижение уровня амилазы составило 46,04%, так и в субпопуляции ИЛ-1в>212 со снижением 64,25%, но без статистической значимости (р=0,514 и р=0,129). При этом в группе контроля за аналогичный период снижение содержания амилазы было менее выраженным и составило 29,22% (р=0,588) в субпопуляции ИЛ-1р£212.
В процессе исследования все испытуемые продемонстрировали достаточно высокий уровень сим-патикотонии, который снизился на втором этапе и вновь повысился на третьем этапе эксперимента, что можно связать с усилением состояния тревожности перед экзаменационной сессией. Тем не менее к концу эксперимента в основной группе наблюдалось снижение процента симпатотоников до 33,33%, тогда как в группе плацебо количество симпатотоников составило 41,67%, а в контроле 50%. Изменения величины индекса Кердо представлены на рисунке.
Обсуждение. Содержание альфа-амилазы ротовой жидкости (sAA) у участников всех групп в процессе эксперимента превышала нормальные величины: у здоровых, физически активных взрослых в состоянии покоя уровень sAA обычно находится в пределах 50–175 МЕ/мл, при этом стресс вызывает двукратное увеличение: до 110–350 МЕ/мл [17]. В изменениях содержания данного фермента во всех группах и на всех трех этапах эксперимента прослеживалась определенная логика. Так, суммарные показатели уровня альфа-амилазы имели тенденцию к снижению в основной группе на втором и третьем этапах исследования, при этом активность фермента в группах плацебо и контроль повысилась на третьем этапе, что может отражать благоприятное влияние корректировки питьевого поведения на мукозальный иммунитет в целом. Учитывая то, что уровень sAA у всех участников превышал нормальные показатели, необходимо было выяснить, связано ли это с воспалительными заболеваниями полости рта или же подобная активность вызвана учебным стрессом. В ходе обработки данных выяснено, что, несмотря на отсутствие жалоб со стороны участников на наличие стоматологических воспалительных заболеваний, существует необходимость разделения групп на суб- популяции в зависимости от значения ИЛ-1β, что позволило нам выявить достоверные закономерности, скрытые при анализе усредненных цифр. Уровень ИЛ-1β свыше 212 пг/мл [5] — это порог, прогнозирующий периодонтит (78% чувствительность и 100% специфичность). С разделением на субпопуляции у участников без предиктора воспалительных заболеваний (значения ИЛ-1β ≤ 212 пг/мл) зафиксировано статистически достоверное снижение альфа-амилазы на третьем этапе исследования в основной группе относительно контрольной (см. табл. 2). При этом показатели альфа-амилазы недостоверно повысились как в группе плацебо (+24%), так и в контроле (+36,7%).
Разделение групп на субпопуляции показало, что даже у лиц без предиктора воспаления в полости рта содержание sAA превышало норму, что позволяет отнести эти изменения за счет стресс-индуцированного состояния. В процессе исследования все испытуемые продемонстрировали достаточно высокий уровень симпатикотонии (см. рисунок), который снизился на втором и вновь повысился на третьм этапе эксперимента, что можно связать с повышенной нагрузкой перед экзаменационной сессией. Тем не менее к концу эксперимента в основной группе наблюдалось уменьшение процента лиц с симпатикотонией.
Таким образом, статистически значимые изменения, а также тенденции, демонстрирующие улучшение состояния мукозального иммунитета и снижение тонуса симпатической нервной системы, свидетельствуют о благоприятном воздействии откорректированного питьевого поведения на участников настоящего исследования.
Выводы:
-
1. Выявлена зависимость между снижением уровня альфа-амилазы ротовой жидкости и откорректированным питьевым поведением в субгруппе людей без предиктора воспалительных заболеваний полости рта (ИЛ-1β в ротовой жидкости менее 212 пг/мл), употребляющих доочищенную электромагнитным способом воду в количестве не менее 30–35 мл/кг.
-
2. Повышение содержания альфа-амилазы ротовой жидкости у обследованных молодых людей в значительной степени связано с повышением тонуса симпатической нервной системы.
-
3. Изменение питьевого поведения способствует снижению напряженности симпатической нервной системы, что проявляется в уменьшении количества участников с симпатикотонией.
Список литературы Влияние питьевого поведения на содержание альфа-амилазы ротовой жидкости у студентов с предиктором воспаления и без них на фоне учебного стресса
- Delves PJ, Martin SJ, Burton DR, Roitt IM. Roitt's Essential Immunology Textbook, 13th edition, 2017; 576
- Nater UM, Rohleder N. Salivary alpha-amylase as a non-invasive biomarker for the sympathetic nervous system: current state of research. J Psychoneuroendocrinology 2009; 34 (4): 486-96
- Yang CJ. The pro-inflammatory cytokines, salivary cortisol and alpha-amylase are associated with generalized anxiety disorder (GAD) in patients with asthma. Neurosci Lett 2017; 24 (656): 15-21
- La Fratta I, Tatangelo K. The plasmatic and salivary levels of IL-1 p, IL-18 and IL-6 are associated to emotional difference during stress in young male. Sci Rep 2018; 18 (1): 3031
- Sanchez GA, Miozza VA, Delgado A, Busch L. Salivary IL-1 p and PGE2 as biomarkers of periodontal status, before and after periodontal treatment. J Clin Periodontol 2013; 40 (12): 1112-7
- Obayashi K. Salivary mental stress proteins. Clin Chim Acta 2013; 425: 196-200
- Strahler J, Skoluda N, Kappert MB, Nater UM. Simultaneous measurement of salivary cortisol and alpha-amylase: Application and recommendations. Neuroscience and biobehavioral reviews 2017;83:657-77
- Esch T, Stefano GB. The neurobiology of pleasure, reward processes, addiction and their health implications. Neuro Endocrinol Lett 2004; 25: 235-51
- Straub RH. Evolutionary medicine and chronic inflammatory state - known and new concepts in pathophysiology. J Mol Med (Berl) 2012; 90: 523-34
- Danese A, McEwen BS. Adverse childhood experiences, allostasis, allostatic load, and age-related disease. Physiol Behav 2012; 106: 29-39
- Epstein JM, Parker J, Cummings D, Hammond RA. Coupled contagion dynamics of fear and disease: mathematical and computational exploration. PLoS One 2008; 3: 3955
- Свечникова M.B., Гильмияров Э.М., Селезнева И.А., Федяев И.М. Метод диагностики стоматитов при гемобластозах по содержанию антител А и G к глиадину и трансглутаминазе. Наука и инновации в медицине 2016; 2 (2): 63-7
- Priumboom L, Reheis D. Intermittent drinking, oxytocin and human health. Med Hypotheses 2016; 92: 80-3
- Krause EG, de KloetAD, Flak JN, etal. Hydration state controls stress responsiveness and social behavior. J Neurosci 2011;31:5470-6.
- Лавров О. В., Пятин В.Ф., Широлапов И. В. Стресс-индуцированные особенности иммунологических показателей у людей дифференцированных вегетативно-гормональных кластеров. Медицинская иммунология 2013; 15 (3): 283-8
- Rohleder N, Nater UM. Determinants of salivary alpha-amylase in humans and methodological considerations. Psychoneuroendocrinology 2009; 34: 469-85.
- Мельник К. H., Баишева Г. M., Гильмияро-ва Ф.Н., Алпатова ТА. Саливадиагностика как метод определения иммунологической адаптации к учебному стрессу в условиях различного питьевого поведения. Клиническая лабораторная диагностика 2018; 63 (6): 353-7


