Влияние поддерживающей терапии ингибиторами PARP после первоначального лечения на эффективность последующей терапии рака яичников: анализ методом псевдорандомизации
Автор: Румянцев А.А., Тихомирова Т.Е., Царева А.С., Гуторов С.Л., Луд А.Н., Чернова А.П., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.14, 2024 года.
Бесплатный доступ
Введение: прогрессирование рака яичников (РЯ) на фоне проведения поддерживающей терапии ингибиторами PARP может ассоциироваться со снижением эффективности последующих линий противоопухолевой терапии, однако влияние прогрессирования РЯ на фоне поддерживающей терапии олапарибом после первоначального лечения заболевания изучено недостаточно. Материалы и методы: в это ретроспективное исследование включались пациентки с III–IV стадиями BRCA/HRD + РЯ, проходившие первоначальное лечение в 2014–2022 гг., с подтвержденным прогрессированием опухолевого процесса после первичного лечения. Пациенты были разделены на две группы: получавшие поддерживающую терапию олапарибом после 1 линии химиотерапии (группа А — после олапариба) или не получавшие (группа Б — контрольная группа) предшествующую терапию ингибиторами PARP. Для обеспечения сбалансированности групп был использован метод «псевдорандомизации» (cardinality method, пакет MatchIT в пакете программ R) с соотношением пациенток 1:1, группы балансировались в соответствии с наличием резидуальной опухоли после первоначального лечения, длительностью бесплатинового интервала после первой линии терапии, выполнением вторичной циторедукции по поводу рецидива, назначением препаратов платины и бевацизумаба. Первичной конечной точкой исследования была выживаемость без прогрессирования (ВБП). Результаты: из исходной популяции пациенток, включенных в исследование (n = 259), после проведения процедуры «псевдорандомизации» сформировано две группы больных численностью по 38 человек, суммарный объем выборки исследования составил 76 пациенток. Медиана возраста составила 48 лет в группе А и 50 лет — в группе Б (p = 0,989), IV стадия опухолевого процесса была у 12 (32%) пациенток в обеих группах (p = 1,000), бесплатиновый интервал длительностью > 12 мес. был у 25 (66%) пациенток в обеих группах. При медиане наблюдения 42,8 мес. (0,6–70,1 мес.) медиана ВБП в группе прогрессирования после олапариба и в контрольной группе составила 6,9 (95% ДИ 6,2–10,6 мес.) и 12,2 (95% ДИ 9,6–21,3 мес.), соответственно (ОР 2,89; 95% ДИ 1,63–5,12; p < 0,001). Медиана общей выживаемости составила 23,2 мес. и 68,2 мес. в контрольной группе (ОР 4,15; 95% ДИ 1,62–10,6). Заключение: исследование демонстрирует значимое уменьшение последующей ВБП и обшей выживаемости пациенток после прогрессирования на фоне поддерживающей терапии ингибиторами PARP в первой линии лечения рака яичников и указывает на необходимость разработки отдельных подходов к лечению данной категории больных.
Олапариб, ингибиторы PARP, резистентность, рак яичников, псевдорандомизация, BRCA
Короткий адрес: https://sciup.org/140309794
IDR: 140309794 | DOI: 10.18027/2224-5057-2024-020
Текст научной статьи Влияние поддерживающей терапии ингибиторами PARP после первоначального лечения на эффективность последующей терапии рака яичников: анализ методом псевдорандомизации
Рак яичников (РЯ) характеризуется хроническим рецидивирующим течением, при этом по мере естественного течения заболевания происходит постепенное формирование множественной лекарственной устойчивости. Основные достижения в лечении РЯ связаны с разработкой и внедрением в клиническую практику ингибиторов поли (АДФ-рибоза) — полимеразы (PARP). Этот класс лекарственных препаратов позволяет значительно улучшить отдаленные результаты лечения при распространенном РЯ, в первую очередь — при BRCA-ассоциированном и/или HRD-позитивном опухолевом процессе. Так, результаты исследования SOLO1 продемонстрировали выраженное снижение риска прогрессирования пациенток с патогенными мутациями в генах BRCA1/2 при проведении поддерживающей терапии олапарибом — применение препарата позволило увеличить медиану выживаемости без прогрессирования (ВБП) при III–IV стадиях РЯ с 13,8 до 56,0 мес. [1]. Увеличение ВБП, в свою очередь, транслировалось в клинически значимое увеличение общей выживаемости (ОВ) пациенток, показатель 7-летней ОВ составил 67,0% в группе олапариба по сравнению с 46,5% в группе плацебо (отношение рисков [ОР] 0,55; p = 0,0004) [2]. Ряд других исследований также продемонстрировал высокую эффективность ингибиторов PARP в лечении рака яичников [3–5].
Описаны перекрестные механизмы резистентности к терапии ингибиторами PARP и многими химиотерапев- тическими агентами, используемыми для лечения рака яичников [6]. Прогрессирование опухолевого процесса на фоне проведения поддерживающей терапии ингибиторами PARP может ассоциироваться со снижением эффективности последующих линий противоопухолевой терапии. Например, это было продемонстрировано в подгрупповом анализе исследования III фазы SOLO2. Из общей популяции исследования (n = 295) были отобраны пациентки с прогрессированием опухолевого процесса после поддерживающей терапии олапарибом (n = 106) или плацебо (n = 80), после была проанализирована эффективность последующей противоопухолевой терапии. По результатам исследования выявлено повышение риска последующего прогрессирования заболевания у пациенток, ранее получавших олапариб, по сравнению с группой плацебо (ОР 2,17; 95% ДИ 1,47–3,19), различия были достоверными в многофакторном анализе (ОР 2,13; 95% ДИ 1,41–3,22; p < 0,001) [7].
В то же время результаты представленного анализа были получены в контексте терапии платиночувствительных рецидивов РЯ. Отсутствуют аналогичные исследования по проблеме резистентности к ингибиторам PARP после первой линии терапии в контексте самостоятельного назначения препаратов данного класса. Мы провели ретроспективное исследование влияния поддерживающей терапии ингибиторами PARP после первоначального лечения BRCA/HRD + РЯ на эффективность последующей линии противоопухолевой терапии.
МАТЕРИАЛЫ И МЕТОДЫ
В это ретроспективное исследование включались пациентки с III–IV стадиями РЯ с рецидивами заболевания после первоначального лечения с наличием патогенных мутаций в генах BRCA и/или наличием дефицита гомологичной рекомбинации (homologous repair deficiency, HRD), проходившие лечение в период с 2014 по 2022 гг. Определение мутационного статуса проводилось до начала этапа поддерживающей терапии ингибиторами PARP. Исследуемая группа формировалась из числа пациенток с прогрессированием опухолевого процесса после проведения поддерживающей терапии ингибиторами PARP, контрольная группа — из числа пациенток с прогрессированием РЯ после первоначального лечения без поддерживающей терапии препаратами данного класса.
Пациентки с прогрессированием заболевания после завершения этапа поддерживающей терапии или отмены терапии по любой другой причине (непереносимая токсичность, проблемы с доступом к препарату и другие) исключались из исследования. Контрольная группа исследования формировалась из числа пациенток, не получавших поддерживающей терапии соответствующими препаратами после первой линии химиотерапии. Дизайн исследования не предусматривал ограничений в отношении использования данной терапевтической опции в составе последующих линий лекарственной терапии.
Терапия ингибиторами PARP производилась в соответствии с одобренными стандартными режимами дозирования — олапариб назначался в дозе 300 мг 2 раза в сутки (суммарная суточная доза — 600 мг/сутки), нирапариб — в дозе 300 мг 1 раз в сутки, редукция доз препаратов осуществлялась по медицинским показаниям в соответствии с инструкцией по применению.
В данный анализ включались только те пациентки, у которых после первоначального лечения рецидива РЯ было отмечено прогрессирование опухолевого процесса в соответствии с критериями RECIST1.1 или критериями GCIG. Пациентки без прогрессирования заболевания или подтвержденной прогрессии опухолевого процесса исключались из анализа. Выбор последующей терапии, которая могла включать проведение платиносодержащей или неплатиновой химиотерапии +/- бевацизумаб, осуществлялся на усмотрение лечащего врача. Оценка эффективности производилась в соответствии с локальной практикой, целевым временем оценки было выполнение контрольного обследования, включавшего компьютерную томографию или магнитно-резонансную томографию и определение концентрации CA-125 в плазме крови каждые 9–12 недель лечения.
Основным оцениваемым показателем (первичной конечной точкой) исследования была выживаемость без прогрессирования, рассчитываемая от даты начала терапии по поводу первого прогрессирования опухолевого процесса (после поддерживающей терапии ингибиторами PARP в экспериментальной группе или без нее — в контрольной группе) до последующего прогрессирования или смерти пациентки по любой причине.
Для обеспечения сбалансированности сравниваемых групп при проведении исследования было запланировано использование метода «псевдорандомизации» (propensity score matching (PSM) анализ) с соотношением пациенток в экспериментальной и контрольной группе 1:1. В качестве отправной точки для расчета необходимого размера выборки были приняты результаты вышеупомянутого подгруппового анализа исследования SOLO2, продемонстрировавшие двукратное (2,17; 95% ДИ 1,47–3,19) повышение риска прогрессирования РЯ после терапии олапарибом по сравнению с группой контроля. Предполагаемая медиана ВБП после прогрессирования на ингибиторах PARP составляла около 6 мес. В соответствии с указанными расчетными данными, для выявления статистически достоверных различий в результатах лечения между группами при ожидаемом увеличении риска прогрессирования в экспериментальной группе (ОР 2), ожидаемой медиане ВБП в группе олапариба, соответствующей 6 мес. и 12 мес. в контрольной группе, при одностороннем уровне ошибки первого рода (α) 0,05 и уровне ошибки второго рода (β) 0,2 в исследование необходимо включить ≥ 70 пациенток (≥ 35 в каждую из групп исследования), что, с учетом вероятной потери данных по 5% пациенток при ожидаемом минимальном периоде наблюдения ≥ 12 мес., обеспечит ≥ 66 событий, достаточных для обеспечения вышеуказанных параметров проведения данного исследования.
С учетом изначально предполагаемого количественного дисбаланса в количестве наблюдений между экспериментальной и контрольной группами было запланировано включить в исследование пациенток, исходя из соотношения 1:5 между группой прогрессирования после ингибиторов PARP и группы без проведения поддерживающей терапии, соответственно. Для проведения анализа методом «псевдорандомизации» проводилась балансировка групп пациенток в соответствии со следующими факторами: наличие или отсутствие резидуальной опухоли после первоначального лечения (наличие или отсутствие), длительность бесплатинового интервала после первой линии терапии (> 12 мес. или ≤ 12 мес.), выполнение вторичной циторедукции по поводу рецидива (да или нет), назначение препаратов платины по поводу рецидива (да или нет), последующее назначение беваци-зумаба (да или нет).
Статистический анализ проводился при помощи набора программ R и RStudio. «Псевдорандомизация» пациенток проводилась при помощи пакета MatchIt [8], был использован метод “cardinality matching”, позволяющий обеспечить наиболее точное сопоставление на уровне анализируемых групп, а не отдельных субъектов, в отличие от классических вариантов PSM [9].
РЕЗУЛЬТАТЫ
Всего в исследование было включено 259 пациенток, составивших первоначальную популяцию исследования, из них 39 пациенток вошло в группу прогрессирования
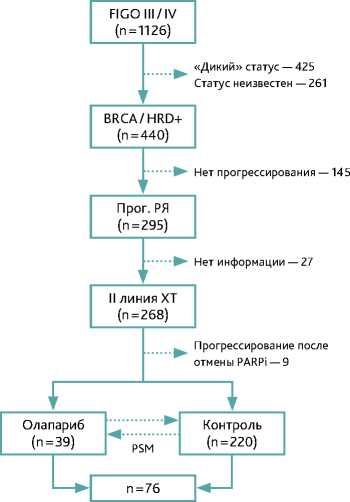
Рисунок 1. Отбор пациенток для проведения исследования
-
Figure 1. Selection of patients for the study
после олапариба, 220 — в контрольную группу исследования. После проведения процедуры псевдорандомизации численность каждой из групп исследования была 38 пациенток, таким образом, суммарный объем выборки исследования составил 76 пациенток. На рисунке 1 представлено графическое отображение данных по отбору пациенток для проведения исследования.
В таблице 1 суммированы данные по характеристикам пациенток в сравниваемых группах. В исходной популя- ции исследования (n = 259) обращает на себя внимание выраженный дисбаланс с точки зрения количества пациенток с IV стадией опухолевого процесса (33% в группе олапариба по сравнению с 15% в контрольной группе; p = 0,005), частоты назначения антиангиогенной терапии бевацизумабом (72% против 18%; p < 0,001), помимо этого отмечена тенденция к увеличению количества пациенток с длительностью бесплатинового интервала > 12 мес. (67% против 50%) с пограничной статистической значимостью различий (p = 0,051). Кроме того, в группе олапариба было нумерически больше пациенток после первичной циторедукции (67% против 60%), а также пациенток, которым по поводу рецидива опухолевого процесса было проведено локальное лечение (21% против 16%).
После проведения процедуры «псевдорандомизации» общий размер выборки исследования составил 76 пациенток, что соответствует первоначально сформулированной статистической гипотезе исследования, а количество наблюдений представляется адекватным для проведения анализа. В популяции групп, сформированных методом PSM-анализа, медиана возраста пациенток составила 48 лет в группе прогрессирования РЯ после терапии олапарибом и 50 лет в контрольной группе (p = 0,989), IV стадия опухолевого процесса была у 12 (32%) пациенток в обеих группах (p = 1,000). Первичная циторедукция была выполнена у 25 (66%) пациенток в обеих группах, а резидуальная опухоль по итогам выполнения хирургического лечения отсутствовала у 9 (24%) пациенток в обеих группах исследования (p = 1,000). Медиана длительности бесплатинового интервала составила 18,2 мес. в группе олапариба по сравнению с 17,7 мес. (p = 0,617) в контрольной группе, бесплатиновый интервал длительностью > 12 мес. был у 25 (66%) пациенток в обеих группах. Равному количеству пациенток по поводу про-
Таблица 1. Характеристика пациенток
Table 1. Characteristics of patients
|
Исходная группа |
PSM анализ |
|||||
|
Олапариб |
Контроль |
Олапариб |
Контроль |
|||
|
N |
39 (100%) |
220 (100%) |
P |
38 (100%) |
38 (100%) |
p |
|
Возраст, медиана |
47 лет (37–75) |
49,5 лет (22–73) |
0,921 |
48 лет (37–75) |
50 лет (37–67) |
0.989 |
|
Стадия IV |
13 (33%) |
33 (15%) |
0,005 |
12 (32%) |
12 (32%) |
1,000 |
|
BRCA1mut |
36 (92%) |
190 (86%) |
0,248 |
35 (92%) |
34 (89%) |
0,696 |
|
Циторедукция — первичная |
26 (67%) |
133 (60%) |
0,464 |
25 (66%) |
25 (66%) |
1,000 |
|
Резидуальная опухоль — нет |
9 (24%) |
40 (22%) |
0,474 |
9 (24%) |
9 (24%) |
1,000 |
|
БПИ, медиана |
18,1 мес. |
11,9 мес. |
0,505 |
18,2 мес. |
17,7 мес. |
0,617 |
|
< 12 мес. > 12 мес. |
13 (33%) 26 (67%) |
110 (50%) 110 (50%) |
0,051 |
13 (34%) 25 (66%) |
13 (34%) 25 (66%) |
1,000 |
|
Локальное лечение — да |
8 (21%) |
35 (16%) |
0,478 |
8 (21%) |
8 (21%) |
1,000 |
|
Pt-терапия |
34 (87,2%) |
200 (91%) |
0,469 |
33 (87%) |
33 (87%) |
1,000 |
|
Бевацизумаб |
28 (72%) |
40 (18%) |
< 0,001 |
27 (71%) |
27 (71%) |
1,000 |
БПИ — бесплатиновый интервал, PSM — propensity score matching, Pt — препараты платины
Полная циторедукция
БПИ >12 мес.
Первичная циторедукция
Pt-содержащие режимы XT
Назначение бевацизумаба
Локальное лечение по поводу рецидива
Стадия IV
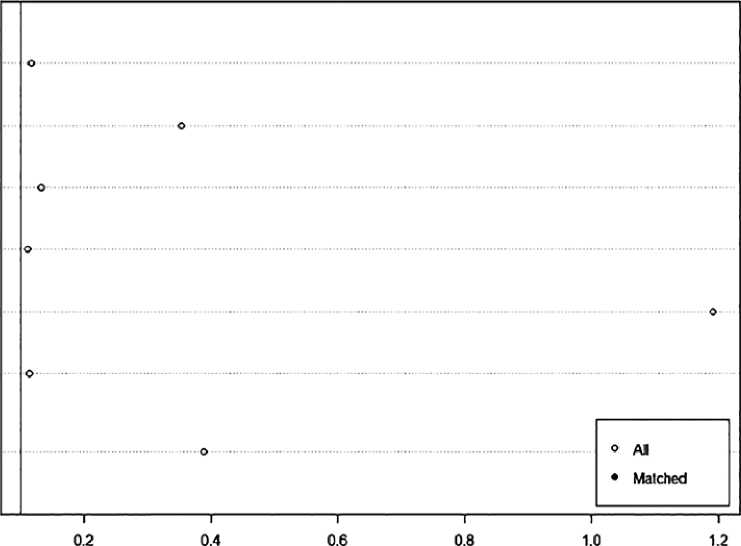
Абсолютная стандартизованная разница средних
Рисунок 2. Стандартизированная разница между средними значениями балансируемых ковариат
-
Figure 2. Standardized difference between means of balanced covariates
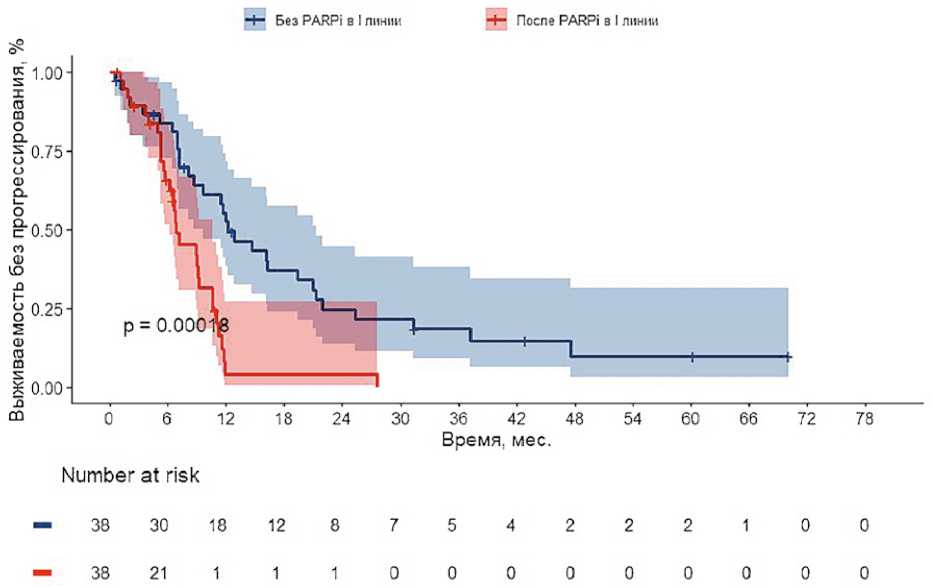
Рисунок 3. Кривые Каплана–Майера по выживаемости без прогрессирования
-
Figure 3. Kaplan – Meier curves for progression-free survival
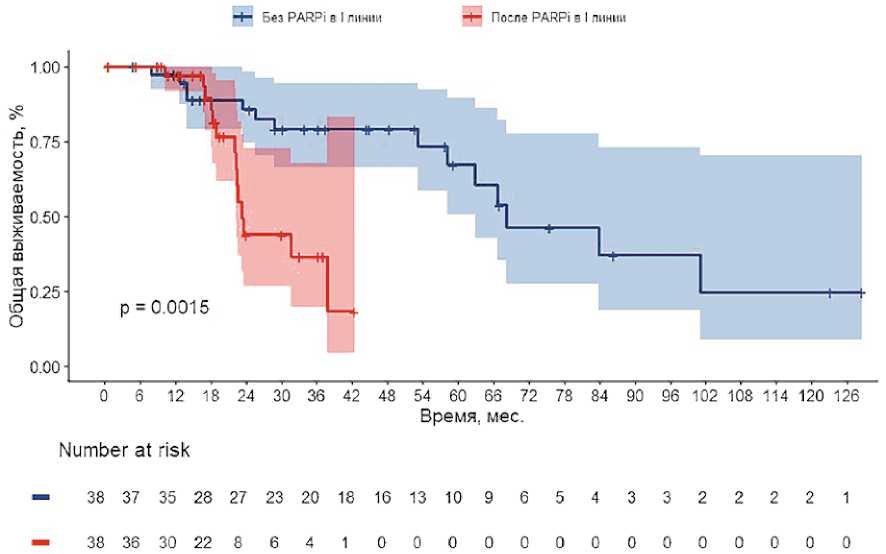
Рисунок 4. Кривые Каплана–Майера по общей выживаемости пациенток
Figure 4. Kaplan – Meier curves for overall survival of patients
грессирования рака яичников было проведено локальное лечение (21%, p = 1,000), назначена платиносодержащая химиотерапия (87%, p = 1,000), а также проведена терапия с включением бевацизумаба (71%, p = 1,000). Сформированные группы были сбалансированы по всем ключевым характеристикам. На рисунке 2 представлены данные по стандартизированным разницам средних величин для ковариат, которые балансировались в ходе проведения «псевдорандомизации».
Медиана наблюдения составила 42,8 мес. (0,6– 70,1 мес.), за указанный период наблюдения прогрессирование опухолевого процесса отмечено у 60 пациенток, включенных в исследование. По результатам анализа медиана ВБП в группе прогрессирования после олапа-риба и в контрольной группе составила 6,9 (95% ДИ 6,2– 10,6 мес.) и 12,2 (95% ДИ 9,6–21,3 мес.), соответственно (ОР 2,89; 95% ДИ 1,63–5,12; p < 0,001), что соответствует достоверному повышению риска прогрессирования после экспозиции к ингибиторам PARP. Различия были статистически и клинически значимыми. Кривые Каплана–Майера по ВБП пациенток представлены на рисунке 3.
Медиана общей выживаемости составила 23,2 мес. в группе прогрессирования после олапариба и 68,2 мес. в контрольной группе (ОР 4,15; 95% ДИ 1,62–10,6), что свидетельствует о достоверном повышении риска смерти у пациенток с прогрессированием после терапии ингибиторами PARP. Кривые Каплана–Майера представлены на рисунке 4.
Таким образом, по результатам исследования нами было отмечено, что предшествующая терапия олапарибом является значимым негативными прогностическим фактором в случае развития прогрессирования заболевания на фоне терапии данным препаратом.
ОБСУЖДЕНИЕ
Результаты этого исследования продемонстрировали достоверное повышение риска прогрессирования опухолевого процесса при рецидивах рака яичников у пациенток с развившейся резистентностью к терапии ингибиторами PARP после первоначального лечения. Это соответствует ранее полученным результатам подгруппового анализа исследования SOLO2, в котором аналогичные данные были продемонстрированы при рецидивах рака яичников.
Отметим, что в подгрупповом анализе результатов исследования PAOLA-1 при прогрессировании на фоне поддерживающей терапии комбинацией олапариба и бева-цизумаба было выявлено схожее негативное влияние на отдаленные результаты лечения — медиана ВБП составила 6,1 мес. в группе пациенток с прогрессированием во время терапии олапарибом/бевацизумабом по сравнению с 11,9 мес. в группе плацебо/бевацизумаба [10].
Анализ данных в этом исследовании был проведен при помощи метода «псевдорандомизации», что позволило обеспечить сбалансированность сравниваемых групп по ключевым прогностическим факторам, что позволяет повысить достоверность сделанных выводов. Можно отдельно отметить крайне высокую сбалансированность характеристик пациенток в сравниваемых группах — для подавляющего большинства сравнений не было отмечено ни нумерических, ни статистических различий (p ≈ 1,000 для всех сравнений), использование метода «псевдорандомизации» позволило сформировать две хорошо сбалансированные по ключевым прогностическим факторам группы пациенток.
Включение бесплатинового интервала как балансирующей ковариаты при проведении процедуры «псевдорандомизации» могло существенно повлиять на результаты, так как длительность бесплатинового интервала значимо увеличивается непосредственно за счет терапии олапарибом. Чтобы оценить влияние данного фактора был проведен ряд анализов чувствительности с включением различных пороговых значений бесплатиного интервала, в том числе 6 мес. (HR 3,08; 95% ДИ 1,74–5,47; p < 0,001), а также без включения данной ковариаты (HR 2,71; 95% ДИ 1,562–4,721; p < 0,001). Ни один из проведенных анализов не выявил существенных различий в результатах исследований в зависимости от включения или исключения бесплатинового интервала в модель PSM анализа.
Количество событий, отмеченных за период проведения исследования, составило 60, что меньше заложенного в статистическую гипотезу (≥ 66). Тем не менее, указанного количества событий хватило для выявления статистически значимых различий между группами, так как выраженность различий в ВБП между группами оказалась выше заложенной в гипотезу (ОР 2,89 против 2,00). Маловероятно, что данный фактор мог оказать существенное влияние на результаты анализа данных.
Мы исключали из анализа пациенток с прогрессированием процесса после завершения терапии ингибиторами PARP. Такое решение было принято для обеспечения большей валидности данных, а также с учетом результатов упомянутого выше подгруппового анализа исследования PAOLA-1, где было продемонстрировано исчезновение негативного влияния терапии ингибиторами PARP на эффективность последующей линии терапии, если прогрессия произошла после завершения либо отмены поддерживающей терапии [10]. Данный фактор также имеет биологическое обоснование: развитие прогрессирования процесса после прекращения экспозиции к ДНК-повре-ждающим агентам свидетельствует о более высокой потенциальной чувствительности опухолевых клеток к терапии, репопуляции чувствительных к ингибиторам PARP и платиновым агентам клонов. Пациентки с прогрессированием РЯ после завершения терапии олапарибом исключались из исследования, соответственно, полученные данные не применимы в отношении данной категории больных. В то же время, включение данных пациенток в анализ могло продемонстрировать менее выраженное негативное влияние ингибиторов PARP на результаты лечения больных.
Исследование имеет ряд ограничений, характерных для ретроспективных работ. В частности, нельзя исключить и потенциальное влияние ряда неидентифицированных факторов, которые могли оказать влияние на результаты исследования. Включенные в исследование пациентки получали различные режимы платиносодержащей и неплатиновой химиотерапии.
Результаты исследования не ставят вопрос о потенциальном ограничении терапевтической роли ингибиторов PARP: так, в исследование включались только те пациентки, у которых было отмечено прогрессирование опухолевого процесса после терапии, а больные без признаков прогрессии исключались из исследования. Тем не менее, полученные результаты указывают на снижение эффективности химиотерапии у пациенток с прогрессированием РЯ на фоне терапии ингибиторами PARP и на необходимость разработки отдельных подходов к лечению данной категории больных.
ЗАКЛЮЧЕНИЕ
Проведенное исследование демонстрирует значимое сокращение последующей ВБП и обшей выживаемости пациенток после прогрессирования на фоне поддерживающей терапии ингибиторами PARP в первой линии лечения рака яичников.


