Влияние показателей безопасности и профиля токсичности на эффективность комбинированной терапии первой линии у больных распространенным почечноклеточным раком: исследование реальной клинической практики
Автор: Волкова М.И., Нерсесова Т.А., Лядова М.А., Кузьмина Е.С., Антонова Т.Г., Царева Е.В., Стативко О.А., Черняев В.А., Покатаев И.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.15, 2025 года.
Бесплатный доступ
Цель: Оценить влияние показателей безопасности и профиля токсичности на эффективность первой линии терапии почечно-клеточного рака (ПКР), основанной на иммуноонкологических препаратах (ИО), в реальной практике. Материал и методы: Критериями включения в ретроспективное исследование являлись возраст ≥ 18 лет, морфологически подтвержденный распространенный ПКР, проведение 1 линии терапии комбинациями, основанными на ИО; критериями исключения — противопоказания к препаратам комбинации, отсутствие данных о ≥ 1 приеме каждого из препаратов комбинации и ≥ 1 контрольном осмотре после старта терапии. Регистрировались все нежелательные явления (НЯ), их характеристики и случаи коррекции лечебного режима из-за НЯ, лучший ответ на лечение, время до прогрессирования, смерти и последнего наблюдения. Проводился анализ потенциальной взаимосвязи показателей безопасности с показателями эффективности терапии 1 линии. Результаты: Включены данные 194 пациентов, получавших ниволумаб с ипилимумабом, ИО-ИО (94 (48,5 %)) или иммуно-таргетную терапию, ИО-ТКИ (100 (51,5 %)). Медиана наблюдения — 28,4 (1–63) месяца. Частота объективного ответа (ЧОО) во всей популяции (ИО-ИО / ТКИ) составила 36,6 %, частота контроля над опухолью (ЧКО) — 79,4 %, медиана беспрогрессивной выживаемости (БПВ) — 20,0 (15,3–24,8) месяцев, общей выживаемости (ОВ) — 29,2 (24,4–34,0) месяца. В группе ИО-ИО / ТКИ независимыми факторами благоприятного прогноза эффективности терапии являлись кожные НЯ (отношение рисков (ОР) для ЧОО 5,9 (95 % доверительный интервал (ДИ): 3,1–38,4), р = 0,002; отношение шансов (ОШ) для БПВ 2,4 (95 % ДИ: 1,2–4,6), р = 0,011), эндокринные НЯ (ОР для ЧОО 2,5 (95 % ДИ: 1,8–3,5), р = 0,021; ОШ для БПВ 2,6 (95 % ДИ: 1,4–4,8), р = 0,002; ОШ для ОВ 2,6 (95 % ДИ: 1,5–4,6), р = 0,001) и гастроинтестинальные (ГИ) НЯ (ОШ для БПВ 1,8 (95 % ДИ: 1,1–3,2), р = 0,030). Независимыми факторами неблагоприятного прогноза ОВ являлись серьезные НЯ (ОШ 24,9 (95 % ДИ: 4,7–130,5), р < 0,0001). Независимым фактором благоприятного прогноза в группе ИО-ИО являлись эндокринные НЯ (ОШ для БПВ 2,1 (95 % ДИ: 1,1–4,1), р = 0,026; ОШ для ОВ 2,8 (95 % ДИ: 1,4–5,6), р = 0,003), в группе ИО-ТКИ — все НЯ (ОШ для ОВ 2,9 (95 % ДИ: 1,1–7,5), р = 0,033), кожные НЯ (ОР для ЧОО — 3,1 (95 % ДИ: 1,2–6,2), р = 0,04; ОШ для БПВ 3,0 (95 % ДИ: 1,2–7,6), р = 0,021), ГИ НЯ (ОШ для БПВ 3,3 (95 % ДИ: 1,5–7,2), р = 0,002) и эндокринные НЯ (ОШ для БПВ 3,3 (95 % ДИ: 1,6–6,7), р = 0,001). Выводы: Развитие НЯ у пациентов с ПКР ассоциировано с улучшением показателей эффективности ИО-основанной комбинированной терапии. Возможность использования НЯ в качестве потенциального маркера клинической пользы ИО-основанной комбинированной терапии требует подтверждения в проспективных исследованиях.
Иммунотерапия, почечно-клеточный рак, безопасность, влияние на эффективность
Короткий адрес: https://sciup.org/140312603
IDR: 140312603 | DOI: 10.18027/2224-5057-2025-050
Текст научной статьи Влияние показателей безопасности и профиля токсичности на эффективность комбинированной терапии первой линии у больных распространенным почечноклеточным раком: исследование реальной клинической практики
Стандартом 1 линии терапии у пациентов с распространенным почечно-клеточным раком (ПКР) являются комбинации, основанные на ингибиторах контрольных точек противоопухолевого иммунного ответа (ИО), в том числе — двойная иммунотерапия ниволумабом с ипили-мумабом (ИО-ИО) и иммуно-таргетная терапия (ИО-ТКИ) [1,2]. Применение ИО ассоциировано с риском развития иммуноопосредованных нежелательных явлений (ИОНЯ) [3]. Введение в схему лечения таргетных антиангиогенных препаратов повышает риск реализации нежелательных явлений (НЯ), обусловленных нарушением микроциркуляции в различных тканях и органах [4]. Специфичный для ИО-ИО спектр токсичности включает кожные,эндо-кринные, гастроинтестинальные, печеночные и почечные ИОНЯ. Наиболее распространенными ТКИ-ассоцииро-ванными проявлениями токсичности являются усталость, кожные, гастроинтестинальные НЯ, артериальная гипертензия (АГ) и гипотиреоз [3,4].
На основании данных, полученных в когортных и ретроспективных исследованиях, неоднократно высказывалось предположение, что ряд отдельных НЯ, связанных с терапией ТКИ, а также развитие ИОНЯ у пациентов, получающих ИО, могут служить маркерами эффективности противоопухолевой терапии у больных злокачественными опухолями, в том числе — ПКР [3,5,10 –12,14,17–20].
В рамках исследования реальной практики мы провели анализ влияния показателей безопасности и профиля токсичности на эффективность первой линии терапии ПКР, основанной на ИО.
МАТЕРИАЛ И МЕТОДЫ
Критериями включения в ретроспективное исследование, проведенное на базе Онкологического центра № 1ГКБ им. С.С. Юдина, являлись возраст ≥ 18 лет, морфологически подтвержденный распространенный ПКР и назначение в качестве 1линии противоопухолевого лечения ИО-ИО или ИО-ТКИ. Критериями исключения служили противопоказания к одному или обоим препаратам комбинации, отсутствие данных о не менее чем одном приеме каждого из препаратов комбинации и не менее чем одном контрольном осмотре после старта терапии.
Ответ на лечение оценивался по критериям Response Evaluation Criteria In Solid Tumors (RECIST) 1.1. Объективным ответом считали полный или частичный ответ, контролем над опухолью — полный, частичный ответы и стабилизацию заболевания в течение 3 и более месяцев.
Нежелательным явлением (НЯ) считался любой неблагоприятный симптом, заболевание, а также увеличение интенсивности ранее имевшихся симптомов, возникшие после начала терапии. Степень тяжести НЯ оценивалась согласно Common terminology criteria for adverse events (CTCAE) v. 5.0. Тяжелыми считали НЯ 3 –5 степеней тяжести, серьезными — НЯ, послужившие показанием к госпитализации с целью их коррекции, фатальным — НЯ, послужившее причиной смерти. Иммуноопосредованным НЯ (ИОНЯ) считали НЯ, являющееся проявлением аутоиммунного воспаления, по мнению врача.
Анализ данных осуществлялся с применением блока статистических программ SPSS Statistics 19. Достоверность различий между количественными показателями вычисляли по критерию t Стьюдента для нормально распределенных величин или по непараметрическому критерию Манна–Уитни. Для сравнения качественных параметров применялся точный критерий Фишера и χ 2 с учетом непараметрических данных и нормального распределения Пуассона. Различия признавали значимыми при p < 0,05. Для оценки точности прогнозирования события в зависимости от значений анализируемых факторов строили ROC-кривые. По координатам ROC-кривых выделяли пороговое значение анализируемых факторов, наиболее значимое для составления прогноза.
Продолжительностью жизни без прогрессирования считали период от начала терапии 1 линии до даты регистрации прогрессирования заболевания или смерти пациента от ПКР. Общую продолжительность жизни рассчитывали от начала терапии 1 линии до даты последнего наблюдения или смерти от любой причины. Продолжительностью жизни без прогрессирования на фоне последующей линии терапии считали период от начала терапии 1 линии до даты прогрессирования или смерти пациента от ПКР на фоне второй линии противоопухолевого лечения. Выживаемость оценивали по методу Kaplan–Meier, различия выживаемости определяли с помощью log-rank теста. Для выявления прогностически значимых для выживаемости факторов использовали однофакторный (ОФА) и многофакторный (МФА) регрессионный анализ Сох.
РЕЗУЛЬТАТЫ
Критериям включения соответствовали данные 194 пациентов, получавших лечение с 07.07.2019 г. по 22.10.2024 г. Медиана возраста — 65,0 (39,0 –87,0) лет, доминировали мужчины (137 (70,6 %)). Статус Eastern Cooperative Oncology Group (ECOG) 2–4 был у 35 (18,0 %) больных. В 180 (92,8%) случаях морфологически был подтвержден светлоклеточный ПКР, в 14 (7,2 %) — несветлоклеточные варианты ПКР. Удаление первичной опухоли выполнено 130 (67,0%) пациентам. Более одной локализации метастазов имелось у 161 (83,0 %) больного. Наиболее распространенными локализациями метастазов были легкие (130 (6 7,0 %)), лимфоузлы (10 9 (56,2 %)) и кости скелета (64 (33,0 %)). В группу благоприятного прогноза International Metastatic Renal Cell Carcinoma Database Consortium (IMDC)отнесено 26 (13,4%), промежуточного — 112 (57,7 %), неблагоприятного — 56 (28,9 %) пациентов.
В 1 линии все пациенты получали комбинированную противоопухолевую терапию: ниволумаб с ипилимумабом (94 (48,5 %)) или ИО-ТКИ (100 (51,5 %)), в том числе — пем-бролизумаб с акситинибом (85 (43,8 %)) или ленватини-бом (10 (5,2 %)) и ниволумаб с кабозантинибом (5 (2,6 %)). Группы ИО-ИО и ИО-ТКИ были сбалансированы по большинству показателей, однако в группе ИО-ИО оказалась выше частота метастазов de novo, меньше доли больных группы благоприятного прогноза и пациентов с артериальной гипертензией (АГ) (р < 0,05 для всех).
Медиана наблюдения за всеми пациентами составила 28,4 (1–63) месяца. Медиана длительности терапии 1 линии — 11,1 (1,0 –55,9) месяца: 7,0 (1,0 –55,9) месяцев в группе ИО-ИО и 13,9 (1,0 –45,2) месяца в группе ИО-ТКИ (р = 0,026). Частота объективного ответа (ЧОО) составила 36,6 %, включая 5,2 % полных ответов. Частота контроля над опухолью (ЧКО) достигла 79,4 %. Любое уменьшение таргетных очагов зарегистрировано у 74,9 % больных. Медиана беспрогрессивной выживаемости (БПВ) составила 20,0 (15,3 –24,8) месяцев, общей выживаемости (ОВ) — 29,2 (24,4–34,0) месяца, БПВ на фоне последующей терапии (БПВ2) — 23,7 (21,3–26,0) месяца. ИО-ТКИ обеспечивала большую ЧКО (р = 0,033) и уменьшения суммы диаметров таргетных очагов (р = 0,028), а также тенденцию к увеличению ОВ (р = 0,052) по сравнению с ИО-ИО (табл. 1).
Таблица 1. Показатели эффективности 1 линии терапии
Table 1. Efficacy indicators of thefirst-line therapy
|
Показатели эффективности 1 линии терапии |
Все пациенты, n 194 |
ИО-ИО, n 94 |
ИО-ТКИ, n 100 |
|
Лучший ответ, абс. (%) 1 |
|||
|
Полный |
10 (5,2) |
7 (7,4) |
3 (3,0) |
|
Частичный |
61 (31,4) |
24 (25,5) |
37 (37,0) |
|
Стабилизация |
83 (42,8) |
34 (36,2) |
49 (49,0) |
|
Прогрессирование |
23 (11,9) |
15 (16,0) |
8 (8,0) |
|
Не оценен |
17 (8,8) |
14 (14,9) |
3 (3,0) |
|
Объективный ответ, абс. (%) 1 |
71 (36,6) |
31 (33,0) |
40 (40,0) |
|
Контроль над опухолью, абс. (%) 1 |
154 (79,4) |
65 (69,1) |
89 (89,0) |
|
Уменьшение суммы диаметров таргетных очагов, абс. (%) 2 |
128 (74,9) |
51 (67,1) |
77 (81,1) |
|
БПВ, медиана, мес. (95 % ДИ) |
20,0 (15,3–24,8) |
20,6 (11,8–29,5) |
19,7 (14,1–25,1) |
|
ОВ, медиана, мес. (95% ДИ) |
29,2 (24,4–34,0) |
25,6 (12,7–38,5) |
29,8 (19,5–40,2) |
|
БПВ2, медиана, мес. (95 % ДИ) |
23,7 (21,3–26,0) |
23,7 (17,6–29,7) |
25,1 (21,7–28,5) |
1 Оценен у 177 (91,2%) из 194 пациентов, включая 80 (85,2%) больных из группы ИО-ИО и 97 (97,0%) — из группы ИО-ТКИ.
2 Оценено у 171 (88,1%) пациента, включая 76 (80,9%) больных из группы ИО-ИО и 95 (95,0%) — из группы ИО-ТКИ.
БПВ — беспрогрессивная выживамость; ОВ — общая выживаемость; БПВ2 — беспрогрессивная выживаемость на фоне последующей терапии; ИО — иммуноонкологический препарат; ТКИ — тирозинкиназный ингибитор.
Во всей популяции исследования и лечебных группах независимых клинических факторов прогноза ЧОО не выделено.
По данным МФА, во всей популяции негативное влияние на прогноз БПВ оказывали статус ECOG > 1 (отношение шансов (ОШ) 1,3 (95 % доверительные интервалы (ДИ): 1,0 –1,7); р = 0,027) и метастазы > 3 локализаций (ОШ 1,2 (95 %ДИ: 1,0 –1,4); р = 0,017), в группе ИО-ТКИ — статус ECOG > 1 (ОШ 2,2 (95 % ДИ: 1,2–4,0); р = 0,015) и отношение нейтрофилы/лимфоциты (NLR) ≥ 3 (ОШ = 2,7 (95% ДИ: 1,2–5,9); р = 0,017). В группе ИО-ИО значимых факторов риска БПВ не выделено.
В МФА продемонстрировано независимое негативное влияние на ОВ всей популяции статуса ECOG > 1 (ОШ 1,6 (95% ДИ: 1,2–2,1); р = 0,001) и анемии (ОШ 1,9 (95 % ДИ: 1,2– 3,1); р = 0,009), в группе ИО-ИО — анемии (ОШ 1,9 (95 % ДИ: 1,1–3,4); р = 0,0 30), в группе ИО-ТКИ — статуса ECOG > 1 (ОШ 5,3 (95 %ДИ: 2,5–11,0); р < 0,0001), метастазов > 3 локализаций (ОШ 1,3 (95 % ДИ: 1,1–1,7); р = 0,018) и метастазов в костях (ОШ 2,7 (95 %ДИ: 1,3–5,6); р = 0,009).
Значимых факторов прогноза БПВ2 не выделено.
НЯ развились у 171 (88,1 %) из 194 пациентов, достигли ≥ 3 степени тяжести в 82 (42,3 %) случаях, потребовали госпитализации в 34 (17,5 %) наблюдениях и привели к смерти 11 (5,7 %) пациентов. Любые ИОНЯ развились у 137 (70,6 %) и достигли 3 –4 степеней тяжести у 64 (33,0 %) больных, потребовали госпитализации 32 (16,5 %) и привели к смерти 8 (4,1 %) пациентов. Мульти-органные ИОНЯ имели место в 53,6 % случаев. Наиболее распространенными НЯ на фоне 1 линии терапии были общие (73 (37,6 %)), эндокринные (66 (34,0 %)) и почечные (58 (29,9 %)) проявления токсичности. Редукция дозы
ИО не допускалась, редукция дозы ТКИ потребовалась 22 (11,3 %) больным. Перерыв терапии ИО потребовался 49 (25,3 %), ТКИ — 9 (4,6 %), обоими препаратами комбинации — 31 (16,0 %) пациенту. Окончательная отмена ИО из-за НЯ использовалась в 15 (7,7 %), ТКИ — в 5 (2,6 %), обоих препаратов комбинации — в 14 (7,2 %) случаях (табл. 2).
Проведен анализ потенциального влияния показателей безопасности и профиля токсичности терапии 1 линии на ее эффективность. Не выявлено влияния любых видов коррекции лечебного режима, включая назначение глюкокортикостероидов, на показатели его эффективности.
Во всей популяции исследования независимыми факторами, ассоциированными с увеличением вероятности достижения объективного ответа, являлись эндокри-нопатии и кожная токсичность. Эндокринные НЯ были ассоциированы с увеличением ЧОО с 33,3 % до 52,4 % (отношение рисков (ОР) 2,5 (95 % ДИ: 1,8–3,5), р = 0,021). ЧОО у пациентов с кожными НЯ во всей популяции увеличивалась с 34,7 % до 66,7 % (ОР 5,9 (95 % ДИ: 3,1–38,4), р = 0,002), в группе ИО-ТКИ — с 33,3% до 54,1% (ОР 3,1 (95% ДИ: 1,2–6,2); р = 0,04). В группе ИО-ИО независимых факторов прогноза ЧОО не выявлено.
В ОФА во всей группе исследования выявлено благоприятное влияние на БПВ любых НЯ, ИОНЯ, мультиорганных и тяжелых ИОНЯ, кожных и гастроинтестинальных, эндокринных и почечных НЯ (р < 0,05 для всех), а также отмечена тенденция к увеличению БПВ при развитии АГ (р = 0082). Проведен МФА влияния профиля безопасности и токсичности на БПВ всех пациентов с включением независимых клинических факторов риска. Подтверждено значимое влияние на БПВ отдельных видов НЯ: кожной токсичности
Таблица 2. Безопасность и виды токсичности терапии 1 линии
Table 2. Safety and toxicity of thefirst-line therapy
|
Показатели безопасности и виды НЯ |
Все пациенты, n 194 |
ИО-ИО, n 94 |
ИО-ТКИ, n 100 |
P |
|
Длительность терапии, медиана (min-max), месяцы |
11,1 (1,0–55,9) |
7,0 (1,0–55,9) |
13,9 (1,0–45,2) |
0,026 |
|
Любые НЯ, n (%) |
171 (88,1) |
79 (84,0) |
92 (92,0) |
0,068 |
|
Тяжелые НЯ (3–5 степени), n (%) |
82 (42,3) |
31 (33,0) |
51 (51,0) |
0,008 |
|
Серьезные НЯ, n (%) |
34 (17,5) |
20 (21,3) |
14 (14,0) |
0,126 |
|
Фатальные НЯ (5 степени), n (%) |
11 (5,7) |
7 (7,5) |
4 (4,0) |
0,234 |
|
Любые ИОНЯ, n (%) |
137 (70,6) |
69 (73,4) |
68 (68,0) |
0,252 |
|
Тяжелые ИОНЯ (≥ 3 степени), n (%) |
64 (33,0) |
24 (25,5) |
40 (40,0) |
0,096 |
|
Серьезные ИОНЯ, n (%) |
32 (16,5) |
19 (20,2) |
13 (13,0) |
0,123 |
|
Фатальные ИОНЯ (5 степени), n (%) |
8 (4,1) |
6 (6,4) |
2 (2,0) |
0,095 |
|
Мультиорганные ИОНЯ |
104 (53,6) |
60 (63,8) |
44 (44,0) |
0,004 |
|
Виды НЯ, n (%) |
||||
|
Общие 1 |
73 (37,6) |
35 (37,2) |
38 (38,0) |
0,220 |
|
Эндокринные 2 |
66 (34,0) |
28 (29,8) |
38 (38,0) |
0,134 |
|
Почечные 3 |
58 (29,9) |
34 (36,2) |
24 (24,0) |
0,045 |
|
Гастроинтестинальные 4 |
52 (26,8) |
18 (19,1) |
34 (34,0) |
0,002 |
|
Печеночные 5 |
50 (25,8) |
20 (21,3) |
30 (30,0) |
0,457 |
|
Кожные 6 |
33 (17,0) |
11 (11,7) |
22 (22,0) |
0,042 |
|
Сердечно-сосудистые 7 |
31 (16,0) |
3 (3,2) |
28 (28,0) |
< 0,0001 |
|
Неврологические |
14 (7,2) |
7 (7,5) |
7 (7,0) |
0,887 |
|
Гематологические |
11 (5,7) |
6 (6,4) |
5 (5,0) |
0,687 |
|
Мышечно-суставные |
9 (4,6) |
5 (5,3) |
4 (4,0) |
0,587 |
|
Коррекция режима терапии из-за НЯ |
22 (11,3) |
– |
22 (22,0) |
|
|
Редукция дозы ТКИ из-за НЯ, n (%) |
||||
|
Перерыв в терапии из-за НЯ, n (%) |
49 (25,3) |
19 (20,2) |
30 (30,0) |
0,444 |
|
– ИО |
28 (14,4) |
19 (20,2) |
9 (9,0) |
0,545 |
|
– ТКИ |
9 (4,6) |
– |
9 (9,0) |
– |
|
– Оба препарата комбинации |
31 (16,0) |
19 (20,2) |
12 (12,0) |
0,080 |
|
Отмена терапии из-за НЯ, n (%) |
||||
|
– ИО |
15 (7,7) |
9 (9,6) |
6 (6,0) |
0,170 |
|
– ТКИ |
5 (2,6) |
– |
5 (5,0) |
– |
|
– Оба препарата комбинации |
14 (7,2) |
9 (9,6) |
5 (5,0) |
0,170 |
-
5 В структуре доминировало повышение сывороточных трансаминаз (24,2 %).
-
6 В структуре доминировала сыпь (8,2 %).
-
7 В структуре доминировала артериальная гипертензия (13,9%).
НЯ — нежелательное явление; ИОНЯ — иммуноопосредованное нежелательное явление; ИО — иммуноонкологический препарат; ТКИ — тирозинкиназный ингибитор.
(ОШ) 2,4 (95% ДИ: 1,2–4,6); р = 0,011), гастроинтестинальных НЯ (ОШ 1,8 (95% ДИ: 1,1–3,2); р = 0,030) и эндокринных НЯ (ОШ 2,6 (95 % ДИ: 1,4–4,8); р = 0,002) (табл. 3, рис. 1A-C). В группе ИО-ИО эндокринопатия являлась единственным значимым фактором благоприятного прогноза БПВ (ОШ 2,1 (95% ДИ: 1,1–4,1); р = 0,026). В группе ИО-ТКИ МФА подтвердил независимое благоприятное влияние на БПВ кожной (ОШ 3,0 (95 % ДИ: 1,2–7,6); р = 0,021), гастроинтестинальной (ОШ 3,3 (95 % ДИ: 1,5–7,2); р = 0,002) и эндокринной токсичности (ОШ 3,3 (95 % ДИ: 1,6 –6,7); р = 0,001).
Во всей популяции исследования в ОФА выявлено благоприятное влияние на ОВ любых НЯ, ИОНЯ, кожных, эндокринных НЯ и АГ (р < 0,05 для всех). Проведен МФА влияния профиля безопасности и токсичности на ОВ всех пациентов с включением независимых клинических факторов риска. Подтверждено независимое негативное влияние на ОВ серьезных НЯ (ОШ 24,9 (95% ДИ: 4,7–130,5) р < 0,0001) и серьезных ИОНЯ (ОШ 13,1 (95 % ДИ: 2,3–73,3) р = 0,003), а также позитивное влияние на ОВ эндокринной токсичности (ОШ 2,6 (95 % ДИ: 1,5–4,6); р = 0,001)
(табл. 4, рис. 2A-C). В группе ИО-ИО подтверждено независимое благоприятное влияние на ОВ эндокринопатий (ОШ 2,8 (95% ДИ: 1,4–5,6); р = 0,003), а в группе ИО-ТКИ — любых НЯ (ОШ 2,9 (95 % ДИ: 1,1–7,5); р = 0,033).
Не доказано влияния профиля безопасности и токсичности 1линии терапии на БПВ2.
Таблица 3. Факторы прогноза БПВ во всей популяции пациентов, получавших терапию 1 линии (МФА) Table 3. Prognosticfactorsfor PFAS in the entire population ofpatients receivingfirst-line therapy (MVA)
|
Фактор прогноза БПВ |
Знач. |
ОШ |
95 ДИ |
|
|
Нижняя граница |
Верхняя граница |
|||
|
Соматический статус ECOG > 1 |
0,002 |
1,919 |
1,269 |
2,902 |
|
Метастазы > 3 локализаций |
0,001 |
1,306 |
1,121 |
1,523 |
|
Любые НЯ отсутствуют |
0,478 |
1,261 |
0,664 |
2,396 |
|
ИОНЯ отсутствуют |
0,329 |
0,729 |
0,386 |
1,376 |
|
Тяжелые ИОНЯ отсутствуют |
0,123 |
1,592 |
0,881 |
2,876 |
|
Мультиорганные ИОНЯ отсутствуют |
0,773 |
1,100 |
0,577 |
2,095 |
|
Кожные НЯ отсутствуют |
0,011 |
2,356 |
1,217 |
4,560 |
|
Гастроинтестинальные НЯ отсутствуют |
0,030 |
1,839 |
1,061 |
3,186 |
|
Эндокринные НЯ отсутствуют |
0,002 |
2,618 |
1,440 |
4,760 |
|
Почечные НЯ отсутствуют |
0,542 |
1,111 |
1,100 |
3,265 |
МФА — многофакторный анализ; НЯ — нежелательные явления; ИОНЯ — иммуноопосредованные нежелательные явления; Знач. — значимость; ОШ — отношение шансов; ДИ — доверительный интервал.
Таблица 4. Факторы прогноза ОВ пациентов всей популяции пациентов (МФА)
Table 4. Prognosticfactorsfor OS in the entirepatientpopulation (MVA)
|
Фактор прогноза ОВ |
Знач. |
ОШ |
95,0 ДИ для ОШ |
|
|
Нижняя граница |
Верхняя граница |
|||
|
Соматический статус ECOG > 1 |
< 0,0001 |
2,361 |
1,555 |
3,586 |
|
Анемия |
0,004 |
2,406 |
1,315 |
4,400 |
|
Любые НЯ отсутствуют |
0,066 |
1,912 |
0,959 |
3,812 |
|
Серьезные НЯ |
< 0,0001 |
24,875 |
4,743 |
130,449 |
|
ИОНЯ отсутствуют |
0,512 |
1,230 |
0,663 |
2,279 |
|
Серьезные ИОНЯ |
0,003 |
13,103 |
2,342 |
73,306 |
|
Кожные НЯ отсутствуют |
0,190 |
1,574 |
0,799 |
3,100 |
|
АГ отсутствует |
0,058 |
2,141 |
0,975 |
4,701 |
|
Эндокринные НЯ отсутствуют |
0,001 |
2,614 |
1,503 |
4,546 |
МФА — многофакторный анализ; НЯ – нежелательные явления; ИОНЯ — иммуноопосредованные нежелательные явления; АГ — артериальная гипертензия; Знач. — значимость; ОШ — отношение шансов; ДИ — доверительный интервал.
ДИСКУССИЯ
Развитие НЯ, обусловленных механизмом действия противоопухолевых препаратов, может являться маркером эффективного воздействия терапии на заданную мишень. В связи с этим развитие аутоиммунного воспаления на фоне применения ИО, возможно, следует расценивать как потенциальное свидетельство реактивации иммунной системы, а расстройства микроциркуляции
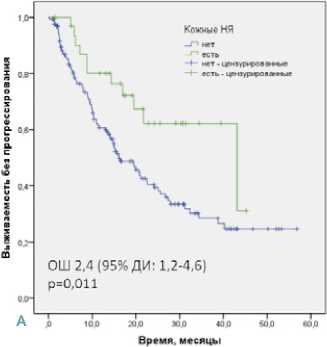
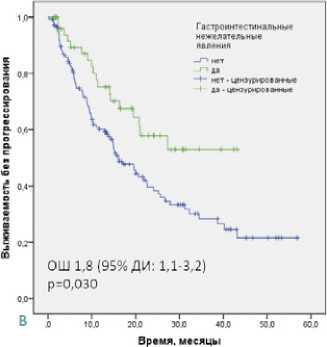
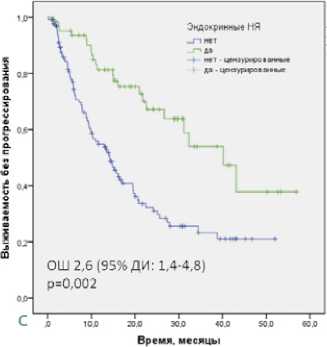
Рисунок 1. Выживаемость без прогрессирования во всей популяции исследования в зависимости от развития кожных НЯ (A), гастроинтестинальных НЯ (B) и эндокринных НЯ (C)
Figure 1. Progression-free survival in the entire study population depending on the development of cutaneous AEs (A), gastrointestinal AEs (B) and endocrine AEs (C)
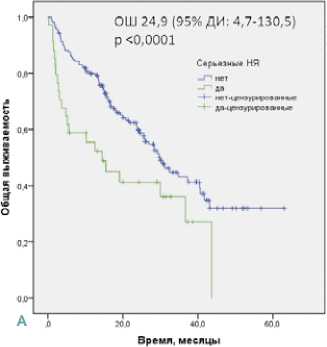
Рисунок 2. Общая выживаемость во всей популяции исследования в зависимости от развития серьезных НЯ (A), серьезных ИОНЯ (B) и эндокринных НЯ (C)
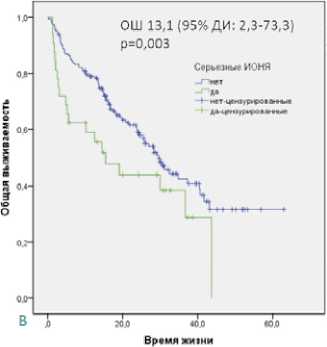
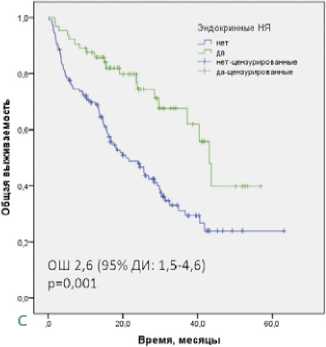
Figure 2. Overall survival in the entire study population depending on the development of serious AEs (A), serious imAEs (B) and endocrine AEs (C)
в разных тканях и органах может служить косвенным признаком высокой антиангиогенной активности ТКИ. В ряде ретроспективных и когортных исследований было продемонстрировано увеличение эффективности противоопухолевой терапии, основанной на ИО,у пациентов с меланомой, немелкоклеточным раком легкого и ПКР, реализовавших проявления аутоиммунной токсичности [5–7]. Сходные данные были получены в отношении отдельных НЯ, ассоциированных с терапией ТКИ при ПКР, включая АГ, гипотиреоз, ладонно-подошвенный синдром и нейтропению [8,9]. На основании скудных и, зачастую, противоречивых данных в последние годы формируется требующая подтверждений гипотеза о возможности прогнозирования течения заболевания на основании профиля переносимости противоопухолевой терапии.
В ретроспективной серии из 194 пациентов с ПКР, получавших первую линию терапии с включением ИО-ИО или ИО-ТКИ в реальной практике, были проанализированы потенциальные взаимосвязи показателей безопасности и профиля токсичности лекарственного лечения с его эффективностью. Нам удалось продемонстрировать значимое влияние профиля безопасности и отдельных видов НЯ на ЧОО, БПВ и ОВ. Независимыми факторами благоприятного прогноза эффективности лечения являлись все НЯ,а также кожная, эндокринная и гастроинтестинальная токсичность.
Кожная токсичность, репортированная у 17,0 % наших пациентов, в большинстве случаев была представлена сыпью и достоверно чаще развивалась в группе ИО-ТКИ по сравнению с группой ИО-ИО (р = 0,042). У пациентов с кожными НЯ отмечено значимое увеличение ЧОО с 34,7% до 66,7 % (р = 0,002). Позитивное влияние кожной токсичности на реализацию противоопухолевого ответа сохранялось в группе ИО-ТКИ,в которой ЧОО при развитии НЯ со стороны кожи и слизистых возрастала с 33,3% до 54,1% (р = 0,04). У больных, получавших ИО-ИО, кожная токсичность не имела независимого влияния на ЧОО. Увеличение вероятности реализации объективного ответа при развитии кожных НЯ транслировалось на увеличение БПВ всех пациентов (ОШ 2,4 (95 % ДИ: 1, 2–4,6)) и больных группы ИО-ТКИ (ОШ 3,0 (95 % ДИ: 1,2–7,6); р = 0,021). Сходные данные были получены в небольшой серии из 35 больных ПКР, получавших ИО-ИО, ИО-ТКИ и ТКИ. Кожные НЯ были ассоциированы со значимым увеличением ЧКО (91,3 % против 50,0 %, р = 0,019) и 1-летней ОВ (91% против 67 %, р = 0,01) [10]. В ретроспективном исследовании, включившем 43 больных ПКР, получавших ИО-ИО, отмечено увеличение БПВ при развитии кожных реакций [11]. Опубликованы данные объединенного анализа 4 проспективных исследований сунитиниба, свидетельствующие о независимом позитивном влиянии ладонно-подошвенного синдрома на ОВ больных ПКР (p = 0,0218) [9]. В мета-анализе 30 исследований у 4971 пациентов со злокачественными опухолями, получавших ИО, кожная токсичность была ассоциирована со значимым снижением риска смерти (ОШ для ОВ 0,45 (95 % ДИ 0,35–0,59), p < 0,001) [3].
В структуре эндокринопатий, развившихся у 34,0 % наших пациентов, доминировал гипотиреоз (25,8%), имевший 1–2 степени тяжести в большинстве случаев.Эндо-кринная токсичность имела равную частоту в группах ИО-ИО и ИО-ТКИ. Эндокринные НЯ были ассоциированы со значимо большей ЧОО во всей популяции исследования (52,4% против 33,3%), увеличением БПВ во всей популяции исследования (ОШ 2,6 (95% ДИ: 1,4–4,8), включая группы ИО-ИО (ОШ 2,1 (95 % ДИ: 1,1–4,1) и ИО-ТКИ (ОШ 3,3 (95 % ДИ: 1,6 –6,7)), что транслировалось в увеличение ОВ всех пациентов (ОШ 2,6 (95 % ДИ: 1,5–4,6)) и больных группы ИО-ИО (ОШ 2,8 (95 % ДИ: 1,4–5,6)). Потенциальная взаимосвязь гипотиреоза с большей эффективностью противоопухолевого лечения у больных ПКР была отмечена еще на этапе применения моно-ТКИ, до появления ИО.В мета-анализе 11 исторических исследований, включавших пациентов с ПКР, получавших ТКИ сунитиниб или сорафениб, приобре- тенный гипотиреоз оказался ассоциирован с большей БПВ (ОШ 0,59 (95% ДИ 0,42–0,84), p = 0,003) и ОВ (ОШ 0,52 (95% ДИ 0,31–0,87), p = 0,01) [8]. После внедрения ИО в стандартные схемы лечения ПКР база данных, подтверждающих позитивную прогностическую значимость гипотиреоза, продолжает пополняться. Так, в ретроспективном одноцентровом исследовании, включившем 200 больных ПКР, получавших ИО-основанную терапию, пациенты с эндокринными ИОНЯ (13 %), в частности, тиреоидными ИОНЯ (8,5 %), имели значимо большую БПВ (ОШ 0,54 (ДИ — 0,31– 0,95); р = 0,032) и ОВ (ОШ 0,34 (ДИ 0,12–0,94); p = 0,038) [12]. Аналогично, в небольшой серии из 49 наблюдений за больными ПКР, получавшими ИО-основанную терапию, тиреоидные НЯ являлись независимым фактором благоприятного прогноза БПВ (ОШ 0,29 (95 % ДИ: 0,11–0,77), p = 0,013) [11]. В мета-анализе 30 исследований у больных злокачественными опухолями, получавших ИО, эндокрино-патии являлись независимым предиктором увеличения ОВ (ОШ 0,52 (95 % ДИ: 0,44–0,62), p < 0,001) [3].
Гастроинтестинальные НЯ развились у 26,8 % наших пациентов, в большинстве случаев были представлены диареей (20,6 %) и имели большую частоту в группе ИО-ТКИ по сравнению с ИО-ИО. Гастроинтестинальная токсичность была связана с увеличением БПВ всех пациентов (ОШ 1,8 (95 % ДИ: 1,1–3,2)) и больных группы ИО-ТКИ (ОШ 3,3 (95% ДИ: 1,5–7,2)). Это позволяет высказать предположение о совместном вкладе ИОНЯ и ТКИ-ассоции-рованных НЯ в прогноз больных ПКР, получающих терапию 1 линии. Данные о корреляции ТКИ-ассоциированной диареи с эффективностью антиангиогенной терапии публиковались ранее. Так, в ретроспективном исследовании (n = 81) было показано, что диарея на фоне терапии ТКИ пазопанибом ассоциирована с увеличением БПВ (р = 0,016) [13]. Иммуноопосредованная диарея, по некоторым данным, также является предиктором хорошего ответа на ИО. В серии из 327 больных злокачественными опухолями, получавшими ИО, диарея (36 %) являлась независимым фактором благоприятного прогноза ОВ (р < 0,001) [14].
В нашей серии наблюдений эндокринная, гастроинтестинальная и кожная токсичность были частыми НЯ, и их совместный вклад в прогноз эффективности терапии реализовался у больных группы ИО-ТКИ. У пациентов с любыми НЯ, развившимися на фоне лечения ИО-ТКИ, отмечено значимое увеличение ОВ (ОШ 2,9 (95 % ДИ: 1,1– 7,5)). Наши результаты подтверждают ранее опубликованные данные. ТКИ-ассоциированная токсичность в ряде исследований была ассоциирована с увеличением БПВ и ОВ больных ПКР [13,15,16]. В многочисленных ретроспективных сериях наблюдений за пациентами со зло- качественными опухолями, в том числе — ПКР, отмечено увеличение БПВ и ОВ при развитии ИОНЯ [12,17–20], что подтверждает крупный мета-анализ 30 исследований (ОШ для ОВ 0,54 (95 % ДИ 0,45–0,65); p < 0,001; ОШ для БПВ 0,52 (95 % ДИ 0,44–0,61), p < 0,001) [3].
Наши результаты, наряду с ранее опубликованными данными, позволяют предположить, что НЯ, связанные с проведением терапии ИО-ИО и ИО-ТКИ у больных ПКР, можно рассматривать как фактор прогноза эффективности лечения, который следует учитывать, принимая клинические решения. Контролируемые НЯ, особенно, кожные, эндокринные и гастроинтестинальные, являются потенциальным маркером клинической пользы и не должны являться показанием к необоснованной отмене противоопухолевой терапии, основанной на ИО. Тем не менее, следует подчеркнуть, что тяжелые НЯ и НЯ < 3 степени, которые представляют потенциальную угрозу жизни и ее качеству (например, миастения, миокардит, энцефалит), несомненно, требуют перерывов или окончательной отмены терапии, а также назначения своевременной адекватной медикаментозной коррекции НЯ для снижения рисков. Подтверждением этому служит выявленное нами независимое негативное влияние серьезных НЯ, в том числе ИОНЯ, на ОВ. Несомненно, ретроспективный набор и ограниченная выборка пациентов требуют осторожной трактовки полученных нами результатов и их подтверждения в проспективных многоцентровых исследованиях.
ЗАКЛЮЧЕНИЕ
У пациентов с распространенным ПКР выявлено значимое позитивное влияние отдельных видов НЯ, включая кожную, эндокринную и гастроинтестинальную токсичность, на показатели эффективности 1 линии терапии с включением ИО.Тем не менее, серьезные НЯ,в том числе,— серьезные ИОНЯ, являются независимым фактором неблагоприятного прогноза ОВ. Таким образом, развитие проявлений токсичности на фоне ИО-основанной терапии ПКР можно расценивать как потенциальный маркер клинической пользы, и контролируемые НЯ, особенно, кожные, эндокринные и гастроинтестинальные, не должны являться показанием к необоснованной отмене лечения. Однако при развитии тяжелых НЯ и потенциально жизнеугрожающих НЯ < 3 степени требуется перерыв или окончательное прекращение противоопухолевой терапии и проведение своевременной и адекватной коррекции проявлений токсичности.


