Влияние полинуклеотидов в качестве инъецируемого пролиферанта на проявления экспериментального посттравматического остеоартроза
Автор: Зубавленко Р.А., Белова С.В., Давыдов А.П., Ульянов В.Ю.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 1 (51), 2023 года.
Бесплатный доступ
Обоснование. Посттравматический остеоартроз (ПТОА) суставов является многофакторным заболеванием, обусловленным механическими и биологическими изменениями; оно, в основном, характеризуется дегенерацией суставного хряща, субхондральной кости и изменением свойств синовиальной жидкости, вязкость которой снижается, что требует коррекции. Биоактивные вещества, состоящие из полинуклеотидов, попадая в сустав, расщепляются до простых нуклеотидов, нуклеозидов и азотистых оснований, которые, как известно из литературы, в физиологических концентрациях присутствуют во внеклеточной среде, и представляют собой фундаментальные субстраты для регенерации клеток сустава. Цель исследования - оценить влияние полинуклеотидов в качестве инъецируемых пролиферантов на проявления экспериментального ПТОА. Материалы и методы. Работа была выполнена на белых нелинейных крысах самцах. Интенсивность перекисного окисления липидов оценивали по уровню накопления в сыворотке крови животных гидроперекисей липидов (ГПЛ), об активности антиоксидантной системы судили по тиоловому статусу (ТС). Для оценки синтетической активности остеобластов определяли содержание остеокальцина (ОК), а для метаболизма суставного хряща - гиалуронана (ГН). Результаты. На 7-е сутки экспериментальной работы нами было подтверждено формирование модели ПТОА на основании изменений уровней маркеров сыворотки крови. В результате внутрисуставных инъекций пролиферантов на основе полинуклеотидов на 28-е сутки эксперимента отмечали повышение ГПЛ, в то время как ТС был снижен. Под действием полинуклеотидов дисбаланса в механизмах регуляции костно-хрящевого компонента сустава не наблюдалось, что подтверждено снижением показателей ОК и ГН на 28-е сутки эксперимента против группы сравнения. Заключение. Данные проведенного эксперимента свидетельствовали о начале дегенеративных изменений на 7-е сутки после моделирования ПТОА. Полинуклеотиды, инъецируемые в качестве пролиферантов, представляют собой вещества способные поддерживать процессы физиологического восстановления костно-хрящевых структур и окислительно-восстановительной реакции суставных тканей при экспериментальном ПТОА.
Травма, остеоартроз, полинуклеотиды, лабораторные животные, экспериментальное лечение
Короткий адрес: https://sciup.org/142238933
IDR: 142238933 | УДК: 616-085: | DOI: 10.17238/2226-2016-2023-1-12-17
Текст научной статьи Влияние полинуклеотидов в качестве инъецируемого пролиферанта на проявления экспериментального посттравматического остеоартроза
Обоснование. Посттравматический остеоартроз (ПТОА) представляет собой хроническое прогрессирующее поражение сустава, возникающее после его травматического повреждения. ПТОА чаще развивается после внутрисуставных переломов, однако может возникать и после травм мягкотканых структур (связок, менисков и т.д.). Осложнения в виде ПТОА встречаются в 35,5-69,75% случаев и развиваются в среднем через 3-5 лет после травмы [1]. Исследования в области ПТОА – это широкий спектр работ от базовых с культурами in vitro до экспериментов с имплантированными тканями, моделированием на животных и клинической оценкой ответной реакции организма. Сопоставление результатов этих различных исследовательских настроек сопряжено со многими проблемами. Преобразование лабораторных результатов в клинически подтвержденные подходы к лечению является основной задачей патофизиологических и ортопедических исследований. Центральная тема продолжающихся исследований заключается в том, что острые механические повреждения суставов инициируют последовательность биологических событий с преобладанием катаболических процессов над анаболическими, в частности – из-за неадекватности репаративного ответа, которые вызывают прогрессирующую дегенерацию суставов. В результате исследований тканей эксплантов и животных появляются значительные доказательства того, что новые молекулярные вмешательства могут смягчить или остановить эти неблагоприятные события, и, таким образом, способствовать восстановлению суставов. Эти результаты еще предстоит подтвердить in vivo на человеческих суставах, но они дают надежду на смену парадигмы в коррекции ПТОА.
Несоответствие суставной поверхности и нестабильность, возникающие после некоторых травм суставов, играют кри- тическую роль в развитии ПTOA – проблеме, которая также требует внимания. Период времени, в течение которого развивается клинически поддающийся измерению ПТОА, сильно варьирует и составляет у грызунов от 7 до 60 дней, и это еще одна проблема, требующая внимания [2-4]. Современный мир нуждается в разработке биоактивных веществ с регенераторным потенциалом, воздействующих на измененную внутрисуставную микросреду, и способных восстанавливать физиологическое состояние хрящевой и костной тканей. Полидезоксирибонеклеотиды представляют собой смесь пуринов, пиримидинов, дезоксирибонуклеотидов и дезоксирибонуклеозидов, осуществляющих регенераторное влияние на ткани сустава. Они связывают воду, обладают вязкоупругими свойствами и вызывают рост клеток, выработку коллагена, миграцию клеток, а также имеют свойство снижать воспаление [5]. Снижение продукции провоспалительных цитокинов наблюдалось и у мышей с индуцированным остеоартритом [6, 7]. Полинуклеотиды в доклинических исследованиях показывают уменьшение деградации протеогликанов и активности металлопротеиназ в хондроцитах при ПТОА [7]. Существует мнение, что полидезоксирибонуклеотиды имитируют естественные процессы излечения остеоартроза, стимулируя локальный воспалительный каскад, который запускает высвобождение факторов роста и синтез коллагена [6, 8]. С учетом этого механизма используемые вещества, содержащие полинуклеотиды в качестве инъецируемого пролиферанта, могут считаться перспективным средством в терапии ПТОА.
Цель исследования – оценить влияние полинуклеотидов в качестве инъецируемых пролиферантов на проявления экспериментального ПТОА в различные сроки его развития.
Материалы и методы. Экспериментальная часть работы была выполнена на 96 белых крысах самцах массой 290-330 г. в виварии ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России. Манипуляции с животными выполняли в соответствии с Федеральным законом «О защите животных от жестокого обращения» от 1 декабря 1999 года, а также рекомендациями комитета по этике ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России (протокол заседания №1 от 05.02.2019 г.).
Лабораторные крысы были разделены на 3 группы: группа контроля – 10 здоровых крыс, группа сравнения – 56 крыс с ПТОА без лечения, опытная группа – 30 крыс с ПТОА, которым проводили лечение препаратом на основе полидексорибону-клеотида («Хронотрон», «Mastelli S.r.L.», Италия). Все действия с животными выполняли под общей анестезией с применением препаратов Золетил-100 в дозе 0,1 мл/кг («Virbac Sante Animale», Франция) и Ксилазин в дозе 10 мг/кг («Interchemie», Нидерланды). Моделирование ПТОА осуществляли хирургическим способом (открытое пересечение передней крестообразной связки и нанесение насечек на нагружаемые поверхности хряща сгибательного сустава).
Эксперимент выполняли в течение 28 дней. В 1-е сутки эксперимента произведен интракардиальный забор крови у 10 здоровых крыс контрольной группы, а также хирургические вмешательства, направленные на моделирование ПТОА у 86 животных. Распределение по дальнейшим манипуляциям отражены в таблице 1. Для внутрисуставного введения использовали инсулиновый шприц D21. В правый коленный сустав вводили биоактивные вещества на основе полинуклеотидов в дозе 20 мг/мл 0,2 мл, 3 инъекции с интервалом в одну неделю.
Таблица 1
Распределение лабораторных животных по группам и проводимым манипуляциям
|
7-е сутки эксперимента |
14-е сутки эксперимента |
21-е сутки эксперимента |
28-е сутки эксперимента |
||||||
|
5 с & я с я я я я & |
S я я я я & я я я & |
я я я л 5 я 3 я О |
Я я я & |
я я я л 5 я 3 я О |
Я S я я я я & я я я & |
я я я 5 я 3 я О |
Я S я я я я & я я я & |
я я я л 5 я 3 я О |
|
|
Выведение животных из эксперимента |
10 |
14 |
- |
14 |
10 |
14 |
10 |
14 |
10 |
|
Внутрисуставное введение веществ на основе полинуклеотидов |
- |
- |
30 |
- |
20 |
- |
10 |
- |
- |
Из эксперимента животных выводили путем передозировки препаратов для наркоза, после чего производили интракардиальный забор крови.
Биологические отходы (трупы животных) утилизировались в соответствии с ветеринарно-санитарными правилами сбора, утилизации и уничтожения биологических отходов №13-7-2/469.
Статистическую обработку результатов исследования проводили с помощью программы Statistica 10. Учитывая тот факт, что распределение переменных отличалось от нормального, полученные данные были обработаны с использованием непараметрического U-критерия Манна-Уитни с представлением результатов в виде медианы и межквартильного размаха 25 и 75 процентилей. Уровень критической значимости р принимали <0,05.
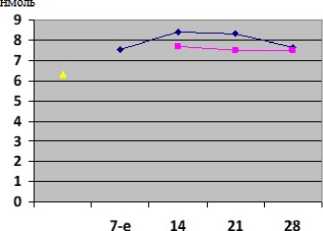
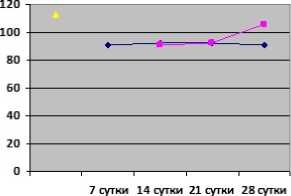
Результаты. У животных группы сравнения с ПТОА группы сравнения динамические изменения содержания ГПЛ и ТС характеризовались некоторыми особенностями (рис. 1, 2). Так, содержание ГПЛ постепенно возрастало после моделирования ПТОА на 7-е сутки эксперимента, увеличившись до 7,55 (6,9; 9,7) нмоль, и достигло своего максимума на 14-е сутки эксперимента, увеличившись в 1,33 раза по сравнению с контрольным значением (p>0,05). При этом следует отметить, что концентрация ГПЛ в сыворотке крови животных группы сравнения во все сроки наблюдения была выше, чем в контрольной группе (p<0,05). Концентрация ТС на 7-е сутки после моделирования ПТОА уменьшилась до 90,35 (85,2; 92,8) мкмоль/л по сравнению с контролем (p<0,001). При этом следует отметить, что концентрация ТС группы сравнения во все сроки наблюдения была ниже, чем в контрольной группе (p<0,05).
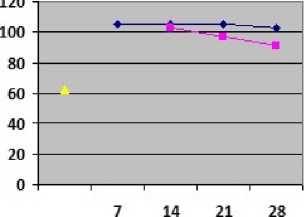
Изменения содержания продуктов метаболизма хрящевой и костной тканей также имели определенные особенности (рис. 3, 4). В нашей работе вследствие негативных изменений в субхондральной кости в группе сравнения выявлено уве- личение уровня ОК с 7-х суток до 209,1(180,9; 241,6) нг/мл по сравнению с группой контроля, максимально на 14-е сутки в 1,15 раза (p<0,01), с последующим незначительным снижением по сравнению с каждыми предыдущими сроками. Концентрация ОК в сыворотке крови животных группы сравнения во все сроки наблюдения была выше, чем в контрольной группе, значимо на 14-е и 21-е сутки (p<0,05), что свидетельствовало о происходящих нарушениях в костном метаболизме суставных структур животных с ПТОА. Содержание ГН группы сравнения увеличилось на 7-е сутки после моделирования ПТОА до 104,75(98,1; 118,5) нг/мл, и достигло своего максимума на 14-е сутки эксперимента, увеличившись в 1,68 раза по сравнению с контрольным значением (p<0,001). Концентрация ГН в сыворотке крови животных группы сравнения во все сроки эксперимента была значимо выше, чем в контрольной группе (p<0,05), что говорило о деструкции процессов в хрящевом матриксе суставов.
сутки сутки сутки сутки
ГПЛ группа сравнения ГПЛ опытная группа
ГПЛ контрольная группа
Рисунок 1. Динамика ГПЛ лабораторных животных
—♦—ТС группа сравнения
—•— ТС опытная группа
ТС контрольная группа
Рисунок 2. Динамика тс лабораторных животных
Под влиянием внутрисуставного введения полинуклеотидов динамичные изменения содержания ГПЛ и ТС характеризовались некоторыми особенностями у животных опытной группы (рис. 1, 2). Непрерывная активация провоспалительных медиаторов индуцируется в процессе прогрессирования ПТОА и связана с окислительно-восстановительным дисбалансом. Вероятно, это обусловлено решающим влиянием ослабленных систем антиоксидантной защиты и повышенной продукцией активных форм кислорода, таких как перекись водорода и реактивный оксид азота. В результате действия веществ на основе полинуклеотидов, введенных внутрисуставно, отмечали снижение ГПЛ в сыворотке крови животных опытной группы на 14-е сутки эксперимента до 7,7(7,5; 8,5) нмоль, на 21-е и 28-е сутки также прослеживалось снижение по сравнению с группой сравнения. Уровень активности ТС крови является прямым показателем окислительно-восстановительного состояния организма, поскольку тиолы легко реагируют с кислородсодержащими свободными радикалами с образованием дисульфидов. В результате действия веществ на основе полинуклеотидов отмечено повышение показателей ТС опытной группы максимально на 28-е сутки эксперимента до 105,5(92,8; 112,2) мкмоль/л по сравнению с группой сравнения. Таким образом снижение ГПЛ и повышение ТС могло быть связано с урегулированием про- и антиоксидантного баланса.
Проанализировав показатели метаболизма костной и хрящевой тканей опытной группы в различные сроки эксперимента после введения полинуклеотидов, были выявлены некоторые особенности (рис. 3, 4). Так, содержание ОК опытнои группы после введения полинуклеотидов при ПТОА уменьшалось максимально на 28 сутки до 194,4(193,3; 212,5) нг/мл после трехкратного введение инъецируемого пролиферанта по сравнению с группой сравнения, что говорило о наметившейся нормализации в костном метаболизме. Концентрация ГН опытной группы на 28-е сутки эксперимента под влиянием полинуклеотидов уменьшилась до 91,3(86,3; 98,1) нг/мл по сравнению с группои сравнении. В результате выявлена явная положительная динамика в виде динамического снижения ГН при деиствии полинуклеотидов во все сроки эксперимента, что свидетельствовало о торможении деградации суставного хрящевого матрикса.
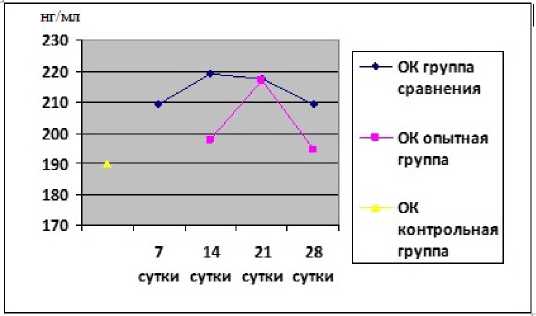
Рисунок 3. Динамика ОК лабораторных животных
Обсуждение. Полинуклеотиды проявляют трофическую активность в сочетании со смесью пуринов, пиримидинов, дезоксирибонуклеотидов и дезоксирибонуклеозидов [5]. Соединение обладает вязкоупругими свойствами в результате того, как оно взаимодействует с водой. Полинуклеотиды также связаны с индуцированным ростом клеток, выработкой коллагена, миграцией нескольких типов клеток и уменьшением воспаления. Исследования in vivo подтвердили положительное влияние полидезоксирибонуклеотидов на хрящ и субхондральную кость [5, 7]. Авторы сообщали, что данные вещества улучшают клиническое течение артроза, снижают экспрессию провоспалительных факторов – таких, как белок группы высокой подвижности-1, фактор некроза опухоли-α и интерлейкин IL-6, а также повышают экспрессию противовоспалительного IL-10 с использованием экспериментальной модели индуцированного ПТОА [5, 7]. Основываясь на этих знаниях, нами было проведено исследование, направленное на оценку эффективности внутрисуставных инъекций биоактивных веществ, состоящих из полинуклеотидов, на развитие ПТОА. В нашей работе полинуклеотиды показали большую медикаментозную эффективность по сравнению с группой сравнения.
НГ МП
—♦— ГН группа сравнения
—■— ГН опытная группа сутки сутки сутки сутки
ГН контрольная группа
Рисунок 4. Динамика ГН лабораторных животных
В большинстве исследований оценивали, в основном, клинико-рентгенологические изменения коленного сустава после инъекции полинуклеотидов [7, 9]. Известна провоцирующая роль интенсификации процессов перекисного окисления липидов в развитии ПТОА. Нами было установлено повышение активности изучаемых процессов, судя по высокой концентрации ГПЛ в сыворотке крови животных. Grigolo B. и соавт. (2003) обнаружили, что хондроциты пораженных остеоартрозом коленных суставов, активированные in vitro, продуцируют активные формы кислорода (АФК) и значительно ускоряют перекисное окисление липидов по сравнению с хондроцитами, активированными in vivo [10]. В нашей работе выявлено, что полинуклеотиды на основе гиалуроновой кислоты эффективно защищают от окислительного повреждения структуры сустава. В нормальных условиях АФК элиминируются акцепторами и реакциями детоксикации, катализируемыми преимущественно антиоксидантными ферментами. Возможно, что отличие нашего исследования от исследований других авторов в отношении антиоксидантного статуса связано с различиями в стадии заболевания. Хроническое заболевание суставов может истощать антиоксидантную защиту, тогда как острое воспаление может усиливать ее активность [10].
Регуляция метаболизма хрящевой и костной ткани происходит под действием механической нагрузки за счет диффузии растворенных веществ в синовиальной жидкости. В результате мы получили данные, в которых инъецируемый в виде полинуклеотидов пролиферанты позволяют улучшить качество хрящевой и костной тканей при ПТОА, основываясь на содержание ОК и ГН, о чем упоминалось в зарубежных источниках [11], но не было раскрыто экспериментально.
Заключение. Представляется перспективным использование полинуклеотидов, инициируемых в качестве пролиферантов, за счет их способности обеспечивать внутреннюю среду сустава нуклеотидами, нуклеозидами, пуриновыми и пиримидиновыми основаниями, тем самым поддерживая процессы физиологического восстановления окислительно-восстановительных реакций и костно-хрящевых структур сустава при экспериментальном ПТОА.
Список литературы Влияние полинуклеотидов в качестве инъецируемого пролиферанта на проявления экспериментального посттравматического остеоартроза
- Герасименко М.А., Белецкий А.В. Диагностика и лечение повреждений и ортопедических заболеваний коленного сустава. Минск: Технологии. 2010. C. 167. [Gerasimenko M.A., Beletsky A.V. Diagnostika i lechenie povrezhdenij i ortopedicheskih zabolevanij kolennogo sustava (Diagnosis and treatment of injuries and orthopedic diseases of the knee joint). Minsk: Technologies. 2010. P. 167].
- Kim S.K., Huh C.K., Lee J.H., Kim K.W., Kim M.Y. Histologic study of bone-forming capacity on polydeoxyribonucleotide combined with demineralized dentin matrix. Maxillofac Plast Reconstr Surg. 2016; 38(1):7. DOI: 10.1186/s40902-016-0053-5
- Veronesi F, Dallari D, Sabbioni G, Carubbi C, Martini L, Fini M. Polydeoxyribonucleotides (PDRNs) from skin to musculoskeletal tissue regeneration via adenosine A2A receptor involvement. J Cell Physiol. 2017;232(9):2299-2307. DOI: 10.1002/jcp.25663
- Зубавленко Р.А., Белова С.В., Ульянов В.Ю. Влияние фармако-биологических препаратов на развитие посттравматического остеоартроза // Вестник новых медицинских технологий. 2022;29(3):71-77. DOI: 10.24412/1609-2163-2022-3-71-77 [Zubavlenko R.A., Belova S.V., Ulyanov V.Yu. Influence of pharmacobiological preparations on the development of posttraumatic osteoarthritis. Bulletin of New Medical Technologies. 2022;29(3):71-77. DOI: 10.24412/1609-2163-2022-3-71-77].
- Bitto A., Polito F., Irrera N., D’Ascola A., Avenoso A., Nastasi G., Campo G.M., Micali A., Bagnato G., Minutoli L., Marini H., Rinaldi M., Squadrito F., Altavilla D. Polydeoxyribonucleotide reduces cytokine production and the severity of collagen-induced arthritis by stimulation of adenosine A(₂A) receptor. Arthritis Rheum. 2011;63(11):3364-3371. DOI: 10.1002/art.30538
- Белова С.В., Гладкова Е.В., Зубавленко Р.А., Ульянов В.Ю. Системные проявления первичного остеоартроза коленных суставов у пациентов на ранней стадии его развития. Вестник медицинского института «РЕАВИЗ»: реабилитация, врач и здоровье. 2021;(2):71-78. DOI: 10.20340/vmi-rvz.2021.2.CLIN.5 [Belova S.V., Gladkova E.V., Zubavlenko R.A., Ulyanov V.Yu. Systemic manifestations of primary osteoarthritis of the knee joints in patients at an early stage of its development. Bulletin of the Medical Institute «REAVIZ»: rehabilitation, doctor and health. 2021;(2):71-78. DOI: 10.20340/vmi-rvz.2021.2.CLIN.5].
- Chung K.I., Kim H.K., Kim W.S., Bae T.H. The effects of polydeoxyribonucleotide on the survival of random pattern skin flaps in rats. Arch Plast Surg. 2013;40(3):181-186. DOI: 10.5999/aps.2013.40.3.181
- De Caridi G., Massara M., Acri I., Zavettieri S., Grande R., Butrico L., de Franciscis S., Serra R. Trophic effects of polynucleotides and hyaluronic acid in the healing of venous ulcers of the lower limbs: a clinical study. Int Wound J. 2016;13(5):754-758. DOI: 10.1111/iwj.12368
- Guizzardi S., Galli C., Govoni P., Boratto R., Cattarini G., Martini D., Belletti S., Scandroglio R. Polydeoxyribonucleotide (PDRN) promotes human osteoblast proliferation: a new proposal for bone tissue repair. Life sciences. 2003;73(15):1973-1983. DOI: 10.1016/s0024-3205(03)00547-2
- Grigolo B., Roseti L., Fiorini M. Enhanced lipid peroxidation in synoviocytes from patients with osteoarthritis. Rheumatol. 2003;30(2):345-347.
- Gennero L, Denysenko T, Calisti GF, Vercelli A, Vercelli CM, Amedeo S, Mioletti S, Parino E, Montanaro M, Melcarne A, Juenemann C, De Vivo E, Longo A, Cavallo G, De Siena R. Protective effects of polydeoxyribonucleotides on cartilage degradation in experimental cultures. Cell Biochem Funct. 2013; 31 (3): 214-227. DOI: 10.1002/cbf.2875


