Влияние последовательности проведения химиолучевой терапии на эффективность лечения у больных с ограниченной стадией мелкоклеточного рака лёгких
Автор: Гладков О.А., Важенин А.В., Райгородский М.В., Кандакова Е.Ю., Шарабура Т.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 (30), 2008 года.
Бесплатный доступ
Проведено рандомизированное, одноцентровое исследование у 67 пациентов ограниченным мелкоклеточным раком лёгкого для сравнения эффективности двух вариантов химиолучевого лечения. В группе А (n=33) на первом этапе выполнялась одновременная химиолучевая терапия по схеме: цисплатин 80 мг/м2 в 1 день, этопозид 120 мг/м2 с 1 по 3 день и дистанционная лучевая терапия в режиме дневного дробления дозы по 1,5 Гр х 2 до 60 Гр на очаг и 44 Гр на пути лимфатического оттока. Впоследствии больным проводилось дополнительно 2 цикла химиотерапии по той же схеме. В группе Б (n=34) на первом этапе проводилось 2 цикла химиотерапии по указанной схеме ЕР, после этого, одновременно с 3 и 4 циклом химиотерапии, выполнялась дистанционная лучевая терапия. Непосредственная эффективность в группе А - 81,8 %, в группе Б - 76,5 %. Разница оказалась статистически недостоверна, p=0,61. Токсические реакции регистрировались чаще в группе А. Медиана перерыва в лечении для группы A составила 15 дней, для группы Б - 12 дней.
Мелкоклеточный рак легкого, химиолучевая терапия
Короткий адрес: https://sciup.org/14054907
IDR: 14054907 | УДК: :
Текст научной статьи Влияние последовательности проведения химиолучевой терапии на эффективность лечения у больных с ограниченной стадией мелкоклеточного рака лёгких
Материал и методы
Для изучения эффективности разной последовательности проведения одновременного химиолучевого лечения с января 2005 г. по декабрь 2006 г. в Челябинском областном онкологическом диспансере проведено проспективное, сравнительное, рандомизированное исследование. Критерии для включения в исследование были следующие: 1) возраст от 18 до 70 лет лет; 2) активность по шкале ECOG ≤ 2; 3) наличие морфологически подтверждённого диагноза мелкоклеточного рака лёгкого; 4) больные с ограниченной стадией мелкоклеточного рака лёгкого (согласно VALG); 5) пациенты предварительно не должны были получать какого-либо противоопухолевого лечения по поводу мелкоклеточного рака лёгких; 6) отсутствие декомпенсированной сопутствующей патологии (нестабильная стенокардия, нарушение ритма сердечной деятельности и т. д.); 7) абсолютное число нейтрофилов ≥ 1500 в мкл, тромбоцитов ≥ 100 000 в мкл, общий билирубин ≤ 30 ммоль/л, АСТ и АЛТ ≤ 2,5 кратного превышения от верхней границы нормы, креатинин ≤ 130 мкмоль/л.
После оценки соответствия критериям включения в исследование больных распределяли в две различные группы в зависимости от кратности и дозы введения цисплатина. Рандомизация осуществлялась с помощью генератора случайных чисел ППП. Statistica 6.0. В группе А на первом этапе выполнялась одновременная химиолучевая терапия. В первый день лечения больным начинали проведение химиотерапии по схеме: цисплатин 80 мг/м2 в 1-й день, с предварительным введением противорвотных средств (блокаторы 5НТ3 рецепторов, дексаметазон) и внутривенного введения физиологического раствора в объёме не менее 2400 мл, этопозид 120 мг/м2 с 1-го по 3-й день – схема ЕР. Дис-
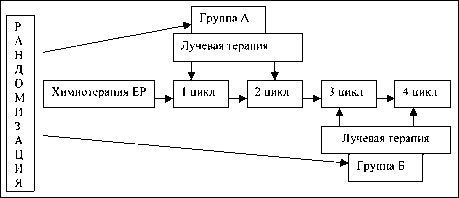
Рис. 1. Дизайн исследования танционная лучевая терапия проводилась с 1-го дня лечения, в режиме ускоренного гиперфракционирования до 60 Гр на очаг и 44 Гр на пути лимфатического оттока с первого дня химиотерапии (аппарат «Рокус М»). К моменту завершения лучевого лечения больные получали по 2 цикла химиотерапии. После окончания лучевой терапии и 2 циклов химиотерапии проводили дополнительно 2 цикла препаратами цисплатин и этопозид в тех же дозах и в том же графике введения. В группе Б на первом этапе проводилось 2 цикла химиотерапии: цисплатин 80 мг/ м2 в 1-й день, этопозид 120 мг/м2 с 1-го по 3-й день. Затем одновременно с 3-м и 4-м циклом химиотерапии проводилась дистанционная лучевая терапия до 60 Гр на очаг и 44 Гр на пути лимфатического оттока. Всего выполнялось 4 цикла химиотерапии по схеме ЕР в каждой группе (рис. 1). Эффект от лечения оценивался согласно критериям RECIST, через 2 нед после окончания химиолучевого лечения. Размеры первичной опухоли и метастатических узлов измерялись с использованием обзорной рентгенографии органов грудной клетки и томографии срединной тени.
Всего было рандомизировано 67 пациентов. В группе А было пролечено 33 больных, в группе Б – 34. В группах преобладали пациенты мужского пола, с IIIA стадией заболевания и общим статусом по ECOG = 1. Медиана возраста в обеих группах составила 54 года (табл. 1).
Непосредственная эффективность оказалась достаточно высокой в обеих группах, с частотой общего эффекта в группе А – 81,8 %, в группе Б – 76,5 %. Разница оказалась статистически недостоверна, p=0,61.
Как известно, проведение одновременного химиолучевого лечения сопровождается значительной токсичностью. По данным литературы,
Таблица 1
Таблица 2
Характеристика сравниваемых клинических групп
Рак лёгкого II–III стадии ввиду особенностей развития опухолевого процесса, часто осложняется обструкцией бронхиального дерева, некрозом опухолевой ткани. Эти явления, в свою очередь, приводят к развитию воспалительных процессов в рядом расположенной паренхиме лёгкого и плевре. Нами было неоднократно отмечено улучшение общего статуса больных, ликвидация воспалительного процесса после проведения инициальных 2 циклов химиоте-
Эффективность химиолучевого лечения по RECIST, n (%)
|
Непосредственная эффективность опухоли по RECIST |
Группа А (n=33) |
Группа Б (n=34) |
|
Полная регрессия |
7 (21,2) |
6 (17,7) |
|
Частичная регрессия |
20 (60,6) |
20 (58,8) |
|
Стабилизация |
4 (12,1) |
6 (17,6) |
|
Прогрессирование |
2 (6,1) |
2 (5,9) |
Таблица 3
Частота токсических реакций
Немаловажным показателем, влияющим негативно на эффективность лечения, являлись перерывы в лечении, связанные с развитием токсических эффектов. Всего приостановить химиолучевую терапию потребовались у 4 пациентов в каждой группе (рис. 2). Медиана перерыва в лечении для группы A составила 15 дней, для группы Б – 12 дней. Перерывы в лечении были более продолжительными у
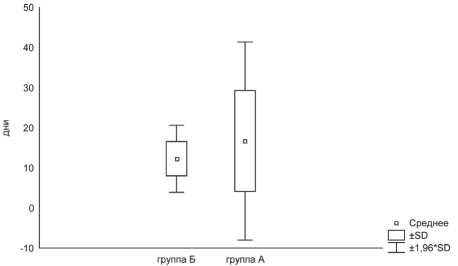
Рис. 2. Продолжительность перерывов в лечении вследствие развития токсических реакций пациентов с химиолучевым лечением, которое проводилось на первом этапе. Наиболее частой причиной являлась миелосупрессия. У 3 больных лечение были вынуждены приостановить вследствие эзофагита, плевропневмонии, острого перикардита.
Возникающая токсичность лечения иногда требовала снижения доз цитостатиков. Редукция доз потребовалась у 4 пациентов, по 2 случая в каждой группе. Дозы снижали на 20 %, вследствие развития на предыдущем цикле фебрильной нейтропении и тромбоцитопении III–IV ст. В целом, мы получили результаты, которые свидетельствуют о более высокой токсичности раннего начала химиолучевой терапии по сравнению с отсроченным лечением.
Анализируя полученные данные, можно отметить высокую эффективность одновременного химиолучевого лечения, получено 79,1 % объективных ответов, включая полные и частичные ремиссии, при приемлемой токсичности лечения. Все пациенты завершили запланиро- ванную терапию. Отмечена тенденция к более высокой непосредственной эффективности раннего начала одновременной химиолучевой терапии. Вместе с тем была зафиксирована более высокая частота развития токсических реакций для этого варианта лечения. Этот факт может иметь практическое значение для планирования лечения и отбора пациентов. С учётом более высокой токсичности следует назначать на первом этапе одновременное химиолучевое лечение больным, ориентируясь на хороший общий статус и отсутствие сопутствующих воспалительных явлений. Это будет способствовать снижению количества осложнений и повышению эффективности лечения вследствие уменьшения количества и продолжительности перерывов. При достижении необходимого времени наблюдения за пациентами, нами планируется изучить выживаемость в каждой группе для получения окончательных данных.


