Влияние поверхностно-активных веществ на комплексообразование титана (IV) с бромпирогаллоловым красным
Автор: Худайбердина Д.Р., Назырова А.П.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
В статье представлены результаты исследования влияния неионогенных поверхностно-активных веществ на комплексообразование титана (IV) с трифенилметановым красителем бромпирогаллоловым красным (БПК). Также изучены оптимальные условия образования и свойства комплексов, влияние на комплексообразование органических растворителей различной природы. Изучены спектры поглощения и кинетика реакции образования комплексов состава БПК-ПАВ и Ti-БПК-ПАВ. В качестве неионогенных поверхностно-активных веществ выбраны ОП-7 и ОП-10, различающиеся длинной оксиэтиленовой цепи. Повышение концентрации ПАВ не приводит к батохромным или гипсохромным сдвигам на спектрах поглощения, однако при достижении концентрации ОП-7 до 0,07 % и ОП-10 до 0,008 % происходит увеличение оптической плотности раствора. При анализе кинетических зависимостей было обнаружено, что в отсутствии поверхностно-активных веществ в образующийся комплекс не стабилизируется в течение двух часов, в то время как при увеличении концентрации ОП-7 комплекс образуется в течении 16 минут и остается стабильным в течение длительного времени. В присутствии ОП-10 комплекс стабилизируется также за 16 минут и остается устойчивым около часа при концентрации 0,008 %, при дальнейшем увеличении концентрации происходит разрушении комплекса и падение оптической плотности. Присутствие в реакционной смеси органических растворителей, в частности ацетона, практически никак не влияет на оптическую плотность раствора органического реагента, но гипохромно воздействует на образующийся комплекс с титаном, что может свидетельствовать о проникновении ацетона во внутреннюю координационную сферу и разрушении соединения металла с органическим реагентом, на что указывает также выпадение осадка при достижении концентрации ацетона 40 %. Градуировочная зависимость Ti-БПК-ОП-10 линейна в диапазоне концентраций от 0,4∙10-5 до 9,6 ∙ 10-5 М, для системы Ti-БПК-ОП-7 этот интервал составляет (0,4-8,0)∙10-5 М. В большей степени комплексообразованию мешают ионы ванадия (V), алюминия (III). Мешающее влияние данных ионов можно устранить введением в систему лимоннокислого аммония и аскорбиновой кислоты. Используя экспериментальные данные и графические методы - метод отношения наклонов, метод молярных отношений и метод изобестической точки, - установили стехиометрический состав реагентов комплекса. В системах с ОП-7 и ОП-10 существуют две формы комплекса титана с БПК: в соотношении 1:2 и, при увеличении концентрации БПК, в соотношении 1:4. Графический метод Комаря показал, что наибольшей устойчивостью обладают комплексы с соотношением 1:4, константы устойчивости для систем Ti-БПК-ОП-10 и Ti-БПК-ОП-7 в этом случае составили соответственно 6∙1015 и 2,5∙1016.
Комплексообразование, титан (iv), бромпирогаллоловый красный, поверхностно-активные вещества, спектрофотометрический анализ
Короткий адрес: https://sciup.org/147246060
IDR: 147246060 | УДК: 54.04+54.021 | DOI: 10.14529/chem240416
Текст научной статьи Влияние поверхностно-активных веществ на комплексообразование титана (IV) с бромпирогаллоловым красным
В настоящее время титан используется в промышленности для получения композиционных твердосплавных материалов, а также его определение проводят в рудах, минералах, промышленных водах и технологических продуктах [1]. Применение титана обширно, поскольку он обладает отличной совместимостью с углепластиком, используемым в двигателях ракет, а также снижает коэффициент теплового расширения [2]. Способы количественного определения титана широко исследуются [3–6]. Спектр применения данного элемента растет с каждым годом, что требует также создания максимально экспрессных, чувствительных и избирательных методик его определения.
Значительную роль в возможности спектрофотометрического обнаружения титана играет его способность образовывать окрашенные комплексные соединения с различными веществами. На эту способность большое влияния оказывают не только сами участники реакции комплексообразования, но и поверхностно-активные вещества (ПАВ) различной природы, которые выступаю в роли модификаторов химических свойств агентов реакции.
В присутствии катионных ПАВ, например, Triton X-114, в реакции комплексообразования с металлами наблюдается увеличение числа координационных лигандов. Вследствие этого увеличивается интенсивность полосы поглощения образующегося комплекса, что позволяет увеличить не только чувствительность, но и точность метода, так как полосы становятся значительно тоньше [7].
Смесь анионных и катионных ПАВ может быть особенно эффективна для улучшения метрологических характеристик анализа благодаря двойному эффекту: катионные ПАВ увеличивают число лигандов за счет разрыхления гидратной оболочки металла, а анионные ПАВ солюбилизируют полученный комплекс, что необходимо для избирательного анализа ионов многих металлов. Лучший эффект выделения и концентрирования комплексного соединения может быть получен при соотношении катионного и анионного составляющих 1:2 [8].
При сравнении влияния ПАВ различной природы на оптическую плотность комплексного соединения не имеющего кислотных или основных групп замечено, что неионные ПАВ и анионные ПАВ увеличивают оптическую плотность значительно эффективнее, чем катионные ПАВ. Неионные ПАВ также имеют ещё одно преимущество в виде высокого молярного коэффициента поглощения и плато на графике его зависимости от pH, что позволяет проводить анализ в большем интервале концентраций и кислотности среды [9].
К свойствам катионных ПАВ можно также отнести образование ионных ассоциатов стехиометрического состава при взаимодействии КПАВ и реагентов, содержащих кислотные группы, что делает возможным использование этих ПАВ в реакциях комплексообразования металлов и хромофорных хелатообразующих реагентов. Литературные данные также показывают, что образование ассоциатов по ионизованным ауксохромным группам реагентов сопровождается бато- и гиперхромными эффектами, изменением протолитических свойств и растворимости реагентов. Неионные ПАВ практически не влияют на положения максимума той или иной формы реагента красителя, а только увеличивают оптическую плотность, в присутствии же катионных ПАВ положения максимумов смещены батохромно, это означает, что ассоциаты образуются в более кислой среде. Эти данные позволяют сделать вывод об эффективности применения именно КПАВ для реагентов с кислотными группами [10, 11].
Улучшение спектрофотометрических характеристик в присутствии ПАВ наблюдается чаще всего для комплексов металлов с трифенилметановыми красителями. Для красителей отличных от трифенилметановой группы существенное влияние ПАВ на сдвиг максимумов или на оптическую плотность практически не наблюдается [12].
Трифениловые красители используются из-за их комплексообразующих свойств. Красители этой группы способны образовывать окрашенные комплексы как с неметаллами, так и с металлами [13]. Для определения металлов используются специфичные красители- бромпирогаллоло-вый и пирогаллоловый красный благодаря их способности образовывать водорастворимые окрашенные комплексы с различными редкоземельными элементами в виде бинарных комплексов для их микроопределения [14–17].
В частности, при изучении влияния катионных поверхностно-активных веществ на комплексообразование титана (IV) и меди (II) с пирогаллоловым красным и бромпирогаллоловым красным показано, что депротонирование реагентов с помощью КПАВ приводит к повышению их реакционной способности и возможности комплексообразования в сильнокислых средах, что играет большую роль для воспроизводимости спектрофотометрического определения малых концентраций ионов металлов [18, 19].
Целью данной работы является изучение влияния неионных ПАВ на комплексообразование титана с бромпирогаллоловым красным, а также получение информации о свойствах образующегося комплекса и оптимальных условиях его образования.
Экспериментальная часть
В ходе выполнения работы использовались следующие реактивы: стандартный раствор титана, раствор бромпирогаллолового красного, растворы ОП-7 и ОП-10. Все растворы готовились растворением точной навески, рабочие растворы готовились из стандартных путем разбавления. Для создания и поддержания кислотности среды использовались буферные растворы с pH в интервале 1–5, для установления влияния органических растворителей использовались полярный апротонный растворитель – ацетон и полярный протонный растворитель – изопропиловый спирт.
Для регистрации оптической плотности исследуемых комплексов использовался Спектрофотометр ПЭ-5300. Кислотность растворов контролировалась с помощью pH-метра «Эксперт-001» с индикаторным стеклянным электродом и хлоридсеребряным электродом сравнения.
Чтобы изучить комплексообразование титана с бромпирогаллоловым красным, необходимо изучить кинетику процесса; влияние на оптическую плотность концентрации компонентов, входящих в комплекс, а также показателя кислотности среды; влияние мешающих ионов на комплексообразование; изучить стехиометрию комплекса и произвести расчёты констант устойчивости комплексов.
Влияние концентрации компонентов изучали путем приготовления растворов с переменной концентрацией определяемого компонента. За оптимальную концентрацию принималась та, при которой светопоглощение комплекса максимально.
Для определения соотношения компонентов, входящих в комплекс, использовали метод отношения наклонов, метод изобестической точки и метод молярных отношений.
Для определения стехиометрических коэффициентов по методу отношения наклонов использовали отношение тангенсов углов наклонов прямолинейных участков зависимости оптической плотности от концентрации бромпирогаллолового красного и тангенса угла наклона градуировочного графика.
Для определения стехиометрического коэффициента реагента по методу молярных отношений была построена зависимость А- C r / C m , для расчёта коэффициента n использовали предельные значения оптической плотности раствора реагента и раствора комплекса A, а также концентрации металла C m и реагента C r по формуле
А ПР / ( C m l )
Апр'/( С-1 ) .
Определение стехиометрического коэффициента реагента по методу изобестической точки проводили с помощью графической зависимости A- C r /( C r + C m ), определяли абсциссу изобестической точки и с помощью неё рассчитывали коэффициент n по уравнению
C r
C r + C m
n
П + 1
Константу устойчивости КР и коэффициент молярного поглощения г к анализируемого комплекса определяли, используя графическую интерпретацию метода Комаря - Толмачева. При определении г к и К р , как и в аналитическом варианте, измеряют оптические плотности растворов с различными концентрациями реагирующих компонентов, но при постоянном стехиометрически требуемом соотношении . По данным измерения оптической плотности растворов строят график в координатах Cl/A - 1/п+>/А ^ , по которому находят сначала гК , а затем, определив угловой коэффициент прямой ( b = Q ), рассчитывают константу равновесия по уравнению [20]:
K P -
C H nln
ПП 8 k Q + 1
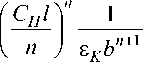
где Сн - концентрация ионов водорода, I - оптическая длина кюветы, см.
Обсуждение результатов
Спектры поглощения. Спектры поглощения комплексов были сняты в присутствии неионных поверхностно-активных веществ различной концентрации в широком интервале длин волн. Результаты приведены на рис. 1, 2.
При определении аналитической длины волны было замечено, что при повышении концентрации ОП-7 и ОП-10 заметных гипсохромных или батохромных сдвигов не происходит, однако при увеличении концентрации ОП-7 до 0,07 % и ОП-10 до 0,008 % происходит увеличение оптической плотности раствора.
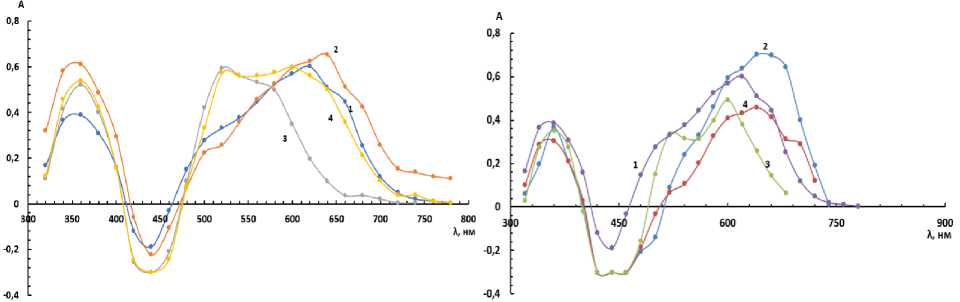
Рис. 1. Спектры поглощения раствора комплекса реагента с титаном (IV) с концентрациями С(Ti) = 3,12∙10–5 М, С(БПК) = 1,7∙10–4 М, при различной концентрации ОП-10, при постоянном pH 1,5:
1 – ОП-10 0 %; 2 – ОП-10 0,07 %; 3 – ОП-10 0,008 %;
4 – ОП-10 0,3 %
Рис. 2. Спектры поглощения раствора комплекса реагента с титаном (IV) с концентрациями С(Ti) = 3,12∙10–5 М, С(БПК) = 1,7∙10–4 М, при различной концентрации ОП-7, при постоянном pH 1,5:
1 – ОП-7 0 %; 2 – ОП-7 0,008 %; 3 – ОП-7 0,07 %;
4 – ОП-7 0,3 %
Кинетика комплексообразования. Путем построения кинетических кривых в координатах А–t (c), полученных измерением оптической плотности через равные промежутки времени, было определено время образования комплексов. При анализе кинетических зависимостей было обнаружено, что в отсутствие стабилизирующих реагентов комплекс не стабилизируется за два часа. При увеличении концентрации ОП-7 комплекс образуется в течении 16 минут и остается стабильным на протяжении двух часов с концентрацией ОП-7 0,07 % и в течение одного часа с концентрацией 0,3 %. Таким образом оптимальная концентрация ОП-7 составила 0,07 %. В присутствии ОП-10 комплекс стабилизируется за 16 минут и остается стабильным час при концентрации 0,008 %, при дальнейшем увеличении концентрации происходит разрушении комплекса и падение оптической плотности, поэтому концентрация 0,008 % в системе с ОП-10 является наиболее оптимальной. Кинетические кривые приведены на рис. 3, 4.
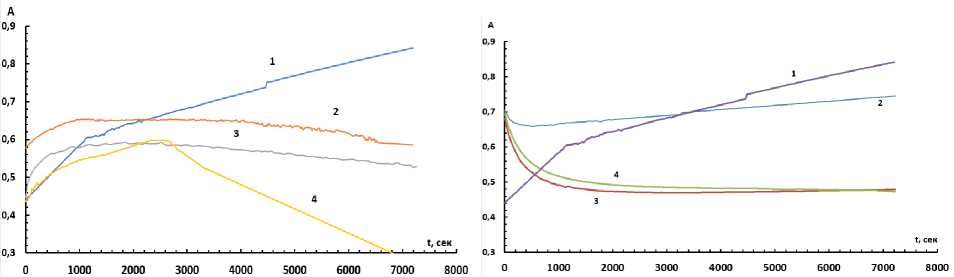
Рис. 3. Кинетическая зависимость оптической плотности раствора реагента с титаном (VI) (С(Ti) = 3,12∙10-5 М, С(БПК) = 1,7∙10–4 М, pH 1,5) от времени: 1 – ОП-10 0 %; 2 – ОП-10 0,008 %;
3 – ОП-10 0,07 %; 4 – ОП-10 0,3 %
Рис. 4. Кинетическая зависимость оптической плотности раствора реагента с титаном (VI) (С(Ti) = 3,12∙10–5 М, С(БПК) = 1,7∙10–4 М, pH 1,5) от времени: 1 – ОП-7 0 %; 2 – ОП-7 0,008 %;
3 – ОП-7 0,07 %; 4 – ОП-7 0,3 %
Определение оптимального pH . В ходе изучения зависимости оптической плотности комплекса от pH был выбран интервал, позволяющий получить максимальную оптическую плотность: 3-3,5 для системы Т^!У)-БПК-ОП-10 и 3,5-3,7 - для системы Ti(IV)-БПК-ОП-7. Известно, что при данном pH в растворе существует форма Н3К-бромпирогаллолового красного, которая и образует комплекс с ионом титана (IV) [21]. Графические зависимости оптической плотности образующихся комплексов от кислотности среды приведены на рис. 5, 6.
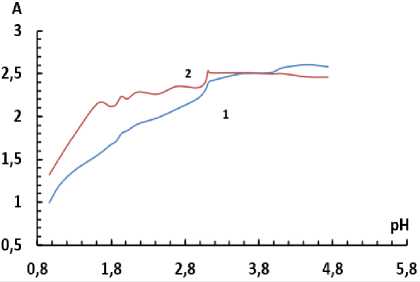
Рис. 5. Зависимость оптической плотности от pH для раствора реагента С(БПК) = 1,7∙10–4 М, 1 – С(ОП-10) = 0,008 %, 2 – С(ОП-7) = 0,07
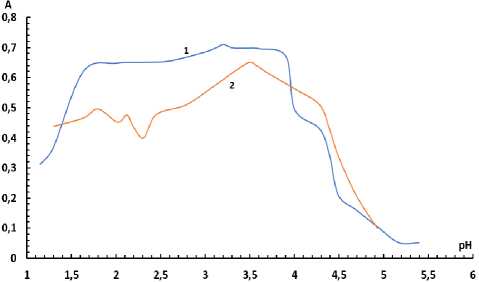
Рис. 6. Зависимость оптической плотности от pH для раствора комплекса С(Ti) = 3,12∙10–5 М, С(БПК) = 1,7∙10–4 М, 1 – С(ОП-10) = 0,008 %, 2 – С(ОП-7)= 0,07 %
Таким образом, были выбраны значения pH растворов, при которых проводили дальнейшие опыты, данные представлены в табл. 1.
Таблица 1
Оптимальный интервал pH в системах с ОП-10 и ОП-7
|
MeR |
pH |
|
БПК–Ti–ОП-10 |
3,00–3,50 |
|
БПК–Ti–ОП-7 |
3,50–3,70 |
Влияние концентрации бромпирогаллолового красного. На рис. 7, 8 представлены зависимости оптической плотности от концентрации БПК для растворов БПК-ПАВ и комплекса Ti-БПК-ПАВ соответственно.
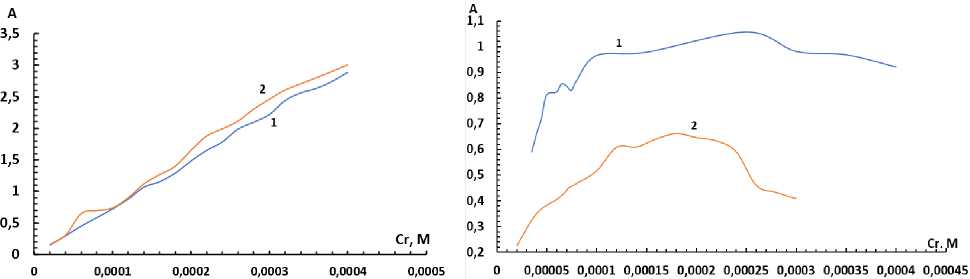
Рис. 7. Влияние концентрации БПК на оптическую плотность раствора реагента при pH 3,5:
1 – С(ОП-10) = 0,008 %, 2 – C(ОП-7) = 0,07 %
Рис. 8. Влияние концентрации БПК на оптическую плотность раствора комплекса при pH 3,5, С(Ti) = 3,12∙10–5 М, 1 – С(ОП-10) = 0,008 %, 2 – C(ОП-7) = 0,07 %
На основании этих зависимостей были подобраны наиболее эффективные концентрации компонентов комплекса, позволяющие получить высокие значения оптических плотностей. Полученные данные приведены в табл. 2.
Таблица 2
Оптимальные концентрации компонентов в комплексе
|
Компонент |
Концентрация, моль/л |
|
|
БПК+Ti+ОП-10 |
БПК+Ti+ОП-7 |
|
|
БПК |
1,5∙10–4 |
1,8∙10–4 |
|
ОП-10 |
1,2∙10–4 |
– |
|
ОП-7 |
— |
1,0∙10–3 |
Влияние органического растворителя. Для изучения влияния растворителей на комплексообразование согласно ранее полученным данным были приготовлены растворы с добавлением соответствующего растворителя. На рис. 9, 10 приведены зависимости оптической плотности раствора Ti-БПК-ОП-7 от концентрации введенного органического растворителя. Аналогичный опыт был проведен для системы Ti-БПК-ОП-10.
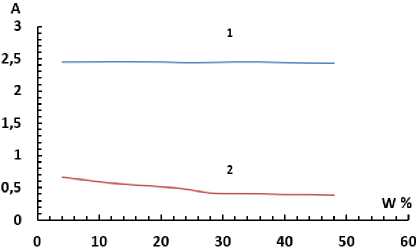
Рис. 9. Зависимость оптической плотности раствора реагента (1) и комплекса (2) от концентрации изопропилового спирта при l = 10 мм, pH = 3,5, С(БПК) = 1,8∙10–4 М, C(Ti) = 3,12∙10–5 М, С(ОП-7) = 0,07 %
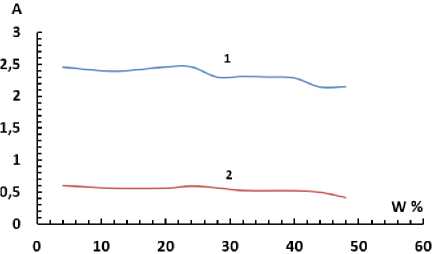
Рис. 10. Зависимость оптической плотности раствора реагента (1) и комплекса (2) от концентрации ацетона при l = 10 мм, pH 3,5, С(БПК) = 1,8∙10–4 М, C(Ti) = 3,12∙10–5 М,
С(ОП-7) = 0 , 07 %
При добавлении в систему ацетона выше 40 % наблюдалось выпадение осадка. Полученные результаты позволяют показывают, что введение органических растворителей практически не влияет на оптическую плотность растворов реагента и негативно, гипохромно, влияет на оптическую плотность раствора комплекса.
Отрицательное влияние органических растворителей на оптическую плотность раствора комплекса может свидетельствовать о проникновении их во внутреннюю координационную сферу и разрушении соединения металла с органическим реагентом, на что указывает также выпадение осадка при достижении высоких концентраций органических растворителей в растворе.
Один из используемых в работе – ацетон – обладает высоким донорным числом (DN = 17,0), но меньшим, чем у воды (DN = 18,0). Акцепторное число ацетона значительно ниже, чем у воды (12,5 и 54,8 соответственно). Уменьшение ε (диэлектрической проницаемости) по мере добавления ацетона (ε(H 2 O) = 81,0; ε(ацетона) = 20,7) способствует процессам ассоциации ионов, что приводит к дополнительной стабилизации комплексных соединений. Однако, ацетон – растворитель координирующий, поэтому вполне вероятно, что его молекулы будут входить во внутреннюю координационную сферу. Это влияние ацетона можно рассматривать как отрицательное, так как разрушая комплекс и одновременно с этим влияя на сольватируемость реагентов он может привести к выпадению осадка.
Еще одним используемым в работе растворителем является изопропиловый спирт. Большинство растворов реагентов готовятся именно в смеси воды и изопропилового спирта. Донорное число изопропилового спирта (36) гораздо выше, чем у ацетона, по-видимому, при низком донорном числе комплекс и краситель перестают растворяться и выпадают в осадок [22–23].
Влияние мешающих компонентов . Для определения влияния мешающих компонентов были приготовлены растворы исследуемых комплексов с различной концентрацией ионов, потенциально оказывающих мешающее воздействие. За мешающие ионы принимались те, присутствие которых в растворе приводит к изменению оптической плотности на 5 и более %. Результаты приведены в табл. 3.
Полученные данные позволяют сделать вывод о том, что анализу сильно мешают ионы ванадия (V), алюминия (III). Мешающее влияние данных ионов можно устранить введением в систему лимоннокислого аммония и аскорбиновой кислоты.
Таблица 3
|
Ион |
Соль |
C ион /C Ti |
|
|
Ti+БПК+ОП-10 |
Ti+БПК+ОП-7 |
||
|
V5+ |
NaVO 3 |
1 |
1 |
|
Al3+ |
AlCl 3 |
2 |
2 |
|
Fe3+ |
Fe(NO 3 ) 3 |
5 |
5 |
|
Cr6+ |
K 2 Cr 2 O 7 |
5 |
5 |
|
Ni3+ |
NiSO 4 |
20 |
10 |
|
NO 3 - |
NaNO 3 |
5 |
5 |
|
SO42- |
Na 2 SO 4 |
> 300 |
> 300 |
Соотношения концентрации ионов, мешающих определению титана
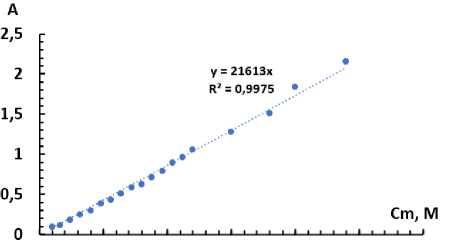
Влияние концентрации Ti. Для определения концентрации титана фотометрировали растворы с различной концентрацией металла, после чего строили градуировочные зависимости в координатах оптическая плотность – концентрация титана (моль/л). Зависимости приведены на рис. 11, 12.
Для системы Ti(IV)-БПК-ОП-10 пределы для градуировки составили (0,4-9,6) ∙10–5 М, градуировочная характеристика:y = 2,16∙104x, для системы Ti(IV)-БПК-ОП-7 – (0,4-8,0) ∙10–5 М, градуировочная характеристика: y = 2∙104x.
О 0,00002 0,00004 0,00006 0,00008 0,0001 0,00012
Рис. 11. Зависимость оптической плотности раствора от концентрации титана: при l = 10 мм, pH = 3,5, С(БПК) = 1,5∙10–4 М, С(ОП-10) = 0,008 %
у = 20474х
R2 = 0,9917
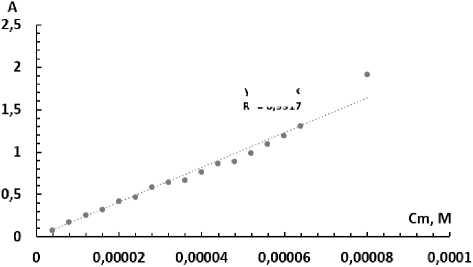
Рис. 12. Зависимость оптической плотности раствора от концентрации титана: при l = 10 мм, pH = 3,5, С(БПК) = 1,8∙10–4 М, С(ОП-7) = 0,07 %
Определение состава комплексного соединения . Изучение стехиометрии тремя методами позволило прийти к выводу, что в системах с ОП-7 и ОП-10 существуют две формы комплекса титана с БПК, со стехиометрией 1:2 и, при увеличении концентрации БПК, 1:4. Стехиометрические коэффициенты систем представлены в табл. 4, 5.
Таблица 4
Стехиометрические коэффициенты БПК в присутствии ОП-10
Таблица 5
Стехиометрические коэффициенты БПК в присутствии ОП-7
|
Метод определения коэффициента |
Соотношение m:n в пределах концентраций органического реагента |
|
|
(3,5–6,5)∙10–5 М |
(0,7–2,0)∙10–4 М |
|
|
Метод молярных отношений |
1:2 |
1:4 |
|
Метод изобестиче-ской точки |
1:2 |
1:4 |
|
Метод отношения наклонов |
1:2 |
1:4 |
|
Метод определения коэффициента |
Соотношение m:n в пределах концентраций органического реагента |
|
|
(2–7,5)∙10–5 М |
(0,8–2,0)∙10–4 М |
|
|
Метод молярных отношений |
1:2 |
1:4 |
|
Метод изобестиче-ской точки |
1:2 |
1:4 |
|
Метод отношения наклонов |
1:4 |
1:4 |
Данные о форме БПК в растворе с pH 3 позволили предположить структуры полученных комплексов. В комплексе со стехиометрическим отношением 1:2 координационное число тита- на 6, этот комплекс достигает устойчивости благодаря двум замкнутым циклам с координационными связями. В комплексе 1:4 координационное число титана 8, что возможно, поскольку частица Ti→O имеет в растворе октаэдрическую координацию, которая может сохраниться и при замещении на ионы бромпирогаллолового красного [24, 25]. Данный комплекс обладает хорошей устойчивостью из-за уже четырех замкнутых через титан циклов c координационными связями, его структурная формула приведена на рис. 13.
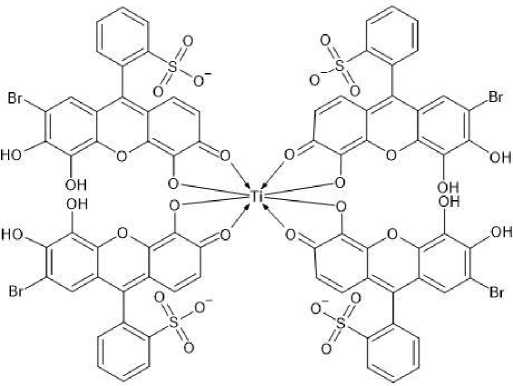
Рис. 13. Предполагаемая структура комплексного соединения бромпирогаллолового красного с титаном (IV) в соотношении 1:4
Константа устойчивости. С использованием графической интерпретации метода Комаря определили константы устойчивости комплексов различного состава, образующихся в присутствии ОП-10 и ОП-7. Результаты приведены в табл. 6.
Таблица 6 Константы устойчивости комплексов различного состава
|
Стабилизирующий реагент в системе Ti(IV)-БПК |
Соотношение m:n |
|
|
1:2 |
1:4 |
|
|
ОП-10 |
2·1012 |
6·1015 |
|
ОП-7 |
4,98·1012 |
2,49·1016 |
Выводы
Таким образом, на основании всего вышеизложенного можно сделать вывод о том, что бромпирогаллоловый красный, стабилизированный неионными ПАВ, является перспективным реагентом для количественного определения титана (IV) с высокой чувствительностью, избирательностью и экспрессностью.
Список литературы Влияние поверхностно-активных веществ на комплексообразование титана (IV) с бромпирогаллоловым красным
- Elias C.N., Lima J.H.C., ValievR. et al. // Biomedical applications of titanium and its alloys. 2008. No. 60. P. 46. DOI: 10.1007/s11837-008-0031-1
- Boyer R.R. // Adv Perform Mater. 1995. No. 2. P. 349.
- Люминесцентный способ определения титана: пат. 256332 A1 CCCPN1237404/23-26: заявл. 05.05.1968; опубл. 04.11.1969; заявитель Институт общей и неорганической химии АН Украинской ССР.
- Способ определения титана: пат. 256336 A1 CCCPN1210130/23-26: заявл. 08.01.1968; опубл. 04.11.1969 / М.К. Ахмедли, Н.Н. Басаргин, М.М. Ширинов; заявитель Азербайджанский государственный университет им. С. М. Кирова.
- Dai Y., Tian L., Zou D., Cao S. // IOP Conference Series: Earth and Environmental Science. 2020. No. 474. P. 26. DOI: 10.1088/1755-1315/474/5/052030
- Симаков П.Е. Концентирование и определение микроколичествмолибдена(У1), циркония(ГУ) и титана(ГУ) в породах и сплавах полимерными комплексообразующими: автореф. дис.... канд. хим. наук. Орловский государственный университет. М., 2010. 21 с.
- Racheva P.V., Milcheva N.P., Gene F. et al. II Spectrochimica Acta. Part A: Molecular and Bio-molecular Spectroscopy. 2021. No. 262. DOI: 10.1016Ij.saa.2021.120106
- Akl Z. F. II Chemical Papers. 2021. No. 75 (11). P. 5729. DOI: 10.1007Is11696-021-01752-2
- Дашдэндэв Бурмаа, Иванов В.М., Фигуровская В.Н. // Вестник Московского университета. Серия 2: Химия. 2000. Т. 41, № 2. C. 115. EDN: ESDBCJ
- Иванов В.М., Мамедова А.М. // Вестник Московского университета. Серия 2: Химия. 2005. Т. 43, № 5. C. 291.
- Денисова С.А., Леснов А.Е. // Вестник Пермского университета. Серия: Химия. 2018. Т. 8, вып. 1. C. 39. DOI: 10.17072I2223-1838-2018-1-39-53
- Денисова С.А., Леснов А.Е. // Вестник Пермского университета. Серия: Химия. 2019. Т. 9, вып. 1. С. 28. DOI: 10.17072I2223-1838-2019-1-28-38
- Амиров Р.Р., Мирсайзянова С.А., Петрова А.А. и др. Спектрофотометрическое исследование комплексообразования железа(Ш) c тироном в водных растворах солей щелочных и щелочноземельных металлов // Ученые записки Казанского университета. Серия: Естественные науки. 2007. Т. 149, кн. 4. C. 39. EDN: JJTQZB
- Susmitha K., Thirumalachary M., Singh T.C. et al. II Journal of the Chilean Chemical Society. 2014. No. 59 (1). P. 2265. DOI: 10.4067IS0717-97072014000100005
- Salveson P.J., Haerianardakani S., Thuy-Boun A. et al. II Journal of the American Chemical Society. 2014. No. 140 (37). P. 11745. DOI: 10.1021Ijacs.8b06568
- Belsare G.W., Zade A.B., Kalbende P.P. et al. II Der Pharma Chemica. 2019. No. 4 (3). P. 1226.
- Zade A.B., DhepeA. S. II Journal of the Indian Chemical Society. 2013. No. 90 (9). P. 1367.
- Мамедова А.М., Иванов В.М., Ахмедов С.А. // Вестник Московского университета. Серия 2: Химия. 2004. Т. 45, № 2. C. 117. EDN: HBOCTL
- Мамедова А.М., Иванов В.М., Ахмедов С.А. // Вестник Московского университета. Серия 2: Химия. 2003. Т. 44, № 5. C. 304. EDN: HBOCFP
- Калинкин И.П., Булатов М.И. Практическое руководство по фотометрическим методам анализа. 5-е изд., перераб. М.: Книга по требованию, 2013. 432 с.
- Иванов В.М., Мамедова А.М. // Вестник Московского университета. Серия 2: Химия. 2002. Т. 43, № 3. С. 167. EDN: ESDCSH
- Аль Ансари С.В., Чернова М.В., Попова Т.В. и др. // Известия высших учебных заведений. Химия и химическая технология. 2003. Т. 46, вып. 1. С. 159. EDN: TABERN
- Payehghadr M., Hashemi S.E. II Journal of Inclusion Phenomena and Macrocyclic Chemistry. 2017. No 89. Р. 253-271. DOI: 10.1007Is10847-017-0759-8
- Эйхгорн Г. Неорганическая биохимия. М.: МИР, 1978. 716 с.
- Пилипенко В.А., Пономарь В.Н., Пилипенко И.В. // Вестник Белорусского государственного университета. Серия 2: Физика. Математика. Информатика. 2004. Т. 3. С. 53.


