Влияние препаратов с противоопухолевой активностью - доксорубицина и циклофосфана - на структурную реорганизацию миокарда крыс и численность кардиомиоцитов
Автор: Непомнящих Л.М., Лушникова Е.Л., Клинникова М.Г., Молодых О.П.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (46), 2011 года.
Бесплатный доступ
Изучена структурная реорганизации миокарда крыс при введении интактным животным противоопухолевых препаратов (доксорубицина и циклофосфана). Показано, что оба цитостатика вызывают некробиотические повреждения кардиомио- цитов, их гибель, обусловливая уменьшение массы сердца и общей численности кардиомиоцитов, наиболее значительные при действии доксорубицина. Установлено, что цитотоксические воздействия вызывают не только повреждение кардио- миоцитов, но и индуцируют регенераторные процессы: отмечаются кариокинез и цитокинез кардиомиоцитов, наиболее выраженные после действия циклофосфана. Для оценки регенераторного потенциала миокарда в постцитостатическом периоде предложен комплексный подход, включающий анализ митотической активности кардиомиоцитов, изменения их размеров и соотношения одно- и двуядерных клеток, выраженность процессов внутриклеточной регенерации. Установ- ленная возможность восстановления численности кардиомиоцитов после воздействия кардиотоксическими препаратами может способствовать развитию новых технологий стимулирования клеточных форм регенерации кардиомиоцитов при сердечной патологии.
Миокард, структурная реорганизация, численность кардиомиоцитов, репликативный резерв, доксорубицин, циклофосфан
Короткий адрес: https://sciup.org/14055925
IDR: 14055925 | УДК: 616.127-018:615.277.3]-092.9
Текст научной статьи Влияние препаратов с противоопухолевой активностью - доксорубицина и циклофосфана - на структурную реорганизацию миокарда крыс и численность кардиомиоцитов
В настоящее время кардиотоксические доза-зависимые эффекты установлены для многих препаратов, используемых для проведения химиотерапии. К ним, прежде всего, относятся антрациклиновые антибиотики, реже – ци-клофосфан (ЦФ), 5-фторурацил, таксаны, цисплатин и др. [1, 2, 6, 8, 11]. Кардиотокси-ческие эффекты химиотерапии подразделяют на острые, хронические и отсроченные. Наиболее значительное ремоделирование сердца и тяжелые формы сердечной недостаточности выявляются в более поздние сроки после завер- шения химиотерапии и характерны в основном для антрациклиновых антибиотиков.
В серии проведенных нами фундаментальных исследований было установлено, что цитотоксические свойства антрациклиновых антибиотиков (в частности, доксорубицина и рубицина) обусловлены их негативным влиянием на процессы воспроизводства ультраструктур кардиомиоцитов (КМЦ), приводящим к угнетению их внутриклеточной регенерации, а развивающаяся в таких условиях сердечная недостаточность была классифицирована как регенераторно-пластическая [5, 6]. В качестве основных молекулярных механизмов ингибирования процессов внутриклеточной регенерации КМЦ антрациклиновыми антибиотиками рассматриваются их способность интеркалировать в молекулу ДНК и генерация свободнорадикальных процессов, вследствие чего происходит значительное изменение физико-химических характеристик сарколеммы и внутриклеточных мембран, изменяются сигнально-трансдукторные пути, интенсивность биосинтетических процессов, в ряде случаев усиливается индукция апоптоза [4, 6].
Кардиотоксические свойства других цитостатиков, в частности циклофосфана, изучены в меньшей степени. Считается, что в цитотоксичности ЦФ важнейшую роль играет интенсификация свободнорадикальных реакций [2]. Однако характер структурных изменений миокарда при действии алкилирующих соединений практически не изучен. Не выяснены также основные типы повреждений КМЦ, не установлены возможности и типы их регенерации.
Цель исследования – изучить характер структурной реорганизации миокарда экспериментальных животных при действии доксорубицина и ЦФ с оценкой общей численности КМЦ в сердце как интегрального показателя выраженности регенераторных реакций.
Материал и методы
Комплексный морфологический анализ миокарда крыс Вистар выполнен при моделировании доксорубициновых и циклофосфановых повреждений миокарда. Исследования проведены на 32 крысах-самцах Вистар, содержавшихся в стандартных условиях вивария. Животные были разделены на две группы: крысам 1-й группы (n=10) вводили однократно внутрибрюшинно доксорубицин (ДОК) («ЛЭНС-Фарм», Москва) в дозе 7 мг/кг; животным 2-й группы (n=10) – однократно внутрибрюшинно ЦФ («Биохимик», Саранск) в дозе 125 мг/кг. Контрольным животным (n=12) внутрибрюшинно однократно вводили физиологический раствор в соответствующем их массе тела объеме. Половину животных всех групп декапитировали с использованием эфирного наркоза через 3 сут, другую половину – через 14 сут после введения препаратов. Эксперименты проведены в соответствии с правилами, принятыми Европейской конвенцией по защите животных (Страсбург, 1986) и одобренными биоэтическим комитетом НИИ региональной патологии и патоморфологии СО РАМН.
После вскрытия грудной клетки сердце быстро отделяли от окружающих тканей и взвешивали. Для получения парафиновых срезов образцы фиксировали в 10 % растворе нейтрального формалина, для получения полутонких срезов – в 4 % растворе параформальдегида с постфиксацией в четырехокиси осмия и заливкой в смесь эпона и аралдита. Парафиновые срезы окрашивали гематоксилином и эозином с постановкой реакции Перлса и по ван Гизону. Полутонкие срезы окрашивали 1 % раствором азура II. Исследование и морфометрический анализ (измерение диаметра КМЦ) проводили в универсальном микроскопе «Leica DM 4000B» с использованием цифровой фотокамеры «Leica DFC 320» и компьютерной программы «Leica QWin».
Для количественной оценки общей популяции КМЦ в сердце применяли метод щелочной диссоциации фиксированных тканей [3]. Кроме общей численности КМЦ в сердце, определяли количественное соотношение одно-, дву- и многоядерных (3 и более ядер) КМЦ. Статистическую обработку результатов проводили с использованием t-критерия Стьюдента.
Результаты и обсуждение
Общетоксические свойства ДОК и ЦФ оценивали по уровню летальности и изменениям массы тела. Однократное введение ЦФ (в дозе 125 мг/кг) вызывало гибель 25 % животных (смерть наступала на 7–10-е сут после введения препарата), в то время как после однократного введения ДОК (в дозе 7 мг/кг) в исследованные сроки эксперимента летальных исходов не было. Масса тела снижалась при введении обоих цитостатиков на протяжении всего эксперимента, но в наибольшей степени – через 14 сут после введения ДОК (на 34 %, р<0,05) (таблица).
Кардиотоксические свойства ДОК и ЦФ проявлялись в повреждениях КМЦ, уменьшении массы сердца, диаметра и общей численности КМЦ. Если после однократного введения ЦФ уменьшение этих показателей наблюдалось в течение первых 3 сут эксперимента, то однократное введение ДОК обусловливало значительное уменьшение всех показателей в течение всего эксперимента (таблица). Через 14 сут после введения ДОК масса сердца снижалась на 24 % (р<0,05), диаметр КМЦ – на 25 % (р<0,05), а их абсолютная численность – на 39 % (р<0,05). Снижение абсолютной численности КМЦ было обусловлено их гибелью преимущественно путем апоптоза [4] и ингибированием пролиферации. Отсутствие существенных изменений численности КМЦ в сердце через 3 сут после введения ЦФ свидетельствует о сохранении клеточной формы их регенерации. Через 14 сут после введения ЦФ абсолютная численность КМЦ в сердце была даже увеличена (на 48 %), хотя и не достоверно, что могло быть обусловлено пролиферацией клеток.
Ведущим типом повреждения КМЦ после действия цитостатиков являются литические повреждения (нарушение компактной упаковки и разрежение миофибрилл, выраженное просветление цитоплазмы, образование очагов
Таблица
Морфометрический анализ и количественная оценка популяции кардиомиоцитов в сердце крыс Вистар после воздействия доксорубицина и циклофосфана (M±m)
|
Показатель |
Ведение доксорубицина |
Ведение циклофосфана |
||
|
контроль |
ДОК |
контроль |
ЦФ |
|
|
3 сут |
||||
|
Масса тела, г |
222,7 ± 6,4 |
217,0 ± 22,4 |
204,0 ± 7,0 |
198,0 ± 8,3 |
|
Масса сердца, г |
0,89 ± 0,03 |
0,84 ± 0,07 |
0,79 ± 0,05 |
0,70 ± 0,03 |
|
Диаметр кардиомиоцитов, мкм |
14,99 ± 0,20 |
13,32 ± 0,17 |
15,80 ± 0,13 |
16,14 ± 0,58 |
|
Концентрация кардиомиоцитов, 103/мг ткани |
14,654 ± 0,487 |
15,340 ± 1,120 |
17,343 ± 0,809 |
17,334 ± 1,268 |
|
Абсолютная численность кардиомиоцитов в сердце, х106 |
11,086 ± 0,453 |
9,610 ± 0,200* |
12,316 ± 0,252 |
11,607 ± 1,199 |
|
Количество клеток, %: |
||||
|
одноядерных |
19,7 ± 0,5 |
15,6 ± 2,1 |
21,5 ± 5,3 |
14,9 ± 0,4 |
|
двуядерных |
79,2 ± 0,5 |
83,1 ± 1,8 |
75,1 ± 5,6 |
82,6 ± 0,7 |
|
многоядерных (3 и более ядер) |
1,1 ± 0,2 |
1,3 ± 0,5 |
3,4 ± 0,3 |
2,5 ± 0,3 |
|
14 сут |
||||
|
Масса тела, г |
319,0 ± 3,8 |
209,4 ± 17,0* |
248,3 ± 15,9 |
226,7 ± 14,2 |
|
Масса сердца, г |
1,03 ± 0,03 |
0,78 ± 0,08* |
0,76 ± 0,04 |
0,76 ± 0,08 |
|
Диаметр кардиомиоцитов, мкм |
14,75 ± 0,38 |
11,03 ± 0,36* |
16,65 ± 0,16 |
16,05 ± 0,24 |
|
Концентрация кардиомиоцитов, 103/мг ткани |
14,811 ± 0,500 |
15,656 ± 0,664 |
13,087 ± 1,733 |
19,651 ± 2,996 |
|
Абсолютная численность кардиомиоцитов в сердце, х106 |
13,807 ± 1,029 |
8,429 ± 1,055* |
9,237 ± 1,411 |
13,716 ± 2,792 |
|
Количество клеток, %: |
||||
|
одноядерных |
14,3 ± 0,7 |
9,5 ± 0,4** |
30,5 ± 2,7 |
26,5 ± 7,9 |
|
двуядерных |
85,5 ± 0,8 |
90,3 ± 0,4 |
66,9 ± 2,2 |
70,2 ± 7,3 |
|
многоядерных (3 и более ядер) |
0,2 ± 0,1 |
0,2 ± 0,1 |
2,5 ± 0,5 |
3,2 ± 0,8 |
Примечание: * – различия статистически значимы по сравнению с группой контроля (p<0,05), ** – различия статистически значимы по сравнению с группой контроля (p<0,01).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №4 (46)
«опустошения», преимущественно вблизи ядер) (рис. 1). Через 3 сут после однократного введения ДОК отмечалась мозаичность окрашивания миокарда кислыми красителями, обусловленная присутствием КМЦ как с литическими, так и контрактурными повреждениями. Наблюдались некроз и некробиоз отдельных КМЦ со скоплениями в данных участках мононуклеаров. Повреждения и гибель КМЦ носили, как правило, диффузный характер с развитием диффузного или мелкоочагового кардиосклероза. Нарушения кровообращения в виде значительного венозного полнокровия и развития выраженного межволоконного и интерстициального отека способствовали разволокнению миокарда.
Через 14 сут после воздействия ДОК литические повреждения КМЦ и интерстициальный отек сохранялись, у некоторых животных – усиливались. В результате гибели КМЦ формировались мелкие очаги кардиосклероза. Выраженные литические изменения и уменьшение (на 25 %, р<0,05) диаметра КМЦ (атрофические изменения) в этот срок связаны с нарушением воспроизводства внутриклеточных структур, т.е. развитием регенераторно-пластической недостаточности. Ультраструктурными эквивалентами регенераторно-пластической недостаточности КМЦ являются диффузный лизис миофибрил-лярных пучков, расширения межмембранного околоядерного пространства и профилей агранулярной саркоплазматической сети, усиление аутофагоцитоза с формированием крупных остаточных телец [1, 5].
После введения ЦФ у большинства животных через 3 сут эксперимента сохранялась нормальная архитектоника миокарда. В то же время отмечались литические и контрактурные изменения отдельных КМЦ. Для циклофосфанового повреждения миокарда характерно появление КМЦ с вакуолеобразными околоядер-ными «опустошениями» цитоплазмы. Регистрировались мелкоочаговые некрозы миокарда. Одновременно у всех животных данной группы манифестировали нарушения гемодинамики, прежде всего венозное и капиллярное полнокровие, лимфостаз, периваскулярный и интерстициальный отек.
Через 14 сут после введения ЦФ нарушения
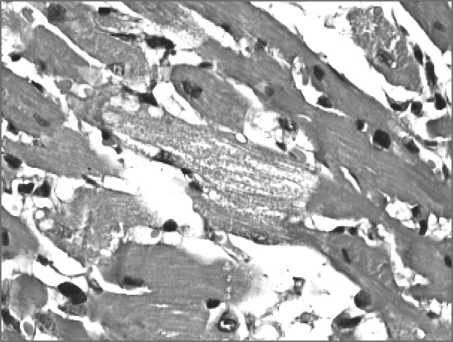
Рис. 1. Микрофото. Литические изменения кардиомиоцитов, интерстициальный отек через 3 сут после введения доксорубицина. Окраска гематоксилином и эозином. ×400
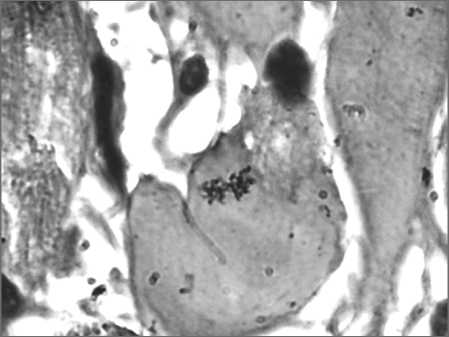
Рис. 2. Микрофото. Митотическое деление ядер кардиомиоцитов через 3 сут после введения циклофосфана.
Окраска гематоксилином и эозином. ×1250 гемодинамики сохранялись. Следует отметить, что практически у всех животных кровеносные сосуды и капилляры, кроме форменных элементов крови, содержали плазму, наблюдались также явления плазморрагии. Количество КМЦ с литическими и вакуолеобразными изменениями цитоплазмы возрастало по сравнению с предыдущим сроком. Наблюдались небольшие очаги некроза и некробиоза КМЦ и их инфильтрация мононуклеарами. Следует отметить также умеренную диффузную мононуклеарную инфильтрацию стромы миокарда и усиление периваскулярного склероза.
При характеристике регенераторных потенций КМЦ после однократного введения ДОК и ЦФ следует отметить появление КМЦ с митотическим делением ядер (рис. 2) и популяции КМЦ небольших размеров («малые» КМЦ) длиной около 40 мкм с близко расположенными ядрами, что не свойственно зрелым КМЦ
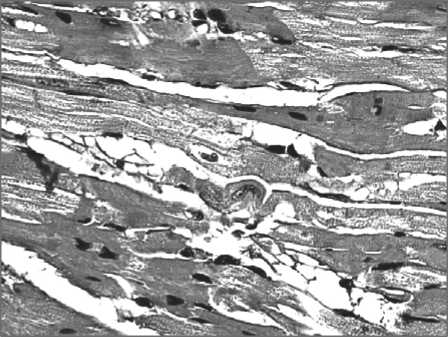
Рис. 3. Микрофото. Выраженная мозаичность окрашивания кардиомиоцитов; появление «малых» кардиомиоцитов через 3 сут после введения циклофосфана. Окраска гематоксилином и эозином. ×400
(рис. 3). Малые КМЦ располагались чаще на концах мышечных волокон, где они формировали своеобразные точки роста. В ряде случаев отмечался интермедиантный рост мышечных волокон – за счет деления клеток, расположенных в середине волокон. Кроме митотического деления ядер КМЦ и телофаз, в миокарде встречались также картины формирования вставочных дисков между разделившимися малыми КМЦ (цитокинез) с образованием одноядерных клеток. Выявление фаз митоза ядер КМЦ и формирование вставочных дисков (цитокинеза) с очевидностью свидетельствуют об их делении. К важным характеристикам индуцированного кардиомиогенеза следует отнести формирование кластеров новообразованных клеток.
Усиление фенотипической гетерогенности (в том числе появление атрофированных клеток) и снижение абсолютного числа КМЦ в сердце после введения ДОК и ЦФ сопровождались изменением соотношения одно- и двуядерных КМЦ, а именно уменьшением доли одноядерных клеток и соответствующим увеличением доли двуядерных клеток (см. таблицу). Доля одноядерных клеток после введения ДОК уменьшалась через 3 и 14 сут эксперимента соответственно на 20 % и 34 %, после введения ЦФ – на 31 % и 13 % соответственно.
По нашим данным и результатам других исследователей [2, 7, 9, 10], одноядерные КМЦ сохраняют способность вступать в клеточный цикл, завершающийся кариокинезом и цитокинезом. Кариокинез без цитокинеза одноядерных КМЦ приводит к снижению их СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №4 (46)
процентного содержания и, соответственно, к увеличению доли двуядерных клеток. Поддержание пула одноядерных КМЦ (репликативного пула) происходит за счет кариокинеза и завершенного цитокинеза. Двуядерные КМЦ преобладают в миокарде взрослых крыс и являются не только основными структурнофункциональными элементами миокарда, но и главным компенсаторно-приспособительным резервом миокарда (гипертрофируются при усилении функциональной нагрузки). По данным количественного анализа популяции КМЦ у контрольных и опытных животных пул двуядерных КМЦ варьирует от 70 до 85 % от общего числа КМЦ, пул многоядерных КМЦ не превышает 3 %. Снижение доли одноядерных КМЦ после введения цитостатических препаратов может быть обусловлено не только кариокинезом (образованием двуядерных клеток), но и гибелью этих клеток и свидетельствовать об истощении репликативного резерва миокарда, невозможности со временем восполнения численности КМЦ. Возможно, эти механизмы лежат в основе развития кардиомиопатий и отсроченной сердечной недостаточности после проведения химиотерапии.
Результаты проведенного исследования свидетельствуют о том, что однократное введение ДОК и ЦФ вызывает преимущественно литические повреждения КМЦ, сопровождающиеся их атрофией и апоптотической гибелью, которые обусловливают развитие регенераторнопластической недостаточности. Наиболее значительные повреждения КМЦ развиваются после введения ДОК и вызывают заметное уменьшение численности КМЦ в сердце и его инволюцию. После введения ДОК происходит также наиболее значительное уменьшение репликативного пула миокарда – доли одноядерных КМЦ. В то же время митотическая активность КМЦ и появление в миокарде после цитотоксических воздействий популяции «малых» КМЦ свидетельствуют об индукции регенераторных реакций. В наибольшей степени регенераторные реакции КМЦ выражены после введения ЦФ.
Учитывая многоуровневость организации регенераторных процессов в миокарде после повреждающих воздействий, которые направлены на восстановление внутриклеточной организации КМЦ, их численности и особенностей архитектоники, мы считаем возможным введение такого понятия, как регенераторный потенциал миокарда. Интегральная оценка регенераторного потенциала миокарда должна включать анализ митотической активности КМЦ, изменения соотношения одно- и двуядерных клеток, изменения размеров КМЦ (атрофические или гипертрофические процессы), выраженность процессов внутриклеточной регенерации.
Выявленная возможность обновления пула КМЦ после воздействия цитотоксическими агентами, представленные морфологические эквиваленты пролиферативной активности КМЦ и подходы к количественной оценке репликативного резерва миокарда [3, 7] обосновывают необходимость поиска эффективных стимуляторов пролиферативной активности КМЦ для коррекции химиотерапевтических повреждений миокарда.


