Влияние прерывистой гипобарической гипоксии на экспрессию HIF-1 и морфофункциональные изменения в миокарде
Автор: Балыкин Михаил Васильевич, Сагидова Светлана Александровна, Жарков Александр Владимирович, Айзятулова Екатерина Дмитриевна, Павлов Денис Анатольевич, Антипов Игорь Викторович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 2, 2017 года.
Бесплатный доступ
Цель - оценить экспрессию Hif-1α, активность свободнорадикального окисления и морфофункциональные изменения в миокарде на разных этапах адаптации к прерывистой гипобарической гипоксии. Материалы и методы. Исследование проводилось на 96 крысах-самцах линии «Вистар». Прерывистую гипоксию (ПГГ) воспроизводили в барокамере (Рв - 330 мм рт. ст.) по схеме: 5 мин - снижение Рв, 10 мин - пребывание в гипобарии, 5 мин - повышение Рв, 5 мин - пребывание в условиях нормоксии (3 гипобарических цикла ежедневно, 6 раз в неделю на протяжении 30 сут). Во время ПГГ в миокарде определяли экспрессию Hif-1α (ПЦР), активность малонового диальдегида, супероксиддисмутазы, каталазы и глутатион-S-трансферазы (спектрофотометрия). Морфометрию капилляров и волокон миокарда проводили на гистологических препаратах после посмертной инъекции кровеносного русла контрастом (световая микроскопия). Результаты. Установлено, что во время ПГГ возникает артериальная гипоксемия (PaO2 - 52,0-57,5 мм рт. ст.) на фоне смешанного метаболического и респираторного ацидоза (1-е сут) и компенсированного респираторного алкалоза (15-30-е сут). Во время сеансов ПГГ аккумуляция Hif-1α в миокарде возрастает в 11,6; 6,4 и 2,7 раза на 1, 15, 30-е сут адаптации. На 1-15-е сут ПГГ активируются процессы ПОЛ (увеличение МДА), повышается активность каталазы и глутатион-S-трансферазы. В последующий период (30-е сут) активность ПОЛ снижается, а ферментов антиоксидантной защиты (СОД, МДА, глутатион-S-трансферазы) повышается. Адаптация к ПГГ приводит к повышению общего числа капилляров на единицу поверхности миокарда (14,0 и 19,8 %) на 15-е и 30-е сут эксперимента. Заключение. ПГГ сопровождается экспрессией Hif-1α, активацией процессов ПОЛ, возникновением реактивных морфофункциональных изменений в миокарде во время первого гипоксического сеанса; на 15-30-е сут экспрессия Hif-1α и активность ПОЛ снижаются при повышении активности системы антиоксидантной защиты, увеличении васкуляризации сердца.
Гипоксия, крысы, адаптация, миокард, перекисное окисление липидов, капилляры
Короткий адрес: https://sciup.org/14113268
IDR: 14113268 | УДК: 612.273.2:612.172 | DOI: 10.23648/UMBJ.2017.26.6227
Текст научной статьи Влияние прерывистой гипобарической гипоксии на экспрессию HIF-1 и морфофункциональные изменения в миокарде
Введение. В настоящее время достаточно хорошо известны пато- и саногенные эффекты гипоксии, ее пре- и посткондициони-рующие воздействия на организм [1–4]. Широкое применение в медицинской практике получили методы прерывистой (интервальной) нормо- и гипобарической гипоксии, которые показали свою эффективность в профилактике, терапии и реабилитации нарушений сердечно-сосудистой системы [5–8], дыхания [9], крови [10], метаболизма [11] и т.д.
В последние годы широко обсуждается прекондиционирующий эффект гипоксии – повышение толерантности органов и тканей к ишемии после однократного или серии гипоксических воздействий и реоксигенации [12, 13].
Установлено, что предварительное гипоксическое воздействие приводит к повышению устойчивости структур миокарда к экспериментальной ишемии (окклюзия венечных артерий) и реоксигенации [2, 12], уменьшению зоны некроза и сохранению высокой сократительной способности миокарда в этих условиях [12, 13]. Показано, что в основе прекондиционирующего действия гипоксии лежит совокупность тканевых и молекулярно-клеточных изменений [12], однако вопрос об их реализации на уровне отдельных органов и тканей остается открытым.
Триггером, запускающим совокупность системных и тканевых механизмов адаптации, является гипоксией индуцированный фактор (hypoxia inducible factor) Hif-1 [14, 15].
Hif-1 представляет собой гетеродимер, состоящий из 2 субъединиц: кислородoчув-ствительной субъединицы Hif-1α и конститутивно экспрессируемой субъединицы Hif-1β [14]. Установлено, что β-субъединица экспрессируется постоянно, а экспрессия α-субъ-единицы регулируется кислородом. При нор-моксии содержание Hif-1α поддерживается на низком уровне. В цитозоле Hif-1α подвергается протеосомальной деградации в кислородозависимых реакциях гидроксилирования с участием пролилгидроксилаз (РHD 1–3), которые являются молекулярными сенсорами О 2 и белка гена тумор-супрессорного протеина фон Хиппеля–Линдау (von Hippel–Lindau protein, pVHL) [10, 16].
При снижении уровня кислорода Hif-1α не гидроксилируется и транслоцируется в ядро, где образует транскрипционный комплекс с Hif-1β, который связывается с особыми последовательностями ДНК в генах, запуская совокупность реакций, направленных на компенсацию и адаптацию к гипоксии [9, 15]. В настоящее время известны около 180 генов, экспрессируемых Hif-1α, включая гены регуляции эритропоэза, роста эндотелия сосудов (ангиогенеза), тонуса сосудов, клеточной пролиферации, апоптоза, липогенеза и т.д. [12].
Влияние на аккумуляцию Hif-1α могут оказывать свободные радикалы, образующиеся при гипоксии [12, 13]. Имеются сведения, что окислительный стресс сопровождается инактивацией пролилгидроксилазных реакций, которые, ограничивая протеосо-мальную деградацию Hif-1α, способствуют его аккумуляции [12].
Принято считать, что Hif-1α является универсальным сигнальным белком, который экспрессируется практически во всех органах и служит механизмом реализации компенсаторно-приспособительных процессов в организме при гипоксии различного генеза [10, 14, 15].
Проведенные нами ранее исследования показали, что при гипоксии механизмы кислородного обеспечения разных органов имеют свои особенности, которые определяют морфофункциональную гетерогенность и гетерохронность формирования процессов адаптации [17]. Исходя из этого можно полагать, что при гипоксии уровень экспрессии Hif-1α в разных органах также будет иметь свои особенности.
Цель исследования. Оценить экспрессию Hif-1α, активность свободнорадикального окисления и морфофункциональные изменения в миокарде на разных этапах адаптации к прерывистой гипобарической гипоксии.
Материалы и методы. Исследование проводилось на 96 крысах-самцах линии Wistar массой 200–250 г, которые содержались в условиях вивария при свободном доступе к воде и сбалансированному корму. Исследования выполнялись в соответствии с рекомендациями о гуманном отношении к лабораторным животным, изложенными в «Правилах проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 742 «Об утверждении правил проведения работ с использованием экспериментальных животных» и № 48 «О контроле за проведением работ с использованием экспериментальных животных»).
Гипоксические воздействия моделировались в барокамере с имитацией подъема животных на высоту 6500 м над у. м. (Рв – 330 мм рт. ст.). Схема эксперимента включала 5-минутное снижение барометрического давления, экспозицию на «высоте» в течение 10 мин, повышение барометрического давления в течение 5 мин с последующим 5-минутным периодом пребывания животных в условиях нормоксии. Каждый сеанс прерывистой гипобарической гипоксии (ПГГ) включал три указанных цикла. Сеансы ПГГ проводились ежедневно, 6 раз в неделю, на протяжении 30 сут.
До и после каждого гипоксического цикла из хвостовой артерии у животных брали 0,1 мл крови для определения напряжения О 2 , СО 2 (РаО 2 , РаСО 2 ) и рНа. Определение газового состава и кислотно-основного состояния (КОС) крови проводили с использованием микрогазоанализатора АМЕ-1 (Radiometer, Denmark).
Оценку структурных изменений в миокарде, активность процессов перекисного окисления липидов (ПОЛ) и антиоксидантной защиты (АОЗ), экспрессии Hif-1α проводили в контрольной группе и в группах животных после однократного сеанса ПГГ (1-е сут), на 15-е и 30-е сут эксперимента.
Для оценки морфофункциональных изменений в миокарде проводили эвтаназию животных с использованием гексенала и КСl. После взвешивания сердца образцы миокарда левого желудочка использовали для приготовления гистологических препаратов с помощью общепринятых методик с окраской гематоксилин-эозином и по Ван Гизону.
В отдельной серии исследований после эвтаназии животных через канюлю в левом желудочке сердца проводили инъецирование кровеносного русла водной взвесью черной туши, которое осуществляли под контролем перфузионного давления. После приготовления просветленных гистологических препаратов (толщина срезов 3–5 и 20 мкм) часть их докрашивали гематоксилин-эозином и по Ван Гизону.
С использованием световой микроскопии определяли диаметры мышечных волокон (Dv), рассчитывали количество волокон (Nv) и капилляров (Nv) на единицу поверхности среза.
Оценку экспрессии Hif-1α проводили с использованием методики полимеразной цепной реакции (ПЦР).
Для получения тотальной РНК ткань сердца помещали в лизирующий раствор («НПФ ЛИТЕХ», Россия) на 10 мин, затем проводили выделение РНК с использованием набора реактивов «Проба-НК» («ДНК-технология», Россия) по протоколу производителя. Для разрушения вторичной структуры РНК и эффективного отжига праймеров полученный образец тотальной РНК (10 мкл,
1 мкг/мкл) инкубировали в течение 5 мин при 65 °С. Затем образец охлаждали и добавляли к 10 мкл реакционной смеси для обратной транскрипции (реактивы «Евроген», Россия). В качестве отрицательного контроля использовали образцы, содержащие вместо M-ML V-ревертазы (обратной транскриптазы) соответствующее количество деионизированной воды. Реакцию обратной транскрипции проводили в амплификаторе CFX96 TouchRealTime («ДНК-Технология», Россия) при 42 °С в течение 60 мин, после чего смесь инкубировали 10 мин при 70 °С для остановки реакции.
Праймеры для определения уровня экспрессии м-РНК генов Hif-1α подбирали на основе открытых публичных данных GeneBank с использованием программы OligоMaster. Специфичность выбираемых праймеров и оценку температуры отжига проводили с использованием программы Primer-BLAST. Вычисление уровня экспрессии гена выполняли по методу относительного определения.
Для оценки процессов перекисного окисления липидов и антиоксидантной защиты ткань сердца промывали охлажденным 0,9 % NaCl, просушивали на фильтровальной бумаге и замораживали. Гомогенат ткани миокарда готовили на охлажденном гипотоническом буфере следующего состава: 10 мМ TRIS (pH 7,4), 10 мM KCl, 1 мМ PMSF. Интенсивность свободнорадикальных процессов оценивали по уровню вторичного продукта ПОЛ – малонового диальдегида (МДА) в тесте с тиобарбитуровой кислотой [18] с максимумом поглощения при 535 нм.
Активность супероксиддисмутазы (СОД) в миокарде определяли по способности антиоксидантного энзима конкурировать с нитро-синим тетразолием за супероксидный анион [18]. Активность каталазы определяли по скорости утилизации Н 2 О 2 в реакционной смеси, в которую вносили биологический материал, содержащий фермент, при длине волны 260 нм, на которой Н 2 О 2 имеет максимум светопоглощения [18].
Активность глутатион-S-трансферазы и МДА оценивали спектрофотометрически в пересчете на 1 мг белка для ткани. Белок определяли по методу Брэдфорда [18].
Статистическую обработку результатов проводили с использованием компьютерных математических программ Statistica 6.0, MS Excel 2010. Достоверность различий рассчитывали по t-критерию Стьюдента, различия считали достоверными при р≤0,05.
Результаты и обсуждение. Результаты исследования показали, что во время каждого цикла на всех этапах ПГГ (1–30-е сут) артериальное напряжение О2 снижается и варьирует в диапазоне 52,0–57,5 мм рт. ст., т.е. на уровне, близком к критическому (50 мм рт. ст.), ниже которого возникают метаболические и структурные клеточные нарушения [5]. Уста- новлено, что во время отдельных циклов ПГГ в первый день эксперимента в артериальной крови отмечаются снижение рНа и тенденция к увеличению РаСО2, что свидетельствует о наличии смешанных форм метаболического и респираторного ацидоза (табл. 1). Во время 5-минутного периода нормоксии эти изменения полностью нивелируются, активная реакция крови сдвигается в сторону компенсированного респираторного алкалоза. Таким образом, каждый последующий цикл ПГГ начинается на фоне компенсации гипоксемии и тканевой гипоксии, возникающих во время предшествующих гипобарических воздействий.
Таблица 1
Изменения газового состава и pH артериальной крови при нормоксии и гипобарической гипоксии в разные сроки адаптации к ПГГ (М±m)
|
Показатель |
1-е сут ПГГ |
15-е сут ПГГ |
30-е сут ПГГ |
|||
|
Нормоксия |
Гипоксия |
Нормоксия |
Гипоксия |
Нормоксия |
Гипоксия |
|
|
PaO 2 , мм рт. ст. |
95,0±1,9 |
52,0±1,3* |
96,1±1,6 |
53,3±1,7* |
96,5±1,8 |
56,5±2,2* |
|
PaСO 2 , мм рт. ст. |
36,5±2,1 |
39,6±1,2 |
36,6±1,8 |
33,3±1,3 |
35,8±1,7 |
30,1±1,1* |
|
pHa |
7,400±0,001 |
7,320±0,001* |
7,420±0,002 |
7,450±0,001 |
7,430±0,001 |
7,45±0,001* |
Примечание. * – различия достоверны по сравнению с показателями при нормоксии, р≤0,05.
В последующие сроки эксперимента (15–30-е сут) наряду с выраженной артериальной гипоксемией отмечается увеличение рНа и снижение РаСО 2 . Эти изменения, с одной стороны, являются следствием повышения эффективности респираторной компенсации метаболических изменений, а с другой – связаны с улучшением доставки и утилизации О 2 тканями, включая сердце [17]. Увеличению транспорта О 2 при гипоксии способствуют перераспределение кровотока в органы и ткани с высоким уровнем окислительного метаболизма, включая сердце, увеличение количества функционирующих капилляров [17], активация ангиогенеза [19], стимуляция эритропоэза [5, 9], повышение активности митохондриальных ферментов [12].
Результаты исследования показали, что двухнедельный курс ПГГ приводит к достоверному повышению общего количества капилляров в миокарде крыс на 14 % (р≤0,05), с последующим их увеличением на 19,8 % (р≤0,05), что, по-видимому, связано с активацией ангиогенеза в процессе адаптации к гипоксии (табл. 2).
Полученные данные свидетельствуют об увеличении капиллярного резерва миокарда, что является одним из признаков структурной адаптации сердца. Увеличение площади капиллярного русла в эти сроки приводит к повышению отношения количества капилляров и волокон миокарда выше 1,0, что способствует снижению диффузионных расстояний для О 2 (табл. 2), улучшению кровоснабжения и кислородного обеспечения сердца, расширяет резервный потенциал сердечной мышцы.
При обзорном рассмотрении гистологических препаратов установлено, что после однократного сеанса ПГГ в первые сутки эксперимента в миокарде отмечаются выраженные реактивные изменения: просветление кардиомиоцитов, их ядер, умеренное расширение интерстициальных и паравазальных пространств, признаки полиморфноклеточной инфильтрации, свидетельствующие о повышении сосудистой проницаемости. На этом фоне появляется тенденция к увеличе- нию диаметров волокон миокарда. В последующие сроки ПГГ (15–30-е сут) указанные реактивные изменения полностью исчезают, диаметр волокон миокарда восстанавливается и практически не отличается от данных в контроле.
Таблица 2
Сосудисто-тканевые отношения в миокарде крыс в разные сроки адаптации к прерывистой гипобарической гипоксии (М±m)
|
Показатель |
Контроль |
1-е сут ПГГ |
15-е сут ПГГ |
30-е сут ПГГ |
|
Nc, мм2 |
3230±162 |
3170±162 |
3689±130* |
3867±121* |
|
Nv, мм2 |
3457,2±196,0 |
3362±176 |
3398±193 |
3475±207 |
|
Dv, мкм |
10,1±0,7 |
12,6±0,3* |
11,5±0,9 |
11,0±0,8 |
|
Nc/Nv, у. е. |
0,93±0,07 |
0,94±0,06 |
1,08±0,05* |
1,08±0,06* |
Примечание. Здесь и далее: * – различия достоверны по сравнению с контролем, р≤0,05.
Таким образом, результаты исследования свидетельствуют о фазовых изменениях в миокарде при действии ПГГ: на ранних этапах адаптации (1-е сут) отмечаются реактивные изменения, которые по мере увеличения гипоксических воздействий приводят к образованию стабильных перестроек, характеризующих формирование структурной адаптации.
Поскольку основная роль в развитии компенсаторно-приспособительных измене- ний при гипоксии отводится Hif-1 [14], в ходе исследования оценивали уровень его экспрессии на разных этапах адаптации к ПГГ.
Результаты исследования показали, что в контрольной группе животных (рис. 1) исходный Hif-1α в миокарде находится на низком уровне (0,03±0,01 у. е.), подвергаясь в условиях нормоксии протеосомальной деградации в цитозоле с участием кислородозависимых реакций гидроксилирования и убикви-тинации [10, 15].
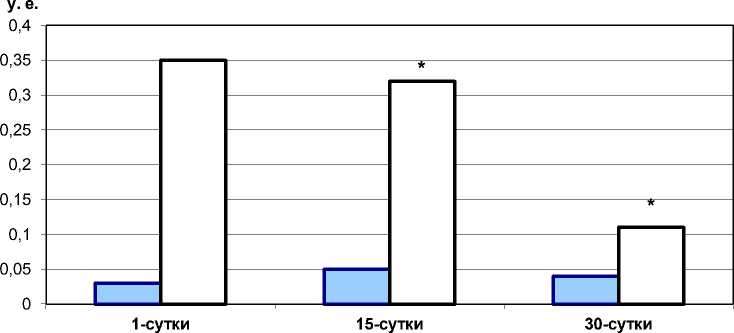
□ Нормоксия D Гипоксия
Рис. 1. Экспрессия HIF-1α в миокарде крыс в разные сроки адаптации к прерывистой гипобарической гипоксии
После сеанса ПГГ в первый день эксперимента уровень Hif-1α в миокарде увеличивается в 11,6 раза (р≤0,001), что, очевидно, связано с инактивацией пролилгидроксилазных реакций (PHD 1–3), индукцией транскрипционных процессов, последующей транслокацией Hif-1α в ядро, гетеродимеризацией с HIF-1ß, образованием транскрипционного активного компонента (HRE) и экспрессией Hif-1 – зависимых генов-мишеней [10, 16]. В число этих мишеней входят белки семействa фaктoров ростa эндотелия сосудов (VEGF), которые являются гликопротеинами, влияющими на образование новых кровеносных и лимфатических сосудов [19] . Можно полагать, что именно VEGF при гипоксической экспрессии Hif-1α является одним из механизмов увеличения общего количества капилляров в миокарде.
Имеются сведения, что таким образом экспрессия Hif-1α запускает цепь компенсаторно-приспособительных реакций уже при однократном гипоксическом воздействии [13, 15]. Установлено, что в условиях нор-моксии при стабилизации кислородного режима ткани Hif-1α достаточно быстро снижается [10, 15]. Важную роль в этом играет активация PHD в присутствии молекулярного кислорода, которая модифицирует HIF-1α, взаимодействуя с фактором von Hippel– Lindau (VHL) и приводит к его протеосо-мальной деградации [14, 16].
Результаты исследования показали, что на 15-е сут эксперимента исходный уровень Hif-1α в миокарде повышается на 40 % по сравнению с контрольной группой, а на 30-е сут снижается и практически не отличается от данных в контроле (рис. 1). Поскольку в процессе восстановления кислородного режима тканей HIF-1α подвергается протео-сомальной деградации, можно полагать, что некоторое его увеличение в миокарде на 15-е сут эксперимента сопряжено с кислородонезависимыми механизмами и, в частности, со свободнорадикальными процессами [12].
Есть сведения, что свободнорадикальные процессы, которые активируются во время гипоксии и в постгипоксический период, вызывают инактивацию пролилгидроксилазных реакций и, соответственно, VHL, что способствует аккумуляции HIF-1α [14, 16].
На фоне относительно высокого исходного уровня Hif-1α на 15-е сут эксперимента сеанс ПГГ сопровождается выраженной его экспрессией, уровень которой мало отличается от отмеченного в первый день ПГГ.
На позднем этапе адаптации (30-е сут) уровень экспрессии Hif-1α при ПГГ в миокарде заметно снижается. При этом нужно отметить, что если в первые дни ПГГ (1–15-е сут) высокая активность Hif-1α соотносится с выраженными реактивными изменениями, то снижение аккумуляции HIF-1α при гипоксии на 30-е сут в целом соответствует сформировавшимся в этот период структурным изменениям в миокарде и может служить критерием становления стабильной фазы адаптации сердца к гипоксии. В литературе имеются сведения, что у высокоустойчивых к гипоксии крыс экспрессия Hif-1α в условиях дефицита О 2 выражена в значительно меньшей степени, чем у низкоустойчивых животных [12]. Более того, причиной различий экспрессии Hif-1α может служить наличие полиморфизмов гена, которые не только определяют высокую резистентность к гипоксии, но и являются причиной наследственного эритроцитоза («чувашский эритроцитоз»), гемохроматоза, опухолевого роста и ангиогенеза [20, 21].
Таким образом, сравнительно низкую экспрессию Hif-1α при гипоксии на 30-е сут эксперимента следует расценивать как критерий формирования морфофункциональных изменений. При этом снижение Hif-1α по мере адаптации к гипоксии, по-видимому, ограничивает его взаимодействие с генами-мишенями, экспрессия которых может привести к неконтролируемым молекулярноклеточным изменениям, однако этот вопрос требует своего самостоятельного изучения.
Одним из важных механизмов, определяющих успешность адаптации сердца к гипоксии, является повышение устойчивости к повреждающему действию активных форм кислорода [22], которые участвуют и в регуляции кислородонезависимых путей образования Hif-1α [12, 16, 20].
Результаты исследования показали, что уровень МДА в миокарде в первый день экс- перимента увеличивается в 2,1 раза (р≤0,001), на 15-е сут – в 1,6 раза (р≤0,001) (табл. 3). На 30-е сут эксперимента уровень МДА в миокарде снижается и достоверно не отличается от контрольного значения. Поскольку МДА является продуктом ПОЛ, можно полагать, что курс ПГГ сопровождается увеличением интенсивности свободнорадикальных процессов в миокарде, которые наиболее вы- ражены в первые две недели эксперимента. Причины образования активных форм кислорода при гипоксии многообразны и связаны с изменениями на уровне электронтранспорт-ной цепи митохондрий, окислением катехоламинов, активацией ксантиоксигеназной системы, приводящей к образованию супероксидного радикала [12].
Таблица 3
Изменения показателей ПОЛ-АОЗ в миокарде крыс в разные сроки адаптации к прерывистой гипобарической гипоксии (М±m)
|
Показатель |
Контроль |
1-е сут ПГГ |
15-е сут ПГГ |
30-е сут ПГГ |
|
Каталаза, моль/мин/л |
0,339±0,028 |
0,562±0,012* |
0,428±0,032 |
0,459±0,023* |
|
Глутатион-S-трансфераза, мкмоль/мин/мг |
0,025±0,002 |
0,071±0,009* |
0,051±0,005* |
0,076±0,005* |
|
СОД, у. е. |
1,447±0,132 |
0,920±0,246 |
1,440±0,082 |
1,424±0,111 |
|
МДА, мкмоль/мг |
2,584±0,351 |
5,632±1,071* |
4,085±0,869* |
3,282±0,426 |
Оценивая увеличение продуктов ПОЛ как результат активации свободнорадикальных процессов, можно полагать, что возрастает и их роль в экспрессии Hif-1α во время ПГГ на 1–15-е сут эксперимента. При этом следует отметить отсутствие признаков деструкции кардиомиоцитов в ходе сеансов ПГГ в эти сроки. Очевидно, несмотря на выраженную артериальную гипоксемию и дефицит О 2 в тканях, повреждающее действие гипоксии ограничено продолжительностью периодов ПГГ и наличием периодов восстановления кислородного режима миокарда.
Результаты исследования показали, что уровень каталазы после однократного сеанса ПГГ увеличивается на 21,7 % (р≤0,05), глута-тион-S-трансферазы – в 2,8 раза (р≤0,05) при снижении СОД на 63,5 %. На 15–30-е сут адаптации активность СОД повышается при достоверно высоком уровне каталазы и глу-татион-S-трансферазы.
Полученные данные свидетельствуют, что курс ПГГ не только сопровождается усилением свободнорадикальных процессов и ПОЛ, но и способствует повышению активности системы антиоксидантной защиты, ко- торая является одним из компонентов увеличения специфической и неспецифической резистентности миокарда.
Заключение. В результате проведенных исследований установлено, что экспрессия Hif-1α, активность процессов ПОЛ, антиоксидантной защиты и структурных изменений в миокарде носят фазовый характер.
На ранних этапах адаптации (1-е сут) к ПГГ происходит аккумуляция Hif-1α, увеличение активности процессов ПОЛ, возникновение реактивных сосудистых изменений в миокарде. По мере увеличения сроков адаптации к ПГГ (15–30-е сут) снижается уровень экспрессии Hif-1α и активности ПОЛ, повышается активность ферментов антиоксидантной защиты, общее количество капилляров, улучшаются условия кровоснабжения и кислородного обеспечения миокарда.
Снижение экспрессии Hif-1α, повышение активности ферментов антиоксидантной защиты и сосудисто-тканевых отношений в миокарде по мере увеличения продолжительности курса ПГГ могут служить критерием морфофункциональной адаптации сердца к гипоксии.
Список литературы Влияние прерывистой гипобарической гипоксии на экспрессию HIF-1 и морфофункциональные изменения в миокарде
- Eckle T., Köhler D., Lehmann R., El Kasmi K., Eltzschig H.K. Hypoxia-inducible factor-1 is central to cardioprotection: a new paradigm for ischemic preconditioning. Circulation. 2008; 118: 166-175.
- Лишманов Ю.Б., Маслов Л.Н., Семенцов А.С., Нарыжная Н.В., Цибульников С.Ю. Стресс-и инфаркт-лимитирующий эффекты раннего гипоксического прекондиционирования. Рос. физиол. журн. им. И.М. Сеченова. 2015; 101 (9): 1013-1021.
- Shimoda L.A., Laurie S.S. HIF and pulmonary vascular responses to hypoxia. J. of Appl. Physiol. 2014; 116 (7): 867-874.
- Heusch G. Molecular basis of cardioprotection signal transduction in ischemic pre-, post-, and remote conditioning. Circ. Res. 2015; 116 (4): 674-699.
- Колчинская А.З., Цыганова Т.Н., Остапенко Л.А. Нормобарическая интервальная гипоксическая тренировка в медицине и спорте. М.; 2003. 407.
- Серебровская Т.В., Шатило В.Б. Опыт использования интервальной гипоксии для предупреждения и лечения заболеваний сердечно-сосудистой системы. Обзор. Журн. кровообiг та гемостаз. 2014; 1-2: 16-33.
- Бочаров М.И. Реакция гемодинамики человека на разные по величине гипоксические воздействия. Ульяновский медико-биологический журнал. 2012; 3: 138-145.
- Балыкин М.В., Сагидова С.А., Макаева Р.Ш. Изменение газового состава крови и реакции сосудов микрогемоциркуляции в сердце под влиянием прерывистой гипобарической гипоксии. Вестник Тверского государственного университета. Сер. Биология и экология. 2012; 18 (14): 9-15.
- Серебровская Т.В. Новая стратегия в лечении болезней: гипоксия-индуцируемый фактор. Вестник Международной академии наук (Русская секция). 2006; 1: 29-31.
- Semenza G.L. Oxygen sensing, hypoxia-inducible factors, and disease pathophysiology. Ann. Rev. Pathol. 2014; 9: 47-71.
- Портниченко А.Г., Носарь В.И., Портниченко А.Г., Древицкая Т.И., Мидоренко А.М., Маньковская И.Н. Фазовые изменения энергетического метаболизма при периодической гипоксии. Фiзiол. журн. 2012; 58 (4): 3-12.
- Лукьянова Л.Д., Кирова Ю.И., Сукоян Г.В. Новое о сигнальных механизмах адаптации к гипоксии и их роли в системной регуляции. Патогенез. 2011; 9 (3): 4-14.
- Маслов Л.Н., Нарыжная Н.В., Подоксенов Ю.К., Прокудина Е.С., Горбунов А.С., Жанг И., Пей Ж.-М. Активные формы кислорода -триггеры и медиаторы повышения устойчивости сердца к действию ишемии -реперфузии. Рос. физиол. журн. им. И.М. Сеченова. 2015; 101 (1): 3-24.
- Sеmenza G.L. HIF-1 and mechanisms of hypoxia sensing. Curr. Opin. Cell. Biol. 2001; 13: 167-171.
- Semenza G.L. Hypoxia-inducible factors in physiology and medicine. Cell. 2012; 148 (3): 399-408.
- Левина А.А., Макешова А.Б., Мамукова Ю.И., Романова Е.А., Сергеева А.И., Казюкова Т.В. Регуляция гомеостаза кислорода. Фактор, индуцированный гипоксией (HIF), и его значение в гомеостазе кислорода. Педиатрия. 2009; 87 (4): 92-97.
- Балыкин М.В., Каркобатов Х.Д. Системные и органные механизмы кислородного обеспечения организма в условиях высокогорья. Рос. физиол. журн. им. И.М. Сеченова. 2012; 98 (1): 127-136.
- Карпищенко А.И. Медицинские и лабораторные технологии и диагностика. СПб.: Интермедика; 1999: 27-28.
- Holmes D.I., Zachary I. The vascular endothelial growth factor (VEGF) family: angiogenic factors in health and disease. Genome Biol. 2005; 6 (2): 209.
- Новиков В.Е., Левченкова О.С. Гипоксией индуцированный фактор (HIF-1α) как мишень фармакологического воздействия. Обзоры по клинической фармакологии и лекарственной терапии. 2013; 11 (2): 8-16.
- Нефедова Н.А., Давыдова С.Ю. Роль сосудистого эндотелиального фактора роста (VEGF) и гипоксия-индуцибельного фактора (HIF) в опухолевом ангиогенезе. Современные проблемы науки и образования. 2015; 3: 51.
- Гончар О.А., Розова Е.В. Влияние разных режимов интервальных гипоксических тренировок на морфологические характеристики и антиоксидантный статус тканей сердца и легких. Бюл. экс-пер. биол. и мед. 2007; 144 (8): 216-220.


