Влияние природных вариантов фактора инвазии InlB на вирулентность листерий
Автор: Собянин К.А., Сысолятина Е.В., Чаленко Я.М., Ермолаева С.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Биологические науки
Статья в выпуске: 6, 2016 года.
Бесплатный доступ
Грамположительная бактерия Listeria monocytogenes относится к числу возбудите-лей сапронозов. Листерии, вызывающие тя-желое заболевание у человека и широкого кру-га домашних и диких млекопитающих, явля-ются факультативными внутриклеточными паразитами. Фактор инвазии InlB, взаимодей-ствующий с консервативным эукариотиче-ским рецептором c-Met, отвечает за актив-ную инвазию листерий в эпителиальные клет-ки. Ранее, исследуя штаммы L. monocytogenes, выделенные из клинических случаев листерио-за и от диких животных, мы идентифициро-вали 16 природных вариантов InlB. В рамках данной работы мы клонировали 4 аллели inlB, кодирующих наиболее часто встречающихся варианты InlB. Клонированные аллели inlB бы-ли введены в штамм L. monocytogenes EGDeΔinlB, лишенный этого гена вследствие сайт-специфической делеции. В результате было получено 4 изогенных рекомбинантных штамма, отличающихся только по последо-вательности InlB. Сравнение эффективности инвазии рекомбинантных бактерий в культу-ры эпителиальных клеток человека HEK293 и мыши С26 показало, что, хотя все изученные варианты InlB обеспечивали инвазию в клетки обоих типов, эффективность инвазии была разной. Варианты, обеспечивающие более эффективную инвазию в клетки человека, бы-ли менее эффективны на клетках мышей, и наоборот, вариант InlB, обеспечивающий мак-симальную эффективность инвазии в клетки мышей, был менее эффективен на клетках человека. Штамм с вариантом InlB, обеспечи-вающим максимальную инвазию в клетки мы-шей, продемонстрировал максимальную виру-лентность на модели интрагастральной ин-фекции лабораторных мышей. В целом наши данные показывают, что природные варианты InlB различаются по эффективности взаимо-действия с клетками разных хозяев, что, в свою очередь, приводит к изменениям в виру-лентности бактерий. Полученные результа-ты важны для понимания механизмов, лежа-щих в основе полипатогенности L. Monocy-togenes и других возбудителей сапронозов, и могут лечь в основу создания систем монито-ринга листерий в окружающей среде.
Сапронозы, полипатогенность, внутрикле-точный паразитизм
Короткий адрес: https://sciup.org/14084720
IDR: 14084720
Текст научной статьи Влияние природных вариантов фактора инвазии InlB на вирулентность листерий
Введение . Листериоз – сапронозное инфекционное заболевание человека и животных, вызываемое факультативным внутриклеточным паразитом Listeria monocytogenes , характеризуется полиморфизмом клинических проявлений и высоким процентом летальных исходов [1]. Листериоз – эмерджентная инфекция пищевого происхождения, критической точкой развития которой является активная инвазия в энтероци-ты и последующее пересечение эпителиального барьера кишечника [2]. Характерной чертой листерий, как и других возбудителей сапронозов, является полипатогенность, т.е. способность вызывать заболевание у широкого спектра потенциальных хозяев [3]. Изучение факторов инвазии, ответственных за пересечение эпителиального барьера кишечника и выявление эпидемиологически значимых маркеров L. monocytogenes , является актуальной задачей изучения возбудителей сапронозов.
Основную роль в инвазии листерий в эпителиальные клетки, в том числе в энтероциты кишечника, играют два поверхностных белка, относящиеся к семейству интерналинов, InlA и InlB [2, 4]. Эти белки характеризуются наличием так называемого LRR (leucine – rich repeat)-домена. LRR-домен вовлечен во взаимодействие белков семейства интерналинов с эукариотическими рецепторами. Интерналины InlA и InlB взаимодействуют с эукариотическими рецепторами Е-кадхерином и с-Met исоответст-венно [2].
Анализ штаммов L. monocytogenes , выделенных из клинического материала диких и домашних животных, показал, что специфическим маркером, характерным для штаммов, ответственных за вспышки перинатального листериоза, является определенный вариант InlA [5, 6]. Изучение листерий, выделенных от диких мелких мышевидных грызунов, установило консерватизм другого интерналина – InlB [5, 6]. Из 16 идентифицированных аллелей inlB у штаммов, выделенных от мышевидных грызунов, было выявлено только 2 [6]. Нами было выдвинуто предположение, что идентифицированные варианты факторов инвазии InlA и InlB, являющиеся маркерами штаммов, выделенных от определенного хозяина, обеспечивают максимальный уровень инвазии в клетки этого хозяина [7, 8]. Различия в эффективности взаимодействия вариантов InlB с рецепторами клеток определенного вида млекопитающих могут влиять на эффективность инвазии листерий в клетки и, следовательно, на вирулентность возбудителя в отношении этого вида.
Цель работы. Экспериментальное изучение роли природных вариантов интерналина InlB в инвазии и вирулентности листерий. Фактор InlB был выбран, поскольку его свойства могут быть изучены как в культурах клеток, так и на экспериментальной модели листериоза у лабораторных мышей. Однако мы полагаем, что закономерности, выявленные для этого фактора, будут актуальны и для InlA, объясняя тем самым причины установленной на основании эпидемиологических данных корреляции между определенным вариантом InlA и вирулентностью штамма для человека.
Материалы и методы. В работе использованы штаммы L. monocytogenes из коллекции лаборатории экологии возбудителей инфекций ФГБУ ФНИЦЭМ им. Н.Ф. Гамалеи Минздрава России VIMHA004, VIMHA015, VIMHA034, а также типовой штамм EGDe (серовар 1/2a) и его изогенный вариант EGDeΔinlB с делецией гена inlB, любезно предоставленные Dr. J.Vazquez-Boland, Univ. Bristol, UK. L. monocytogenes культивировали в сердечно-мозговом бульоне или агаре (BHI, BD, США) при 37°С. Рекомбинантные штаммы листерий выращивали на той же питательной среде в присутствии 10 мкг/мл эритромицина (Sigma, США). Штаммы E. coli выращивали на среде Луриа-Бертани (LB) (Amresko,США) при 37°С. Культуру для инфицирования эукариотических клеток и мышей готовили, как описано в [9]. Компетентные клетки E. coli и L. monocytogenes готовили, как в [10]. Трансформацию компетентных клеток проводили методом электропорации с помощью прибора Gene Pulse Xcell (BioRad, США) согласно инструкции. Лизаты L. monocytogenes для ПЦР готовили, как описано в [6]. ПЦР проводили в термоциклере Терцик (ДНК-технология, Россия) в условиях, описанных в [6]. Рестрикцию и лигирование проводили стандартными методами. Фрагменты ДНК очищали с помощью набора Wizard® SV Gel and PCR Clean-Up System (Promega, США).
Для определения эффективности инвазии были использованы человеческие эмбриональные клетки почечного эпителия НЕК293 и клетки карциномы кишечника мышей C26. Клетки культивировали в среде DMEM (Пан-Эко, Москва) с добавлением 10% фетальной телячьей сыворотки (HyClone, Бразилия), при 37°С в атмосфере 5 % СО 2 . Эффективность инвазии определяли в тесте защиты от гентамицина, как описано в [9].
Для экспериментальной модели листериоза использовали мышей линии BALB/c массой 16– 18 грамм, по 5 штук в группе. Бактериальную суспензию, содержащую 1,5х108 КОЕ в 200 мкл физиологического раствора, вводили внутриже-лудочно зондом. Оценку накопления бактерий в печени и селезенке проводили через 72 часа путем высевов 10-кратных разведений стерильно приготовленных гомогенатов органов. Все высевы проводили в дупликате. Результаты экспериментов обработаны с использованием программного пакета Microsoft Excel 2007.
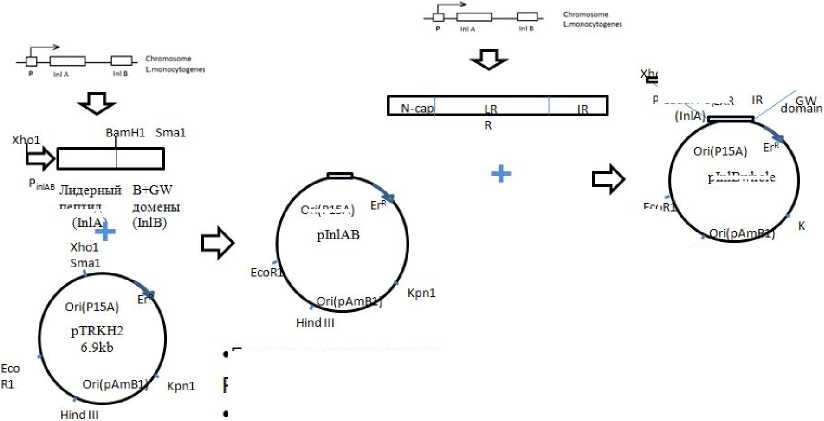
Результаты исследования. Для объективной оценки эффективности природных вариантов InlB необходимо было получить изогенные штаммы L. monocytogenes, экспрессирующие эти варианты. Для этого был использован штамм L. monocytogenes EGDeΔinlB с делецией гена inlB, любезно предоставленный Prof. J.A. Vazquez-Boland. 4 аллели inlB были клонированы в штамм EGDeΔinlB, используя плазмиду pInlAB в качестве вектора. Плазмида pInlAB, созданная на основе шаттл-вектора pTRKH2 [11], была сконструирована для того, чтобы штаммы не отличались по уровню экспрессии и представленности InlB на поверхности бактерии (рис. 1). Для создании pInlAB в вектор pTRKH2 были встроены фрагменты оперона inlAB, несущие промоторную область оперона и фрагмент гена inlA (кодирующего лидерный пептид InlA), соединенные с 3’-концевой частью гена inlB, кодирующей В- и GW-домены, ответственные за презентацию InlB на поверхности бакте- рии [1, 2]. Фрагменты были синтезированы на матрице хромосомной ДНК штамма EGDe, встроены в вектор pTRKH2 по сайтам узнавания рестриктаз XhoI и SmaI. Для удобства в конструкцию был встроен сайт узнавания рестрикта-зы BamH1.
Фрагменты, кодирующие LRR-домен и фланкирующие его последовательности, были синтезированы в ПЦР на матрице хромосомной ДНК четырех штаммов L. monocytogenes , VIMHA004 (вариант 1, кодируемый аллелью 1 в соответствии с номенклатурой, использованной в [6]), VIMHA015 (вариант 9), EGDe (вариант 13) и VIMHA034 (вариант 14). Аминокислотные различия указанных вариантов InlB приведены в таблице 1. Полученные ПЦР продукты, встроенные в плазмиду pInlAB, создавали непрерывную рамку считывания, кодирующую белок InlB, у которого лидерный пептид был замещен лидерным пептидом белка InlA, а LRR-домен был представлен одним из природных вариантов.
Аминокислотные различия между природными вариантами InlB, использованными в данной работе
|
Положение |
69 |
73 |
91 |
117 |
132 |
138 |
164 |
176 |
181 |
197 |
205 |
246 |
251 |
262 |
|
Вариант 9 |
L |
S |
I |
A |
I |
L |
L |
L |
I |
E |
S |
S |
M |
I |
|
Вариант 1 |
. |
N |
V |
. |
. |
I |
P |
. |
. |
. |
. |
. |
T |
. |
|
Вариант 13 |
A |
N |
V |
. |
V |
. |
P |
I |
V |
Q |
A |
P |
S |
T |
|
Вариант 14 |
A |
N |
V |
T |
. |
. |
P |
I |
V |
Q |
A |
S |
T |
Набор изогенных штаммов был получен введением плазмид в штамм EGDeΔinlB. Таким образом, было получено 4 изогенных штамма, отличающихся только по последовательности LRR-домена InlB, т.е. домена, который непосредственно вовлечен во взаимодействие с рецептором c-Met [2]. Полученные рекомбинантные изогенные штаммы были проверены по основным биохимическим свойствам, скорости роста и не отличались по этим показателям от родительского штамма. Вместе с родительским штаммом EGDeΔinlB они составили коллекцию изогенных штаммов для анализа роли природных вариантов InlB во взаимодействии L. monocytogenes с клетками человека и мыши in vitro.
Бактерии родительского штамма EGDeΔinlB с делецией гена inlB очень плохо входили в эукариотические клетки (рис. 2). Особенно это ка- салось мышиных клеток С26, где внутриклеточно выявлялись буквально отдельные бактерии. Эффективность инвазии всех рекомбинантных штаммов по крайней мере в 100 раз превышала эффективность инвазии штамма EGDeΔinlB. Это свидетельствует, что все природные варианты интерналинового домена InlB функционально активны и способны взаимодействовать с рецептором с-Met как человека, так и мыши.
Попарное сравнение инвазии рекомбинантных штаммов выявило статистически достоверные различия. В частности, эффективность инвазии в клетки HEK293 штаммов «9» и «13» (экспрессирующих варианты InlB 9 и 13), превышала эффективность инвазии штамма «1» в 3,4 и 3,6 раза соответственно. Эффективность инвазии штаммов «1» и «14» достоверно не отличалась. Напротив, в клетки мышей наиболее эффективно входил штамм «14». Эффектив- ность его инвазии превышала эффективность ность инвазии остальных штаммов не сильно инвазии штамма «13» в 4,6 раза. Эффектив- отличалась от инвазии штамма «13».
_ _ ^а-Ч^ BarpHlSrp l
Р Lead. PeflRR
plnlBwhole
Ori(P15A
Hind III
•Был сконструирован вектор plnlAB, несущие промотор PinlAB и З’и 5' концевые фрагменты гена inIB
•Было созданы 4 плазмиды, несущие аллели inIB 1,9,13,14
•Полученные плазмиды были введены в штамм
L monocytogenes EGDeAinIB
Рис. 1. Схема конструирования рекомбинантных плазмид для экспрессии природных вариантов InlB в L. monocytogenes
пептид.
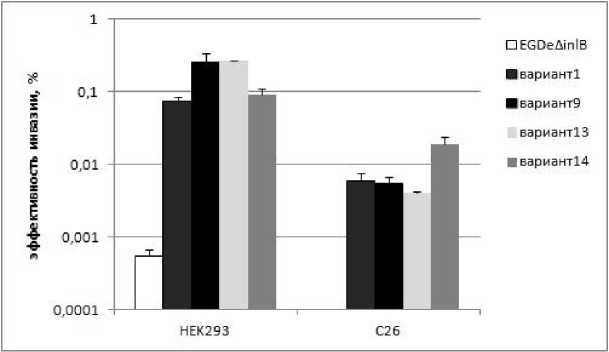
Рис.2. Эффективность инвазии изогенных рекомбинантных штаммов L. monocytogenes в клетки почек эмбриона человека HEK293 и карциномы кишечника мыши С26. Эффективность инвазии была определена в опыте по защите от гентамицина и выражена как процент бактерий, вошедших в клетки в течение 1 часа, к числу бактерий, использованных для инфекции
В естественных условиях наиболее вероятным путем инфицирования животных является пищевой. Через 72 часа после интрагастрально-го введения 108КОЕ/животное в печени и селезенке были выявлены бактерии всех штаммов, включая родительский (рис. 3). Максимальная нагрузка в печени была достигнута при инфек- ции штаммом «14»: количество бактерий превышало показатели штамма EGDeΔinlB в 250 раз (р≈0). Штамм «9» практически не отличался от родительского штамма EGDeΔinlB. Отличия нагрузки в селезенке были менее выраженными.
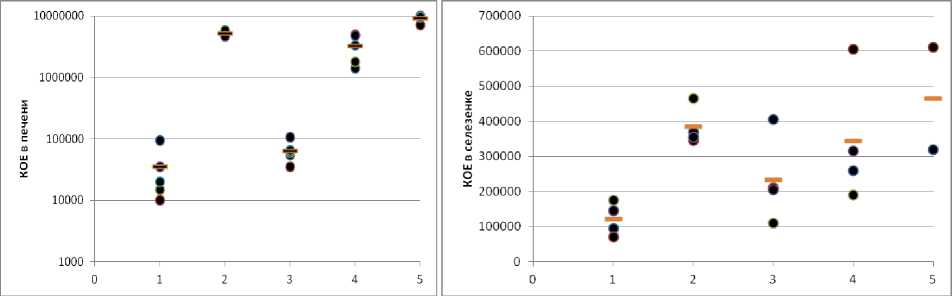
Рис. 3. Накопление бактерий в печени (слева) и селезенке (справа) мышей линии BALB/c через 72 часа после интрагастральной инфекции. Цифрами обозначены штаммы: 1 – EGDeΔinlB; 2 – EGDeΔinlB::pInlBallele1; 3 – EGDeΔinlB::pInlBallele9; 4 – EGDeΔinlB::pInlBallele13; 5 – EGDeΔinlB::pInlBallele14. Черные кружки обозначают значение, полученное для мыши на основании высева трех последовательных десятикратных разведений в дупликате, коричневый штрих – среднее, вычисленное для группы из 5 животных
Таким образом, природные варианты InlB обеспечивали разную вирулентность изогенных штаммов листерий при интрагастральном способе инфицирования лабораторных мышей. Важно отметить, что варианты InlB, обозначенные 1 и 14 (табл.), которые были найдены у штаммов листерий, выделенных от мелких мышевидных грызунов, обитающих в природных очагах листериоза [6], обеспечивали максимальное накопление бактерий во внутренних органах мышей. Вариант 14 также обеспечивал максимальную инвазию в линию клеток мышей С26.
Выводы. Полученные данные показывают, что изученные природные варианты InlB функционально активны и обеспечивают инвазию бактерии в клетки млекопитающих. Вместе с тем разные природные варианты InlB по-разному влияют на эффективность инвазии в клетки человека и мышей: варианты InlB, обеспечивающие более эффективную инвазию в клетки человека, уступают другому варианту при взаимодействии бактерии с клетками мышей. Полученные данные экспериментально доказывают, что корреляция между источником выделения листерий и наличием определенного варианта фактора инвазии, которая была ранее установлена на основании эпидемиологических данных [5, 6], связана с более эффективным распространением бактерий, несущих данный вариант, во внутренние органы конкретного хозяина.
Работа поддержана грантом РНФ № 16-1500091.
Список литературы Влияние природных вариантов фактора инвазии InlB на вирулентность листерий
- Тартаковский И.С., Малеев В.В., Ермолаева С.А. Листерии: роль в инфекционной пато-логии человека и лабораторная диагностика. -М.: Медицина для всех, 2002. -195 с.
- Vázquez-Boland J.A., Kuhn M., Berche P. . Listeria Pathogenesis and Molecular Virulence Determinants//Clinical Microbiology Reviews. -2001. -Vol.14. -P. 584-640
- Ряпис Л.А. Биомолекулярные основы поли-патогенности сапрофитов (на примере псевдомонад и буркхолдерий)//Ветери-нарная патология. -2004. -№ 4. -С. 6-12.
- Lecuit M. Understanding how Listeria monocytogenes targets and crosses host bar-riers//Clinical Microbiology and Infection. -2005. -Vol. 11. -Р. 430-436.
- Зайцева Е.А. Система анализа микробио-логических и молекулярно-генетических маркеров для выявления высоковирулент-ных штаммов Listeria monocytogenes: дис. … д-ра мед. наук. -М.,2010. -196 с.
- Adgamov R., Zaytseva E., Thiberge J-M. . Genetically related Listeria monocytogenes strains isolated from lethal human cases and wild animals//Genetic Di-versity of Microorganisms. -Croatia: InTech, 2012. -Р. 235-250.
- Ермолаева С.А., Зайцева Е.А., Тимченко Н.Ф. . Вариабельность функциональ-ных доменов факторов патогенности как молекулярная основа полигостальности возбудителей сапронозов//Тихоокеан. мед. журн. -2010. -№ 4. -С. 24-28.
- Адгамов Р.Р., Тимченко Н.Ф., Зайцева Е.А. . Эколого-генетические механизмы формирования эпидемически значимых ва-риантов возбудителей сапронозных инфек-ций//Успехи современной биологии. -2012. -Т. 132, № 6. -С. 551-567.
- Sysolyatina E., Sobyanin K., Vasiliev M. . Non-thermal microwave argon plasma affects interactions of Listeria monocytogenes with mammalian cells but it does not kill the in-tracellular pathogen//Clinical Plasma Medi-cine. -2015. -Vol. 3. -P. 87-92.
- Pushkareva V.I., Ermolaeva S.A. Listeria monocytogenes virulence factor Listeriolysin O favors bacterial growth in co-culture with the ciliate Tetrahymena pyriformis, causes proto-zoan encystment and promotes bacterial sur-vival inside cysts//BMC Microbiology. -2010. -Vol.10:26 DOI: 10.1186/1471-2180-10-26
- O'Sullivan D.J., Klaenhammer T.R. High-and low-copy-number Lactococcus shuttle cloning vectors with features for clone screening//Gene. -1993. -Vol.137. -P. 227-231.


