Влияние природы органических лигандов на процессы химического и электрохимического никелирования меди
Автор: Иванцова П.М., Портнова Е.А., Тюрин В.Ю.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 16 т.5, 2017 года.
Бесплатный доступ
В работе представлен большой объем данных по влиянию О- и N-содержащих добавок на процесс химического никелирования меди. Установлено, что в присутствии N-содержащих добавок скорость процесса химического никелирования меди существенно возрастает. В присутствии О-содержащих добавок процесс химического никелирования не протекает. Основным критерием протекания эффективного процесса никелирования является возможность ионов никеля образовывать катионные комплексы, обладающие низкими значениями потенциалов восстановления.
Короткий адрес: https://sciup.org/147249403
IDR: 147249403 | УДК: 544.6:669.248
Текст научной статьи Влияние природы органических лигандов на процессы химического и электрохимического никелирования меди
Никелевые покрытия широко востребованы в различных отраслях промышленности благодаря наличию высокой коррозионной и износостойкости, твердости [1]. Их можно получать как электрохимическим способом, так и химическим. В основе последнего лежит реакция окисления гипофосфита натрия, в результате которой на каталитически активной поверхности восстанавливаются компоненты и выделяется водород. В литературе имеется большое количество работ, посвященных исследованию механизмов электро- и химического осаждения никеля. Несмотря на это, единых представлений о процессах, происходящих на поверхности никелевых покрытий, до сих пор не сложились. Поэтому управление такой системой с целью получения покрытий заданного состава представляет сложную задачу, неразрешимую без знания механизмов реакций.
Целесообразным представляется подход, основанный на изучении механизма индивидуальных реакций осаждения никеля, восстановления гипофосфит-иона и выделения водорода, и в дальнейшем обобщение полученных данных. Также в процесс никелирования меди вводятся органические добавки (стабилизаторы). Однако они могут влиять на процессы, протекающие на никелевой поверхности и изменять механизм реакций, происходящих в ходе электро- и химического никелирования.
Подготовка поверхности состоит из нескольких этапов: механическая обработка, обезжиривание, травление.
Буферные растворы для химического осаждения никеля гипофосфитом натрия готовили согласно справочнику по аналитической химии [2].
Анализ литературных данных показывает, что подбор оптимальных условий для получения качественного покрытия из никеля представляет трудоемкую задачу, поскольку необходимо варьировать минимум четырьмя параметрами: концентрацией хлорида никеля, концентрацией гипофосфита натрия, температурой и рН раствора. Для получения качественного покрытия необходимо соблюсти тонкий баланс между этими параметрами. Однако для каждой из изученных систем данное соотношение различно, поскольку отсутствует общий механизм протекающего процесса. В этой связи подбор оптимальных условий приходится выполнять путем перебора изменения этих параметров [3].
Первоначально была исследована зависимость массы осажденного никеля от концентрации NiCl 2 . Концентрация хлорида никеля варьировались в пределах 30–60 г/л. Данные о влиянии концентрации хлорида никеля на массу Ni представлены на рисунке 1.
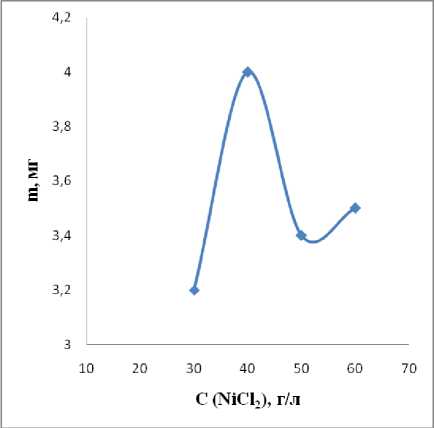
Рис. 1. Влияние концентрации NiCl 2 на массу осаждения никеля.
Из рисунка 1 видно, что оптимальная концентрация хлорида никеля составляет 40 г/л и дальнейшее увеличение его концентрации приводит к незначительному уменьшению массы прироста никеля. На наш взгляд, это связанно с блокированием поверхности медной пластины анионами Сl¯, что приводит к уменьшению скорости осаждения за счет образования структуры, изображенной на схеме 1.
Cu CuCu
Cl ClCl
NiNi
Схема 1.
Вторым важным параметром является концентрация NaH 2 PO 2 ·2H 2 O. Химическое никелирование проводили с различными концентрациями, которые варьировались в пределах 5–20 г/л. Данные о влиянии концентрации гипофосфита натрия на массу покрытия представлены на рисунке 2.
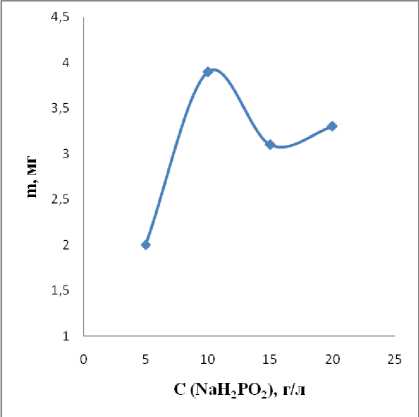
Рис. 2. Влияние концентрации NaH 2 PO 2 ·2H 2 O на скорость осаждения никеля.
В нашем случае оптимальное соотношение составило ν (Ni2+) : ν (NaH 2 PO 2 ·2H 2 O) – 2:1, т.е. 10 г/л. При дальнейшем увеличении соотношения NaH 2 PO 2 ·2H 2 O увеличивается содержание P на поверхности никеля. Фосфор неблагоприятно влияет на процесс осаждения, так как труднорастворимые фосфиты оседают на поверхности пластины и делают ее шероховатой.
Восстановление ионов никеля гипофосфитом натрия приводит к образованию плотного однородного слоя, преимущественно состоящего из никеля (см. рис. 3). Как видно из рисунка, образующийся слой никеля имеет практически одинаковую толщину по всему контуру. На основе этих данных можно предположить, что процесс никелирования протекает с одинаковой скоростью по всей площади медной поверхности.
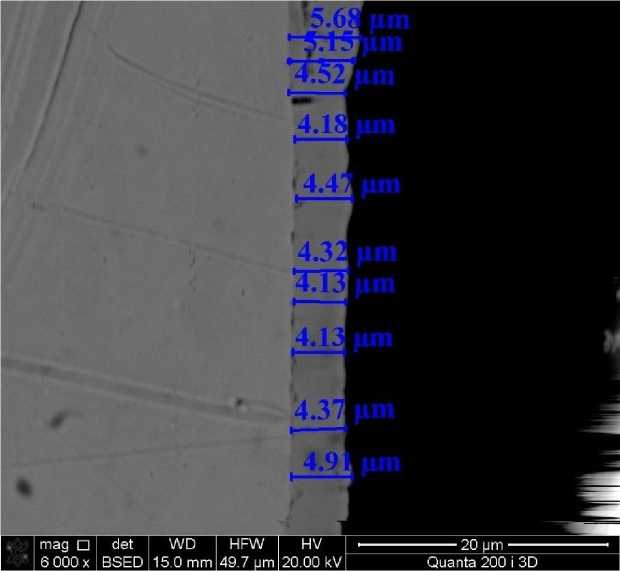
Рис. 3. Структура среза, полученного при никелировании медной пластины методом растровой электронной микроскопии (РЭМ).
Интересные данные были получены при исследовании элементного состава образующегося слоя никеля по профилю толщины слоя, изображенного на рисунке 4.
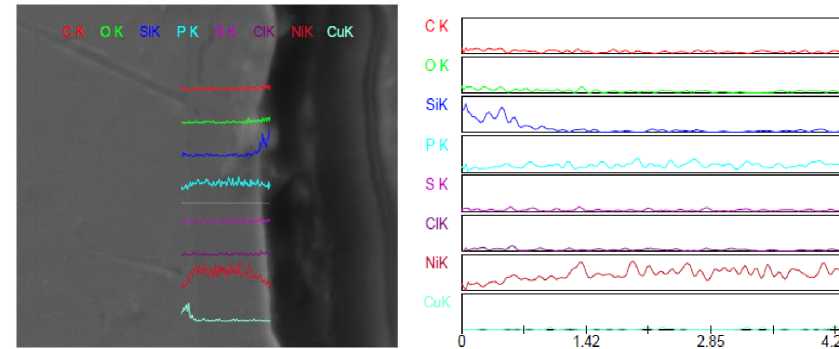
Рис. 4. Профиль элементного состава среза полученного при никелировании медной пластины, полученного методом растровой электронной микроскопии (РЭМ).
Элементное содержание фосфора хорошо коррелирует с содержанием никеля по всей толщине слоя. Из рисунка 4 видно, что содержание фосфора по всему профилю толщины мало меняется при увеличении толщины слоя. Это указывает на отсутствие в растущем слое никеля соединений фосфора, которые бы внедрились в него в ходе случайной адсорбции.
Подбор оптимальной температуры осуществлялся путем изучения зависимости массы прироста никеля относительно заданной температуры. Осаждение никеля вели при значении рН раствора равном 6 (фосфатного буфера). Температура поддерживалась с помощью водяной бани. Полученные данные представлены на рисунке 5.
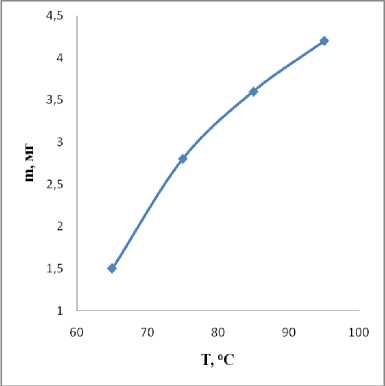
Рис. 5. Влияние температуры на скорость осаждения никеля.
Из рисунка видно, что скорость образования никеля максимальна при 95 оС. Однако при этой же температуре бурно протекает побочный процесс – каталитическое образование молекулярного Н 2 из гипофосфита натрия:
NaH 2 PO 2 + Н 2 О → NaH 2 PO 3 + H 2 ↑
Известно, что никелевые покрытие обладают склонностью к поглощению водорода, причем водород изменяет физико-механические свойства поверхности пластины. С точки зрения физико-механических свойств, поглощение водорода вызывает хрупкость и это приводит к потере прочностных характеристик и ускорению коррозионных процессов [4]. Наиболее оптимальный баланс между скоростью осаждения никеля и скоростью выделения водорода составил 89–90 оС.
Нами была исследована зависимость массы осажденного никеля от рН раствора.
Данные представлены на рисунке 6.
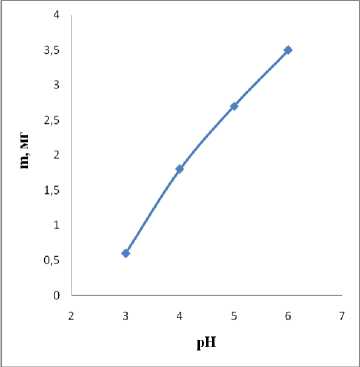
Рис. 6. Влияние рН раствора на скорость осаждения никеля.
Можно выделить две области: с pH от 1 до 3 и с рН от 3 до 6. При дальнейшем повышении рН никелирование проводить нецелесообразно, так как происходит процесс частичного образования гидроксида никеля.
Наилучшие результаты в отношении скорости восстановления никеля получаются в растворах с кислотностью рН = 6. Отсутствие протекания процесса при рН от 1 до 3 может быть связано с низкой восстановительной способностью гипофосфита натрия. Это подтверждается данными ЦВА, которые получены при изучении влияния рН на потенциал окисления гипофосфита. С повышением pH раствора с 1 до 6 восстановительная способность гипофосфит-иона увеличивается. Это связанно с тем, что при переходе рН от 1 до 6 деполяризующая способность протонов уменьшается.
Интересно отметить, что разность потенциалов при изменении на единицу рН от 1 до 3 больше, чем с 4 до 6. Наименьшая разность потенциалов наблюдается при переходе рН с 3 до 4. На наш взгляд, это связано с изменением механизма электрохимического окисления гипофосфит-иона. Так, при рН от 1 до 3 происходит одноэлектронное окисление Н 3 PO 2 ˉ с образованием катион-радикала [5]. Образованный катион-радикал может претерпевать дальнейшую деструкцию по двум путям. Первый путь – отщепление от катион-радикала Н радикала с образованием частиц Н 3 PO 2 + и H•. Второй путь – это отщепление от катион-радикала Н+ протона с образованием Н 3 PO 2 , который подвергается дальнейшему окислению. Наше предположение хорошо подтверждается данными ЦВА: так значение тока при рН от 1 до 3 для окисления Н 3 PO 2 приблизительно в 2 раза меньше, чем в случае окисления при переходе от 4 до 6. Добавление хлорида никеля к раствору, содержащему гипофосфит натрия, при рН от 1 до 3 не приводит к изменению потенциала восстановления ионов никеля.
Следовательно, при данных условиях отсутствует какое-либо взаимодействие между гипофосфит-ионом и ионом никеля. Из литературы известно, что процесс переноса электронов может реализовываться по двум механизмам: внешнесферном и внутрисферном. Исходя из данных полученных методом ЦВА, для окисления гипофосфита и восстановления хлорида никеля (окислителя) видно, что реализация внешнесферного механизма невозможна из-за положительной ∆G процесса. Это подтверждается отсутствием процесса восстановления ионов никеля. Из данных ЦВА видно, что при рН от 3 до 6 происходит смещение потенциала как катодного процесса восстановления ионов никеля, так и анодного процесса. Можно предположить, что это является следствием взаимодействия ионов никеля с гипофосфит-анионами. Восстановление ионов никеля происходит ступенчато (последовательный перенос электронов) [6]. Кроме того, pK a (Н 3 PO 2 ) = 1, 2, следовательно, при рН = 1, 2 кислота не диссоциирует на ионы. Вследствие этого, протекание процесса восстановления никеля невозможно.
По проделанной работе можно сформулировать следующие выводы. Выбрана оптимальная концентрация хлорида никеля, которая составляет 40 г/л. Выбрана оптимальная концентрация гипофосфита натрия, которая составляет 10 г/л. Изучено влияние рН на процесс химического никелирования и установлено, что с повышением рН от 3 до 6 скорость осаждения ионов никеля возрастает.
Список литературы Влияние природы органических лигандов на процессы химического и электрохимического никелирования меди
- Соцкая Н. В., Гончарова Л. Г., Кравченко Т. А., Животова Е. В. Влияние фосфит-ионов на кинетику осаждения никеля гипофосфитом // Электрохимия. - 1997. - Т. 33, № 5. - С. 529-533. EDN: TZOTKH
- Таразайте Р., Буткивичюс Ю. О включении глицина в никелевые покрытия, осаждаемые гипофосфитом // Защита металлов. - 1995. - Т. 31, № 1. - С. 87-90.
- Татарников П. В., Головчанская Р. Г., Оганесян Л. Б., Свирщевская Г. Г., Новикова М. В. Влияние фосфита натрия на анодную и катодную реакции при химическом восстановлении никеля // Электрохимия. - 1989. - Т. 25, № 11. - С. 1450-1454.
- Халдеев Г. В., Петухов И. В., Щербень М. Г. Электроокисление Н2РОˉ2 на Pd-электроде // Электрохимия. - 2000. - Т. 36, № 9. - С. 1062-1069. EDN: WOBOVY
- Ярлыкин Л. А. Информация к действию (технологические советы) // Сделай Сам (Знание) - 1992. - № 3. - С. 129-130.
- Abrantes L. M., Correia J. P. On the mechanism of electroless Ni-P plating // Journal of the Electrochemical Society. - 1994. - Vol. 141. - pp. 2356-2360.


