Влияние природы растворителей на кинетику деполимеризации хитина и хитозана
Автор: Чеботок Е.Н., Новиков В.Ю., Коновалова И.Н.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 4 т.9, 2006 года.
Бесплатный доступ
В работе изучена деполимеризация хитина и хитозана в воде, органических растворителях и воздухе, в присутствии KI, Nal, NaCl, КОН и NaOH. Показано отсутствие влияния щелочи и солей на кинетику расщепления гликозидных связей в течение до 15 суток. Подтверждено существование окислительной деструкции хитина.
Короткий адрес: https://sciup.org/14293789
IDR: 14293789
Текст научной статьи Влияние природы растворителей на кинетику деполимеризации хитина и хитозана
Щелочной химический гидролиз хитина и хитозана является одним из основных методов деацетилирования этих природных полисахаридов с целью получения водорастворимых производных. При деацетилировании хитина было показано, что в щелочных условиях происходит не только расщепление амидных, но и гликозидных связей, что приводит к снижению молекулярной массы хитозана и вязкости его растворов. Например, среднечисленные молекулярные массы продуктов, полученных обработкой хитина 50 % NaOH при 100°C за 0.5 и 5 ч, были соответственно равны 322 и 139 кД (Bough et al., 1978).
Деструкция макромолекулы в щелочной среде, хотя и не такая сильная, как при кислотной обработке, зависит от условий деацетилирования. Она увеличивается при повышении температуры, продолжительности обработки, а также, по-видимому, в присутствии кислорода воздуха. Нудьга и др. (Нудьга и др., 1971; Нудьга, 1979) наблюдали разложение хитина при деацетилировании в воздухе и атмосфере азота при высокой температуре (140°C). Они сделали вывод, что для приготовления высоковязких (высокомолекулярных) хитозанов требуется комбинация низкой температуры и бескислородной атмосферы.
Одной из возможных причин деполимеризации в щелочной среде считается окислительная деструкция гликозидных связей под действием кислорода воздуха. Влияние кислорода на процесс деструкции отмечается в ряде работ ( Domard, Rinaudo , 1983; Focher et al. , 1990). Авторы работы ( Bough et al. , 1978) делают вывод о том, что в присутствии кислорода воздуха динамическая вязкость растворов полимера и, следовательно, его молекулярная масса резко уменьшаются.
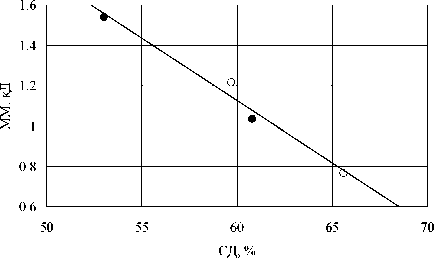
Рис. 1. Зависимость молекулярной массы хитозана, полученного при дезацетилировании хитина в 50 %
NaOH при 145-150 ° C в воздухе (о) и атмосфере азота (•)
было показано, что использование атмосферы азота
Нами показано, что в этой работе наблюдается корреляция между молекулярной массой и степенью деацетилирования, т.е. уменьшение вязкости растворов хитозана, по которой авторы работы вычисляли молекулярную массу, вызвано увеличением растворимости вследствие увеличения степени деацетилирования (рис. 1).
Аналогично в работе ( Tolaimate et al. , 2000)
не влияет на молекулярную массу, что, по мнению авторов, согласуется с предположением о том, что разрыв гликозидных связей при щелочном гидролизе не является окислительным процессом.
В настоящей работе мы изучили влияние растворителей на щелочную деполимеризацию хитина с целью выяснения механизма расщепления гликозидных связей.
-
2. Объекты и методы исследования
В работе использовали хитин, полученный из панциря краба по общепринятой методике ( No, Meyers , 1995). Среднюю молекулярную массу хитина и хитозана определяли с помощью эксклюзионной ВЭЖХ.
-
3. Обсуждение результатов
Чеботок Е.Н. и др. Влияние природы растворителей на кинетику деполимеризации…
Нами была модифицирована методика получения карбоксиметилированных производных хитинов ( Chen, Park , 2003) для использования этих производных с целью определения молекулярной массы и молекулярно-массового распределения методом эксклюзионной хроматографии. Предварительно образцы хитинов и хитозанов с различными степенями деацетилирования были ацетилированы 20 % раствором уксусного ангидрида в этаноле при 4°С в течение 24 часов . Затем из полностью ацетилированных хитинов были получены карбоксиметилированные производные взаимодействием с монохлоруксусной кислотой в щелочной среде. Карбоксиметилирование проводили в изопропиловом спирте при 4°С в течение 3 суток. После окончания реакции образцы промывали два раза этанолом и один раз ацетоном. В результате такой модификации мы получали производные, имеющие высокие коэффициенты экстинкции в УФ области спектра (205-210 нм) за счет ацетильных групп, хорошо растворимые в воде. Полученные образцы имеют практически одинаковый химический состав мономерного звена, что позволяет сравнивать их хроматограммы.
Для хроматографии использовали 0.1 % растворы карбоксиметилхитина. Элюировали образцы 0.3 M NaCl при pH 6.5-7.5 и 25 ° C, скорость потока 1 мл/мин. Калибровку колонки проводили по образцам хитозана с известными средневязкостными молекулярными массами.
Мы попытались выяснить вклад окислительной деполимеризации, и деполимеризации, вызванной собственно действием горячего раствора щелочи, в процесс деструкции полимерных макромолекул хитина и хитозана.
Как следует из распределения электронной плотности во фрагменте гликозидной связи молекулы хитина, на гликозидной связи находится избыточный отрицательный заряд. Таким образом, следует ожидать, что из-за электростатического отталкивания атака гликозидной связи гидроксил анионами будет подавлена, и, следовательно, в щелочной среде гидролиз гликозидной связи происходить не будет (или будет протекать с малой скоростью).
Нами было показано отсутствие заметного влияния деацетилирования в обычных условиях, а именно, в течение 30 мин при 98 ° C в 50 % NaOH, на изменение молекулярной массы (табл. 1, образцы 3 и 4, 5 и 6).
Обработка хитина в течение 2 суток при 95 ° C в воде, 25 %-ном NaCl и 50 %-ном NaOH в атмосфере кислорода и атмосфере азота показала практически одинаковое снижение молекулярной массы карбоксиметилхитинов (КМХТН). Отмечается незначительно большая ММ для образцов, обработанных 50 % NaOH. Таким образом, полученные данные позволяют предположить, что растворенный кислород и гидроксил-ион не являются инициаторами расщепления гликозидной связи. По всей видимости, эту роль выполняет вода, которая присутствует во всех рассмотренных системах в избытке. Меньшая деполимеризация в растворах NaOH объясняется, по-видимому, меньшей концентрацией воды (50 %), по сравнению с чистой водой (100 %) и раствором NaCl (75 %).
Таблица 1. Относительные молекулярные массы (ММ/ММ 0 , %) карбоксиметилхитинов, полученных из хитинов и хитозанов, обработанных в разных условиях. ММ 0 – молекулярная масса карбоксиметильного производного исходного хитина, 120 кД
|
№ |
Условия обработки |
Воздух |
Кислород |
Азот |
|||
|
90 мин |
96 ч |
48 ч |
72 ч |
48 ч |
72 ч |
||
|
1 |
Исходный ХТН |
100.0 |
|||||
|
2 |
ХТН + 0.5 M HCl, 50 ° C |
87.1 |
|||||
|
3 |
ХТЗ из образца № 2 |
86.6 |
|||||
|
4 |
ХТН + 5.0 M HCl, 50 ° C |
70.6 |
|||||
|
5 |
ХТЗ из образца № 4 |
71.3 |
|||||
|
6 |
ХТН + H 2 O, 90 ° C |
89.3 |
80.0 |
91.4 |
77.9 |
||
|
7 |
ХТН + 50 % NaOH, 98 ° C |
89.3 |
88.5 |
93.1 |
85.9 |
||
|
8 |
ХТН + 25 % NaCl, 98 ° C |
94.0 |
89.7 |
93.6 |
90.2 |
||
|
9 |
ХТН + 50 % NaOH, 98 ° C |
91.0 |
|||||
|
10 |
ХТН + 50 % NaI, 98 ° C |
88.5 |
|||||
|
11 |
ХТН + 50 % KOH, 98 ° C |
92.3 |
|||||
|
12 |
ХТН + 50 % KI, 98 ° C |
91.4 |
|||||
Нами было изучено влияние природы катиона и аниона соли и щелочи, как нуклеофильных и электрофильных реагентов, которые могут оказывать влияние на скорость гидролиза гликозидной связи. Для этого проводили гидролиз в 50%-ных растворах KI, NaI, KOH и NaOH при температуре 98°С в течение 4 суток. Как видно из результатов, приведенных в табл. 1, молекулярные массы образцов хитина после проведения гидролиза в этих растворах практически одинаковы.
Мы изучили влияние природы растворителей на деполимеризацию хитина. Для получения более заметного изменения ММ обработку хитина проводили в запаянных ампулах при 100 ° C в течение месяца. Результаты приведены на рис. 2.
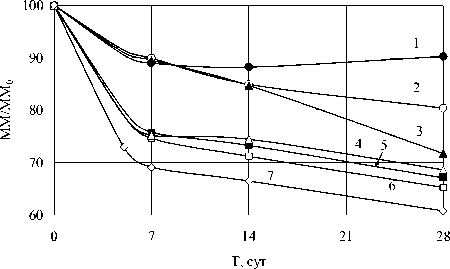
Рис. 2. Кинетика изменения относительной молекулярной массы хитина при 100 ° C в воде, насыщенной азотом (1) и насыщенной воздухом (2), в 50 % NaOH (3), в насыщенных воздухом ацетоне (4), тетрагидрофуране (5), ацетонитриле (6) и сухой образец в воздухе (7)
Результаты позволяют сделать предположение о существовании окислительной деполимеризации за счет кислорода воздуха. В пользу этого предположения говорит различие кинетических кривых деполимеризации в водных суспензиях (кривые 1, 2 и 3), в суспензиях в органических растворителях (кривые 4, 5 и 6) и в воздухе (кривая 7). Растворимость кислорода в воде составляет 0.031 мл/мл жидкости при 20°C. В органических растворителях растворимость кислорода выше, например, в ацетоне - 0.22 мл/мл при 20°C. При контакте сухого хитина с воздухом деструкция еще больше.
Практически одинаковая деструкция в атмосфере азота и воздухе, а также в 50 % NaOH в первые 5-7 суток свидетельствует, по-видимому, о том, что на этом этапе над окислительной деполимеризацией преобладает гидролиз гликозидных связей.
При длительной обработке форма кинетической кривой деполимеризации в 50 % NaOH отличается от таковой в воде. Вначале кинетические кривые совпадают, что говорит об отсутствии влияния щелочи на гидролиз гликозидных связей. Но после 15 суток наблюдается ускорение реакции деполимеризации в щелочи. Мы предполагаем, что изменение характера кинетической кривой объясняется изменением структуры хитозана в результате глубокого деацетилирования. По-видимому, гликозидные связи в высокодеацетилированном хитозане легче подвергаются щелочному гидролизу.
-
4. Выводы
При щелочном гидролизе хитина и хитозана гидроксил-ион не является инициатором расщепления гликозидной связи. По всей видимости, эту роль выполняет вода, которая присутствует во всех рассмотренных системах в избытке, и растворенный кислород. Влияние кислорода начинает заметно проявляться при длительной обработке.
Установлены практически одинаковые закономерности в изменении молекулярной массы хитина при его гидролизе в растворах NaOH, KOH, NaCl, NaI, KI.
В органических растворителях скорость деполимеризации хитина выше, чем в воде, приближаясь к скорости деполимеризации сухого хитина в воздухе, что объясняется, вероятно, большей растворимостью кислорода.


