Влияние прогестерона на фагоцитарную и окислительную активность моноцитов и нейтрофилов
Автор: Ширшев С.В., Куклина Е.М., Баженова А. в
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 9, 2008 года.
Бесплатный доступ
В ходе исследования изучено влияние прогестерона (Pr) в дозах, сопоставимых с концентрацией гормона в I и III триместрах беременности, на окислительную и фагоцитарную активность моноцитов и нейтрофилов женщин in vitro. При оценке окислительной функции нейтрофилов наблюдалось снижение интенсивности люминолзависимой хемилюминесценции (ЛЗХЛ). В спонтанной ЛЗХЛ моноцитов гормон в обеих концентрациях не проявлял активности. При активации клеток опсонизированным зимозаном Pr также не оказал влияния на ЛЗХЛ как моноцитов, так и нейтрофилов. Гормон не влиял на фагоцитарную активность нейтрофилов, однако угнетал процесс фагоцитоза моноцитов периферической крови.
Короткий адрес: https://sciup.org/147204443
IDR: 147204443 | УДК: 612.018:612.017.1:611.018.53
Текст научной статьи Влияние прогестерона на фагоцитарную и окислительную активность моноцитов и нейтрофилов
Беременность является иммунологическим феноменом, уникальность которого заключается не только в преодолении трансплантатом иммунных механизмов, но и в становлении новых эндокринных взаимодействий, обеспечивающих на качественно новом уровне нормальное сосуществование и развитие двух организмов (Ширшев, 2002). Геном развивающегося плода в организме матери наполовину заимствован у отца, однако при физиологически нормально протекающей беременности отторжения генетически чужеродного трансплантата не происходит.
Важную роль в регуляции иммунной системы в период беременности играют женские половые стероидные гормоны, благодаря которым существуют половые различия иммунной реактивности человека и млекопитающих. Известно, что самки различных видов имеют более высокий, чем самцы, уровень клеточно-опосредованных и гуморальных иммунных реакций (Biliss, Kogshavn, 1970; Cohn, 1979).
Велика роль в женском организме прогестерона (Рr), который синтезируется яичниками и плацентой (Kase, Reyniak, 1985; Wittliff, 1995).
Действие Pr на ткань-мишень, например на матку или молочную железу, опосредуется через специфический рецептор Рr – PR, экспрессия которого индуцируется эстрадиолом (Guire, Horvitz, 1975; Wiest, 1971). Установлено, что PR экспрессируются на моноцитах и нейтрофилах, что позволяет Pr оказывать существенное влияние на адаптивные и неспецифические защитные реакции ор- ганизма в период беременности (Revelli et al., 1998).
Основной функцией нейтрофилов и моноцитов является фагоцитоз чужеродных агентов. Однако эти клетки выполняют и ряд специфических функций. Так, нейтрофилы являются основными клеточными эффекторами неспецифической защиты, первыми появляются в очаге повреждения и определяют пусковые механизмы острого воспаления. В отличие от них моноциты способствуют инициации адаптивных иммунных реакций благодаря антигенной презентации и секреции провоспали-тельных цитокинов.
Цель нашего исследования – определение влияние Pr на окислительную и фагоцитарную активность моноцитов и нейтрофилов.
Материалы и методы исследования
В работе использованы фракционированные лейкоциты периферической крови (моноциты и нейтрофилы) небеременных женщин репродуктивного возраста.
В эксперименте использовали Pr («Sigma», США) в физиологических концентрациях, соответствующих их уровню в периферической крови в I и III триместрах беременности – 20 и 100 нг/мл соответственно (Ширшев, 2002). Для стимуляции клеток использовали зимозан (0,5 мг/мл), опсони-
зированный пулом сывороток. Для проведения люминолзависимой хемилюминесценции (ЛЗХЛ) использовали люминол («Sigma», США) в концентрации 5 х 10 -4 М.
Мононуклеарные клетки периферической крови (МНК) и нейтрофилы выделяли из гепаринизированной (25 МЕ/мл) венозной крови центрифугированием в двойном градиенте плотности фиколл-верографина («Pharmacia», Швеция; «Спофа», Чехия) с плотностью верхнего и нижнего градиентов 1,077 и 1,112 г/мл соответственно. С верхней интерфазы собирали МНК, с нижней – нейтрофилы. Затем из МНК путем адгезии выделяли моноциты с двух пассажей на чашках Петри («Аnumbra», Куба). Чистота выделения для моноцитов составляла 78–85% (по оценке моноклональных антител к CD14 (ICN Ph, США)), для нейтрофилов – 95% (гистологическая оценка).
При культивировании клеток использовалась среда 199 (НПО «Биомед», Россия) с добавлением 5% эмбриональной телячьей сыворотки («Serva», Германия), 0,01М HEPES («Serva», Германия), 300 мкг/мл L-глутамина («Serva», Германия), 100 мкг/мл гентамицина («Pharmacia», Швеция). Затем клетки (5 х 10 6 /мл) инкубировали с гормоном в течение 6 часов при 37°С и 5% СО 2 , после чего определяли их фагоцитарную и окислительную активность. Контрольные культуры клеток инкубировали с растворителем гормона (NaCl 0,9%) при аналогичных условиях. Жизнеспособность клеток оценивалась с помощью 5% эозина, она составила 95– 97%.
Оценка фагоцитарной активности проводилась по степени гашения биолюминесценции лиофилизированной культуры люминесцентных бактерий генно-инженерного штамма E.coli Lum+ со спонтанным свечением (Патент 2292553, 27.01.2007). Одну ампулу препарата разводили в 1 мл холодной дистиллированной воды, выдерживали 1 час при 4°С, 30 мин – при комнатной температуре, затем еще 30 мин – при 37°С и центрифугировали 10 мин (3000 об/мин), после чего доводили физиологическим раствором до 50 мл, получая рабочую концентрацию бактерий 5 х 106 /мл.
Готовую суспензию бактерий (180 мкл) вносили в лунки 96-луночного планшета, инкубировали при 37°С 3–5 мин и снимали фоновой уровень свечения бактерии, затем, после внесения клеточной культуры в соотношении 1:10, измеряли степень гашения биолюминесценции в течении 30 мин с интервалом в 10 мин. Происходило полное поглощение E. coli Lum+ фагоцитирующими клетками.
Измерение производилось на люминоскане «As-cent» (Финляндия) в относительных единицах свечения (RLU). Дополнительно рассчитывался индекс фагоцитарной активности клеток ( ИФА ), отражающий процент гашения биолюминесценции
Х 1 – Х 2
ИФА = -------х 100,
Х 1
по сравнению с исходным уровнем, по формуле где Х 1 – интенсивность биолюминесценции контрольной пробы;
Х 2 – интенсивность биолюминесценции опытной пробы.
Окислительную активность моноцитов и нейтрофилов оценивали по интенсивности ЛЗХЛ клеточной культуры (Dahigren, Stendal, 1984). Для этого в планшет вносили 180 мкл раствора Хенкса без фенолового красного («Биолот», Россия), содержащего люминол (5 х 10- 4 М). После инкубации в течение 3-5 мин при 37 ° С и замера фонового свечения добавляли 20 мкл клеточной суспензии (5 х 106/мл) и при непрерывном перемешивании измеряли интенсивность спонтанной хемилюминесценции для оценки исходного уровня окислительного метаболизма клеток. Затем в кювету вносили 20 мкл зимозана (0,5 мг/мл), опсонизированного пулом сывороток, и фиксировали интенсивность стимулированной хемилюминесценции в течение 50 мин с интервалом в 10 мин. Измерения производились также на люминоскане «Ascent» (Финляндия) в относительных единицах (RLU).
Все экспериментальные данные были обработаны по парному t -критерию Стьюдента и считались достоверными при р < 0,05.
Результаты исследований и их обсуждение
На первом этапе исследований оценивалось влияние Pr на фагоцитарную активность нейтрофилов или моноцитов по степени гашения биолюминесценции. Как видно из рис. 1, в динамике исследований Pr не влияет на уровень фагоцитарной активности нейтрофилов.
В то же время гормон в дозах, характерных для крови в I и III триместров беременности приводил к достоверному угнетению процесса фагоцитоза моноцитов, но только на 10 мин (рис. 2).
Таким образом, Pr не влияет на процесс фагоцитоза нейтрофилов, но ингибирует фагоцитарную активность моноцитов вне зависимости от дозы гормона.
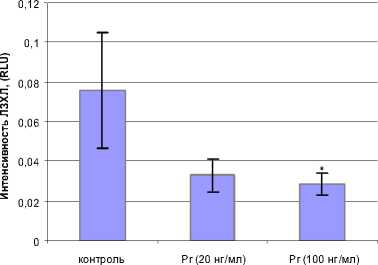
При оценке регулирующего действия Pr на окислительную активность нейтрофилов установлено, что гормон снижает интенсивность ЛЗХЛ в дозе 100 нг/мл (рис. 3).
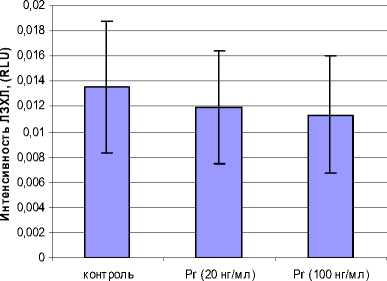
При оценке спонтанного варианта ЛЗХЛ моноцитов в обеих дозах гормон не проявлял активности (рис. 4).
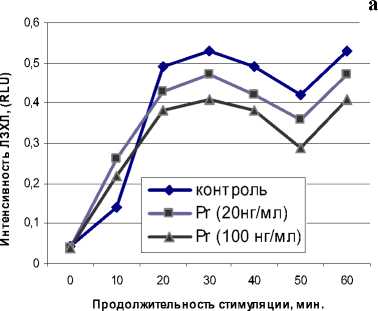
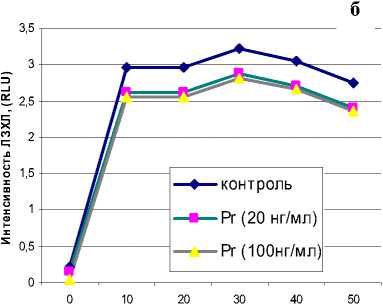
При активации клеток опсонизированным зи- цитах, однако Pr не оказал влияния на данный процесс (рис. 5).
Оценивая полученные результаты, можно говорить о слабой регуляторной активности Pr на клетки неспецифической резистентности. Это сви-
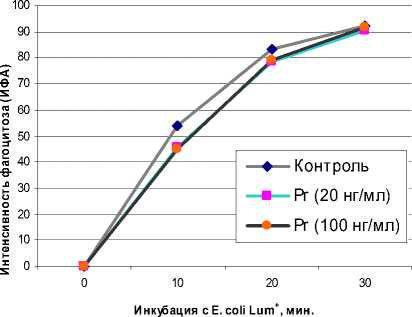
Рис. 1. Влияние Pr на фагоцитарную активность нейтрофилов
Гормональное воздействие
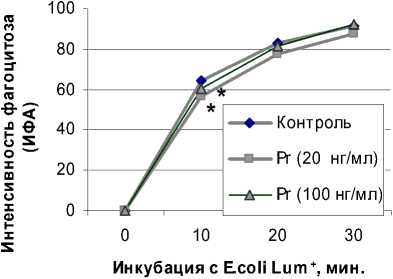
Рис. 2. Влияние Pr на фагоцитарную активность моноцитов
Примечание: * - здесь и далее р < 0,05 в сравнении с контролем
Рис. 4. Влияние Pr на спонтанную ЛЗХЛ моноцитов
Горм ональное воздействие
Рис. 3. Влияние Pr на спонтанную ЛЗХЛ нейтрофилов мозаном наблюдалось резкое повышение продукции метаболитов как в нейтрофилах, так и в моно-
Продолжительность стимуля ции, мин .
Рис. 5. Влияние Pr на динамику зимозан-стимулированной ЛЗХЛ: а – нейтрофилы, б - моноциты
детельствует о низкой чувствительности нейтрофилов к гормону.
В то же время важно отметить, что Pr по-разному влияет на моноциты и нейтрофилы, угне-
тая фагоцитарную активность моноцитов, не влияя на их окислительный потенциал, а при действии на нейтрофилы, напротив, гормон, не влияя на фагоцитоз, угнетает спонтанную ЛЗХЛ.
Учитывая вышесказанное, можно предположить, что благодаря Pr осуществляется фагоцитарная активация моноцитов в крови как в I, так и в III триместрах беременности, в конце же гестационного процесса под регуляторное влияние попадают нейтрофилы, снижая свой окислительный потенциал.
Список литературы Влияние прогестерона на фагоцитарную и окислительную активность моноцитов и нейтрофилов
- Пат. 2292553 Российская Федерация, МПК7 G01N33/53. Способ определения фагоцитарной активности нейтрофилов периферической крови человека по степени гашения биолюминесценции/Ширшев С.В., Куклина Е.М., Заморина С.А., Никитина Н.М., Некрасова И.В. -заявитель и патентообладатель Ин-т экологии и генетики микроорганизмов УрО РАН, Ширшев С.В. (RU). № 2005118124/15; заявл. 10.06.05; опубл. 27.01.07, Бюл. № 3.
- Ширшев, С.В. Механизмы иммунноэндокринного контроля процессов репродукции: в 2 т./С.В. Ширшев. Екатеринбург: УрО РАН, 2002.
- Cohn, D. A. Sensitivity to antigen. A possible factor in sex differences in the immune response//Clin. And Exp. Immunol. 1979. Vol. 38. P 218-227.
- Dahigren, C. Myeloperoxidase modulates the phagocytic activity of polymorphonuclear neutrophil leukocytes. Studies with cells from a myeloperoxidase deficient patient/C. Dahigren, O. Stendahl//J. Clin. Invest. 1984. Vol. 73. P. 366-373
- Kase, N. Endocrinology of pregnancy/N. Kase, J. Reyniak//Mount Sinai J Med. 1985. Vol. 52. P. 11-34.
- Kogshavn, P.A. Sex differences in survivable of H-2 incompatible skin grafts in mice treated with antithymocyte serum/P. Kogshavn, J. Biliss.//Nature. 1970. Vol. 226. P. 451-452.
- Horvitz, K.B. Specific progesterone receptors in human breast cancer/K.В. Horvitz., Mc. W. Guire//Steroids. 1975. Vol. 25. P. 497-505.
- Revelli, A. Monogenetic actions of steroid hormones in reproductive tissues/A. Revelli, M. Mascobrio., J. Tesarik//Endocr. Rev. 1998. Vol. 19. P.2-17.
- Wiest, W.G. Progesterone binding proteins in rabbit uterus and human endometrium//Schering Workshop on Steroid Hormone «Receptors»/еd. Raspe G. Oxford: Pergamon Press, 1971. P. 251-264.
- Wittliff, J.L. Mechanisms of signal transduction: sex hormones, their receptors and utility//J. Clinical Ligand Assay. 1995. Vol. 18. P. 211-235.


