Влияние производного С2,С3-хиноксалина соединения А81 и диазепама на содержание основных катехоламинов и их метаболитов в головном мозге крыс
Автор: Скрипка Мария Олеговна, Мальцев Дмитрий Васильевич, Мирошников Михаил Владимирович, Смирнова Людмила Андреевна, Абрамов Олег Константинович, Рябуха Анна Федоровна, Спасов Александр Алексеевич
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 2 (74), 2022 года.
Бесплатный доступ
В настоящем исследовании было изучено влияние нового производного С2,С3-хиноксалина с анксиолитической активностью - соединения под шифром А81 - на содержание в тканях мозга норадреналина, дофамина, серотонина, 5-гидроксииндолуксусной кислоты (5-ОИУК) и дигидроксифенилуксусной кислоты (ДОФУК). Исследование было выполнено с применением методики высокоэффективной жидкостной хроматографии. На основании проведенного исследования в биологических пробах под влиянием соединения А81, в отличие от диазепама, характерно увеличение концентрации свободного серотонина с более существенным снижением содержания дофамина и его метаболита ДОФУК.
Вэжх, 5-оиук, дофук, норадреналин, серотонин, дофамин, крысы, хиноксалин, диазепам, анксиолитик, мозг
Короткий адрес: https://sciup.org/142234848
IDR: 142234848 | УДК: 615.07
Текст научной статьи Влияние производного С2,С3-хиноксалина соединения А81 и диазепама на содержание основных катехоламинов и их метаболитов в головном мозге крыс
Acknowledgements: the study was carried out under the RFBR project No. 20-015-00164; the authors express gratitude to the staff of the Research Institute of the Federal State Educational Institution of the Southern Federal University (Rostov-on-Don) L. N. Divaeva and A. S. Morkovnik, as well as to the staff of the Federal State Budgetary Research Institution SKZNIVI (Novocherkassk) A. A. Zubenko and A. I. Klimenko for providing the substance for research.
На современном этапе существует широкий ряд препаратов для лечения тревожнофобических заболеваний с различной механизацией действия – ГАМК-, серотонин- норад-рен-, глутамат-, гистамин-, дофаминергические, а также ингибиторы моноаминоксидазы и TRPC 4-5 [1]. Серотониновая теория патогенеза тревожных расстройств остается одной из фундаментальных разработок в указанном направлении. Известно, что катехоламины ЦНС, а именно норадреналин, серотонин и дофамин, принимают непосредственное участие в формировании настроения, эмоций и аффективных расстройств. Ранее в ходе скрининговых исследований было обнаружено вещество с выраженным анксиолитическим свойством – производное хиноксалина под шифром А81 [3].
Интерес представляет изучение содержания основных моноаминов и их метаболитов в ЦНС лабораторных животных под действием экспериментального соединения с противотре-вожной активностью.
ЦЕЛЬ РАБОТЫ
Изучить влияние производного хиноксалина соединения А81 в сравнении с диазепамом на содержание основных катехоламинов и их метаболитов в головном мозге крыс.
МЕТОДИКА ИССЛЕДОВАНИЯ
В работе были задействованы 24 особи белых беспородных самцов крыс со средней массой тела 180–220 г, полученных из ФГУП ПЛЖ «Рапполово», Ленинградская область, Россия. Эксперименты одобрены локальным этическим комитетом ВолгГМУ, Волгоград, Россия, номер протокола: IRB 00005839 IORG 0004900 (OHRP). Декапитацию крыс проводили при наркотизации животных хлоралгидратом в дозе 300 мг/кг. Препарат сравнения диазепам вводили крысам за 0,5 часа до декапитации в дозе 2 мг/кг перорально атравматичным металлическим зондом. Изучаемое соединение – производное С2,С3-хиноксалина под шифром А81, 2-(2-{[3-(4-трет-бутилфенил)хиноксалин-2-ил]метил}-4,5-димето-ксифенил)-N-метилэтан-1-амин гидрохлорид, вводили крысам в дозе 3,5 мг/кг.
Метод высокоэффективной жидкостной хроматографии (ВЭЖХ) позволяет в полной мере оценить уровень содержания указанных катехоламинов в биологических пробах и сделать предположение о возможной механизации действия указанной субстанции [3, 4]. Эксперименты на целом мозге были выполнены согласно литературным источникам [5, 6]. После экстракции мозг крыс помещался в жидкий азот. После гомогенизации образцы были растворены в 0,1Н HClO4 в соотношении 1:4. Количественное определение проводилось на жидкостном хроматографе с флуоресцентным детектором при длине волны экстинкции 280 нм и длине волны эмиссии 320 нм. Мобильная фаза для колонки содержала 5 % ацетонитрила для ВЭЖХ (УФ 210 нм, Россия) и 95 % буферной системы, состоящей из 50 мМ KH2PO4 (рН 3,0).
Использовались стандарты норадреналина, допамина, серотонина, дигидроксифенилуксусной кислоты (ДОФУК), гидроксииндолуксусной кислоты (5-ОИУК) (Sigma, США). Для анализа полученных первичных данных применен метод абсолютных стандартов.
Статистический обсчет полученных результатов проводился с применением программы GraphPad Prism v.7.0., а также Microsoft Excel 2010. Проверка распределения в выборке на нормальность проводили тестом Колмогорова – Смирнова с поправкой Лиллиефорса для малых выборок (n = 6). При непараметрическом распределении применяли тест Краскелла – Уоллиса с посттестом Данна (р < 0,05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
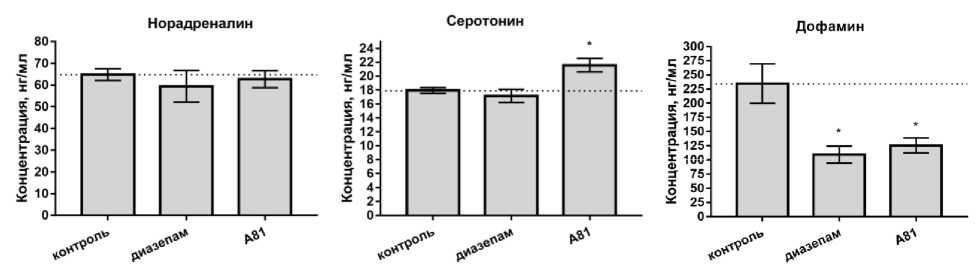
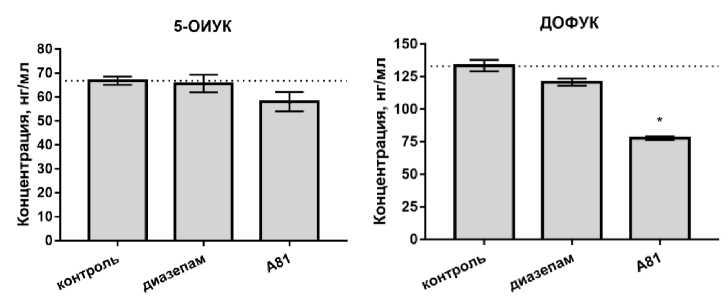
По результатам проведенного исследования было показано, что препарат сравнения диазепам в дозе 2 мг/кг не оказал значительного влияния на концентрации норадреналина и серотонина, что согласуется с его известным ГАМК-ергическим действием [7]. Содержание серотонина под действием диазепама составило (17,20 ± 0,92) нг/мл, что находится на уровне контрольных значений. Концентрация норадреналина также соответствовала исходным параметрам при введении крысам диазепама: (59,40 ± 7,34) нг/мл в группе препарата сравнения против (64,80 ± 2,70) нг/мл в группе контроля. Содержание в тканях мозга метаболита серотонина – 5-гидроксииндолуксусной кислоты – также осталось на уровне исходных значений. Концентрация дофамина составила (109,40 ± 15,08) нг/мл.
В свою очередь, коэффициент ДОФУК/до-фамин под действием диазепама был повышен: 1,1 против 0,5 в группе контроля, что, возможно, связано с более активным переходом дофамина в его метаболит, чем в контрольной группе. Снижение концентрации дофамина под действием диазепама согласуется с литературными данными [8].
Для производного хиноксалина соединения А81 не отмечено значимого влияния на концентрацию норадреналина, а также метаболита серотонина - 5-гидроксииндолуксусную кислоту. Концентрация норадреналина в головном мозге крыс под влиянием соединения А81 составила (62,70 ± 3,94) нг/мл, а 5-ОИУК -(58,00 ± 3,97) нг/мл. Было отмечено снижение содержания в биологических пробах дофамина на 47 % и его метаболита, диоксифенилуксус- ной кислоты (ДОФУК) на 43 % относительно контроля, а величина соотношения ДОФУК/до-фамин составила 0,6, что соответствует контрольным значениям.
Возможно, полученные результаты обоснованы переходом дофамина в гомованилиновую кислоту, которая является метаболитом дофамина в биохимической цепи трансформаций, отличной от образования ДОФУК. Концентрация серотонина под влиянием изучаемого соединения была повышена относительно контроля на 20 % (р < 0,05).
Сводные результаты анализа содержания основных моноаминов и их метаболитов в головном мозге крыс представлены на рисунке.
S 100-
27 75- а б в
д
г
Рис. Содержание основных моноаминов ЦНС и их метаболитов в головном мозге крыс под действием диазепама в дозе 2 мг/кг и экспериментального соединения А81 в дозе 3,5 мг/кг, введенных крысам за 30 минут до тестирования внутрижелудочно, M ± SEM: * – отличия статистически значимы по отношению к контролю, критерий Краскелла – Уоллиса и посттест Данна, p < 0,05. Пунктиром помечен уровень контрольных значений; а – концентрация норадреналина, б – концентрация серотонина, в – концентрация дофамина, г – концентрация 5 ОИУК, д – концентрация ДОФУК
ЗАКЛЮЧЕНИЕ
Таким образом, по результатам проведенного исследования содержания основных моноаминов и их метаболитов в головном мозге крыс для препарата сравнения диазепама показано снижение концентрации дофамина с повышением коэффициента ДОФУК/дофамин в 2,2 раза относительно группы контроля. Для соединения с анксиолитической активностью под шифром А81, производного хиноксалина, было отмечено повышение концентрации серотонина со снижением содержания дофамина относительно контроля, а также сопутствующее снижение концентрации метаболита дофамина ДОФУК в биологических пробах.
Список литературы Влияние производного С2,С3-хиноксалина соединения А81 и диазепама на содержание основных катехоламинов и их метаболитов в головном мозге крыс
- Мальцев Д. В., Спасов А. А., Мирошников М. В., Скрипка М. О. Современные подходы к поиску анксиолитических средств // Биоорганическая химия. 2021. Т. 47, № 4. С. 431-463. DOI: 10.1134/S1068162021030122
- Скрипка М. О., Мусаев Р. И., Мирошников М. В. Хиноксалин как перспективный скаффолд для разработки препаратов с психотропной активностью // MedChem Pussia 2021: материалы конференции 5-ой Российской конференции по медицинской химии с международным участием. Волгоград, 2021. С. 513.
- Влияние новых природных азотсодержащих соединений на изменение уровня биогенных аминов и их метаболизм в структурах головного мозга и продолжительность жизни крыс / А. В. Мекеня, А. Ф. Рябуха, Е. А. Сучков [и др.] // Экспериментальная и клиническая фармакология. 2012. № 9. С. 11-14.
- Особенности пробоподготовки для метода высокоэффективной жидкостной хроматографии количественного определения малорастворимых соединений / Л. А. Смирнова, А. А. Озеров, Е. А. Сучков [и др.] // Волгоградский научно-медицинский журнал. 2013. № 2(38). С. 14-16.
- Bhatt S., Mahesh R., Devadoss T., Jindal A. Neuropharmacological evaluation of a novel 5-HT3 receptor antagonist (4-benzylpiperazin-1-yl)(3-metho-xyquinoxalin-2-yl) methanone (6g) on lipo-polysaccharide-induced anxiety models in mice // J Basic Clin Physiol Pharmacol. 2017. № 28 (2). С. 101-106. DOI: 10.1515/jbcpp-2016-0083
- Kurhe Y., Mahesh R., Gupta D., Thangaraj D. Effect of (4a) a novel 5-HT3 receptor antagonist on chronic unpredictable mild stress induced depressive-like behavior in mice: an approach using behavioral tests battery // J Basic Clin Physiol Pharmacol. 2015. No. 26 (1). Р. 25-33. DOI: 10.1515/jbcpp-2013-0160
- Anxiolytic Activity of Derivatives 11H-2, 3,4,5-Tetrahydro[1,3]diazepino[1,2-A]benzimidazole and 2-mercaptobenzimidazole / A. A. Spasov, O. N. Zhukovskaya, D. V. Maltsev [et al.] // Russian Journal of Bioorganic chemistry. 2020. Vol. 46 (1). С. 92-100. DOI: 10.1134/S1068162020010124
- Diazepam Inhibits Electrically Evoked and Tonic Dopamine Release in the Nucleus Accumbens and Reverses the Effect of Amphetamine / A. A. Gomez, A. M. Fiorenza, S. L. Boschen, [et al.] // ACS Chem Neurosci. 2017. No. 8(2). Р. 300-309. DOI: 10.1021/acschemneuro.6b00358


