Влияние психротолерантных метилотрофных бактерий на рост, пигментный состав и накопление белка и углеводов у микроводоросли chlorella vulgaris
Автор: Шаравин Д.Ю., Беляева П.Г., Цещинская Е.М., Галямина В.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Изучено влияние шести психротолерантных метилотрофных бактерий, выделенных из образцов мохово-лишайниковой растительности и водных объектов на территории Антарктических оазисов и горных районов республики Алтай на рост, пигментный состав и накопление белка и углеводов в культуре зелёной микроводоросли Chlorella vulgaris при температурах +10 и +20°С. Стандартные графики роста хлореллы без бактериальной суспензии при +20 и +10°С выходили на плато на 5-6 и 9 сутки соответственно, достигая 30 и 16^106 кл/мл. Установлено, что пять из шести психротолерантных штаммов при совместном культивировании с хлореллой при температуре +10°С на численность хлореллы, содержание пигментов и концентрацию белка влияния не оказывали. Положительное воздействие выявлено только для хПргЗ, в частности на содержание углеводов. Также обнаружен негативный эффект Бел19 на численность хлореллы и содержание пигментов при +10°С. При культивировании хлореллы со штаммами бактерий при температуре +20°С выявлено увеличение численности водорослей с хПргЗ, концентрации хлорофилла а с Бел19 (119% от контроля), углеводов с изолятом хПрг17 и содержания внутриклеточного белка хлореллы с Ал5, Бел19, Бел62 и хПрг17.
Chlorella vulgaris, метилотрофы, пигменты, белки, углеводы, холодовой стресс
Короткий адрес: https://sciup.org/147247246
IDR: 147247246 | УДК: 579.68 | DOI: 10.17072/1994-9952-2024-4-412-420
Текст научной статьи Влияние психротолерантных метилотрофных бактерий на рост, пигментный состав и накопление белка и углеводов у микроводоросли chlorella vulgaris
Криосфера представляет интерес как долгосрочное хранилище микробного разнообразия планеты, где доминируют различные виды холодоустойчивых микроорганизмов [Priscu, Christner, 2004; Miteva, 2008; Sajjad et al., 2020]. Психрофильные и психротолерантные бактерии способны синтезировать широкий спектр пигментов, экзополисахаридов, уникальные ферменты холодового шока и другие полимеры для защиты от воздействий окружающей среды [Hoover, Pikuta, 2010; Sajjad et al., 2020]. Предполагается, что психротолерантные и психрофильные микроорганизмы как составная часть растительно-микробных ассоциаций могут эффективно стимулировать рост и продуктивность сельскохозяйственных растений в условиях холодного климата [Balcazar et al., 2015].
Растения являются глобальным продуцентом C 1 -соединений, а аэробные метилотрофные бактерии часто ассоциированы с ними и могут заселять поверхность листьев, присутствуя в семенах и ризосфере многих растений, поставляя растению-симбионту фитогормоны (ауксины, цитокинины), витамины и другие биологически активные вещества [Kutschera, 2007; Madhaiyan et al., 2007; Delmotte et al., 2009]. Ввиду того, что источником метанола могут служить не только наземные растения, но и водоросли, можно сделать вывод о глобальном распространении фитосимбиоза метилотрофных бактерий на поверхности планеты [Mincer, Aicher, 2016].
Зелёная микроводоросль Chlorella vulgaris наиболее интенсивно используется для биологической очистки сточных вод, получения зелёной биомассы, в качестве кормовой и пищевой добавки, в медицинской и парфюмерной промышленности. Биомасса хлореллы может служить источником разнообразных высокомолекулярных соединений: белков, жиров, углеводов, органических кислот, витаминов и т.д. Бактериальное микроокружение хлореллы (фикосфера) играет существенную роль в продуктивности экосистем и совместно с ассоциированными бактериями может использоваться в целях биоремедиации и производстве зелёной водорослевой биомассы [Wirth et al., 2020].
Несмотря на интерес со стороны исследователей к бактериям, ассоциированным с представителями рода Chlorella , есть единичные работы, где метилотрофные бактерии рассматривались как симбионты хлореллы и микроводорослей в целом. Поэтому, особенно актуально в этой связи использование экстре-мофильных, в частности психрофильных метилотрофов для снижения негативного воздействия низких температур на хлореллу.
Цель работы – изучить возможность использования холодоустойчивых метилотрофов, выделенных из Антарктики и горных районов, для стимулирования роста и увеличения содержания пигментов и метаболитов Chlorella vulgaris при пониженных температурах.
Материалы и методы
Объектом исследований служил штамм Chlorella vulgaris IMBR-19 (получен из Института морских биологических исследований им. А.О. Ковалевского РАН) без бактериального загрязнения, поддерживаемый в стерильных условиях при оптимальной для данного штамма температуре +28°C (точность поддержания температуры ±0.1°С) на жидкой среде BG-11, с освещённостью около 6500 Лк и чередованием световых и темновых фаз 12ч/12ч [Rogers et al., 2020]. Колбы, содержащие микроводоросли, встряхивали вручную два раза в день.
Для выделения холодоустойчивых культур метилотрофов использовали образцы воды из водотоков, альгобактериальных матов и биообрастаний, почв, мха и лишайников, отобранные в ходе полевых работ 65-й Российской антарктической экспедиции и в горных районах республики Алтай. Для получения изо- лятов метилотрофных бактерий использовали модифицированную среду «К» [Sharavin, Belyaeva, 2024]. Для выделения и культивирования метилобактерий, обладающих альтернативной метанолдегидрогеназой, вместо CaCl2×2H2O добавляли смесь LaCl3×7H2O и Ce2(SO4)3×4H2O до концентрации 30 μM каждого. Культивирование метилотрофов осуществляли при +10°С. Оптическую плотность культур измеряли при длине волны 590 нм на спектрофотометре (Cary 100, Agilent Technologies). Бактериальные клетки осаждали центрифугированием при 6 000 об/мин, осадок ресуспендировали в физрастворе. Влияние 6 штаммов метилобактерий (список штаммов представлен в таблице) на рост зелёной водоросли Chlorella оценивали в процессе их совместного культивирования в стеклянных ёмкостях объёмом 25 мл при температурах +10°С и +20°С. Засевная доза хлореллы содержала 1.5–1.6 ×106 кл./мл. Начальная pH культуральной среды составляла 7.0. Оптимальная температура роста для большинства из используемых в данной работе культур бактерий составляла +20°С.
Список использованных в работе культур бактерий [List of bacterial cultures]
|
Штамм |
Источник выделения |
Координаты точки отбора |
Оптимальная температура роста культуры, °С |
|
Ал1 |
Вода с эпилитоном из горного озера (Алтай) |
49°52.6649' СШ 86°34.3694' ВД |
20 |
|
Ал5 |
Обрастания на камнях, р. Кучерла (Алтай) |
49°54.1298' СШ 86°24.9902' ВД |
20 |
|
Бел19 |
Вода из руч. Станционный, вытекающего из оз. Китеж |
62° 11,869' ЮШ 58° 57,777' ЗД |
20 |
|
Бел62 |
Накипной лишайник (р-н ст. Беллинсгаузен, о. Кинг-Джордж) |
62° 12.713' ЮШ 59° 00.374' ЗД |
20 |
|
хПрг3 |
Мхи и водоросли на солнечной стороне скал (р-н ст. Прогресс, Холмы Ларсе-манн) |
69° 22.975' ЮШ 76° 23.252' ВД |
20 |
|
хПрг17 |
Отложения чёрного цвета на дне озера (р-н ст. Прогресс, Холмы Ларсеманн) |
69° 23.200' ЮШ 76° 22.538' ВД |
12 |
Соотношение стартовых концентраций клеток бактерий и водорослей (при засеве) составляло 1:1. Подсчёт численности клеток хлореллы проводили в камере Горяева на микроскопе ZEISS Axiostar Plus (Германия) [Dvoretsky et al., 2017]. Эксперименты проведены в трёх биологических повторностях.
Определение пигментов микроводорослей производили в карбиноловых экстрактах на 14-е сутки культивирования. Аликвоты культур осаждали центрифугированием и отмывали от культуральной жидкости дистиллированной водой. Осаждённые клетки хлореллы разрушали при помощи ручного гомогенизатора. Затем в гомогенат добавляли холодный ацетон «хч» (80%), содержимое встряхивали и помещали в темноту на 12 часов при 4°C. После этого центрифугировали при 6 000 об/мин 10 мин. Надосадочную жидкость, которая представляла собой вытяжку пигментов, переносили в кварцевую кювету и спектрофотометрировали на Cary 100 (Agilent Technologies, США) при длинах волн, соответствующих максимуму абсорбции пигментов (663 нм – хлорофилл а , 645 нм – хлорофилл b , 470 нм – каротиноиды и 750 нм – поправка на неспецифическую абсорбцию и рассеяние света экстрактом). Концентрацию (мкг/мл) исследуемых пигментов – хлорофиллов a , b и каротиноидов – в клетках хлореллы определяли по формулам H.K. Lichtenthaler [1987].
Количественную оценку внутриклеточного белка в разрушенных при помощи ручного гомогенизатора клетках осуществляли методом Бредфорда с использованием красителя Кумасси бриллиантовый синий G-250 (100 мг) при длине волны 595 нм [Bradford, 1976].
Общее содержание углеводов определяли по методу Герберт с антроновым реактивом при длине волны 625 нм. Концентрацию углеводов в пробах высчитывали по калибровочной кривой стандартных растворов глюкозы [Herbert, Phipps, Strange, 1971].
Полученные результаты обработаны статистически с использованием программы Statistica 6.0 по t–критерию Стьюдента.
Результаты и обсуждение
Согласно графику роста хлореллы (рис. 1), полученному опытным путём, через 2 дня культивирования количество клеток при +20°С достигало 11×106 кл/мл, в то время как при +10°С – не превышало 5×106 кл/мл. К пятым суткам плотность культур составляла 30 и 7 ×106 кл/мл при +20 и +10°С соответственно. Кривые роста выходили на плато на 5–6 сутки при +20°С и на 9 сутки при +10°С (до 16×106 кл/мл).
+20℃ ■ +10℃
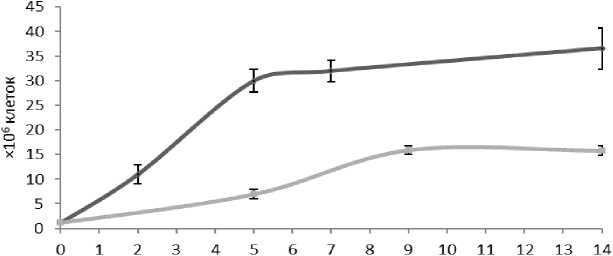
Сутки
Рис. 1. Стандартный график роста хлореллы при +10°С и +20°С
[Standard chlorella growth curve at +10°C and +20°C]
При совместном культивировании хлореллы с тестируемыми штаммами метилотрофных бактерий стимулирующего влияния бактерий на численность микроводорослей при температуре +10°С на 7 и 14 сутки не выявлено (рис. 2). Более того, эффект штамма Бел19 был негативный. При температуре инкубации +20°С заметный положительный эффект на рост хлореллы оказал хПрг3 на 14е сутки (126% от контроля) (рис. 3). Остальные варианты опыта при +20°С не имели существенных отличий от контроля.

ШПІ
□ 7 сут.
圆 14 сут.
Алі Ал5 Бел 19 Бел62 хПргЗ хПрг17
Рис. 2. Численность хлореллы на 7 и 14 сутки при инокулировании с культурами бактерий при +10°С [The number of chlorella cells inoculated with bacterial cultures at +10°C on day 7 and 14]
35 -1
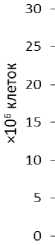
ІІ11ІІ1
□ 7 сут.
圖 14 сут.
К Алі Ал5 Бел 19 Бел62 хПргЗ хПрг17
Рис. 3. Численность хлореллы на 7 и 14 сутки при инокулировании с культурами бактерий при +20°С [The number of chlorella cells inoculated with bacterial cultures at +20°C on day 7 and 14]
На содержание пигментов микроводоросли при +10°С метилотрофные бактерии значимого положительного воздействия также не оказали. За исключением хлорофилла а у хПрг3 (3.13 мкг/мл), опытные варианты либо находились на уровне контрольных значений (К – 3.00 мкг/мл; хПрг17 – 2.98 мкг/мл), либо имели более низкую концентрацию (рис. 4). Ранее, при +10°С, нами было выявлено стимулирующее влияние штамма хПрг3 как на численность, так и на содержание пигментов хлореллы [Шаравин и др., 2023].
В текущем эксперименте обнаружено негативное воздействие Бел19 как на содержание пигментов при +10°С, так и на численность клеток хлореллы. Однако при +20°С данный штамм оказал стимулирующее влияние на содержание хлорофилла а , превысив контроль на 19% (рис. 5), при этом численность соответствовала контрольным значениям (рис. 3). Количество каротиноидов при +20°С в эксперименте со штаммами Ал1, хПрг3 и хПрг17 на 14 сутки выше контрольных в среднем в 1.7 раза, что может быть связано со старением культуры водоросли.
§^-v=>-
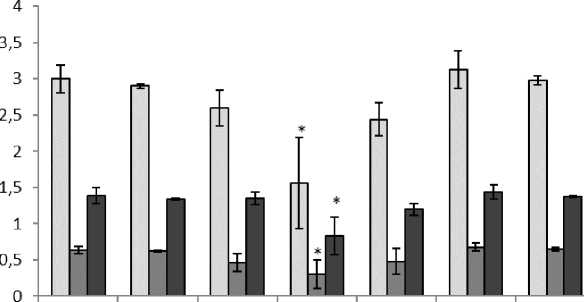
К Ал1 Ал5 Бел 19 Бел62 хПргЗ хПрг17
Рис. 4. Содержание пигментов, на 14 сутки (+10°С) [Pigment content, within 14 days (+10°C)]]
-
□ Хл а ОХл Ь ИКэр
3 5 2 5 15 0 2.1.0,

3,5
HAI/JHIAI
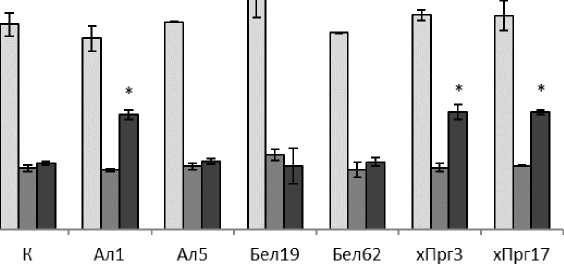
Рис. 5. Содержание пигментов, на 14 сутки (+20°С) [Pigment content, within 14 days (+20°C)]]
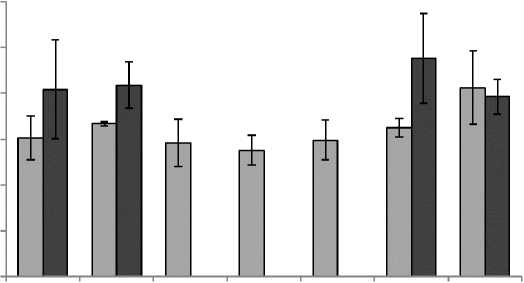
Эксперимент по совместному культивированию психротолерантных метилотрофов с хлореллой при +10 и +20°С выявил положительное влияние двух штаммов (хПрг3 на 16% при +10°С и хПрг17 на 37% при +20°С относительно контролей) на содержание углеводов в хлорелле (рис. 6). Концентрация углеводов в хлорелле в опытах при +10°С с Ал5, Бел19 и Бел62 не могла быть достоверно измерена из-за сильного развития бактериальных культур и невозможности полного разделения компонентов.
Данные по синтезу углеводов при воздействии низких температур, исходя из ряда источников – весьма противоречивы. Согласно [Lindberg et al., 2022], концентрация некоторых сахаров в Ch. vulgaris может существенно увеличиваться при пониженной (+5°С) температуре, по сравнению со значениями при +22°С. Однако показано, что при увеличении температуры роста относительно оптимальной (на 7–12°С), также может воз- растать содержание углеводов [Dai et al., 2022]. Некоторые представители рода Chlorella склонны выделять растворимые сахара в культуральную среду с увеличением температуры, в то время как содержание внутриклеточных растворимых сахаров не изменялось с колебаниями температуры [Cao et al., 2016].
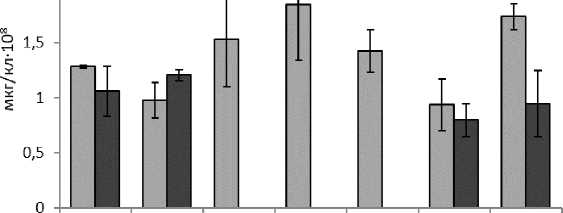
На содержание внутриклеточного белка хлореллы в опытах при температуре +20°С выявлено положительное воздействие Ал5, Бел19, Бел62 и хПрг17 (120, 144, 111 и 136% относительно контроля соответственно). При инокулировании хлореллы штаммами Ал1 и хПрг3 при температуре +10°С на 14-е сутки зафиксировано снижение количества белка в культуре микроводоросли относительно контроля (рис. 7). Как и в случае с углеводами, данные по внутриклеточным белкам хлореллы при +10°С с Ал5, Бел19 и Бел62 получить не удалось по вышеуказанной причине. В литературе показано, что Chlorella sp.-Arc накапливает белки, а также липиды при низких температурах (менее +15°С) [Cao et al., 2016]. Также отмечено, что разные штаммы хлореллы могут синтезировать большее количество белка как при повышенных, так и при пониженных (5–10°С) температурах [Cao et al., 2016; Idenyi et al., 2021]. В нашем случае используется относительно теплолюбивый штамм хлореллы и для него температура +10°С, исходя из графика роста (см. рис. 1), является существенным фактором, замедляющим рост культуры. При этом метилотрофные бактерии, продолжая своё развитие, вероятно, начинали подавлять микроводоросли, находясь в ограниченном объёме.
-
□ 20℃ 01О℃
К Дл1 Ал5 Бел 19 Бел62 хПргЗ хПрг17
Рис. 6. Концентрация углеводов в культуре Chlorella с бактериями на 14 сутки при +20°С и +10°С [Carbohydrate concentration in Chlorella culture with bacteria on day 14 at +20°C and +10°C]]
-
□ 20℃ Е10℃
К Ал1 Ал5 Бел 19 Бел62 хПргЗ хПрг17
Рис. 7. Концентрация белка в культуре Chlorella с бактериями на 14 сутки при +20°С и +10°С [Protein concentration in Chlorella culture with bacteria on day 14 at +20°C and +10°C]]
В литературе можно встретить работы по изучению влияния психрофильного бактериального микроокружения холодоустойчивых микроводорослей, но не используемых в биотехнологии штаммов хлореллы. Упоминания метилотрофных компонент таких сообществ единичны, а данные о положительном влиянии психрофилов на морфологические и биохимические показатели представителей рода Chlorella не отличаются стабильностью.
Заключение
В результате проведённого исследования явного стимулирующего влияния психротолерантных мети-лотрофных бактерий на численность, содержание пигментов и концентрацию белка хлореллы при температуре +10°С не выявлено, но при этом обнаружено положительное влияние на содержание углеводов в хлорелле при культивировании с хПрг3 (116% от контроля).
Более значимое воздействие оказали используемые штаммы бактерий при сокультивировании с хлореллой при температуре +20°С. Заметный положительный эффект на численность культуры водоросли оказал только штамм хПрг3 (126% от контроля), на содержание пигментов, в частности хлорофилла а – Бел19 (119% от контроля), на содержание углеводов относительно контроля хПрг17 (137% от контроля). На содержание внутриклеточного белка хлореллы выявлено положительное воздействие с Ал5, Бел19, Бел62 и хПрг17 (120, 144, 111 и 136% от контроля соответственно).
Для использования психротолерантных метилотрофов стимуляции роста Chlorella vulgaris при пониженных температурах необходимы дальнейшие исследования по подбору оптимальных соотношений численности бактерий и водорослей для достижения устойчивого положительного эффекта.
Список литературы Влияние психротолерантных метилотрофных бактерий на рост, пигментный состав и накопление белка и углеводов у микроводоросли chlorella vulgaris
- Шаравин Д.Ю. и др. Влияние психротолерантных метилотрофных бактерий на рост и концентрацию пигментов микроводоросли Chlorella vulgaris // Развитие современных систем земледелия и животноводства, обеспечивающих экологическую безопасность окружающей среды: материалы Всерос. науч. конф. Пермь, 2023. С. 398-404.
- Balcazar W. et al. Bioprospecting glacial ice for plant growth promoting bacteria // Microbiol. Res. 2015. Vol. 177. P. 1-7. DOI: 10.1016/j.micres.2015.05.001.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Analytical Biochemistry. 1976. Vol. 72. P. 248-254. DOI: 10.1006/abio.1976.9999.
- Cao K. et al. The eurythermal adaptivity and temperature tolerance of a newly isolated psychrotolerant Arctic Chlorella sp. // J. Appl. Phycol. 2016. Vol. 28. P. 877-888. DOI: 10.1007/s10811-015-0627-0.
- Dai Y.R. et al. Thermal-tolerant potential of ordinary Chlorella pyrenoidosa and the promotion of cell harvesting by heterotrophic cultivation at high temperature // Front. Bioeng. Biotechnol. 2022. Vol. 10. Art. 1072942. DOI: 10.3389/fbioe.2022.1072942.
- Delmotte N. et al. Community proteogenomics reveals insights into physiology of phyllosphere bacteria // PNAS. 2009. Vol. 106, № 38. P. 16428-16433. DOI: 10.1073/pnas.0905240106.
- Dvoretsky D. et al. The effect of the complex processing of microalgae Chlorella vulgaris on the intensification of the lipid extraction process // Chem. Eng. Trans. 2017. Vol. 57. P. 721-726. DOI: 10.3303/CET1757121.
- Herbert D., Phipps P.J., Strange R.E. Chapter III. Chemical analysis of microbial cells // Methods in microbiology / eds. J.R. Norris, D.W. Ribbons. 1971. Vol. 5. P. 209-344.
- Hoover R.B., Pikuta E.V. Psychrophilic and psychrotolerant microbial extremophiles in polar environments. CRS Press, 2010. P. 1-42. URL: https://ntrs.nasa.gov/api/citations/20100002095/downloads/20100002095.pdf.
- Idenyi J.N. et al. Characterization of strains of Chlorella from Abakaliki, Nigeria, for the production of high-value products under variable temperatures // J. Appl. Phycol. 2021. Vol. 33. P. 275-285. DOI: 10.1007/s10811-020-02313-y.
- Kutschera U. Plant-associated methylobacteria as co-evolved phytosymbionts // Plant Signaling & Behavior. 2007. Vol. 2, № 2. P. 74-78. DOI: 10.4161/psb.2.2.4073.
- Lichtenthaler H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Methods Enzymol. 1987. Vol. 148. P. 350-382. doi: 10.1016/0076-6879(87)48036-1.
- Lindberg A. et al. Cold stress stimulates algae to produce value-added compounds // Biores. Technol. Rep. 2022. Vol. 19. Art. 101145. DOI: 10.1016/j.biteb.2022.101145.
- Madhaiyan M. et al. Methylobacterium oryzae sp. nov., an aerobic pinc-pigmented, facultatively methylotrophic, 1-aminocyclopropane-1-carboxylate deaminase-producing bacterium isolated from rice // IJSEM. 2007. Vol. 57. P. 326-331. DOI: 10.1099/ijs.0.64603-0.
- Mincer T.J., Aicher A.C. Methanol production by a broad phylogenetic array of marine phytoplankton // PLoS ONE. 2016. Vol. 11, № 3. Art. e0150820. DOI: 10.1371/journal.pone.0150820.
- Miteva V.R. Bacteria in Snow and Glacier Ice // Margesin R. et al. Psychrophiles: from biodiversity to biotechnology. 2008. P. 31-50. DOI: 10.1007/978-3-540-74335-4_3.
- Priscu J.C., Christner B.C. Earth's icy biosphere // Microbial diversity and bioprospecting. ASM Press, 2004. P. 130-145.
- Rogers T.L. et al. Trophic control changes with season and nutrient loading in lakes // Ecol. Lett. 2020. Vol. 23, № 8. P. 1287-1297. DOI: 10.1111/ele. 13532.
- Sajjad W. et al. Pigment production by cold-adapted bacteria and fungi: colorful tale of cryosphere with wide range applications // Extremophiles. 2020. Vol. 24. P. 447-473. DOI: 10.1007/s00792-020-01180-2.
- Sharavin D.Y., Belyaeva P.G. Biotechnological potential of psychrotolerant methylobacteria isolated from biotopes of Antarctic oases // Arch. Microbiol. 2024. Vol. 206, № 323. P. 1-16. DOI: 10.1007/s00203-024-04056-7.
- Wirth R. et al. Chlorella vulgaris and its phycosphere in wastewater: Microalgae-bacteria interactions during nutrient removal // Front. Bioeng. Biotechnol. 2020. Vol. 8. Art. 557572. DOI: 10.3389/fbioe.2020.557572.


