Влияние растительного средства на течение экспериментального гепаторенального синдрома, вызванного комплексом противотуберкулезных средств
Автор: Усов Лев Акимович, Мондодоев Александр Гаврилович, Разуваева Янина Геннадьевна, Бартанова Елена Алексеевна, Бутуханова Ирина Сергеевна, Юндунова Оюна Владимировна
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Медицина
Статья в выпуске: SC, 2012 года.
Бесплатный доступ
Комплекс противотуберкулезных препаратов вызывает развитие гепаторенального синдрома у белых крыс. Курсовое введение животным растительного средства «нефрофит» в экспериментально-терапевтической дозе на фоне туберкулостатической терапии оказывает позитивное влияние на течение гепаторенального синдрома.
Туберкулостатики, гепаторенальный синдром, "нефрофит"
Короткий адрес: https://sciup.org/148181398
IDR: 148181398 | УДК: 615.244-322
Текст научной статьи Влияние растительного средства на течение экспериментального гепаторенального синдрома, вызванного комплексом противотуберкулезных средств
Успешность лечения туберкулеза во многом зависит от возможности проведения полного курса терапии туберкулостатиками в адекватных ситуации дозах и режимах. Тем не менее наблюдаемая частота лекарственных осложнений приводит к необходимости смены препаратов, изменения доз, перерывам в лечении, что в итоге может привести к снижению эффективности терапии. Одним из частых осложнений, лимитирующих назначение противотуберкулезных препаратов, является нарушение функций почек и печени на фоне приема указанных средств или уже имеющиеся сниженные функциональные возможности этих органов в результате их отягощенных состояний. По данным литературы, нарушения функций почек разной степени выраженности наблюдаются в 68,3% случаев при назначении туберкулостатиков, а среди больных туберкулезом легких в 16,3% случаев развивается токсический гепатит лекарственной этиологии [4]. Нарушения функционального состояния почек и печени связывают с нефро-и гепатотоксическими свойствами туберкулостатиков [4,5].
В сложившейся ситуации представляется оправданным и логичным предупреждать или максимально снижать токсическое действие противотуберкулезных препаратов. Одним из вариантов решения указанной проблемы, на наш взгляд, является использование растительных средств, которые способны оказывать не только нефро- и гепатопротекторное действие, но и повышать адаптивные возможности организма в целом. Ранее нами были установлены выраженные нефропротекторные свойства комплексного растительного средства, условно названного «нефрофит» при поражениях почек токсической и ишемической этиологии [6].
Целью настоящего исследования явилось определение влияния «нефрофита» на функциональную активность почек и печени при назначении комплекса туберкулостатиков.
Материалы и методы
Исследования проведены на крысах линии Wistar обоего пола массой 160-180 г. Повреждение почек и печени туберкулостатиками моделировали по методике Н.П. Скакуна, О.Е. Табачука (1992). Лабораторным животным внутрижелудочно с 2-часовым интервалом вводили противотуберкулезные препараты (ПТП): изониазид (50 мг/кг), рифампицин (50 мг/кг), пиразинамид (1,5 мг/кг) 1 раз в сутки в течение 14 дней.
Животные опытной группы на фоне введения туберкулостатиков получали комплексный фитоэкстракт «нефрофит», в состав которого входят сухие экстракты: толокнянки обыкновенной – 2 части, ортосифона тычиночного - 4 части, горца птичьего – 3,5 части, десмодиума канадского – 0,5 части, в экспериментально-терапевтической дозе 150 мг/кг массы 1 раз в сутки, внутрижелудочно, в течение эксперимента. Препарат сравнения «канефрон» вводили другой группе животных на фоне введения ПТП в объеме 1,5 мл/кг 1 раз в сутки внутрижелудочно по аналогичной схеме. Животные контрольной группы получали дистиллированную воду в эквиобъемных количествах в аналогичных условиях. На 3-и и 15-е сутки после введения ПТП оценивали функциональное состояние почек и печени общепринятыми методами, а также определяли содержание продуктов перекисного окисления липидов (ПОЛ) и активность ферментов антиоксидантной защиты организма (АОЗ). Концентрацию диеновых конъюгатов (ДК) в плазме крови определяли по Гаврилову, Мишкорудной (1983). Концентрацию малонового диальдегида (МДА) определяли в сыворотке крови и в гомогенате почек белых крыс (Osakawa, Matshushita, 1980). Активность каталазы сыворотки крови определяли по Королюк и соавт., (1988). Активность супероксиддисмутазы (СОД) определяли по Чевари и соавт., (1985). Статистическая обработка результатов проводилась с использованием t-критерия Стьюдента. Полученные данные представлены в таблицах 1 - 5.
Результаты и обсуждение
Как следует из данных табл. 1, введение комплекса ПТП у белых крыс на 3-и сутки наблюдения не оказывает заметного влияния на функциональное состояние почек, тем не менее, отмечалась выраженная индукция процессов свободнорадикального окисления биомакромолекул и компенсаторное увеличение каталитической активности. Так, концентрация ДК и МДА в крови почках белых крыс возрастала по сравнению с показателями у интактных животных соответственно в 1,9, 1,5 и 1,6 раза.
Курсовое введение «нефрофита» оказывало антиоксидантное действие, об этом свидетельствовало достоверное снижение уровня накопления ДК и МДА в крови и гомогенате почек животных на 24, 34 и 20 %, также отмечалось выраженное повышение активности каталазы на 70% соответственно по сравнению с показателями у крыс контрольной группы. При этом антиоксидантная активность препарата сравнения «канефрона» значительно уступала действию «нефрофита».
Таблица 1
Влияние «нефрофита» на показатели азотистого обмена, перекисного окисления липидов и активность ферментов АОЗ в сыворотке крови белых крыс при комплексном введении противотуберкулезных препаратов (3-и сутки)
|
Показатели |
Группы |
|||
|
Интактная |
Контрольная (ПТП) |
Опытная 1 (ПТП + «Нефрофит» |
Опытная 2 (ПТП + «Канефрон» |
|
|
Креатинин, мкмоль/л |
62,00±0,77 |
64,50±2,35 |
62,25±1,18 |
63,78±0,76 |
|
Мочевина, ммоль/л |
5,37±0,46 |
5,62±0,41 |
5,39±0,59 |
5,45±0,76 |
|
ДК, усл. ед. |
6,11±0,39 |
11,45±0,87* |
8,73±0,52** |
10,63±1,09 |
|
МДА в сыворотке, мкмоль/мл |
11,45±0,83 |
17,59±1,56* |
11,53±0,94** |
15,74±1,26 |
|
МДА, нмоль/г ткани |
10,30±0,56 |
16,47±1,52* |
13,24±1,28 |
16,82±1,56 |
|
Каталаза, млкат/л |
4,01±0,37 |
4,20±0,45 |
7,25±0,66** |
4,72±0,36 |
Примечание: здесь и далее * - различия достоверны между группами интакт – контроль, ** - различия достоверны между группами контроль – опыт при Р ≤ 0,05
Как следует из таблицы 2, курсовое введение ПТП вызывает у лабораторных животных умеренное поражение почек, сопровождающееся гиперазотемией, протеинурией, повышением диуреза, снижением скорости клубочковой фильтрации (СКФ) и относительной плотности мочи. Так, на 15-е сутки исследования в сыворотке крови животных контрольной группы наблюдали возрастание концентрации креатинина и мочевины в 1,2 и 1,3 раза соответственно; уровень протеинурии – на 50 %; диурез увеличивается в 1,5 раза, а СКФ снижалась на 26 % по сравнению с данными у интактных крыс. Снижение СКФ, удельного веса мочи и увеличение диуреза у крыс контрольной группы следует рассматривать как проявление угнетения концентрационной функции почек под влиянием комплекса туберкулостатических средств.
Таблица 2
Влияние «нефрофита» на функциональное состояние почек белых крыс при экспериментальной лекарственной нефропатии, вызванной комплексным введением противотуберкулезных препаратов (ПТП) (15-е сутки)
|
Показатели |
Группы животных |
|||
|
Интактная |
Контрольная (ПТП) |
Опытная 1 (ПТП + «Нефрофит») |
Опытная 2 (ПТП + «канефрон») |
|
|
Креатинин, мкмоль/л |
52,10±3,16 |
63,02±3,98* |
54,42±3,02 |
56,83±5,11 |
|
Мочевина, ммоль/мл |
5,56±0,32 |
7,19±0,38* |
5,78±0,42 |
6,45±0,58 |
|
Белок в моче, г/л |
0,70±0,05 |
1,05±0,07* |
0,65±0,04** |
0,78±0,06 |
|
СКФ, мкл/мин |
173,41±10,34 |
127,68±9,37* |
152,90±8,76 |
134,82±12,03 |
|
Объем мочи за 2 часа, мл/100 г. |
80,66±5,02 |
120,50±6,56* |
86,21±4,85** |
89,36±7,93 |
|
Удельный вес мочи |
1030,21±65,47 |
1021,14±78,01 |
1029,45±76,31 |
1024,01±91,22 |
Курсовое введение «нефрофита» в указанной дозе сопровождалось сохранением функционального состояния почек. В частности, не наблюдали увеличения уровня креатинина и мочевины в сыворотке крови животных опытных групп, роста протеинурии. СКФ повышалась в 1,2 раза; диурез снижался на 28 % по сравнению с контролем. Основные регистрируемые показатели у животных опытной группы к данному сроку наблюдения статистически не отличались от аналогичных данных у интактных крыс.
Данные, приведенные в таблице 3, свидетельствуют, что введение ПТП сопровождается выраженной индукцией процессов ПОЛ и снижением активности эндогенной антиокислительной системы организма. Так, на 15-е сутки эксперимента наблюдали повышение содержания ДК и МДА в сыворотке крови и почках белых крыс соответственно в 2,3; 1,4 и 1,5 раза; одновременно с этим происходило снижение активности каталазы и СОД на 29 и 45 % соответственно по сравнению с показателями у крыс интактной группы.
Таблица 3
Влияние «нефрофита» на показатели перекисного окисления липидов и активность ферментов АОЗ в сыворотке крови белых крыс при комплексном введении противотуберкулезных препаратов (15-е сутки)
|
Группы животных |
ДК, усл. ед. |
МДА, в сыворотке крови, мкмоль/л |
МДА, мкмоль/г ткани почки |
Каталаза, млкат/л |
СОД, в эритроцитах, мкмоль/л |
|
Интактная |
5,81±0,42 |
13,28±0,65 |
14,01±1,27 |
8,60±0,61 |
14,06±1,26 |
|
Контрольная (ПТП) |
10,34±0,72* |
19,17±1,70* |
21,59±1,76* |
6,10±0,36* |
7,69±1,04* |
|
Опытная 1 (ПТП + «Нефрофит» |
7,18±0,56** |
13,94±0,76** |
16,01±0,96** |
8,61±0,77** |
12,32±0,86** |
|
Опытная 2 (ПТП + «Канефрон» |
8,26±1,01 |
15,92±1,49 |
17,36±1,52 |
7,92±0,49 |
11,41±0,91 |
Курсовое введение «нефрофита» животным, получавшим ПТП, сопровождалось достоверным снижением накопления продуктов пероксидации липидов в крови и почках белых крыс. Так, под влиянием испытуемого средства происходило снижение концентрации ДК в сыворотке крови на 30 %; концентрации МДА в крови и почках белых крыс - на 27 и 26 % соответственно по сравнению с показателями у крыс контрольной группы. Наряду с этим, у животных, получавших фитоэкстракт, повышалась активность каталазы и СОД в сыворотке крови в 1,4 и 1,6 раза по сравнению с показателями у крыс контрольной группы. Антиоксидантная активность препарата сравнения в этих условиях уступала таковой у «нефрофита».
Как следует из таблицы 4, при сочетанном введении белым крысам изониазида, рифампицина и пирази-намида в указанных дозах в сыворотке крови повышается активность мембраносвязанных ферментов : аланинаминотрансферазы (АлТ) и аспартатаминотрансферазы (АсТ) в 2,2 и 1,5 раза соответственно по сравнению с показателями у крыс интактной группы. Наряду с этим, отмечали повышение в сыворотке крови: тимоловой пробы в 2,1 раза, концентрации общего билирубина в 7 раз, активности щелочной фосфатазы на 30% соответственно с аналогичными показателями у интактных крыс.
Влияние «нефрофита» на функциональное состояние печени белых крыс при комплексном введении противотуберкулезных препаратов (15-е сутки)
Таблица 4
|
Показатели |
Группы животных |
||
|
Интактная |
Контрольная (ПТП) |
Опытная (ПТП + «Нефрофит» |
|
|
АсТ, ЕД/л |
38,41±2,68 |
86,01±5,17* |
66,34±3,79** |
|
АлТ, ЕД/л |
58,09±4,17 |
87,59±7,01* |
69,18±4,39** |
|
Тимоловая проба, ЕД |
0,81±0,05 |
1,70±0,08* |
1,06±0,05** |
|
Общий билирубин, мкм/л |
3,36±0,16 |
23,59±1,87* |
19,56±1,23 |
|
Щелочная фосфатаза, ЕД/л |
4,52±0,31 |
5,87±0,31 |
5,56±0,29 |
Под влиянием «нефрофита» на фоне введения туберкулостатиков наблюдали менее выраженные проявления цитолиза, холестаза, улучшалась белковообразующая функция печени. Так, уровни активности АсТ и АлТ и концентрация билирубина в сыворотке крови были ниже на 23, 21 и 17 % соответственно, показатель тимоловой пробы ─ на 38 % ниже по сравнению с аналогичными данными у животных контрольной группы.
При патоморфологическом исследовании было установлено, что сочетанное введение ПТП оказывает повреждающее действие на канальцы коркового слоя почек, в частности, на проксимальные канальцы. Просветы канальцев представлялись расширенными, многие из них были заполнены белковыми и гиалиноподобными массами. Эпителий канальцев был подвержен разной степени дистрофии (рис.1): некоторые эпителиальные клетки были увеличены в объеме и представляли собой рыхлые образования с небольшими компактными ядрами; другие клетки, наоборот, представлялись уплощенными и не содержали ядер или ядра имели бледную окраску. Также встречались канальцы в состоянии деструкции с разрушенными эпителием и базальной мембраной. На фоне курсового введения «нефрофита» отмечено его защитное действие на структуры канальцев. На рис. 2 просматриваются канальцы с сохраненными эпителием и базальной мембраной. Просветы канальцев свободны от возможных включений. При морфометрической оценке подтверждено нефрозащитное влияние данного средства (табл. 5).
Таблица 5
Влияние «нефрофита» на площадь и периметр канальцев при нефропатии, вызванной комплексным введением противотуберкулезных препаратов (ПТП) (15-е сутки)
|
Показатели |
Группы животных |
|
|
Контрольная (ПТП) |
Опытная (ПТП +«нефрофит») |
|
|
Площадь канальцев, мкм² |
959,81±38,79 |
412,57±12,53** |
|
Периметр канальцев, мкм |
150,31±7,54 |
83,04±4,72** |
Выводы и заключение . Таким образом, комплексное введение лабораторным животным рифампицина, изониазида, пиразинамида в указанных дозах сопровождается развитием полиорганной патологии, характеризующейся как гепаторенальный синдром и способствует развитию синдромов: цитолиза (повышение активности ферментов АсТ и АлТ), холестаза (возрастание активности щелочной фосфатазы, гипербилирубинемия) и мезинхимального воспаления (повышение показателя тимоловой пробы), а также вызывает снижение белково-синтетической функции печени, на что указывало повышение осадочной тимоловой пробы. Эти данные согласуются с положением о биотрансформации указанных препаратов, происходящих в основном в печени, вызывая ее токсические изменения [5]. Поражение почек при назначении ПТП характеризовалось незначительной азотемией, протеинурией, снижением скорости клубочковой фильтрации, умеренным повышением диуреза и гипостенурией. На фоне медикаментозного гепаторенального синдрома у белых крыс развивался оксидативный стресс с понижением возможностей эндогенной антиокислительной защиты. Также комплексное введение ПТП сопровождалось дистрофическими изменениями эпителия проксимальных канальцев и реакцией интерстициальной ткани.
Курсовое введение «нефрофита» животным на фоне ПТП сопровождалось нефропротекторным и умеренным гепатозащитным влиянием, благодаря способности данного полиэкстракта экранировать отрицательное действие противотуберкулезных препаратов. Этот эффект обусловлен комплексом биологически активных веществ, прежде всего фенольной природы, оказывающих антиоксидантное, мембраностабилизирующее действие [7]. Кроме того, в дополнительных сериях экспериментов было установлено стимулирующее влияние «нефрофита» на макрофагальное звено иммунитета при азати-оприновой иммуносупрессии у мышей линии СВА х F1 [1]. Также было показано, что данный полиэкстракт подавляет активность каспазы-3 в гомогенате почек белых крыс при их ишемии/реперфузии [8], что характеризует его как средство, ингибирующее индуцированный апоптоз. Эти наблюдения имеют определенное значение, поскольку есть данные, свидетельствующие о важной роли ускорения процессов ПОЛ при назначении ПТП как фактора, способствующего развитию указанных нарушений, а также роли индуцированного апоптоза в генезе лекарственных повреждений почек [9]. Очевидно, благодаря указанным свойствам «нефрофита», обеспечивается его положительное влияние на течение гепаторенального синдрома при использовании комплекса противотуберкулезных средств.
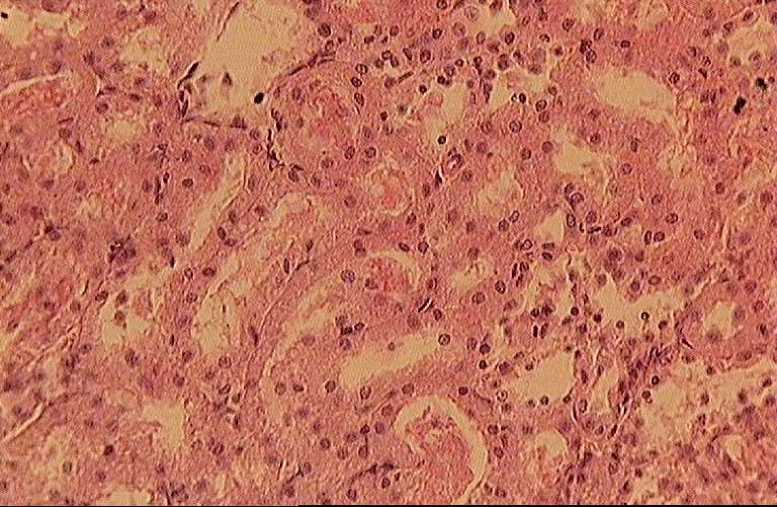
Рис. 1. Почка крысы. Контроль. 15-е сутки исследования. Расширение канальцев. Наличие в просвете канальцев белково-гиалиновоподобных цилиндров. Окраска гемотоксилин-эозином. Увел. 10х40
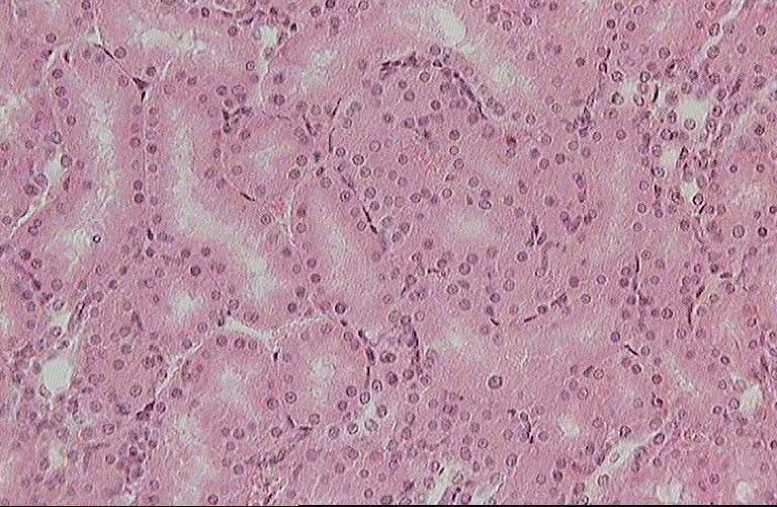
V С<
О о
«♦о
1 .. »'L 0
У О ;*•* "Л
“оу о
0ф 1ft ^ ^^
• V^" 0 Г1^
-0 $, .@ “ •
° '\- V ■■' и v**^ \. ч и |1Р‘ ‘*к
Рис. 2. Почка. Курсовое введение «Нефрофита». 15 сутки исследования. В проксимальных канальцах почки отсутствуют белково-гиалиновые цилиндры. Окраска гематоксилин-эозином. Увел. 10х40


