Влияние различного гелеобразующего агента в составе питательной среды на индукцию гиногенного развития неопыленных семяпочек огурца (Cucumis sativus L.)
Автор: Белов Сергей Николаевич
Журнал: Овощи России @vegetables
Рубрика: Селекция, семеноводство и биотехнология растений
Статья в выпуске: 5 (67), 2022 года.
Бесплатный доступ
Актуальность. Индукцию гиногенного развития в культуре неопыленных семяпочек Cucumis sativus L. проводят на твердых питательных средах с агар-агаром, либо Phytagel™. Гелеобразующие агенты определяют мобилизацию веществ в составе питательной среды и оказывают различные эффекты на экспланты, что сказывается на качестве полученных регенератов. Однако работы, в которых изучается влияние данных гелеобразующих агентов на развитие семяпочек и сравнение их между собой для C. sativus L. отсутствуют. Цель исследований: изучить влияние различного гелеобразующего агента в питательной среде на индукцию гиногенеза и развитие неопыленных семяпочек огурца. Материалы и методы. В исследование были включены два перспективных коллекционных образца огурца №58 и №831 лаборатории селекции и семеноводства тыквенных культур ФГБНУ ФНЦО. Для индукции гиногенеза использовали питательную среду IMC (Induction Medium for Cucurbitaceae) с 30 г/л сахарозы, 200 мг/л ампициллина, 0,2 мг/л тидиазурон (ТДЗ). В качестве гелеобразующего агента использовались агар-агар в концентрации 7 г/л, либо Phytagel™ в концентрации - 3,5 г/л. Семяпочки были выделены из завязей, находящихся в фазе полураскрытого цветка (FL-1) и фазе полностью раскрытого цветка (FL). Культивирование проводили в пластиковых чашках Петри диаметром 60 мм с объемом воздушной прослойки 28,8 см3 - "КС №1", и стеклянных культуральных банках с объемом воздушной прослойки 140 см3 - "КС №2". Результаты. На питательных средах, содержащих Phytagel™ и агар - агар площадь семяпочек за 30 дней культивирования увеличивалась неравномерно. Коэффициенты увеличения семяпочек между гелеобразующими агентами отличались от 1,7 до 2,6 раз в зависимости от времени культивирования. Средняя скорость увеличения семяпочек на средах с Phytagel™ составляла 0,08 мм2/сут., в то время как на средах с агар-агаром она была 0,02 мм2/сут. Генотип и тип гелеобразующего агента являются значимыми факторами, влияющими на увеличение площади введенных в культуру неопыленных семяпочек огурца. При этом доля влияния гелеобразующего агента составила 55,01%, а доля влияния генотипа составила 14,53%. Влияние стадии развития цветка и типа культурального сосуда не оказывало существенного влияния на развитие семяпочек у обоих генотипов. В исследовании удалось достичь индукции гиногенеза у 67 % введенных в культуру неопыленных семяпочек у генотипа №831 на питательной среде с агар-агаром. Выводы. На питательной среде, где в качестве гелеобразующего агента используется Phytagel™, семяпочки увеличиваются в размере быстрее, чем на питательных средах с агар-агаром. В тоже время процент индуцированных семяпочек был существенно выше на питательных средах с агар-агаром для обоих генотипов. Тип гелеобразующего агента и генотип и являются значимыми факторами, влияющими на индукцию и развитие неопыленных семяпочек.
Гиногенез, неопыленные семяпочки, гелеобразующий агент, агар-агар, phytagel
Короткий адрес: https://sciup.org/140295696
IDR: 140295696 | УДК: 635.63:631.531.011.2:581.13 | DOI: 10.18619/2072-9146-2022-5-15-23
Текст научной статьи Влияние различного гелеобразующего агента в составе питательной среды на индукцию гиногенного развития неопыленных семяпочек огурца (Cucumis sativus L.)
Оригинальные статьи / Originalarticles УДК 635.63:631.531.011.2:581.13
Vegetable crops of Russia. 2022;(5):15-23. (In Russ.)
П ри разработке технологии получения удвоенных гаплоидов, одним из факторов, влияющих на успешное получение растений, является изучение влияния различных добавок в составе индукционной питательной среды. Для приготовления плотной питательной среды необходимо использовать гелеобразующий агент, в качестве которого наиболее часто используют агар-агар. В качестве альтернативы агар-агару, может выступать Phytagel™, при применении которого питательная среда становится прозрачнее, и по сравнению с агар-агаром для получения плотной среды его требуется в два раза меньше. Большинство исследований по оптимиза- ции технологии гиногенеза неопыленных семяпочек огурца (Cucumis sativus L.) были проведены на плотной среде с агар-агаром в качестве гелеобразующего агента, вне зависимости от основного состава среды MS [1], СBM [2], и только 2 исследования для этой культуры были выполнены на среде MS, где в качестве гелеобразующего агента использовали Phytagel™ [3,4], при этом ни в одной из публикаций о получении удвоенных гаплоидов методом гиногенеза в культуре неопыленных семяпочек C. sativus L. не было отражено его влияние на развитие семяпочек и индукцию гиногенного развития. Для свеклы столовой (Beta vulgaris L.) ранее было показано, что гелеобразующий агент в составе индукционной питательной среды оказывает существенное влияние на выход эмбриоидов и каллуса в культуре неопыленных семяпочек in vitro [5].
При культивировании растений in vitro в замкнутом пространстве накапливается в большом количестве этилен, который может оказывать сильное морфогенетическое действие на растительные клетки. Этилен ингибирует удлинение проростков, останавливает рост листьев и вызывает задержку митозов, тормозит полярный транспорт ауксина и способствует образованию его коньюга-тов. По-видимому, с этим, связана способность этилена, усиливать процессы старения. Механизм действия этилена изучен еще недостаточно. Предположительно, он влияет на состояние цитоскелета, взаимосвязь мембран, микротрубочек и микрофиламентов. В работе Li et al., 2013 [6] впервые в изучении гиногенеза огурца поднимается вопрос о том, что этилен оказывает отрицательное воздействие на развитие эксплантов огурца, и как решение предлагается включение в состав питательной среды в качестве ингибитора этилена AgNO 3 . Полученные результаты показали, что AgNO 3 в диапазоне от 5 до 10 мг/л был эффективен в индукции образования эмбриоидов и регенерации растений.
Ралдугина и Соболькова [7] показали, что накопление этилена в сосудах ингибирует рост и развитие растений рапса. Культуральные сосуды в которых культивируются семяпочки, могут быть разнообразны по форме и объему. Остаточный объем воздушной прослойки для каждого типа культуральных сосудов будет разный, соответственно концентрация этилена в каждом сосуда будет отличаться. Нами высказана гипотеза, что использование сосудов различного объема, в которых культивируется семяпочки, будет влиять на развитие эксплантов.
Цель исследований: изучить влияние различного гелеобразующего агента в питательной среде IMC на развитие неопыленных семяпочек огурца, по таким факторам как скорость увеличения семяпочек и коэффициент увеличения семяпочек. В исследовании проведены наблюдения за развитием семяпочек огурца, выделенных из завязей разной степени раскрытия цветка (полураскрытый и полностью раскрытый цветок) и культивирующийся в разных по объёму культуральных сосудах и определенна зависимость этих факторов между собой и с типом гелеобразующего агента.
Материалы и методы исследования
В работе использовали селекционные образцы огурца №831 и №58 лаборатории тыквенных культур ФГБНУ ФНЦО. Данные образцы являются партенокарпическими, среднеспелым, устойчивыми к ложной мучнистой росе, обладающие темно-зелеными плодами. Донорные растения выращивали в 2021 году в условиях кондиционируемой вегетационной камеры при 23°С и фотопериоде 16 часов день/8 часов ночь, освещенности 9 тыс. люкс.
Женские бутоны с желто-зеленым венчиком изолировали с использованием колпачка из пергаментной бумаги. Во время фазы полураскрытого цветка (Рисунок 1А) и фазы раскрытого цветка (Рисунок 1B), бутоны срывали. Сбор бутонов и закладку опытов производили с середины февраля по середину сентября, с растений, возраст которых не превышал 10 недель.
С женских бутонов удаляли околоцветник и промывали под струей водопроводной воды с коммерческим моющим средством «АОС» в течение 5 минут. Поверхностную стерилизацию проводили 30 секунд в 96% этаноле, затем в течение 15 минут в 50% водном растворе коммерческого препарата «Белизна» с добавлением Твина-20 (1 капля на 100 мл), с последующим трехкратным промыванием в течение 10 минут в стерильной дистиллированной воде.
У генотипа №831 размер завязи был от 21,3 до 22 мм для раскрытого цветка, от 18 до 18,5 мм – для полураскрытого цветка, у генотипа №58 размер завязи – от 21,5 до 21,8 мм для раскрытого цветка, от 18,7 до19 мм – для полураскрытого цветка.
После стерилизации завязи разрушали с помощью скальпеля и преправильных игл под стереомикроскопом Stemi 305 (Carl Zeiss Microscopy GmbH, Germany) при 10×

Рис. 1. Завязи огурца,генотипа №831,разных фаз раскрытия цветка перед поверхностной стерилизацией: А) Полураскрытый цветок (FL-1); B) Раскрытый цветок (FL) Fig. 1. Cucumbergenotype №831 ovaryon differentstages of floweropening before surface sterilization:
A) half-opened flower(FL-1); B) opened flower(FL)
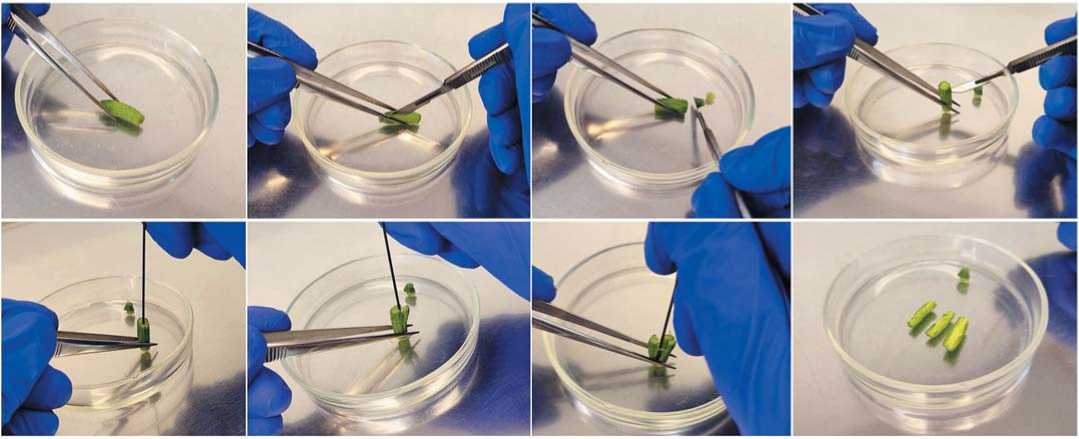
Рис. 2. Процесс разрушения завязи огурца Cucumis sativus L.
Fig. 2. The process ofcucumber(Cucumis sativus L.) ovarydestruction
увеличении в ламинарном боксе с использованием метода, позволяющего сохранить максимальное число семяпочек без признаков повреждения (рис. 2) [8].
Для индукции гиногенеза использовали питательную среду IМС (Induction Medium for Cucurbitaceae – разработана в лаборатории биотехнологии ФГБНУ ФНЦО (ВНИ-ИССОК)) с минеральной основой МСм [9] с добавлением аминокислот (100 мг/л пролина, 100 мг/л серина, 800 мг/л глутамина) и витаминов прописи среды NLN [10], 30 г/л сахарозы, 200 мг/л ампициллина, 0,2 мг/л тидиазурон (ТДЗ), в качестве гелеобразующего агента использовались агар-агар в концентрации 7 г/л и Phytagel™ в концентрации 3,5 г/л.
Для культивирования использовали стерильные пластиковые чашки Петри диаметром 60 мм и высотой 15 мм (ООО «Биомедикал», Москва, Россия) – "КС №1", и стеклянные культуральные банки, диаметром 50 мм и высотой 65 мм, закрытые пластиковыми крышками Magenta™ B-cap (Magenta Corporation, Chicago, USA) – "КС №2".
Для приготовления питательных сред использовали реактивы марки «протестировано для культуры клеток» (Sigma) и сверхчистая вода (Type 1, 18.2 MΩ•cm), полученная с помощью установки для очистки воды Simplicity® UV Water Purification System (Merck KGaA, Darmstadt, Germany).
Культивирование проводили на стеллажах со смешанным освещением люминесцентными лампами двух типов: OSRAM Fluora L36W/77 (с преобладанием синего и красного спектра) и Philips 36W/54-765 (с преобладанием белого спектра), при общей освещенности 3000 люкс, фотопериоде 16 часов – день и 8 часов – ночь при температуре 25 °С круглосуточно.
Обработку экспериментальных данных проводили с использованием общепринятых математико-статистических методов с использованием пакета прикладных программ Microsoft Excel 2016 для Windows 10.
Морфологические изменения отмечали и фотодоку-ментировали один раз в 10 суток, с помощью стереомикроскопа Stemi 305, оснащенного камерой Axiocam 105 color (Carl Zeiss Microscopy GmbH, Germany) и программного обеспечения ZEN 3.1 (blue edition) (Carl Zeiss Microscopy GmbH, Germany).
Площадь семяпочек рассчитывали с помощью инструмента «Область» в прикладном программном обеспечении ZEN 3.1 (blue edition) (Carl Zeiss Microscopy GmbH, Germany).
Коэффициент увеличения семяпочек рассчитывали по формуле:
S n
— S0 , где S – площадь семяпочек (S), выраженную в мм2, n – сутки, а S0– площадь семяпочек в день введения в культуру.
Скорость увеличения семяпочек рассчитывался по формуле:
Sx - Sn X , где S – площадь семяпочек (S), выраженную в мм2, х – сутки на конец периода, n – сутки на начало периода, а х– количество суток между периодами.
Результаты и их обсуждение
Известно, что одним из показателей индукции гиногенного развития является изменение размера, формы и цвета выделенных семяпочек.Как правило, эмбриоиды и каллус образуются из семяпочек зеленого цвета,которые значительно увеличились в размере.
Сразу после изоляции семяпочки огурца представляют собой прозрачную, бесцветную структуру каплевидной формы, размером до 0,6 мм2 (рис. 3А, рис. 4), к 30 дню, семяпочка растет до 3,06 мм2, окраска меняется на зеленую,клетки специализированной ткани начинают дифференцироваться, появляется обводнение (рис. 3B), за следующие 2-3 месяца развития наблюдается рост каллусной ткани с формирующимися меристематическими очагами (рис. 3C), к концу 6 месяца наблюдается регенерация побегов (рис. 3D). Прямого образования эмбриоидов из семяпочек в этом эксперименте у изучаемых гено-

Рис. 3. Развитие гинногенного растения от неопыленной семяпочки,введённой в культуру in vitroдо растения,высажен-ного в условия in vivo:
А -семяпочка огурца после введения в культуру in vitro,размер масштабной линейки 200 мкм;
B -семяпочка огурца на 30 день культивирования,размер масштабной линейки 500 мкм;
C - рост каллусной ткани,размер масштабной линейки 1 мм;
D -регенерация побегов;
E,F - развития полученного растения в условиях in vitro;
G - полученное гинногенное растения,высаженного в условия in vivo
Fig. 3. The developmentofgynogenic plantfrom untpollinated ovule introduced intoan in vitroculture toa plantplanted in vivo: Cucumberovule afterintroduction intothe culture in vitro (A),Bar= 200 μm; cucumberovule on the 30th dayofcultivation (B),Bar= 500 μm; callus tissue growth (С),Bar= 1 mm; regeneration ofshoots (D); developmentofthe resulting plant in vitro(E,F); obtained gynogenic plantplanted in vivo (G)
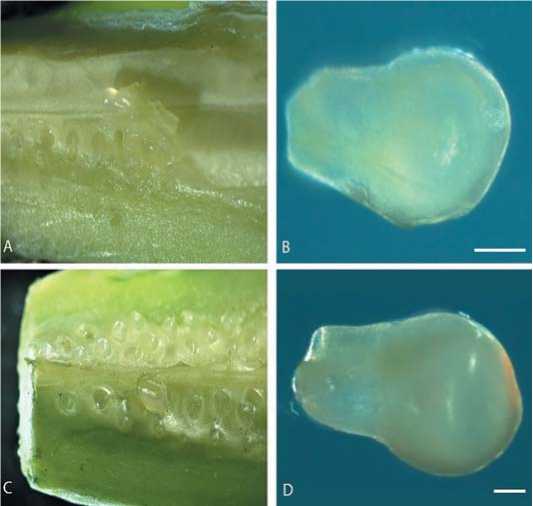
Рис. 4. Срезы завязи и семяпочки огурца разных фаз раскрытия цветка:
А) Срез завязи огурца полураскрытого цветка;
B) Семяпочка огурца из полураскрытого цветка,размер масштабной линейки 200 мкм;
С) Срез завязи огурца из раскрытого цветка;
D) Семяпочка огурца из завязи огурца раскрытого цветка, размер масштабной линейки 200 мкм
Fig. 4. Cucumberovaryand ovules slices on the differentphases offloweropening:
A) Cucumberovarycutfrom a half-opened flower;
B) Cucumberovule from a half-opened flower,Bar= 200 μm;
C) Cucumberovarycutfrom a tripled flower;
D) Cucumberovule from a tripled flower,Bar= 200 μm
типов не отмечали.Полученные растения пересаживали в культуральные сосуды и поддерживали в сосуде до достижения ими максимальной высоты, (рис. 3E, 3F). Спустя 8 месяцев проводился этап укоренения и полученные растения с хорошо развитой корневой системой переносили в условия in vivo (рис. 3G).
-
1.1. Влияние гелеобразующего агента в составе индукционной питательной среды на изменение площади введенных в культуру неопыленных семяпочек
В качестве характеристик,отражающих изменение размера семяпочек при культивировании на питательных средах с агар-агаром и Phytagel™, был рассчитан коэффициент увеличения площади семяпочек и скорость увлечения семяпочек (мм2/сут). Исходя из этих показателей,изменение площади семяпочек происходит по-разному (рис. 5).
На питательной среде, содержащей Phytagel™, в период от введения в культуру до 10 суток культивирования, средняя скорость увеличения семяпочек была быстрее на 0,06 мм2/сутки, чем на агар-агаре. Коэффициенты увеличения семяпочек между гелеобразующими агентами к 10 суткам отличались в 1,7 раз.
В следующие 10 суток культивирования тенденция осталась прежней, но скорость увеличения семяпочек на питательной среде, содержащей Phytagel™, стала выше на 16 2,5 % по сравнению с первыми 10 сутками культивирования. На агар-агаре скорость увеличения семяпочек была меньше на 10% , чем в прошлый период. Для Phytagel™ данная скорость увеличения семяпочек была самой высокой,за весь
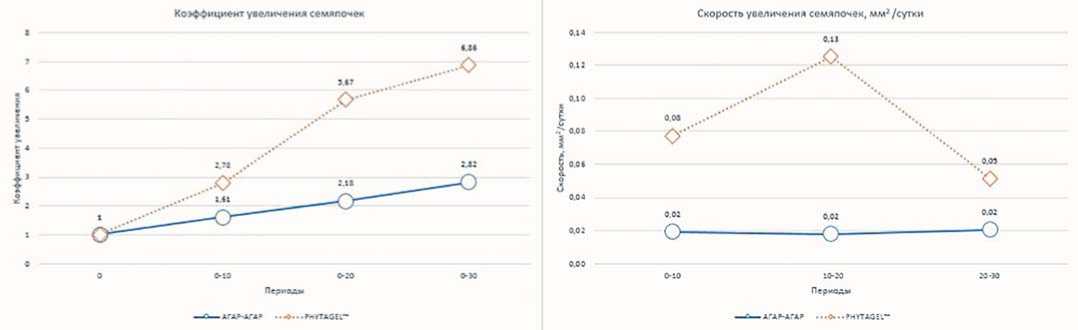
Рис. 5. Изменение площади семяпочек на питательных средах с разным типом гелеобразующего агента в течение 30 суток
Fig. 5. Changes in seed-buds area on nutrientmedia with differentgelling agentduring 30 days
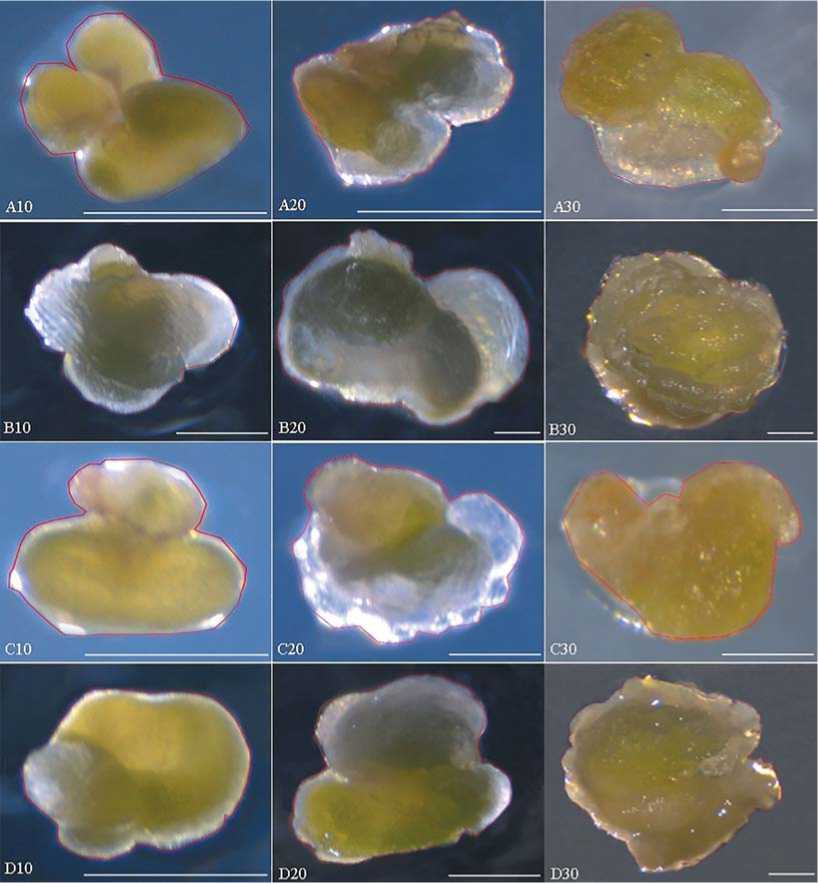
Рис. 6. Изменение размера введенных в культуру неопыленных семяпочек огурца при разном гелеобразующим агенте: А10-А30 - Семяпочки из завязи с полураскрытым цветком на 10,20,30 день на среде с агар-агар, размер масштабной линейки 500 мкм;
B10-B30 - Семяпочки из завязи с полураскрытым цветком на 10,20,30 день на среде с Phytagel™, размер масштабной линейки 500 мкм;
C10-C30 - Семяпочки из завязи с раскрытым цветком на 10,20,30 день на среде с агар-агар, размер масштабной линейки для С10; С30 - 500 мкм, для С20 – 200 мкм;
D10-D30 - Семяпочки из завязи с раскрытым цветком на 10,20,30 день на среде с Phytagel™ размер масштабной линейки для D10; D30 - 200 мкм, для D20 – 1 мм.
Fig. 6. The change of size of unpollinated ovules at the different gelling agent:
ovules with a half-opened flower on the 10 th , 20 th , 30 th day on medium with agar-agar (A10-A30), the size of a large-scale line of 500 microns; ovules with a semi-open flower on the 10 th , 20 th ,30 th day on a medium with Phytagel™ ( B10-B30), Bar = 500 µm; ovules with an open flower on the 10 th , 20 th , 30 th day on medium with agar-agar(C10-C30), for C10, C30 Bar =500 μm, for C20 Bar = 200 μm; ovules with an open flower on the 10 th , 20 th , 30 th day on medium with Phytagel™ (D10-D30), for D10; D30 Bar = 200 μm, for D20 Bar =1 mm.
период наблюдений.Коэффициент увеличения семяпочек на питательной среде, содержащей Phytagel™ был выше в 2,6 раз по сравнению, с питательной сре-дой,содержащей агар-агар в качестве гелеобразующего агента.
К 30 суткам коэффициенты увеличения семяпочек, культвируюшихся на разных гелеобразующих агентах отличались в 2,4 раза. Скорость увеличения семяпочек на агар-агаре увеличилась на 10% и равнялась скорости в период от дня введения семяпочек в культуру до 10 суток культивирования. На Phytagel™ скорость увеличения семяпочек стала ниже на 61,5% по сравнению с прошлым периодом. Для Phytagel™ данная скорость увеличения семяпочек была самой низкой, за весь период наблюдений. Средняя скорость увеличения семяпочек на средах с Phytagel™ составляла 0,08 мм2/сут, в то время как на среда с агар-агаром она была 0,02 мм2/сут.
Рисунок 6 наглядно отображает зависимость изменения коэффициента увеличения и скорости увеличения семяпочек для каждого типа гелеобразующего агента. Агар-агар позволяет развиваться семяпочкам прямолинейно и равномерно, а на Phytagel™ изменение происходит неравномерно,что возможно объясняется тем, что вода на Phytagel™ более доступна, чем на агаре, за счет чего и происходит более ускоренное увеличение семяпочек.
В результате двухфакторного дисперсионного ана-лиза,было определено,что генотип и тип гелеобразующего агента являются значимыми факторами, влияющими на увеличение площади введенных в культуру неопыленных семяпочек огурца. При этом доля влияния фактора А (гелеобразующего агента) составляет 55,01%, а доля влияния фактора B (генотипа) составляет 14,53%, но взаимодействия данных факторов между собой не значимо (табл. 1).
-
1.2.1. Влияние фазы раскрытия цветка и объёма культурального сосуда на изменение площади неопыленных семяпочек в зависимости от гелеобразующего агента в составе питательной среды
У генотипа №831 значимое отличие увеличения площади наблюдалось только на среде с агар-агаром для семяпочек, выделенных из завязи с полностью распустившимся цветком (FL) и культивирующихся в КС - №2 (рис. 7). Для остальных вариантов опыта, данное влияние отмечено не было,как на агар-агаре, так и на Phytagel™.
Для генотипа №58, совместное влияние данных факторов (объема культурального сосуда и стадии развития цветка) на изменение площади, не было отмечено,ни на одном из гелеобразующих агентов.
-
1.2.2. Влияние культурального сосуда в составе индукционной питательной среды на изменение площади введенных в культуру неопыленных семяпочек огурца
При изучении влияния культурального сосуда на изменение площади семяпочек, был рассчитан объем воздушной прослойки внутри сосуда после заполнения его плотной питательной средой. Для в культуральном сосуде – "КС №2" он составляет 140,14 см3, а для в культуральном сосуде – "КС №1" – 28,80 см3. Площадь занимаемой поверхности одной семяпочки в культуральном сосуде – "КС №2" составляет 110 мм2, а в культуральном сосуде – "КС №1" 102 мм2. За счет того, что воздушная прослойка в культуральном сосуде – "КС №2" больше на 487%, а занимая площадь отличается незначительно, то изменение роста и развития семяпочек в культуральном сосуде – "КС №2", должно происходить быстрее, за счет того,что концентрация этилена в культуральном сосуде – "КС №2" меньше, чем в культуральном
Таблица 1. Влияние различного гелеобразующего агента в составе индукционной питательной среды (фактор А), генотипа (фактор В) на площадь (мм2 ) введенных в культуру неопыленных семяпочек огурца in vitro (30 сутки культивирования) Table 1. The effects of different gelling agent in the composition of induction culture medium (Factor A), and genotype (Factor B) on the change in the area of unpollinated cucumber ovules introduced into culture in vitro
|
Гелеобразующий агент |
Генотип |
||
|
№831 |
№58 |
В среднем по фактору A (НСР 0,5 = 0,21) |
|
|
Phytagel™ |
3,07±0,03 |
2,88±0,03 |
2,98 |
|
Агар-агар |
0,93±0,05 |
0,85±0,02 |
0,88 |
|
В среднем по фактору В (НСР0,5 = 0,30) |
2,00 |
1,87 |
|
|
Доля влияния |
|||
|
Фактор А*** |
55,01% |
||
|
Фактор B*** |
14,53% |
||
|
Взаимодействие факторов АB NS |
1,97% |
||
Примечание: представленные значения являются средними для трех независимых экспериментов с тремя повторами внутри каждого опыта. Использовался двухфакторный дисперсионный анализ (ANOVA), а средние значения сравнивались с использованием t-критерий Стьюдента с вероятностью 95%.
-
* значимо на уровне 0.05, ** значимо на уровне 0.01, *** значимо на уровне 0.001, NS = не значимо
Note: The values presented are averages for three independent experiments with three replicates within each experiment. Within each genotype, ANOVA was used and average values were compared using Student's t-test with 95% probability. * - significant at 0.05; ** - significant at 0.01; *** - significant at 0.001, NS = not significant
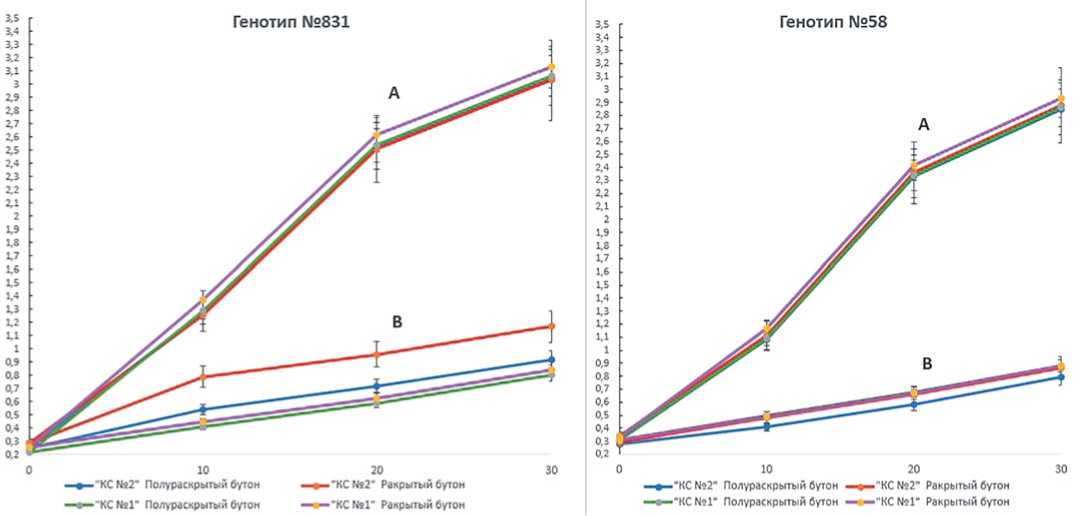
Рис.7. Влияние фазы раскрытия цветка и объема культурального сосуда на изменение площади (мм2) неопыленных семяпочек в зависимости от гелеобразующего агента в составе питательной среды:A) Phytagel™ B) Агар-агар
сосуде – "КС №1". Однако в культуральном сосуде – "КС №2", количество зеленых семяпочек огурца на 10 день после введения в культуру было меньше на 4%, чем в культуральном сосуде – "КС №1".
С помощью однофакторного дисперсионного ана-лиза,было показано,что для генотипа №831,объем культурального сосуда оказывает значимое влияние на изменение размеров семяпочек, а для генотипа №58 влияние данного фактора не подтвердилось (табл.2). Таким образом, в первые 30 дней культивирования, объём воздушной прослойки в культураль- ном сосуде и концентрация образующихся при культивировании неопыленных семяпочек огурца газообразных веществ в данном эксперименте не оказало значимого влияния на индукцию гиногенного развития.
Таблица 2. Влияние типа культурального сосуда на площадь неопылённых семяпочек (мм2) после 30 суток культивирования на питательной среде с агар-агаром
|
Фактор |
Площадь неопыленных семяпочек огурца, mm2 |
|
|
Генотип |
||
|
№831 |
№58 |
|
|
"КС №1" |
0,82±0,02a |
0,88±0,16a |
|
"КС №2" |
1,05±0,07b |
0,83±0,11a |
|
НСР 0,5 |
0,19 |
0,43 |
|
Значимость влияния |
F ф =75,20 F 05 = 4,30 F ф > F 05 |
F ф = 0,29 F 05 = 4,96 F ф < F 05 |
Примечание: представленные значения являются средними для трех независимых экспериментов с тремя повторами внутри каждого опыта ± SE (стандартная ошибка). Использовался однофакторный дисперсионный анализ (ANOVA), а средние значения сравнивались с использованием t-критерий Стьюдента с вероятностью 95%. Значения, отмеченные одинаковой буквой, не имели достоверных различий при p ≤ 0.05.
Note: The values presented are averages for three independent experiments with three replicates within each experiment ±SE (standard error). Within each genotype, one-way ANOVA was used and average values were compared using Student's t-test with 95% probability. Values marked with the same letter have no significant difference at p ≤ 0.05.
|
Фактор |
Генотип |
|
|
№831 |
№58 |
|
|
Полузакрытый цветок |
1,96±0,24b |
1,85±0,18a |
|
Раскрытый цветок |
2,04±0,24a |
1,89±0,27a |
|
НСР 0,5 |
0,7 |
1,09 |
|
Значимость влияния |
F ф =0,53; F 05 = 4,96 F ф < F 05 |
F ф =0,76; F 05 = 4,36 F ф < F 05 |
Примечание: представленные значения являются средними для трех независимых экспериментов с тремя повторами внутри каждого опыта ± SE (стандартная ошибка). Использовался однофакторный дисперсионный анализ (ANOVA), а средние значения сравнивались с использованием t-критерий Стьюдента с вероятностью 95%. Значения, отмеченные одинаковой буквой, не имели достоверных различий при p ≤ 0.05.
Note: The values presented are averages for three independent experiments with three replicates within each experimen ±SE (standard error). Within each genotype, one-way ANOVA was used and average values were compared using Student's t-test with 95% probability. Values marked with the same letter have no significant difference at p ≤ 0.05.
зрелый зародышевый мешок (семиклеточный). Данные стадии соответствует цветку,который распустится через 6 часов (9). В этот период бутон имеет полураспустившийся цветок, и желтую окраску вен-чика.В данном опыте использовали цветки,которые уже полностью распустились (FL), и полураспустив-шиеся (FL-1).
В данном опыте,влияние стадии развития цветка оказалось не значимым, что подтвердили результаты статистической обработки,как двухфакторным,так и однофакторным дисперсионным анализом (табл.3). Данные результаты, возможно связаны с тем, что размеры самих завязей,используемых в опыте,были близки, как между генотипами, так и между стадиями раскрытия цветка и возможно содержали семяпочки на практически одинаковых стадиях развития.Кроме того,ранее нами было показано,что размер завязи, из которых выделяются семяпочки оказывает существенное влияние на индукцию гиногенного развития [11].
Максимальное количество индуцированных семяпочек на питательной среде с Phytagel™ на 30 день культивирования отмечалось у генотипа №58 из полураскрытого цветка при культивировании в культуральном сосуде – "КС №2"– 60%, а минимальное количество было получено у генотипа №831 из раскрытого цветка также при культивировании в культуральном сосуде – "КС №2" – 42%.
При использовании питательной среды с агар-агаром максимальное количество зеленых семяпочек было получено у генотипа №831, из раскрытого цветка, который вводили в культуральный сосуд – "КС №1" – 67%, минимальное
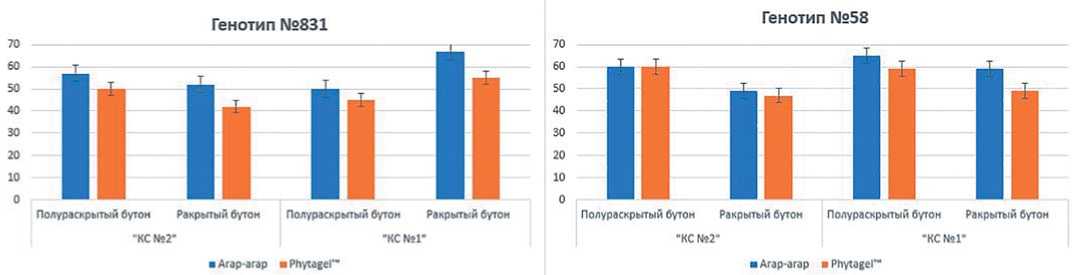
Рис. 8. Влияние фазы раскрытия цветка,объема культурального сосуда и генотипа на индукцию гиногенного развития в культуре неопыленных семяпочек (в %) в зависимости от использующегося гелеобразующего агента в составе питательной среды
Fig. 8. The effectoffloweropening phase,culture vesselvolume,and genotype on induction ofgynogenic developmentofunpollinated ovules depending on gelling agents in culture medium
количество было получено у генотипа №58 из раскрытого цветка, который вводили в культуральный сосуд – "КС №2" – 47%.
В исследовании, среднее значение индукции гиногенеза в культуре неопыленных семяпочек для двух генотипов составило 54%.
Заключение
На питательной среде, содержащей Phytagel™, в период от введения в культуру до 30 суток культивирования, средняя скорость увеличения семяпочек была быстрее чем на агар-агаре.Коэффициенты увеличения семяпочек между гелеобразующими агентами отличались от 1,7 до 2,6 раз.
Генотип и тип гелеобразующего агента являются значимыми факторами, влияющими на увеличение площади введенных в культуру неопыленных семяпочек огурца.При этом доля влияния гелеобразующего агента составляет 5 5 ,01% , а доля влияния генотипа составляет 14,53%.
У генотипа №831 значимое отличие увеличения площади наблюдалось только на среде с агар-агаром для семяпочек, выделенных из завязи с полностью распустившимся цветком (FL) и культивирующихся в "КС №2". Для остальных вариантов опыта и геноти-пов,данное влияние отмечено не было,как на агар-агаре, так и на Phytagel™.
Влияние стадии развития цветка оказалось не значимым, что подтвердили результаты статистической обработки,как двухфакторным,так и однофакторным дисперсионным анализом.
На питательной среде,где гелеобразующим агентом являлся агар-агар, количество индуцированных семяпочек огурца после введения в культуру было больше на 2-12% , по сравнению с питательной средой, где использовался Phytagel™, в зависимости от варианта опыта.
Максимальное количество индуцированных семяпочек на питательной среде с Phytagel™ на 30 день культивирования отмечалось у генотипа №58 из полураскрытого цветка при культивировании в культуральном сосуде – "КС №2" – 60%, а минимальное количество было получено у генотипа №831из раскрытого цветка также при культивировании в культуральном сосуде – "КС №2" – 42%.
При использовании питательной среды с агар-агаром максимальное количество зеленых семяпочек было получено у генотипа №831, из раскрытого цветка, который вводили в культуральный сосуд – "КС №1" – 67%, минимальное количество было получено у генотипа №58 из раскрытого цветка, который вводили в культуральный сосуд – "КС №2" – 47%.
В исследовании,среднее значение индукции гиногенеза в культуре неопыленных семяпочек для двух генотипов составило 54%.
Об авторе:
Aboutthe author:
Sergey N. Belov – Junior Researcher of Laboratory of Reproductive Biotechnology in Crop Breeding, ,
Список литературы Влияние различного гелеобразующего агента в составе питательной среды на индукцию гиногенного развития неопыленных семяпочек огурца (Cucumis sativus L.)
- Murashige T., Skoog F. A Revised Medium for Rapid Growth and Bio-Assays with Tobacco Tissue Cultures. Physiol Plant. 1962;15:437-97. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
- Gémes-Juhász A., Balogh P., Ferenczy A., Kristóf Z. Effect of Optimal Stage of Female Gametophyte and Heat Treatment on in Vitro Gynogenesis Induction in Cucumber (Cucumis sativus L.). Plant Cell Reports. 2002;21(2):105-111. https://doi.org/10.1007/s00299-002-0482-8
- Tantasawat P.A., Sorntip A., Pornbungkerd P. Effects of Exogenous Application of Plant Growth Regulators on Growth, Yield, and In Vitro Gynogenesis in Cucumber. HortScience. 2015;50(3):374-82. https://doi.org/10.21273/hortsci.50.3.374
- Tantasawat P.A., Sorntip A., Poolsawat O., Chaowiset W., Pornbungkerd P. Evaluation of Factors Affecting Embryo-like Structure and Callus Formation in Unpollinated Ovary Culture of Cucumber (Cucumis sativus). International Journal of Agriculture and Biology. 2015;17(3):613-8. https://doi.org/10.17957/ijab.17.3.14.257
- Grigolava T.R., Monakhos G.F., Monakhos S.G. Nutrient medium gelling agent effect on embryo- and callusogenesis in isolated ovules of red beet (Beta vulgaris L.). Izv Timirâzevsk s-h akad. 2021;(6):32-41. https://doi.org/10.26897/0021-342X-2021-6-32-41
- Li J.W., Si S.W., Cheng J.Y., Li J.X., Liu J.Q. Thidiazuron and Silver Nitrate Enhanced Gynogenesis of Unfertilized Ovule Cultures of Cucumis Sativus. Biologia Plantarum. 2013;57(1):164-8. https://doi.org/10.1007/s10535-012-0269-x
- Raldugina G.N., Sobolkova G.I. The Genotype Dependent Effect of Abscisic Acid on Callus Cultures of Brassica Napus L. Russ J Plant Physiol. 1994;41:702-6.
- Белов С.Н. Улучшенный способ введения в культуру in vitro неопыленных семяпочек огурца (Сucumis sativus L.). ФГБНУ ФИЦ ‘Всероссийский институт генетических ресурсов растений имени Н.И. Вавилова’; 2022. (В печати) [Belov SN. An improved method for introducing unpollinated cucumber ovules (Cucumis Sativus L.) into in vitro culture. Federal State Budgetary Institution Federal Research Center “N. I. Vavilov All-Russian Institute of Plant Genetic Resources”; 2022. (In press)
- Masuda K., Kikuta Y., Okazawa Y. Instructions for Use a Revision of the Medium for Somatic Embryogenesis in Carrot. Journal of the faculty of agriculture. 1981.
- Lichter R. Induction of Haploid Plants From Isolated Pollen of Brassica Napus. Zeitschrift für Pflanzenphysiologie. 1982;105(5):427-34. https://doi.org/10.1016/s0044-328x(82)80040-8
- Domblides E.A., Shmykova N.A., Belov S.N., Korottseva I.B., Soldatenko A.V. DH-plant production in culture of unpollinated ovules of cucumber (Cucumis sativus L.). Vegetable crops of Russia. 2019;(6):3-9. (In Russ.) https://doi.org/10.18619/2072-9146-2019-6-3-9


