Влияние редкоионизирующего излучения и химиопрепаратов на опухолевые стволовые клетки (SP) меланомы B16 и аденокарциномы молочной железы MCF-7
Бесплатный доступ
Существование опухолевых стволовых клеток (ОСК), резистентных к радиационному и химическому воздействию, является одной из возможных причин рецидивирования онкологических заболеваний. Поскольку закономерности изменения этой фракции клеток изучены недостаточно, целью данной работы стало исследование относительного и абсолютного количества ОСК после действия редкоионизирующего излучения и противоопухолевых препаратов на стабильные культуры клеток меланомы В16 и рака молочной железы MCF-7. ОСК идентифицировали с помощью метода side population (SP) по способности исключать флуоресцентный краситель Хёхст 33342. Установлена линейная зависимость доли клеток SP от дозы облучения (R=0,98 для линии В16 и R=0,96 для MCF-7). После радиационного воздействия происходило увеличение абсолютного количества клеток SP, максимально выраженное при дозах 5-10 Гр (в 3 и 5 раз в культурах B16 и MCF-7, соответственно, по сравнению с контролем р
Опухолевые стволовые клетки, редкоионизирующее излучение, меланома b16, рак молочной железы mcf-7
Короткий адрес: https://sciup.org/170170109
IDR: 170170109
Текст научной статьи Влияние редкоионизирующего излучения и химиопрепаратов на опухолевые стволовые клетки (SP) меланомы B16 и аденокарциномы молочной железы MCF-7
Риск возникновения рецидивов онкологических заболеваний после консервативного лечения во многом определяется сохранением фракции опухолевых клеток, резистентных к радиационному, химическому или комбинированному воздействию. Выяснение причин этой резистентности и поиск способов/средств её уменьшения остается актуальной задачей экспериментальной и клинической онкологии на протяжении многих лет. К широко известным причинам гетерогенности опухолевых клеток по чувствительности к противоопухолевым агентам относится генетическая нестабильность опухолевых клеток, в результате которой могут возникать разные по чувствительности клоны, различный уровень оксигенации в разных участках опухоли, изменения чувствительности в разных фазах клеточного цикла и т.д. В последнее время успешно развивается представление о том, что высокая радио- и химиорезистентность являются характерными свойствами опухолевых стволовых клеток (ОСК), составляющих небольшую фракцию в опухолях in vivo или в стабильных культурах опухолевых клеток in vitro . Выяснение закономерностей изменения этой фракции клеток после радиационного и химического воздействий представляет значительный интерес, т.к. составляет фундаментальную основу для дальнейшего совершенствования противоопухолевой терапии.
В настоящее время для выявления ОСК применяют два основных метода – иммунофено-типирование и функциональный тест, позволяющий оценивать эффективность исключения из клеток флуоресцентных красителей, таких как родамин-123 и Хёхст 33342 (Hoechst 33342 – Ho 342). ОСК (в отличие от остальных клеток) обладают способностью исключать указанные
красители вследствие высокой экспрессии на плазматической мембране соответствующих транспортёров, включая, прежде всего, различные белки АВС-семейства [3, 4, 7, 8, 16]. Благодаря этой способности ОСК могут быть выявлены с помощью проточной цитометрии т.н. боковая популяция (side population – SP). Учитывая широкое распространение этого термина в мировой литературе, в данной статье использована его английская аббревиатура, а для обозначения остальных клеток в культуре – общепринятый термин NSP (non SP). Для ряда злокачественных опухолей показано, что SP характеризуется высокой туморогенной активностью при трансплантации в организм иммунодефицитных мышей, способностью к самообновлению, дифференцировке и воспроизведению морфофункциональной гетерогенности опухоли [6, 11, 14], т.е. эта популяция обладает признаками ОСК согласно классическому определению Американской ассоциации раковых исследований [5].
Поэтому целью данной работы является исследование относительного и абсолютного количества клеток SP в сравнении с NSP после действия редкоионизирующего излучения и противоопухолевых препаратов в разных дозах на стабильные культуры клеток меланомы (линия В16) и рака молочной железы (линия MCF-7).
Материалы и методы
Культивирование клеток
Клетки меланомы мыши линии В16 и аденокарциномы молочной железы человека линии MCF-7 культивировали в питательной среде DMEM (ПанЭко, РФ), содержащей 10 % эмбриональной сыворотки крупного рогатого скота (Gibco, США), пенициллин (50 ед/мл), стрептомицин (50 мкг/мл) и глютамин (292 мкг/мл) в CO 2 -инкубаторе (NuAire, США) при температуре 37 ° С с 5 % содержанием CO 2 в пластиковых флаконах (SPL, Китай).
Изучение влияния у-излучения 60 Со на количество клеток SP и NSP в культурах меланомы В16 и рака молочной железы MCF-7
По достижении 30-40 % конфлюэнтности клетки подвергали воздействию у -излучения (60Со) на установке «Луч-1» (Россия) в дозах 1,0-20,0 Гр (мощность дозы 0,9 Гр/мин, средняя энергия 1,253 МэВ). Через 48 ч (в случае B16) или 72 ч (в случае MCF-7) после облучения, по достижении 95 % конфлюэнтности в контрольных флаконах, клетки снимали с подложки с помощью раствора Версена или трипсина (ПанЭко, РФ).
Далее определяли количество клеток в каждом флаконе с помощью камеры Горяева и проводили стандартное окрашивание с применением флуоресцентного красителя Ho 342 для определения доли клеток SP в культурах В16 и MCF-7, как подробно описано в работе Матчук О.Н. и др., 2012 [1]. Анализ образцов выполняли с помощью проточного цитофлуориметра FACS Vantage (BDIS, США), оборудованного двумя лазерами с длинами волн 364 нм и 488 нм. Флуоресценцию Ho 342 измеряли в синей (424±20 нм) и красной (675±20 нм) областях спектра (при Хвозб=364 нм), также регистрировали флуоресценцию йодистого пропидия (для исключения мёртвых и погибающих клеток) при длине волны 585±20 нм. Для контроля окрашивания использовали параллельные образцы клеток, инкубированных с Но 342 в присутствии верапамила – блокатора кальциевых каналов I класса, препятствующего выведению Ho 342 из клеток. Полученные данные обрабатывали с помощью программы CellQuestPro (BDIS, США). Регион SP выделяли графически для каждой исследуемой культуры отдельно (как показано на рис.1 и 2) таким образом, чтобы в контрольных образцах с верапамилом в этот регион попадало минимальное количество клеток. Вычисляли сначала относительное количество (процент) клеток SP и NSP, затем их абсолютное количество в каждом флаконе.
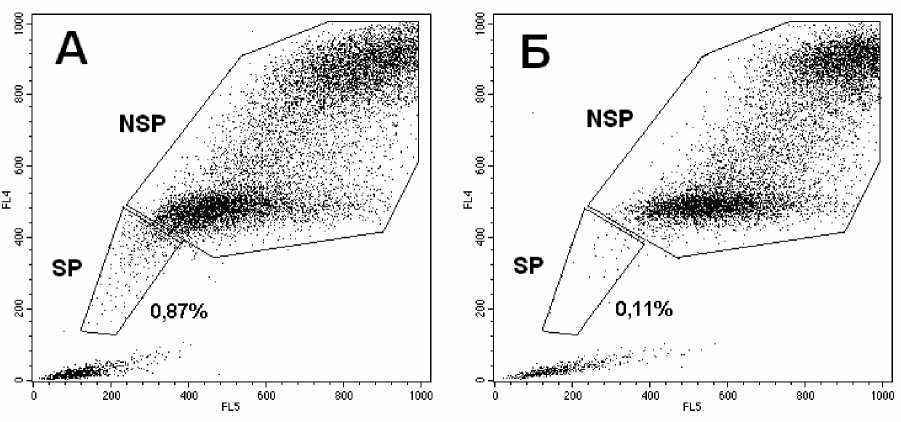
Рис . 1 . Графики распределения клеток линии В16 по интенсивности флуоресценции Но 342.
Приведены результаты одного из экспериментов: А – препарат клеток без инкубации с верапамилом; Б – препарат клеток после инкубации с верапамилом. Выделены регионы клеток SP и NSP; указана доля клеток SP; на каждом графике показано 30 тыс. клеток. По оси абсцисс (FL5) – интенсивность флуорес-
ценции в красной области (λ=675±20 нм). По оси ординат (FL4) – интенсивность флуоресценции в синей
области (λ=424±20 нм).
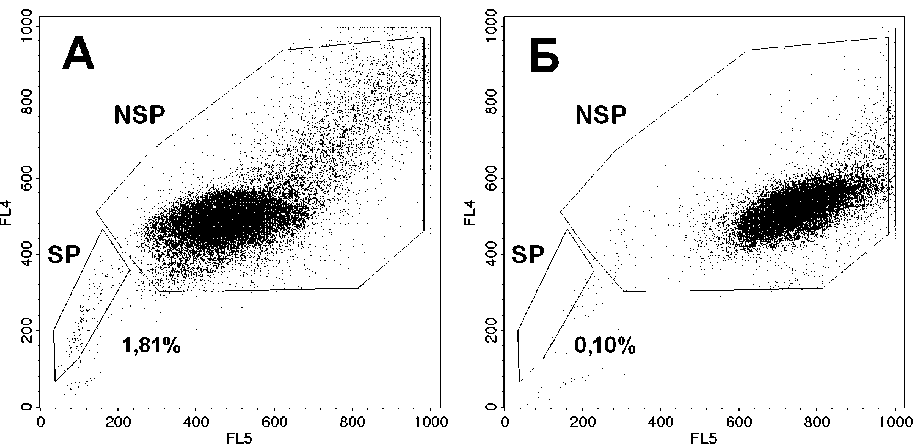
Рис . 2. Графики распределения клеток линии MCF-7 по интенсивности флуоресценции Но 342. Приведены результаты одного из типичных экспериментов: А – препарат клеток без инкубации с верапамилом; Б – препарат клеток после инкубации с верапамилом. Выделены регионы клеток SP и NSP; указана доля клеток SP; на каждом графике показано 30 тыс. клеток. По оси абсцисс (FL5) – интенсивность флуоресценции в красной области (λ=675±20 нм). По оси ординат (FL4) – интенсивность флуоресценции в синей области (λ=424±20 нм).
Воздействие химиопрепаратов на клеточные культуры B16 и MCF-7
По достижении 40-50 % конфлюэнтности клеток В16 и MCF-7 во флаконы добавляли метотрексат (ОАО «ВЕРОФАРМ», РФ) в конечных концентрациях 1,0 или 5,0 мкг/мл или цисплатин (ОАО «ВЕРОФАРМ», РФ) в конечных концентрациях 2,5 или 12,5 мкг/мл. Минимальная концентрация препаратов соответствовала стандартной лекарственной дозе (в соответствии с инструкцией по использованию препаратов). Время инкубации составляло 48 часов, после чего клетки снимали со дна флакона и определяли их количество с помощью камеры Горяева. Полученную суспензию клеток инкубировали с Но 342 для определения SP (как описано выше). Затем анализировали относительное и абсолютное количество клеток SP и NSP в пробах с разной концентрацией указанных химиопрепаратов.
Статистическую обработку результатов проводили с использованием программ «Origin 6.0» (Microcal Software, Inc.) и «Statistica 6.0» (StatSoft., Inc.).
Результаты и обсуждение
Доля клеток SP в интактных культурах линий В16 и MCF-7 составляла в среднем ( ± se) 0,90( ± 0,04) % и 1,81( ± 0,04) %, соответственно, что подтверждает данные литературы [2, 15].
Влияние γ- излучения на изучаемые популяции опухолевых клеток
Дозовые зависимости уменьшения абсолютного количества клеток NSP после γ -облучения показаны на рис. 3. Общее число клеток, подавляющее большинство которых составляет NSP, уменьшается аналогичным образом (данные не показаны). По этому критерию клетки линии В16 демонстрируют более высокую радиочувствительность по сравнению с таковой культуры MCF-7. Наблюдаемые различия, по крайней мере, частично, могут быть объяснены различной скоростью пролиферации клеток исследуемых линий, поскольку для В16 время удвоения числа клеток составляет около 16 часов, для MCF-7 – 25 часов. В соответствии с классическими радиобиологическими представлениями можно полагать, что указанные выше различия являются следствием более высокой радиочувствительности быстро пролиферирующих клеток.
После облучения доля клеток SP возрастает пропорционально дозе и в той, и в другой культуре, причём сильнее в более радиорезистентной MCF-7 (рис. 4). Эти результаты, свидетельствующие об относительно высокой радиорезистентности SP по сравнению с NSP в культурах опухолевых клеток, согласуются с данными литературы [9, 13]. Можно предположить, что обнаруженное увеличение доли клеток SP в изучаемых культурах связано как с избирательным уменьшением основной популяции (NSP), так и с увеличением абсолютного количества самих клеток SP. Для оценки вклада второго фактора был выполнен расчёт абсолютного количества клеток SP в контроле и после облучения (рис. 5). Зарегистрировано статистически значимое увеличение абсолютного количества клеток SP при дозах 5 Гр и выше по сравнению с контролем (p<0,05 по критерию Манна-Уитни). Этот показатель достигал максимальной величины при дозах 5-10 Гр, затем несколько снижался (статистически незначимо). Механизмы наблюдаемого увеличения количества клеток SP пока не изучены, но можно предположить, что они могут быть связаны как с низкой гибелью SP при облучении (даже в высоких дозах), так и с увеличением их пролиферативной активности и/или дедифференцировкой (переходом клеток из основной популяции, выжившей после облучения, в SP). В пользу предположения о возможной взаимосвязи наблюдаемого увеличения количества клеток SP со стимуляцией процессов их пролиферации косвенно свидетельствуют данные о корреляции экспрессии АВС-транспортёров на клеточной поверхности с активностью ряда протеинкиназ, регулирующих клеточную пролиферацию [10, 12]. Предположение о дедифференцировке клеток NSP под действием радиации требует дальнейшего изучения.
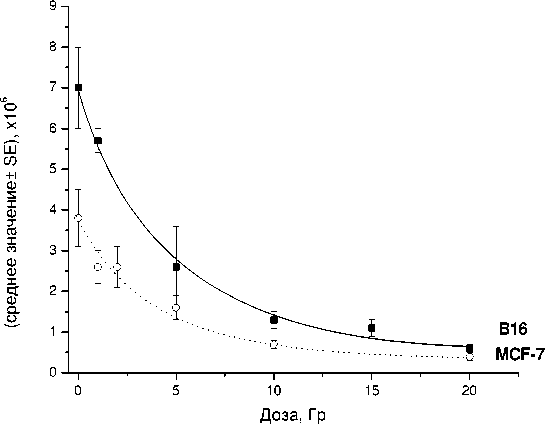
Рис . 3. Уменьшение абсолютного количества клеток NSP в зависимости от дозы радиационного воздействия на изучаемые культуры линий В16 и MCF-7.
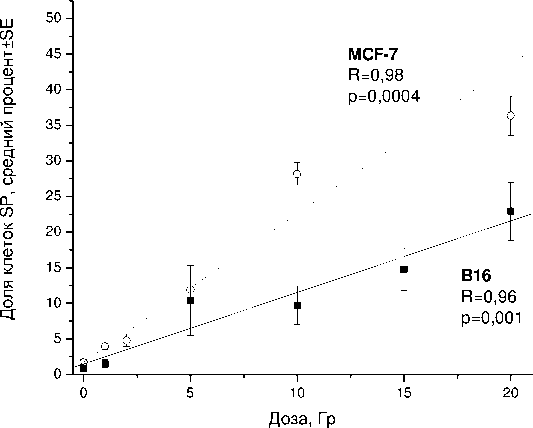
Рис . 4. Зависимость относительного количества клеток SP в культурах B16 и MCF-7 от дозы радиационного воздействия.
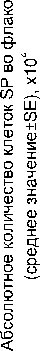
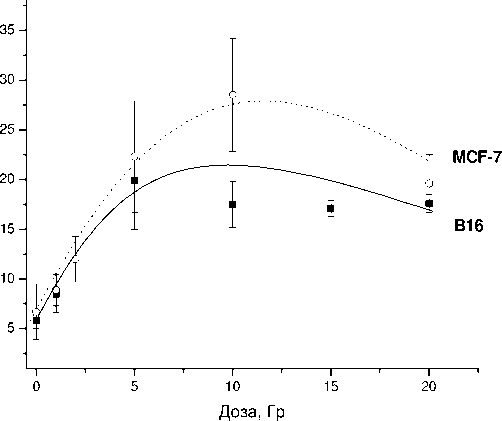
Рис . 5. Абсолютное количество клеток SP, выявленных после радиационного воздействия в разных дозах на культуры линий B16 и MCF-7.
Эффекты действия химиопрепаратов на изучаемые популяции клеток линий B16 и MCF-7
Как и при облучении, инкубация с метотрексатом приводила к уменьшению общего количества клеток и клеток NSP (рис. 6), а также к увеличению доли клеток SP в обеих линиях (рис. 7). Для сопоставления эффектов, наблюдаемых в разных линиях, абсолютное количество клеток было отнормировано по контрольному уровню, принятому за 100 % в каждой клеточной культуре. В культуре линии В16 уменьшение абсолютного числа клеток NSP под действием метотрексата было выражено сильнее, чем таковое в культуре линии MCF-7 (как и в случае радиационного воздействия). При этом доля клеток SP сильнее возрастала в более резистентной культуре MCF-7, а увеличение дозы препарата не приводило к снижению эффекта в этой клеточной культуре. В то же время в культуре В16 5-кратное увеличение дозы метотрексата приводило к снижению доли SP (по сравнению с однократной концентрацией), хотя значимое различие по сравнению с контролем всё равно сохранялось.
Как и в случае радиационного воздействия, значительный интерес представляла оценка абсолютного количества клеток SP после инкубации с метотрексатом (рис. 8). Увеличение этого показателя зарегистрировано только в культуре клеток MCF-7, в то время как в культуре линии B16 отмечено уменьшение абсолютного количества клеток SP (статистически значимое при использовании метотрексата в 5-кратной дозе) по сравнению с интактным контролем.
В работе исследовано действие другого химиопрепарата (цисплатина) на культуру клеток MCF-7, которая является более резистентной по изученным показателям, чем культура B16. Установлено значительное уменьшение абсолютного количества клеток NSP под влиянием цисплатина в концентрациях 2,5 мкг/мл и 12,5 мкг/мл в 2,3 и 17,9 раз, соответственно, по сравнению с контролем (p<0,01 по критерию Манна-Уитни). При этом хотя и происходило увеличе- ние доли клеток SP по сравнению с контролем (р<0,01 по критерию Манна-Уитни), абсолютное количество SP значимо не изменялось, а при использовании препарата в более высокой дозе даже отмечена тенденция к уменьшению абсолютного количества SP по сравнению с контролем примерно в 2 раза (р=0,010 по критерию Манна-Уитни). Полученные результаты свидетельствуют о более высокой эффективности действия цисплатина, чем метотрексата на клетки линии MCF-7, включая как NSP, так и SP.
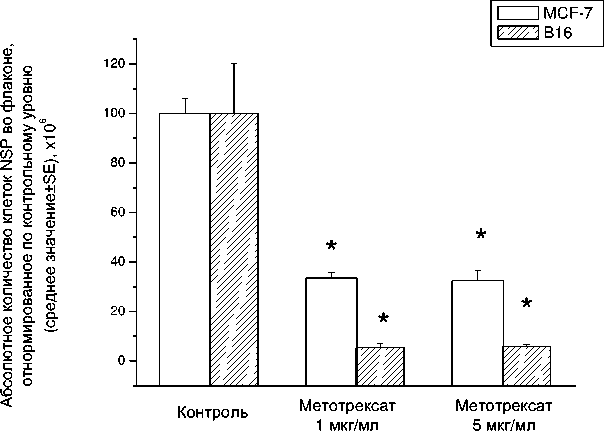
Рис. 6. Уменьшение абсолютного количества клеток NSP под действием метотрексата в разных дозах.
* – р<0,05 по критерию Манна-Уитни по сравнению с интактным контролем, принятым за 100 %.
Рис . 7. Доля клеток SP после инкубации изучаемых культур с метотрексатом. * – р<0,01 по критерию Манна-Уитни по сравнению с соответствующим контролем.
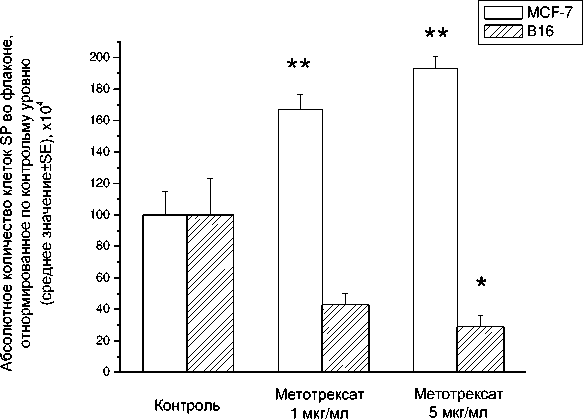
Рис . 8. Абсолютное количество клеток SP после инкубации изучаемых культур с метотрексатом в разных дозах.
* – р<0,05 по критерию Манна-Уитни по сравнению с интактным контролем, принятым за 100 %.
** – р<0,01 по критерию Манна-Уитни по сравнению с интактным контролем, принятым за 100 %.
Заключение
Полученные результаты доказывают более высокую резистентность клеток SP изучаемых культур к действию редкоионизирующего излучения и химиопрепаратов по сравнению с основной массой опухолевых клеток, составляющих NSP. Существенно, что после радиационного воздействия наблюдается повышение не только относительного, но и абсолютного количества клеток SP в обеих исследованных линиях по сравнению с контролем. Механизмы этого явления, имеющего важное научно-практическое значение, пока не выяснены. Клетки линии MCF-7 более резистентны к радиационному и химическому воздействию, чем клетки линии В16 по критерию уменьшения их общего количества и размера NSP. При этом увеличение количества клеток SP после облучения и воздействия метотрексата также выражено лучше в культуре MCF-7. Регистрируемые изменения в популяционном составе опухолевых клеток являются интегральным показателем целого ряда процессов: клеточной гибели, задержки деления в первые сутки после облучения, пролиферации в последующее время, возможной дедифференцировки клеток и т.д. Выяснение роли каждого из них представляет значительный интерес и требует дальнейших исследований.
Список литературы Влияние редкоионизирующего излучения и химиопрепаратов на опухолевые стволовые клетки (SP) меланомы B16 и аденокарциномы молочной железы MCF-7
- Матчук О. Н., Замулаева И. А., Селиванова Е. И. и др. Чувствительность клеток SP линии меланомы В16 к действию редко-и плотноионизирующего излучений//Радиац. биология. Радиоэкология. 2012. Т.52, № 3. С. 261-267.
- Britton K.M., Eyre R., Harvey I.J. et al. Breast cancer, side population cells and ABCG2 expression//Cancer Lett. 2012. V. 323, № 1. P. 97-105.
- Chen K.J., Valencia J.C., Gillet J. et al. Involvement of ABC transporters in melanogenesis and the development of multidrug resistance of melanoma//Pigment Cell Melanoma Res. 2009. V. 22, № 6. P. 740-749.
- Choi C.H. ABC transporters as multidrug resistance mechanisms and the development of chemosensitizers for their reversal//Cancer Cell Int. 2005. V. 4. Р. 5-30.
- Clarke M.F., Dick J.E., Dirks J.E. et al. Cancer stem cells-perspectives on current status and future directions: AACR Workshop on cancer stem cells//Cancer Res. 2006. V. 66, № 19. P. 9339-9344.
- Feuring-Buske M., Hogge D.E. Hoechst 33342 efflux identifies a subpopulation of cytogenetically normal CD34(+)CD38(-) progenitor cells from patients with acute myeloid leukemia//Blood. 2001. V. 97, № 12. P. 3882-3889.
- Gottesman M.M., Fojo T., Bates S.E. Multidrug resistance in cancer: role of ATP-dependent transporters//Nat. Rev. Cancer. 2002. V. 2. Р. 48-58.
- Hirschmann-Jax C., Foster A.E., Wulf G.G. et al. A distinct "side population" of cells with high drug efflux capacity in human tumor cells//Proc. Natl. Acad. Sci. USA. 2004. V. 101. Р. 14228-14233.
- López J., Poitevin A., Mendoza-Martínez V. et al. Cancer-initiating cells derived from established cervical cell lines exhibit stem-cell markers and increased radioresistance//BMC Cancer. 2012. V. 12, N 48 DOI: 10.1186/1471-2407-12-48
- Mogi M., Yang J., Lambert J.F. et al. Akt signaling regulates side population cell phenotype via Bcrp1 translocation//J. Biol. Chem. 2003. V. 278. P. 39068-39075.
- Moserle L., Ghisi M., Amadory A., Indraccolo S. Side population and cancer stem cells: therapeutic implications//Cancer Letters. 2010. V. 288. P. 1-9.
- Takada T., Suzuki H., Gotoh Y., Sugiyama Y. Regulation of the cell surface expression of human BCRP/ABCG2 by the phosphorylation state of Akt in polarized cells//Drug. Metab. Dispos. 2005. V. 33. P. 905-909.
- Woodward W.A., Chen M.S., Behbod F. et al. WNT/β-catenin mediates radiation resistance of mouse mammary progenitor cells//Proc. Natl. Acad. Sci U S A. 2007. V. 104, N 2. P. 618-623.
- Wu C., Wei Q., Utomo V. et al. Side population cells isolated from mesenchymal neoplasms have tumor initiating potential//Cancer Res. 2007. V. 67, N 17. P. 8216-8222.
- Zhong Y., Guan K., Zhou C. et al. Cancer stem cells sustaining the growth of mouse melanoma are not rare//Cancer Lett. 2010. V. 292, N 1. P. 17-23.
- Zhou S., Schuetz J.D., Bunting K.D. et al. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype//Nat. Med. 2001. V. 7. Р. 1028-1034.


