Влияние rhodococcus-биосурфактантов на фитотоксичность ионов свинца
Автор: Литвиненко Л.В., Тищенко А.Т.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Изучено влияние различных концентраций ионов свинца на прорастание семян сельскохозяй-ственных культур растений: вики полевой, горчицы белой и овса посевного в присутствии Rhodoccocus-биосурфактантов. Выявлена прямая зависимость между присутствием Rhodoc-cocus-биосурфактантов и повышением всхожести семян, роста корней и побегов проростков растений-аккумуляторов тяжелых металлов.
Rhodococcus-биосурфактанты, тяжелые металлы, вика полевая, горчица белая, овес посевной
Короткий адрес: https://sciup.org/147204814
IDR: 147204814 | УДК: 579.66+58.04+58.02
Текст научной статьи Влияние rhodococcus-биосурфактантов на фитотоксичность ионов свинца
Загрязнение окружающей среды тяжелыми металлами (ТМ) является одним из самых распространенных и экологически опасных для живых организмов и их сообществ. Основными источниками загрязнения ТМ являются предприятия, которые специализируются на добыче и переработке руды металлов. нефтепродуктов, а также синтезе химических веществ. Металлы, в отличие от органических соединений, нс подвергаются процессам биодеградации; они перераспределяются между компонентами природной среды, оседают в почве или грутпах. и, в конечном итоге, по трофическим цепям передаются высшим животным и человеку.
Многие виды растений способны накапливать тяжелые металлы, причем содержание ионов ТМ в органах растений может в десятки и даже согни раз превышать их содержание в окружающей среде. Способность растений накапливать ТМ реализуется на разных уровнях организации: клеточном, тканевом и органном, что связано, прежде всего, со способностью растений накапливать металлы в клеточных оболочках и вакуолях, а также с существованием барьерных тканей, ограничивающих передвижение ряда тяжелых металлов.
По способности к аккумуляции тяжелых металлов выделяют три группы растений: (1) индифферентные растения, которые не накапливают ТМ в органах; (2) растения-исключатели, которые обладают способностью поглощать ТМ корневой системой. но не передают их в побеги: (3) растения-аккумуляторы, которые в больших количествах накапливают ТМ в тканях надземных органов [Титов и др.. 2007: Иванова, Шарф. 2011], Так. например, свинец подавляет аккумуляцию и передвижение по тканям корневой системы и побегов растений жизненно необходимых ионов Fe_+, FeJ+, Са2+, Мп2". Мп3+, Мп^+ и 2щ+, нарушая процессы их связывания с металлохелатирующими соединениями [Линдиман и др.. 2010], Свинец, в отличие от некоторых других металлов при незначительных концентрациях практически не проникает в листья [Яковншина, 2014], вызывая быстрое закрывание устьиц. Таким образом, свинец снижает транспирацию, ограничивает поступление СО; в листья и, следовательно, уменьшает интенсивность фотосинтеза, при этом барьером для ионов РЬ2" выступают эпидерма и кутикула. В то же время в условиях сильного загрязнения через листовые пластинки в ткани растения может попадать до
(С Литвиненко Л. В., Тищенко А. Т, 2017
50% свинца. содержащегося в атмосферном воздухе [Пугаев. 2013].
Существующие способы очистки почвы от ТМ базируются в основном на использовании физикохимических приемов, которые нс обеспечивают полноты удаления ионов ТМ. Более цивилизованные методы предполагают использование биологических способов очистки, таких как биовыщелачивание с помощью сурфактантов биогенного происхождения [Костина, Куюкина. Ившина. 2009], а также методов фиторемедиации [Андреева. Байбеков. Злобина. 2009]. Однако каждый из данных методов по отдельности малоэффективен при очистке почвы. Так, например, методы фиторемедиации при высоком уровне загрязнения почвы ТМ (уровень загрязнения кратностью > 100 ПДК) не используются в связи с гибелью растений [Коротченко, Львова. 2015], тогда как использование исключительно биосурфактантов также неэффективно из-за невозможности выведения десорбированных мобилизованных форм тяжелых металлов из почвы [Mulligan, Wang, 2006].
Б настоящее время в Индии и Китае активно разрабатываются комбинированные и экологически безопасные технологии очистки почвы от ТМ. основанные на использовании методов фиторемедиации и биосурфакгантов.
Цель работы - оценка влияния различных концентраций ионов свинца на прорастание семян вики полевой, горчицы белой и овса посевного в присутствии Rhodoccoctt 5-биосурфакгантов.
Материалы и методы
В сравнительных исследованиях изучали влияние йА^^ососс^л-биосурфактантов (в концентрациях 2.0; 4.0 и 8.0 г/л воды) на фитотоксичность нитрата свинца (Pb(NO3)2) в отношении всхожести семян растений: овса посевного (Лу^^ saliva L ), горчицы белой (Sinapis alba L) и вики полевой tyicia saliva L.). Уровень фитотоксичности определяли в соответствии СО стандартными Методическими рекомендациями МР 2.1.7.2297-07 «Обоснование класса опасности отходов производства и потребления по фитотоксичности (Фитотсст)» (МР 2. L7.2297-07, 2007). Условия проращивания: подсветка белыми люминесцентными лампами, спектр которых максимально приближен к дневному' свету: температура 23-25°С: pH = 6.3-6.5. Как видно из табл. 1, нитрат свинца добавляли из расчета кратности уровня предельно-допустимой концентрации (ПДК) ионов РЬ + с учетом фона по Кларк (ГН 2.1.7.2041-06. 2006). В качестве контроля использовали дистиллированную воду.
В работе использовали штамм актинобактерий Rhodococcus ruber ИЭГМ 231, хранящийся в Региональной профилированной коллекции алкано-трофных микроорганизмов (ИЭГМ, No. 768 во Всемирной федерации коллекций культур;
реестровый номер УНУ гГ. ni/usu/73559). Бактериальную культуру выращивали в среде RS (Rhodococcus Surfactant) на орбитальном шейкере в течение 7 сут. (160 об/мин, 28°С). Состав среды RS (г/л): Na2HPO4 - 2.0; КН2РО4 - 2.0: KNO3 - L0; (NH.)2SO4 - 2.0; NaCl -1.0; MgSO4x7H2O - 0.2; СаСЬх2Н2О - 0.02; РсС13х7Н2О - 0.01. В качестве единственного источника углерода и энергии использовали н-додекан (С]2К либо н-гексадекан (С1б) в концентрации 3 об. %. В качестве источника витаминов и фактора роста добавляли раствор микроэлементов по Пфеннигу — 1.0 мл/л и 10%-ный дрожжевой экстракт - 1.0 мл/л [Ivshina et al., 1998]. Неочищенные Я/ю£/<эсоссм5-биосурфактантные комплексы гликолипидной природы, продуцируемые родококками, получали методом [Kuyukina et al., 2001]. В тексте статьи для условного обозначения Rhodococc ^.у-биосурфактантов, продуцируем ых родококками в жидкой минеральной среде с и-додеканом, нами использован термин R Ао^срссш-биосурфактанты С ] 2; для Rhot /ососсг/.у-биосурфактантов, продуцируем ых родококками в среде с н-гексадеканом, -/?/ю^£г)ссг/.у-бносурфактанты С16.
Таблица 1
Соотношение ПДК с концентрациями ионов свинца
|
Уровень ПДК |
Концентрация (мг/кг почвы) Pbi+ с учетом фона по Кларк |
|
1 ПДК |
32.0 |
|
10 ПДК |
320.0 |
|
50 ПДК |
1600.0 |
|
100 ПДК |
8000.0 |
|
200 ПДК |
16000.0 |
Статистическую обработку результатов проводили стандартными методами с вычислением среднего арифметического, стандартной ошибки, среднеквадратичного отклонения и доверительного интервала с помощью пакета компьютерных программ Microsoft Excel 2007 (Microsoft Inc., 2007). Все эксперименты проводили в 3-кратной повторности.
Результаты и их обсуждение
Исследовано влияние спектра концентраций нитрата свинца на устойчивость и прорастание семян растений-фитоаккумуляторов в присутствии водных растворов АЛо^/огосс^у-бносурфактантов, продуцируемых при выращивании родококков в среде с я-додеканом и н -гексадеканом. В результате проведенных исследований установлено, что по степени устойчивости семян к ионам РЬ" изученные растения можно распределить в ряд: Ягеля saliva L. > Sinapis albaL. > Vida saliva L.
Результаты по исследованию влияния ионов Pb2+ на длину побегов и корневой системы овса, горчицы и вики в присутствии Rhodococcus-бисур- фактантов С] з представлены в табл. 2. Наиболее интенсивное прорастание корневой системы и побегов выявлены у овса посевного. Семена данного растения прорастали при всех используемых в ра боте концентрациях ТМ+ и в подавляющем большинстве случаев энергия их прорастания была выше, чем у семян горчицы и вики.
Таблица 2
Влияние свинца на всхожесть побегов и корневой системы (мм) овса, горчицы и вики в присутствии Яй^ссш5-биосур фактантов Сц
|
Варианты экс-перименга |
Овёс посевной |
1 орчица белая |
Вика полевая |
|||
|
Длина побега |
Длина корня |
Длина побега |
Длина корня |
Длина побега |
Длина корня |
|
|
Контроль |
49Л83 |
40.815.2 |
25.219.9 |
22.514.8 |
27.316.0 |
19319.8 |
|
РЬ2+ 1 ПДК |
443124 5 |
21.21103 |
20.715.0 |
14.616.8 |
23.214.6 |
— |
|
РЬ2^ 10 ПДК |
29,418,0 |
20.919.9 |
19.716.3 |
9.213.9 |
11.И3.9 |
- |
|
РЬ2^ 50 ПДК |
28,019,1 |
10.213.2 |
13.718.5 |
11.414.6 |
||
|
РЬ2^ 100 ПДК |
14314,4 |
5.712.7 |
— |
— |
11313.8 |
— |
|
РЬ2+ 200 ПДК |
4,312,3 |
— |
— |
— |
— |
— |
|
Б/нт 2 г/л |
55.7114.4 |
48.4193 |
32.218.7 |
31.713.0 |
30.812.6 |
18.213.0 |
|
Б/пт 4 г/л |
67415,7 |
53,016,1 |
39.716.7 |
37.013.8 |
32.5И.8 |
19313.4 |
|
Б/нт 8 г/л |
45.115.2 |
35.113.2 |
24.615.0 |
26.218.0 |
27.012.0 |
12.313.4 |
|
1 ПДК / 2 г/л |
56.5177 |
46.513.3 |
29.513.9 |
28315 8 |
29.016.2 |
83И.4 |
|
1 ИДК/4 г/л |
64.816.6 |
51.817.8 |
37.112.5 |
32.815.7 |
31.312.4 |
9312.1 |
|
1 ПДК / 8 г/л |
44.614.1 |
41.813.5 |
27.716.1 |
23.113.0 |
26.217.5 |
6.110.4 |
|
10 ПДК/2 г/л |
40.9179 |
23.914.2 |
20.914.9 |
14.И9.1 |
20.714.1 |
2.1Ю.4 |
|
10 ПДК/4 г/л |
48.916.6 |
24.312.6 |
22.016.8 |
16.712.1 |
20.013.6 |
8.110.6 |
|
10 ПДК/8 г/л |
53.819.0 |
25.U4.2 |
19.715.0 |
14.313.4 |
19.014.2 |
— |
|
50 ПДК/2 г/л |
38.313.6 |
18.214.6 |
20.615.5 |
13.5178 |
19.011.6 |
- |
|
50 ПДК/4 г/л |
46.014.1 |
21.713.7 |
20.013.1 |
13312.1 |
22.011.4 |
3.110.6 |
|
50 ПДК / 8 г/л |
33.412.2 |
15.012.8 |
12.217.0 |
3.5Ю.1 |
20312.7 |
— |
|
100 ПДК/2 г/л |
24.715.7 |
7.9140 |
16.314.3 |
— |
||
|
1(10 ПДК/4 г/л |
28.016.6 |
9.214.2 |
8.211.4 |
— |
18.011.0 |
— |
|
100 ПДК/8 г/л |
31.615.0 |
6.512.1 |
— |
— |
14.013.7 |
— |
|
200 ПДК / 2 г/л |
29.213.4 |
8.814.8 |
— |
— |
12.814.2 |
— |
|
200 ПДК/ 4 г/л |
21.214.4 |
73133 |
— |
— |
15.613.8 |
— |
|
200 ПДК / 8 г/л |
25.713.3 |
7314.2 |
— |
13.512.8 |
— |
|
Примените, В разделе «Варианты эксперимента)) представлены используемые в работе растворы в виде концентрации ионов свинца / jR/w/(Xz>ccw^^ (ПДК / г/л).
Следует отметить полное ингибирование прорастания корневой системы у вики полевой в присутствии ионов свинца. Данная закономерность наблюдалось при всех используемых в работе концентрациях ТМ. Прорастание корневой системы семян вики полевой выявлено только в серии контрольных экспериментов и в присутствии препарата /5/гос7сосс1?5-бисурфактантов С12 в концентрации 2.0 и 4.0 г/л. Подавление прорастания семян горчицы отмечено нами при использовании нитрата свинца в концентрациях 100 и 200 ПДК.
Аналогичная тенденция наблюдалась нами при проведении экспериментов по изучению влияния ионов РЬ2^ на длину побегов и корневой системы овса, горчицы и вики в присутствии препарата /ЭДо^соссы^-бисурфакгантов С16. В табл. 3 приведены результаты измерений длины побегов и корневой системы растений овса, горчицы и вики, при прорастании их семян в водных растворах соли ТМ и препарата /^Ло^Лэ^эсс/^-бисуффактантов, полученного при культивировании родококков на н- гексадекане.
Таблица 3
Влияние с винца на всхожесть побегов и корневой системы (мм) овса, горчицы и вики в присутствии Я/г/^с^ссил-биосурфактантов Ci6
|
Варианты эксперимента |
Овёс посевной |
Горчица белая |
Вика полевая |
|||
|
Длина побега |
Длина корня |
Длина побега |
Длина корня |
Длина побега |
Длина корня |
|
|
Б/нт 2 г/л |
39.5126.0 |
41.81213 |
3031114 |
33.6126.3 |
29.212.8 |
|
|
Б/нт 4 г/л |
51.9И93 |
3531183 |
27.918.7 |
33,8120.1 |
31.811.7 |
- |
|
Б/нт 8 г/л |
23.517.0 |
23.9113.6 |
20317.4 |
40.2129.7 |
30.811.8 |
— |
|
1 ПДК / 2 г/л |
51.2126.2 |
52.7120.3 |
24.0И0.6 |
20,41171 |
34.3И.5 |
- |
|
1 ПДК/4 г/л |
47.3117.7 |
51.4116.2 |
22314.6 |
28.0110.9 |
29.812.5 |
|
|
1 ПДК / 8 г/л |
34.6118.7 |
45.5121.8 |
20.416.2 |
16.0111.0 |
27.4И.6 |
— |
|
10 ПДК/2 г/л |
496126.8 |
23.9112.6 |
23.018.0 |
12014.2 |
27314.1 |
- |
Окончание табл. 3
|
Варианты экспериме!гга |
Овёс посевной |
Горчила белая |
Вика полевая |
|||
|
Длина побега |
Длина корня |
Длина побега |
Длина корня |
Длина побега |
Длина корня |
|
|
10 ПДК / 4 г/л |
65.7±25.4 |
41,6±15.6 |
21.3±3.7 |
15.1 ±6.4 |
29.6±3.4 |
— |
|
10 ПДК / 8 г/л |
54.3±28.6 |
23.3±6.8 |
19.5±6.2 |
9.3±5.5 |
26.2±2.1 |
— |
|
50 ПДК / 2 г/л |
43.9±19.2 |
15.6±5.8 |
18.7±3.5 |
4.2-2.1 |
18.6^2.5 |
— |
|
50 ПДК / 4 г/л |
41.5±20.9 |
16.3±4.0 |
16.0±2.4 |
5.1 : 1.4 |
23.3±4.2 |
— |
|
50 ПДК / 8 г/л |
53.8^21.0 |
13.2±5.2 |
14.9±2.6 |
— |
21.7±3.3 |
— |
|
100 ПДК / 2 г/л |
31.2±14.2 |
8.2±3.0 |
— |
— |
19.0±2.4 |
— |
|
100 ПДК / 4 г/л |
34.7±15.8 |
6.7±1.8 |
— |
— |
15.2±1.6 |
— |
|
100 ПДК/8 г/л |
26.6±8.1 |
7.Н3.6 |
— |
— |
18.4±1.4 |
— |
|
200 ПДК / 2 г/л |
12.2±7.6 |
— |
— |
— |
11.2±0.6 |
— |
|
200 ПДК/ 4 г/л |
14.8±8.8 |
8.3±4.7 |
— |
— |
8.6±1.2 |
— |
|
200 ПДК / 8 г/л |
14.9±8.5 |
3.0±0.7 |
— |
— |
— |
— |
Примечание. В разделе «Варианты эксперимента» представлены используемые в работе растворы в виде концентрации ионов свинца / /^(х/ососси^-биосурфакгангов (ПДК / г/л).
Как видно на рис. 1. наиболее высокая степень всхожести (100%) семян овса выявлена в присутствии ионов свинца в концентрации 1 ПДК, самый низкий уровень всхожести семян (64%) отмечен нами в условиях обработки овса посевного раствором ТМ в концентрации 100 ПДК. Можно отметить. что прорастание семян овса в условиях содержания ТМ в концентрациях 10 и 50 ПДК отличаются друг от друга на 2%.
■ Кол-во проросших семян
ИНН
Вода 1 10 50 100 200
Концентрация свинца (ПДК)
Рис. 1. Всхожесть семян Avena saliva в присутствии ионов свинца (ПДК. мг/кг почвы)
Как видно на рис. 2, всхожесть семян овса в растворах с нитратом свинца выше после обработки их препаратом ЛАо^огогги^-биосурфактантов, продуцированных родококками на //-гексадекане, по сравнению с обработкой Rhodococxus-биосур-фактантами С12. При добавлении Rhodococcus-биосурфактантов Ci6 в концентрации 2.0 г/л всхожесть семян овса выше на 26%. тогда как при концентрации препарата биосурфактантов Cie 4.0 г/л семена овса прорастают в 6.5 раз более интенсивно по сравнению с вариантом эксперимента при обработке семян Я/ю/й^^сда-биосурфактантами С12. Всхожесть семян овса в среднем на 24% выше в присутствии /^Ло^соссмх-биосурфактантов (8.0 г/л), продуцируемых родококками на н-гекса-декане. по сравнению с его всхожестью в присутствии биосурфактантов, продуцируемых на //-додекане.
Суммарное количество проросших семян овса в присутствии ионов ТМ и Rhodococcus -биосурфактантов. продуцированных родококками на //-додекане, выше в 1.2—2.7 раз, по сравнению с вариантами эксперимента с использованием растворов свинца и биосурфактантов, продуцированных в среде с н-гексадеканом (рис. 2).
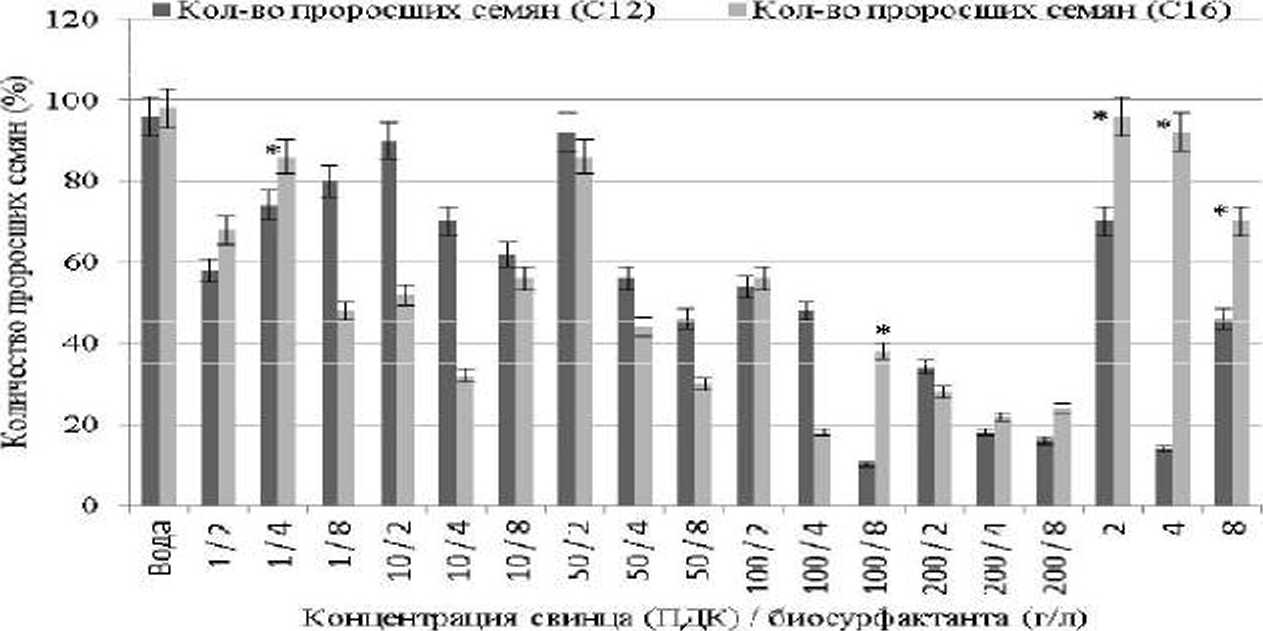
Рис. 2. Всхожесть семян Avena saliva в присутствии ионов свинщ и биосурфактантов (ПДК, мг/кг почвы / г/л).
*Статистически достоверно (р < 0,05) от /^/tidbcoccz/5-6nocyp(])a^ С12; С12 -№х/бхчл7с//5-биосурфактаэт^ продуцируемые на //-додекане; Сю -/^za/ococcz/5-биооурфактангы, продуцируемые на //-гексадекане
Как видно на рис. 3, наиболее высокий уровень всхожести (60%) семян горчицы выявлен нами при прорастании их в присутствии ионов свинца в концентрации 1 ПДК. Всхожесть семян горчицы в присутствии ионов свинца в концентрациях 10 и 50 ПДК отличается между собой на 2%. При более высоких концентрациях свинца прорастание семян горчицы нами не выявлено.
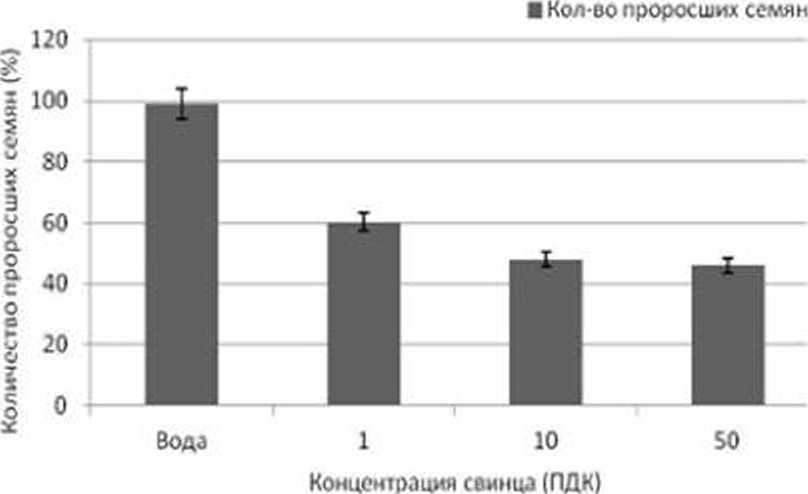
Рис. 3. Всхожесть семян Sinapis alba в присутствии ионов свинца (ПДК, мг/кг почвы)
Как видно на рис. 4, количество проросших семян при обработке их Rhodococcus-биосурфак- тантом Cie выше на 6%. чем Rhodococcus-бт- сурфактантом С12 при концентрации препаратов 2.0 г/л. Однако при обработке семян горчицы биосурфактантами, продуцированными на //-додекане.
всхожесть семян в 1.3-1.5 раз выше, чем на н- гексадекане при использовании растворов в концентрации 4.0 и 8.0 г/л. Как видно из рис. 4. всхожесть семян горчицы в 1.5-7.2 раз лучше при обработке их /?//о^ос(?ссг/5-биосурфактантами С16, по сравнению с прорастанием семян после обработки их /tAodbeocci/5-биосурфактантами С] 2. При концентрации свинца выше 100 ПДК всхожесть семян горчицы нами нс выявлена. Всхожесть семян вики полевой в присутствии нитрата свинца в концентрации 50 ПДК в 1.6 раз более интенсивна, по сравнению с таковой при концентрации ТМ 10 ПДК и в 2.6 раз выше по сравнению с прорастанием семян вики в присутствии ТМ в концентрации 200 ПДК (рис 5).
Как видно на рис. 6. всхожесть семян вики полевой при обработке их препаратом Rhodococcus- биосурфактантов С12 в 1.6-3.0 раза выше по сравнению с всхожестью семян после обработки их растворами /?/?(><7ососсм5-биосурфактантов Cie. Исключение из данной тенденции составили варианты эксперимента с концентрацией нитрата свинца 10 ПДК. Следует отметить, что в варианте эксперимента с обработкой семян препаратами био-сурфактантов в концентрации 4.0 г/л в присутствии ТМ в концентрации 1 ПДК прорастания семян вики нами не выявлено.
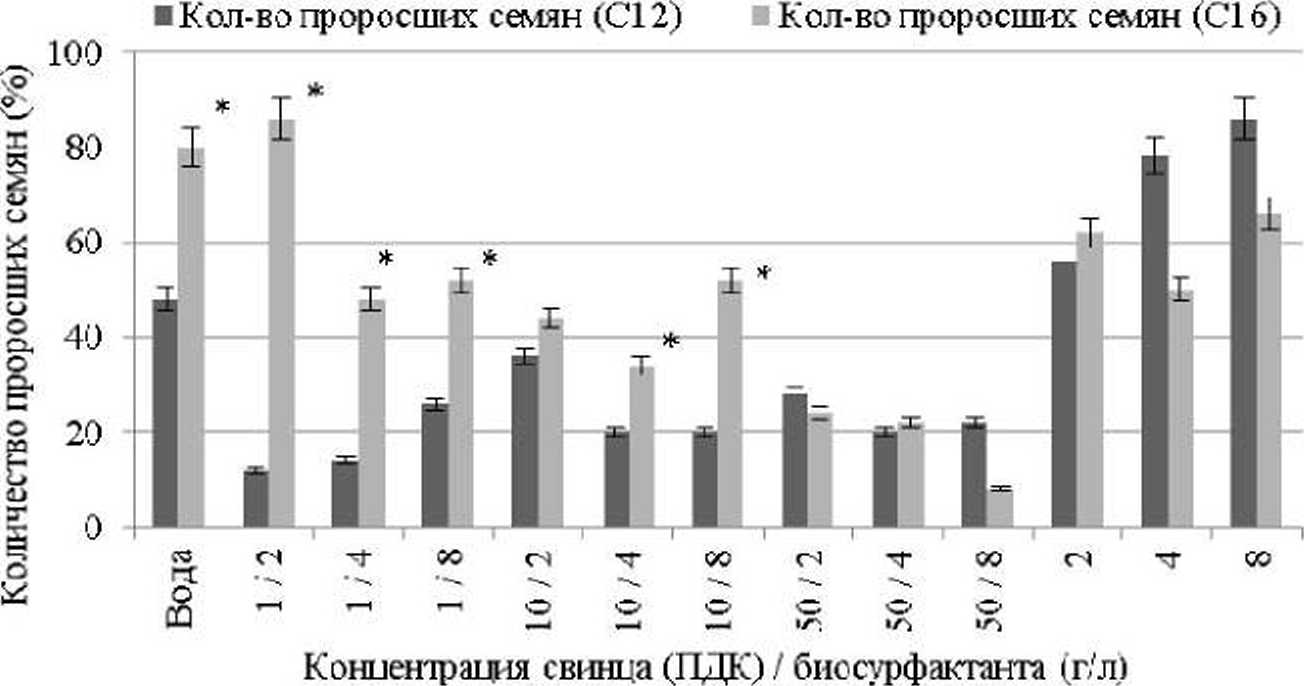
Рис. 4. Всхожесть семян Sinapis alba в присутствии ионов свинца и биосурфактантов (ПДК, мг/кг почвы / г/л).
продуцируемые на //-додекане; Ci6-7^<%fcxv>ceHS-6nocy^ продуцируемые на н-гексадекане
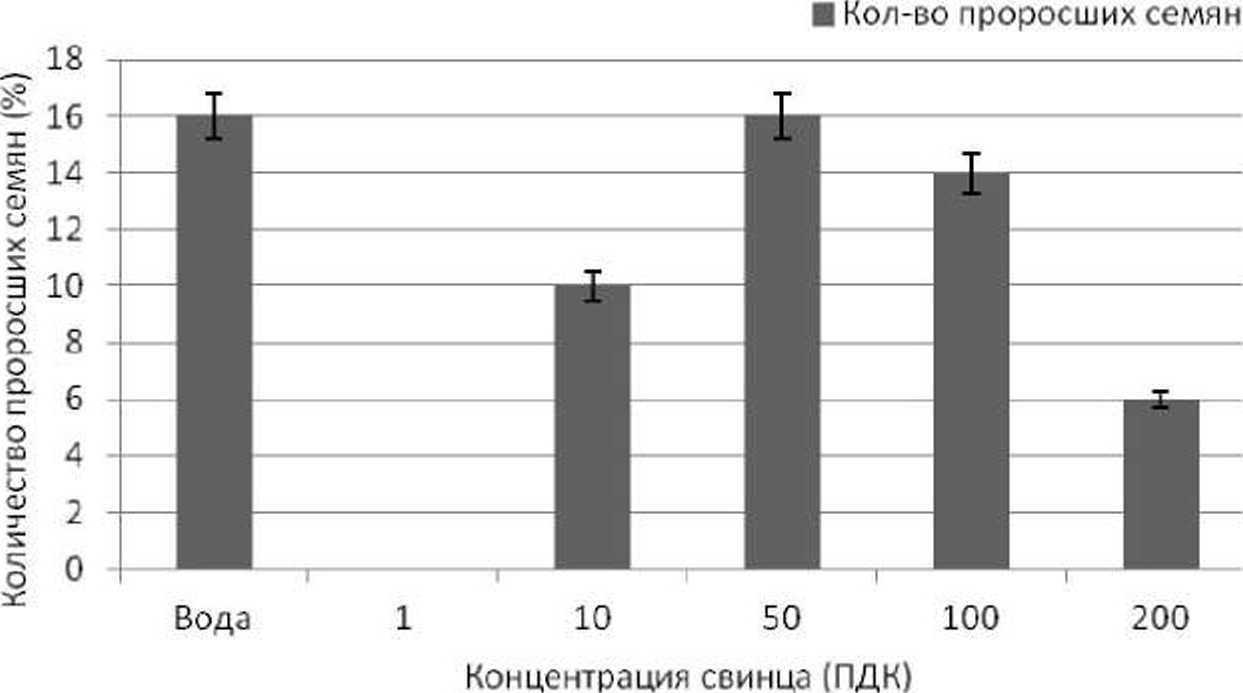
Рис. 5. Всхожесть семян Vieta saliva в присутствии ионов свинца (ПДК. мг/кг почвы)
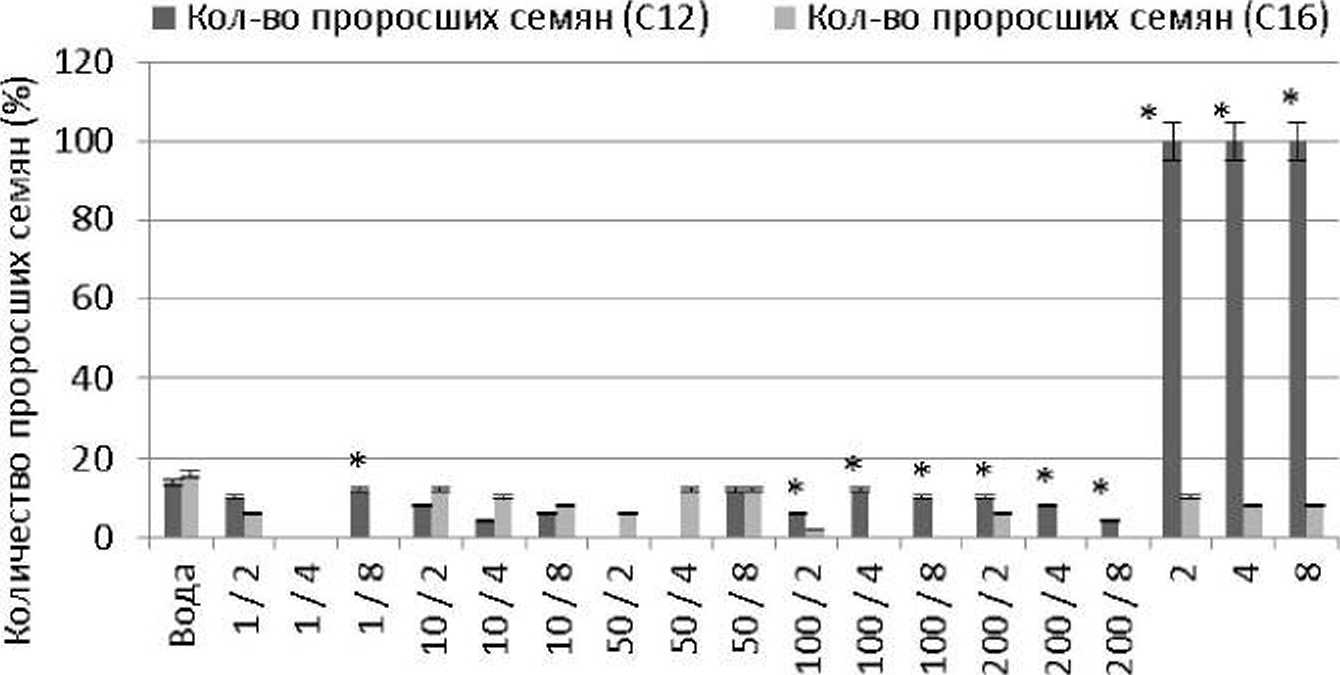
Концентрация свинца (ПДК) / биосурфакганта (г/л)
Рис. 6. Всхожесть семян Vicia saliva в присутствии ионов свинца и биосурфактантов (ПДК, мг/кг почвы / г/л).
♦Статистически достоверно (р < 0,05) аг /^к)^<х^ем$-биосурфак^ Ci£ С12 -/^?о^бХ'<%с7/5-биосурфак1'аты, продуцируемые на //-додекане; С|б-/Укх/(Эгосп/$-био^^ продуцируемые на //-гексадекане
Заключение
Таким образом, в результате проведенных исследований нами установлено, что наиболее устойчивым растением к действию ионов РЬ24 является овес посевной, менее устойчивы семена вики полевой. Уровень прорастания семян овса колебался от 10 до 92% в зависимости от концентрации ионов свинца. Следует отметить, что побеги и корневая система семян овса при добавлении Rhodoccocus- биосурфактантов с л-гексадеканом. были длиннее на 6.9 и 5.3 см. соответственно, по сравнению с таковым при изучении фитотоксичности ионов РЬ2 в присутствии ЛЛог/оссосд/л-биосурфактантов с н- додеканом. Семена горчицы и вики при концентрации ионов РЬ2 50 ПДК и выше не прорастали.
Ионы РЬ‘ во всех вариантах эксперимента ингибировали прорастание корневой системы у вики полевой, тогда как количество проросших побегов не превышало 12%.
Исследования поддержаны Российским Научным Фондом (14-14-00643) и грантом Комплексной программы УрО РАН (15-12-4-10).
Список литературы Влияние rhodococcus-биосурфактантов на фитотоксичность ионов свинца
- Андреева И.В., Байбеков Р.Ф., Злобина М.В. Фиторемедиация почв, загрязненных тяжелыми металлами//Природообустройство. 2009. № 5. С. 5-10
- ГН 2.1.7.2041-06. Почва, очистка населенных мест, отходы производства и потребления, санитарная охрана почвы. Предельно допустимые концентрации (ПДК) химических веществ в почве . 2006. URL: http://www.gosthelp.ru/text/GN217204106 Predelnodopust.html
- Иванова Н.А., Шарф Н.А. Особенности поглощения и миграции тяжелых металлов в органах растений в условиях Среднего Приобья//Вестник Нижневартовского государственного университета. Сер. Биология. 2011. № 2. С. 3-5
- Коротченко И.С., Львова В.А. Миграция кадмия и никеля в растениях-фиторемедиантах//Международный журнал прикладных и фундаментальных исследований. 2015. № 11 (ч. 2). С. 251-254
- Костина Л.В., Куюкина М.С., Ившина И.Б. Методы очистки загрязненных тяжелыми металлами почв с использованием (био)сурфактантов (Обзор)//Вестник Пермского университета. 2009. Вып. 10. Биология. № 36. С. 95-110
- Линдиман А.В. и др. Применение янтарной кислоты в процессе фитоэкстракции свинца и кадмия из загрязненных почв//Вестник МИТХТ. 2010. Т. 5, № 5. С. 102-107
- МР 2.1.7.2297-07. Обоснование класса опасности отходов производства и потребления по фитотоксичности . 2007. URL: http://www.ohranatruda.ru/ot_biblio/normativ/dat a_normativ/52/52957/
- Пугаев С.В. Содержание свинца, меди и марганца в компонентах антропогенно-измененных биогеоценозов//Российский научный мир. 2013. № 1. С. 43-49
- Титов А.Ф. и др. Устойчивость растений к тяжелым металлам. Петрозаводск: Изд-во Карельского научного центра РАН, 2007. С. 169
- Яковишина Т.Ф. Фиторемедиационная способность сельскохозяйственных культур к загрязнению почвы тяжелыми металлами//Естественные и математические науки в современном мире. 2014. № 22. С. 1-5
- Ivshina I.B. et al. Oil desorption from mineral and organic materials using biosurfactant complexes produced by Rhodococcus species//World Journal of Microbiology and Biotechnology. 1998. Vol. 14. P. 711-717
- Kuyukina M.S. et al. Recovery of Rhodococcus biosurfactants using methyl-tertiary butyl ether extraction//J. Microbiol. Meth. 2001. Vol. 46. P. 149-156
- Mulligan C.N., Wang S. Remediation of a heavy metal-contaminated soil by a rhamnolipid foam//Engineering Geology. 2006. Vol. 85. P. 75-81


