Влияние селективной стимуляции правого желудочка на электрическую и механическую диссинхронию миокарда
Автор: Комлев А.Е., Шитов В.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 (52), 2021 года.
Бесплатный доступ
Актуальность. Длительная верхушечная стимуляция правого желудочка может приводить к развитию межжелудочковой и внутрижелудочковой диссинхронии. Селективная (альтернативная) стимуляция различных отделов межжелудочковой перегородки за счет более физиологичного распространения волны возбуждения позволяет предотвратить ухудшение механической функции миокарда, ассоциированное с постоянной электрокардиостимуляцией.Цель: изучить динамику показателей электрической и механической желудочковой диссинхронии при традиционной (верхушечной) и альтернативной с установкой правожелудочкового электрода в межжелудочковую перегородку или выходной тракт правого желудочка у пациентов с постоянной электрокардиостимуляцией в раннем и отдаленном послеоперационном периоде.Материалы и методы. В исследование были включены 73 пациента (средний возраст 61,0 ± 2,5 года) с показаниями к постоянной электрокардиостимуляции без признаков сердечной недостаточности выше 2 ФК по NYHA и перенесенного Q-образующего инфаркта миокарда. Пациентам 1-й группы (n = 39) стимулирующий желудочковый электрод имплантирован в средний отдел межжелудочковой перегородки (подгруппа 1А, n = 25) или в выходной тракт правого желудочка (подгруппа 1Б, n = 14). В контрольную 2 группу включили 34 пациента с имплантацией электрода в верхушку правого желудочка.Результаты. Время предызгнания из правого и левого желудочка до и после имплантации не отличалось в 1-й группе и достоверно различалось во 2-й группе (25 ± 3 мс и 50 ± 6 мс, р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Постоянная электрокардиостимуляция, верхушечная стимуляция правого желудочка, селективная стимуляция, межжелудочковая диссинхрония
Короткий адрес: https://sciup.org/143177467
IDR: 143177467 | УДК: 616.124.3:615.844.3 | DOI: 10.20340/vmi-rvz.2021.4.CLIN.4
Текст научной статьи Влияние селективной стимуляции правого желудочка на электрическую и механическую диссинхронию миокарда
Известно, что длительная верхушечная стимуляция правого желудочка (ПЖ) приводит к нарушениям систолической и диастолической функции левого желудочка (ЛЖ) [1–3]. Аномальное распространение фронта деполяризации, которое при верхушечной стимуляции соответствует ходу возбуждения при блокаде левой ножке пучка Гиса, приводит к электрической, а затем и механической межжелудочковой диссинхронии, то есть в изменении нормальной последовательности и временных характеристик фаз сокращения миокарда обоих желудочков. Разность между электромеханической задержкой (время между началом комплекса QRS и началом изгнания крови) для ПЖ и ЛЖ отражает межже- лудочковую диссинхронию. В норме при допплеровском исследовании транспульмонального и трансаортального потоков различие между началом сокращения ПЖ и ЛЖ не превышает 40 мс [4]. Методом тканевой миокардиальной допплерографии и двумерного анализ миокардиального стрэйна при верхушечной стимуляции ПЖ доказано также развитие внутрижелудочковой диссинхронии ЛЖ, которая определяется величиной задержки в механической активации между сегментами межжелудочковой перегородки (МЖП) и задне-боковой стенки ЛЖ [5, 6].
Влияние как межжелудочковой, так и внутрижелудочковой диссинхронии при постоянной правожелудочковой ЭКС с течением времени приводит к снижению фракции выброса ЛЖ [7, 8]. Негативные эффекты правожелудочковой стимуляции особенно неблагоприятно отражаются на прогнозе пациентов с исходно имеющейся систолической сердечной недостаточностью [3].
Селективная стимуляция различных отделов МЖП за счет более физиологичного распространения волны возбуждения позволяет предотвратить ухудшение механической функции миокарда, ассоциированное с постоянной ЭКС [9, 10]. В большинстве исследований продемонстрированы преимущества неверхушечной стимуляции ПЖ, однако нет однозначного мнения о выборе оптимальной позиции стимулирующей головки электрода (различные отделы МЖП, выходной тракт ПЖ) [11, 12]. Также отсутствует единое мнение о надежности использования продолжительности стимулированного комплекса QRS как критерия выбора оптимальной позиции правожелудочкового эндокардиального электрода с точки зрения физиологичности возбуждения и сокращения миокарда [13]. Соответственно, возрастает число исследований, в которых авторы с помощью эхокардиографических технологий оценивают влияние различных вариантов альтернативной правожелудочковой стимуляции на показатели межжелудочковой и внутрижелудоч- ковой диссинхронии и ремоделирования ЛЖ [14, 15].
Таким образом, поиск, оценка эффективности и целесообразности имплантации электродов в межжелудочковую перегородку и выходной тракт ПЖ является актуальной проблемой на современном этапе развития электрокардиостимуляции.
Цель исследования : изучить динамику показателей электрической и механической желудочковой диссинхронии при традиционной (верхушечной) и альтернативной стимуляции ПЖ с установкой правожелудочкового электрода в МЖП и выходном тракте ПЖ у пациентов с постоянной ЭКС в раннем и отдаленном послеоперационном периоде.
Материалы и методы
В исследование включили 73 пациента (средний возраст 61,0 ± 2,5 года, 39 мужчин, 32 женщины) с показаниями к постоянной ЭКС, страдающих ишемической болезнью сердца (ИБС) и/или артериальной гипертензией, без признаков сердечной недостаточности выше 2 ФК по NYHA и перенесенного Q-образующего инфаркта миокарда. Пациенты были разделены на три группы. Пациентам 1-й группы (n = 39) стимулирующий желудочковый электрод имплантировали в средний отдел МЖП (подгруппа 1А, n = 25) или в выходной тракт ПЖ (подгруппа 1Б, n = 14). В контрольную 2-ю группу включили 34 пациента с имплантацией электрода в верхушку ПЖ. Средний процент стимуляции у пациентов обеих групп составил более 80 %.
Критерии включения: атриовентрикулярная блокада 2-й степени типа Мобитц-2 или полная атриовентрикулярная блокада и предполагаемый высокий процент стимуляции ПЖ (не менее 70 %).
Критерии исключения: исходная длительность комплекса QRS более 120 мс; острый инфаркт миокарда; нестабильная стенокардия; перенесенный трансмуральный инфаркт миокарда левого желудочка;
патология клапанного аппарата сердца, требующая хирургического лечения; фракция выброса левого желудочка (ФВ) менее 35 %; хроническая сердечная недостаточность 3–4 ФК на момент включения в исследование; беременность, лактация.
ЭКГ в 12 отведениях и комплексное эхокардиографическое исследование с использованием тканевой миокардиальной допплерографии проводили до операции, перед выпиской из стационара и через два года после имплантации.
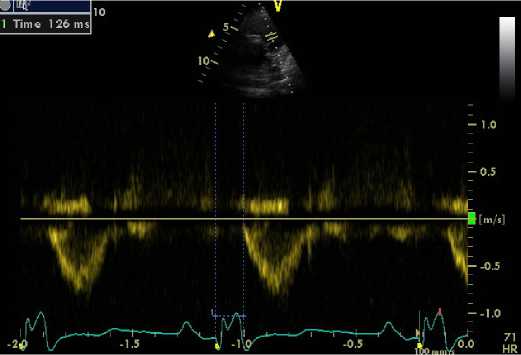
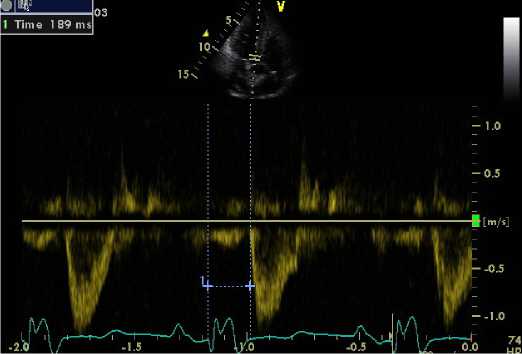
В качестве критерия межжелудочковой диссинхронии методом традиционной допплерографии использовали величину разности времени предызгнания между ЛЖ и ПЖ [(Q – Ao) – (Q – Pa)] > 40 мс (рис. 1).
При тканевой миокардиальной допплерографии критерием межжелудочковой диссинхронии считали задержку систолического сокращения на уровне базальных сегментов ПЖ и МЖП/задней стенки ЛЖ > 40 мс (рис. 2). В качестве критерия внутрижелудочковой диссинхронии ЛЖ принимали время задержки систолического сокращения между базальными сегментами МЖП и боковой стенки ЛЖ > 60 мс.
Интраоперационно при поиске точки стимуляции при имплантации желудочкового электрода в группах 1 и 2 ориентировались на минимально возможную продолжительность комплекса QRS.
А
Б
Рис. 1. Допплеровское ЭхоКГ-исследование при стимуляции верхушки ПЖ: A. Оценка времени предыз-гнания из ПЖ. Б. Оценка времени предызгнания из ЛЖ
Fig. 1. Doppler echocardiography with RV apex stimulation A. Estimation of pre-expulsion time from the RV:
A. Estimate of pre-fire time from RV. B. Estimation of pre-expulsion time from LV
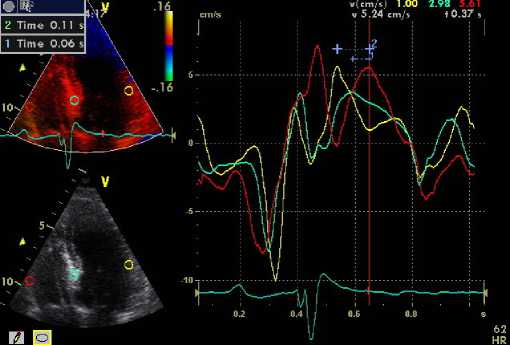
Рис. 2. Метод тканевой миокардиальной допплерографии в оценке межжелудочковой дисинхронии
Fig. 2. The method of tissue myocardial Doppler in the assessment of interventricular dysynchrony
Результаты исследования
При сравнении параметров электрической межжелудочковой диссинхронии в раннем послеоперационном периоде время активации желудочков в группе альтернативной стимуляции оказалось достоверно меньше, чем в группе с верхушечной стимуляцией (табл. 1). Среднее значение комплекса QRS в 1-й группе не отличалось до и после имплантации: 116 ± 11 мс и 123 ± 14 мс соответственно, р > 0,05. Во 2-й группе длительность QRS после имплантации достоверно увеличилась: 105 ± 12 мс и 170 ± 15 мс соответственно, p < 0,05, при этом различие между группами после имплантации также достигло статистической значимости. Значения механической параметров межжелудочковой диссинхронии, оцененной по времени предызгнания из правого и левого желудочка, в 1-й группе до и после имплантации достоверно не отличались (22 ± 5 мс и 29 ± 4 мс). Во 2-й группе эти показатели составили 25 ± 3 мс и 50 ± 6 мс соответственно (р < 0,05). Достоверных различий в степени внутрижелудочковой диссинхронии в раннем послеоперационном периоде выявлено не было. Средние значения фракции выброса ЛЖ достоверно не отличались и составили 58 ± 5 и 51 ± 8 (р > 0,05) в 1-й и 2-й группах соответственно.
Таблица 1. Параметры межжелудочковой диссинхронии у пациентов с классической (верхушечной) и альтернативной стимуляцией правого желудочка в раннем послеоперационном периоде
Table 1. Parameters of interventricular dyssynchrony in patients with classical (apical) and alternative pacing of the right ventricle in the early postoperative period
|
Параметр |
Группа альтернативной стимуляции (n = 39) |
Группа стимуляции верхушки (n = 34) |
p-value |
|
Длительность QRS, мс (М ± δ ) до имплантации после имплантации |
116 ± 11 123 ± 14 |
105 ± 12# 170 ± 15# |
0,3 0,04 |
|
Разность времени предызгнания между ЛЖ и ПЖ, (Q – Ao) – (Q – Pa), мс (М ± δ ) до имплантации после имплантации |
22 ± 5 29 ± 4 |
25 ± 3# 50 ± 6# |
0,2 0,04 |
|
Время задержки систолического сокращения между ПЖ и МЖП (базальные сегменты), мс (М ± δ ) до имплантации после имплантации |
39 ± 9 37 ± 8 |
36 ± 5 49 ± 10 |
0,3 0,05 |
Примечание: # – p = 0,04 для внутригруппового сравнения.
Через 2 года после вмешательства время активации желудочков в группе стимуляции МЖП оказалось также достоверно меньше, чем в группе с верхушечной стимуляцией. Среднее значение комплекса QRS в 1-й группе составило 116 ± 11 мс до имплантации и 123 ± 14 мс после (р > 0,05). Во 2-й группе эти цифры составили 105 ± 12 мс и 170 ± 15 мс соответственно (p < 0,05). Средние значения ФВ ЛЖ до операции в обеих группах достоверно не отличались и составили 58 ± 5 и 51 ± 8 (р > 0,05). Длительности QRS сразу после операции и через два года не различались между собой в обеих группах. Значения межжелудочковой диссинхронии, оцененной по времени предызгнания из правого и левого желудочка, в 1-й группе до и после имплантации достоверно не отличались (22 ± 5 мс и 29 ± 4 мс). Во 2-й группе эти показатели составили 25 ± 3 мс и 50 ± 6 мс соответственно (р < 0,05). Через два года после имплантации величина данного показателя межжелудочковой диссинхронии составила 32 ± 5 мс и 59 ± 6 мс в 1-й и 2-й группах соответственно (р < 0,05) (табл. 2).
Достоверной разницы в отношении показателей внутрижелудочковой диссинхро-нии и параметров ремоделирования желудочков между группами в течение двух лет выявлено не было, однако отмечена тенденция к меньшей величине фракции выброса ЛЖ (59 ± 6 % и 50 ± 2 %, р = 0,05) и большей частоте митральной регургитации 2-й степени и выше у пациентов в группе верхушечной стимуляции.
При изучении различия между группами альтернативной стимуляции (МЖП и выходного тракта ПЖ) через два года после операции была отмечена тенденция к меньшей величине времени задержки систолического сокращения между ПЖ и МЖП как показателя межжелудочковой диссинхронии при стимуляции ВТПЖ (30 ± 8 мс и 38 ± 10 мс, р = 0,05). Достоверные различия в параметрах межжелудочковой диссинхронии, оцененной с помощью тканевой миокардиальной допплерографии, между данными группами выявлены не были (табл. 3).
Следует отметить, что, по-видимому, при сравнении альтернативных точек стимуляции ПЖ особенно важную роль играют исходные нарушения внутрижелудочковой проводимости (нарушения проводимости по правой и ветвям левой ножки пучка Гиса), от которых зависит характер распространения фронта возбуждения в миокарде как при спонтанной электрической активности сердца, так и при ЭКС.
Таблица 2. Параметры межжелудочковой диссинхронии и ФВ ЛЖ у больных с верхушечной и альтернативной стимуляцией правого желудочка через 2 года после имплантации ЭКС
Table 2. Parameters of interventricular dyssynchrony and LVEF in patients with apical and alternative right ventricular pacing 2 years after pacemaker implantation
|
Параметр |
Группа альтернативной стимуляции, М± δ (n = 39) |
Группа стимуляции верхушки, М± δ (n = 34) |
p-value |
|
Длительность QRS, мс |
123 ± 14 |
170 ± 15 |
0,04 |
|
Разность времени предызгнания между ЛЖ и ПЖ, (Q – Ao) – (Q – Pa), мс |
32 ± 5 |
59 ± 6 |
0,04 |
|
Время задержки систолического сокращения между ПЖ и МЖП (базальные сегменты), мс |
38 ± 10 |
69 ± 11 |
0,04 |
|
ФВлж, % |
59 ± 6 |
50 ± 2 |
0,05 |
|
Митральная регургитация 2-й степени и выше, % |
15 % |
22 % |
0,06 |
Таблица 3. Параметры межжелудочковой диссинхронии и ФВ ЛЖ у пациентов со стимуляцией МЖП и выносящего тракта правого желудочка через 2 года после имплантации ЭКС
Table 3. Parameters of interventricular dyssynchrony and LVEF in patients with IVS and right ventricular outflow tract stimulation 2 years after pacemaker implantation
|
Параметр |
Группа стимуляции ВТПЖ, М ± δ (n = 14) |
Группа стимуляции средней трети МЖП, М ± δ (n = 25) |
p-value |
|
Длительность QRS, мс |
113 ± 12 |
123 ± 14 |
0,04 |
|
Разность времени предызгнания между ЛЖ и ПЖ, (Q – Ao) – (Q – Pa), мс |
30 ± 5 |
32 ± 6 |
0,2 |
|
Время задержки систолического сокращения между ПЖ и МЖП (базальные сегменты), мс |
30 ± 8 |
38 ± 10 |
0,05 |
|
ФВлж, % |
58 ± 5 |
59 ± 3 |
Н.д. |
При сравнении клинических исходов у пациентов с различными видами стимуляции ПЖ на сроках до двух лет от начала постоянной ЭКС была выявлена тенденция к снижению характеристик качества жизни и толерантности к физической нагрузке в группе верхушечной стимуляции по сравнению с альтернативной. Летальных исходов за два года наблюдения не было ни в одной из групп.
Выводы
На сегодняшний день проблема поиска оптимальных мест стимуляции при наличии показаний к постоянной ЭКС остается до конца не решенной. Альтернативная стимуляция ПЖ по сравнению с верхушечной характеризуется меньшей степенью межжелудочковой диссинхронии как непосредственно после операции, так и в отдаленном периоде. Для оценки физиологичности, клинической эффективности и безопасности нового метода стимуляции межжелудочковой перегородки необходимо более тщательное изучение выраженности внутри- и межжелудочковой диссинхронии, показателей систолической и диастолической функции левого и правого желудочков. Новые эхокардиографические технологии, в том числе тканевая миокардиальная допплерография, позволяют количественно оценивать показатели не только глобальной, но и региональной систолической и диастолической функции миокарда и различные параметры диссинхронии. Однако на сегодняшний день не продемонстрировано преимуществ какого-либо из различных эхокардиографических критериев внутри- и межжелудочковой диссинхронии для оценки ремоделирования сердца при постоянной ЭКС.
Список литературы Влияние селективной стимуляции правого желудочка на электрическую и механическую диссинхронию миокарда
- Lieberman R., Padeletti L., Schreuder J., Jackson K., Michelucci A., Colella A. et al. Ventricular pacing lead location alters systemic hemodynamics and left ventricular function in patients with and without reduced ejection fraction. J Am Coll Cardiol. 2006;48(8):1634-1641. https://doi.org/ 10.1016/j.jacc.2006.04.099
- Sweeney M.O., Hellkamp A.S., Ellenbogen K.A., Greenspon A.J., Freedman R.A., Lee K.L. et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation. 2003;107:2932-2937. https://doi.org/10.1161/01 .CIR.0000072769
- Khurwolah MR, Yao J, Kong XQ. Adverse Consequences of Right Ventricular Apical Pacing and Novel Strategies to Optimize Left Ventricular Systolic and Diastolic Function. Curr Cardiol Rev. 2019;15(2):145-155. https://doi.org/10.2174/1573403X15666181129161839
- Rouleau F., Merheb M., Geffroy S., Berthelot J., Chaleil D., Dupuis J.M. et al., Echocardiographic Assessment of the Interventricular Delay of Activation and Correlation to the QRS Width in Dilated Cardiomyopathy. Pacing and Clinical Electrophysiology. 2001;24:1500-1506. https://doi.org/10.1046/j. 1460-9592.2001.01500.x
- Liu WH, Chen MC, Chen YL, Guo BF, Pan KL, Yang SH et al. Right ventricular apical pacing acutely impairs left ventricular function and induces mechanical dyssynchrony in patients with sick sinus syndrome: a realtime three-dimensional echocardiographic study. J Am Soc Echocardiogr 2008;21:224-9. https://doi.org/10.1016/j.echo.2007.08.045
- Lupi G., Sassone B., Badano L., Peraldo C., Gaddi O., Sitges M. et al. Effects of right ventricular pacing on intra-left ventricular electromechanical activation in patients with native narrow QRS. Am J Cardiol. 2006;98(2):219-222. https://doi.org/10.1016/j.amjcard.2006.01.077
- Tops LF, Schalij MJ, Holman ER, van Erven L., van der Wall E.E, Bax J.J. Right ventricular pacing can induce ventricular dyssynchrony in patients with atrial fibrillation after atrioventricular node ablation. J Am Coll Cardiol. 2006;48(8): 1642-1648. https://doi.org/10.1016/j.jacc.2006.05.072
- Schmidt M, Bromsen J, Herholz C., Adler K., Neff F., Kopf C. et al. Evidence of left ventricular dyssynchrony resulting from right ventricular pacing in patients with severely depressed left ventricular ejection fraction. Eu-ropace. 2007;9(1):34-40. https://doi.org/10.1093/europace/eul131
- Parekh S., Stein K.M. Selective site pacing: Rationale and practical application. Curr. Cardiol. Rep. 2008;10:351-359. https://doi.org/10.1007/s11886-008-0057-6
- Sweeney M.O., Prinzen F.W. A new paradigm for physiologic ventricular pacing. J. Am. Coll. Cardiol. 2006;47(2):282-288. https://doi.org/10.1016Zj.jacc.2005.09.029
- De Cock C.C., Giudici M.C., Twisk J. Comparison of the haemodynamic effects of right ventricular outflow-tract pacing with right ventricular apex pacing: a quantitative review. Europace. 2003;5(3):275-278. https://doi.org/10.1016/S1099-5129(03)00031-X
- Alhous M.H.A., Small G.R., Hannah A., Hillis G.S., Frenneaux M., Broadhurst P.A. Right ventricular septal pacing as alternative for failed left ventricular lead implantation in cardiac resynchronization therapy candidates. Europace. 2015;17:94-100. https://doi.org/ 10.1093/europace/euu259
- Peschar M., de Swart H., Michels K.J. Reneman R.S., Prinzen F.W. Left ventricular septal and apex pacing for optimal pump function in canine hearts. J Am Coll Cardiol. 2003;41(7):1218-1226. https://doi.org/10.1016/s0735-1097(03)00091-3.2003
- Yu C.M., Lin H., Fung W.H., Zhang Q, Kong S.L., Sanderson J.E. Comparison of acute changes in left ventricular volume, systolic and diastolic functions, and intraventricular synchronicity after biventricular and right ventricular pacing for heart failure. Am Heart J. 2003; 145(5):E18. https://doi.org/10.1016/S0002-8703(03)00071-1
- Pitzalis M.V., lacoviello M., Romito R., Massari F., Rizzon B., Luzziet G. et al. Cardiac resynchronization therapy tailored by echocardiographic evaluation of ventricular asynchrony. J Am Coll Cardiol. 2002;40:1615-22. https://doi.org/ 10.1016/s0735-1097(02)02337-9.


