Влияние селенита натрия и 6-бензиламинопурина на продукционный процесс смородины красной
Автор: Прудников Павел Сергеевич, Голяева Ольга Дмитриевна
Журнал: Овощи России @vegetables
Рубрика: Плодоводство, виноградарство
Статья в выпуске: 5 (55), 2020 года.
Бесплатный доступ
Актуальность. В современных климатических условиях на фоне кратковременного или длительного воздействия неблагоприятных факторов среды на сельскохозяйственные растения происходит угнетение продукционного процесса, а, следовательно, и снижение урожайности. В связи с этим возникает необходимость в применении регуляторов роста, обладающих как протекторным, так и стимулирующим многие физиологические процессы действием. Цель работы заключалась в изучении влияния микроэлемента селена и 6-бензиламинопурина на продукционный процесс смородины красной. Методы. На растениях сортов Дана и Ася селекции ФГБНУ ВНИИСПК после цветения проводили некорневые обработки растворами селенита натрия и 6-бензиламинопурина (6-БАП). Для определения содержания абсцизовой кислоты (АБК), количества пигментов, определения скорости световых реакций фотосинтеза отбирали листья смородины с однолетних побегов. Проводили учет показателей плодовой кисти растений. Результаты. Показано, что обработки селенитом натрия и 6-бензиламинопурином способствуют снижению в 2,1-3,5 раза в тканях листа эндогенного уровня АБК, увеличивают биосинтез хлорофилла на 27,5-48,0% и ускоряют на 19,3-45,8% скорость переноса электронов на уровне световых реакций фотосинтеза. Обработка селеном и 6-БАП растений сорта Дана увеличила среднюю массу плодовой кисти на 19,30% и 24,5% соответственно, сорта Ася - на 20,7 и 35,8%. Увеличение средней массы плодовой кисти произошло за счет укрупнения средней массы одной ягоды в ней. Показано, что селен и 6-БАП у сорта Дана увеличил массу ягоды на 27,3% и 47,3%, у Аси на 33,3% и 45,8%. Достоверного влияния на сумму сахаров проводимые обработки не оказали влияния. Таким образом, в период вегетации на растениях смородины красной для увеличения продукционного процесса целесообразно проводить некорневые обработки, как селенитом натрия, так и 6-БАП.
Красная смородина, селенит натрия, 6-бап, абсцизовая кислота, фотосинтез, продуктивность
Короткий адрес: https://sciup.org/140250330
IDR: 140250330 | УДК: 634.722:631.811.98 | DOI: 10.18619/2072-9146-2020-5-71-74
Текст научной статьи Влияние селенита натрия и 6-бензиламинопурина на продукционный процесс смородины красной
Продукционный процесс является важнейшей частью в жизни растения. Под продукционным процессом подразумевается совокупность процессов синтеза и преобразо- вания ассимилянтов, их транспорт, усвоения минеральных элементов, активности регуляторных систем и систем защиты. Другими словами, речь идет о процессах фотосинтеза, дыхания, донорно-акцепторных отношениях, гормональной и антиоксидантной систем. В современных климатических условиях под воздействием неблагоприятных факторов среды зачастую происходит угнетение того или иного процесса, что в конечном итоге, сказывается на продукционном процессе и урожайности. В связи с этим возникает необходимость в стимуляции продукционного процесса экзогенными регуляторами роста. Из последних особый интерес представляют фитогормоны и трофические элементы питания. Согласно многим исследованиям микроэлемент селен являясь антиоксидантом участвует в регуляции фитогормонально-го статуса, изменяет соотношение ИУК/АБК в сторону увеличения ауксина [1,2], устойчивости и урожайности растений [3.4,5]. Одновременно фитогормоны участвуют в регуляции накопления растениями селена. Так, согласно исследованиям, на чесноке [6] эпибрассинолиды способствуют аккумулированию селена листьями, гиббереллины, напротив, приводят к преимущественному накоплению Se в луковице растения. В то же время цитокинины участвуют в регуляции деления и морфогенеза клеток, функционировании фотосинтетического аппарата, роста и развитии плодов, клубней, семян [7,8,9,10,11]. Кроме того, согласно исследованиям, при действии стресса умеренной силы цитокинины обеспечивают поддержание роста растений [12,13]. Растения смородины красной, имея достаточно многолетний жизненный цикл, часто подвергаются воздействию неблагоприятных факторов среды, таких как гипо- и гипертермия, засуха и т.д., что, в конечном итоге, сказывается на ее продуктивности. Кроме того, в целях коммерческой реализации в вакуумных упаковках, для смородины красной, в отличии от черной, актуален вопрос сохранения количества ягод в плодовой кисти. Однако особенность культуры заключается в частом измельчении ягод или массовом сбросе завязи из-за чего плодовая кисть имеет непривлекательный вид. Вместе с тем ягоды красной смородины богаты витаминами С – 18,3-36,5 мг/100 г, P – 29,3-88,7 мг/100 г, антоцианами 31,0-75,8 мг/100 г, лейкоан-тоцианами – 30,1-147,7 мг/100 г, суммарным пектином – 0,741,03%, растворимыми сухими веществами – 11,2-13,4% [14], сахарами: 1,7-4,32% глюкозы, 2,0-5,66 фруктозы, 0,1-0,4 сахарозы, количество органических кислот – 1,44-5,0%, в зависимости от региона возделывания [15]. Кроме того, ягоды красной смородины содержат множество антиоксидантов, способных противостоять раковым клеткам. В связи с этим возникает необходимость в защите основных звеньев продукционного процесса смородины красной с целью не только сохранения, но и увеличения урожайности растения за счет использования регуляторов роста. Цель работы заключалась в изучении влияния микроэлемента селена и 6-бензила-минопурина на продукционный процесс смородины красной.
Материал и методы исследований
Объектами исследования служили сорта смородины красной сортов Дана и Ася. Сорт Дана позднего срока созревания, получен во ВНИИ селекции плодовых культур от скрещивания сортов Роте Шпетлезе и Йонкер ван Тетс. Ягоды средние и крупные (0,6-0,9 г), светло-красные, сладко-кислого вкуса. Сорт морозостойкий, высокоурожайный, среднемноголетняя урожайность составляет 20,2 т/га (2,9 кг/куст при схеме посадки 0,5 х 2,8 м), устойчив к мучнистой росе, в средней степени поражается септориозом [16].
Сорт Ася среднераннего срока созревания, получен во ВНИИ селекции плодовых культур от скрещивания сортов
Чулковская и Маарсес Проминент. Ягоды средней величины (средняя масса 0,6 г, максимальная – 1,0 г), темно-красные, вкус сладко-кислый. Сорт зимостойкий, высокоурожайный, среднемноголетняя урожайность составляет 17,8 т/га (2,5 кг/куст при схеме посадки 0,5 х 2,8 м), слабовосприимчив к мучнистой росе и листовым пятнистостям [16].
Исследования проводили на базе ФГБНУ ВНИИСПК N53°00.222ʹ E36°04.112ʹ Растения смородины красной выращивались на серой лесной, среднесуглинистой почве, имеющей следующую агрохимическую характеристику: гумус (по Тюрину) – 3,4%; обменная кислотность (рH солевой вытяжки) – 6,2; сумма поглощённых оснований – 19,5 мг-экв. на 100г почвы; содержание подвижных форм фосфора (P 2 O 5 ) и калия (K2O), соответственно, 15-20 и 12-15 мг/100 г почвы.
Схема посадки растений 0,5 х 2,8 м. Междурядье – черный пар, в ряду залуженье. Растения смородины красной после цветения обрабатывали растворами селенита натрия (Sigma-Aldrich) и 6-БАП (Sigma-Aldrich) в соответствующей концентрации 5,78•10-5М и 6,7•10-5М, которые были ранее подобраны опытным путем. Всего было проведено три некорневых обработок с периодичностью в семь дней. После окончания обработок отбирались с однолетних побегов листья срединной формации. Определение содержания пигментов проводили в ацетоновой вытяжке (масса навески 200 мг) на спектрофотометре BioRad SmartSpeс Plus (США) согласно [17]. Расчет суммы хлорофиллов и каротиноидов вели по формуле:
С хл.а+ хл.b = 5,134 x Е 662 + 20,436 xЕ 644
С кар = 4,695 x 440,5 – 0,268 х С хл.а + хл.b
Анализ фотохимической активности изолированных хлоропластов (ФХА) в листьях растений осуществляли на основе использования потенциометрического метода по скорости фотовостановления железосинеродистого калия [18]. Хлороласты выделяли из 2 г навески листьев путем двухратного центрифугирования на Jouan MR1812 (Франция) при 1000 и 2500 об/мин в среде, содержащей 25мМ трис-HCl буфер (pH 7,8) и 0,35 М NaCl. Реакционная смесь для темновой и световой пробы объемами по 5 мл содержала 4 мл суспензии хлоропластов и 1 мл 0,002 М раствора железосинеродистого калия. Оптическую плотность растворов промеряли при длине волны 420нм на спектрофотометре BioRad SmartSpek Plus (США). ФХА хлоропластов выражали в мкМоль K 3 [Fe(CN) 6 ]/(мг хл · ч).
Содержание абсцизовой кислоты (АБК) анализировали методом биологической пробы [19]. Экстракцию АБК проводили 25 мл 70% этанола из сухой навески 500 мг, предварительно зафиксированной в парах этанола. После упаривания экстракта до водного остатка, его подкисляли до рН 2-3 и экстрагировали АБК трижды диэтиловым эфиром. Сухой остаток АБК растворяли в 1 мл 96% этанола и наносили на хроматографическую бумагу. При фракционировании в качестве растворителя использовали смесь изопропанол-аммиак-вода (соотношение компонентов 10:1:1). Из хроматограмм после анализа вырезали зону с Rf АБК и элюировали 2 мл 2% раствора сахарозы с дальнейшим использованием биотеста. Биотестом на АБК служили колеоптили пшеницы Московская 39. В качестве стандартного раствора абсцизовой кислоты для построения калибровочной кривой была взята АБК (Sigma-Aldrich). Сумму сахаров определяли в свежевыжатом соке ягод смородины красной после центрифугирования на цифровом рефрактометре «Atago» PAL-3 (Япония). Учет продуктивности осуществляли на основе программы и методики сортоизучения плодовых, ягодных и орехоплодных культур [20]. Достоверность результатов оценивали по стандартным методикам с использованием программ MS EXEL.
Результаты и обсуждения
Известно, что основными регуляторами роста и развития растения являются фитогормоны. В связи с этим, представляло интерес изучить, как повлияет обогащение растений селеном и 6-бензиламинопурином на уровень абсцизовой кисло-
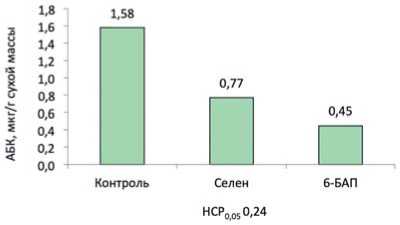
Рис. 1. Влияние селенита натрия и 6-бензиламинопурина на содержание абсцизовой кислоты в листьях смородины красной на примере сорта Ася.
Fig. 1. The influence of sodium selenite and 6-benzylaminopurine on the content of abscisic acid in leaves of red currant on the example of the Asya variety.
показано положительное действие селена на уровень хлорофиллов [5,22]. Увеличение содержания зеленого пигмента под воздействием селена также отмечено и в работах Pilon-Smits E.A.H. [23]. На уровень увеличения количества каротиноидов в листьях, обработки изучаемыми препаратами не оказали положительный эффект.
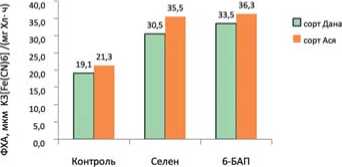
Определение влияния проведенных обработок на фотохимическую активность изолированных хлоропластов также показало положительный эффект на увеличение скорости переноса электронов в фотосистемах ассимилирующего аппарата. Так у изучаемых сортов скорость переноса электронов под влиянием селенита натрия на 60,0% увеличилась у сорта Дана и на 67,0% – у сорта Ася. Под влиянием 6-БАП – на 75,4% и 70,4%, соответственно (рис. 2). Можно полагать, что
Таблица 1. Влияние селенита натрия и 6-бензиламинопурина на содержание фотосинтезирующих пигментов в листьях сортов смородины красной.
Table 1. The influence of sodium selenite and 6-benzylaminopurine on the content of photosynthetic pigments in the leaves of red currant varieties
|
Вариант |
Содержание пигментов, мг/г |
|||
|
сорт Дана |
сорт Ася |
|||
|
хлорофиллa+b |
каротиноиды |
хлорофиллa+b |
каротиноиды |
|
|
Контроль |
2,90 |
0,04 |
2,50 |
0,09 |
|
Na 2 SeO 3 |
3,70 |
0,06 |
3,10 |
0,07 |
|
6-БАП |
4,20 |
0,07 |
3,70 |
0,06 |
|
НСР 0,05 |
0,23 |
0,83 |
0,34 |
0,86 |
сорт Ася („„„.,,„) сорт Даиа(НСРом -3,03)
Рис. 2. Влияние селенита натрия и 6-бензиламинопурина на фотохимическую активность хлоропластов (ФХА) в листьях сортов смородины красной
Fig. 2. The influence of sodium selenite and 6-benzylaminopurine on the photochemical activity of chloroplasts in the leaves of red currant varieties
снижение количества эндогенной АБК вызвала изменение соотношения между ауксинами и АБК, что повлияло на ФХА изолированных хлоропластов. Так известно, что ауксины способны ускорять перенос электронов к НАДФ на фоне усиления биосинтеза пластохинона [24,25], тогда как АБК снижает перемещение поглощенной светособирающим комплексом листа энергии [26].
При определении показателей продуктивности показано, что обработки селеном и цитокининами оказали влияние на среднюю массу плодовой кисти. Так обработки селенитом натрия и 6-БАП растений сорта Дана увеличили среднюю массу плодовой кисти на 19,30% и 24,5% соответственно, у сорта Ася – на 20,7 и 35,8%. Увеличение средней массы пло-
Таблица 2. Влияние обработок смородины красной селенитом натрия и 6-БАП на показатели плодовой кисти
Table 2. The influence of red currant treatments with sodium Selenite and 6-BAP on the characteristic of the fruit brush
Так количество АБК под влиянием селенита натрия снизилось в 2,1 раза, а под влиянием 6-бензиламинопурина в 3,5 раза. В исследованиях, проведенных на пшенице, также показано, что обработка растений цитокининами в виде кинетина снижала в листьях содержание АБК, увеличивала содержание зеатина и его рибозида [21]. Снижение абсцизовой кислоты под влиянием селена также отмечено и в исследованиях на картофеле [2].
На фоне снижения уровня эндогенной АБК под влиянием обработок отмечали увеличение количества зеленого пигмента в ассимиляционном аппарате (табл. 1). Под действием экзогенного селена и 6-БАП содержание хлорофилла (a+b) у сорта Дана возросло на 27,5% и 44,8% соответственно, у сорта Ася на 24,0% и 48,0% против их контролей. В исследованиях на яровой пшенице в условиях действия засухи также довой кисти произошло за счет укрупнения средней массы одной ягоды в ней. Показано, что селенит натрия и 6-бензила-минопурин у сорта Дана увеличили массу ягоды на 27,3% и 47,3%, у Аси на 33,3% и 45,8%. Вместе с тем, достоверного влияния на сумму сахаров проводимые обработки не оказали влияния (табл. 2).
Заключение
Таким образом, проведенные исследования показали, что некорневые обработки растений смородины красной микроэлементом селеном в виде селенита натрия и 6-БАП существенно снижают эндогенный уровень абсцизовой кислоты, увеличивают биосинтез зеленого пигмента и увеличивают скорость световых реакций фотосинтеза. На этом фоне происходит увеличение средней массы, как плодовой кисти, так и средней массы одной ягоды в ней. В связи с этим, в период вегетации на растениях смородины красной для усиления продукционного процесса целесообразно проводить некорневые обработки, как селенитом натрия, так и 6-БАП.

Сорт смородины красной Дана
Сорт смородины красной Ася
Об авторах:
Pavel S. Prudnikov – Senior Researcher,
Cand. Sci. (Biology),
Olga D. Golyayeva – Leading Researcher, Cand. Sci. (Agriculture)
Список литературы Влияние селенита натрия и 6-бензиламинопурина на продукционный процесс смородины красной
- Солдатов С.Ф., Хрянин. В.Н. Влияние селена на фитогормональный статус и проявление пола у двудомных растений конопли. Тезисы докладов Международной конференции "Физиологические и молекулярно-генетические аспекты сохранения биоразнообразия". 2005; Вологда: 159.
- Прудников П.С. Влияние селена на физиолого-биохимические процессы при адаптации растений картофеля к гипотермии. Автореф. дисс.. канд. биол. наук. М.: МСХА. 2007, 28.
- Кузнецов Вас. В. Защитное действие селена при адаптации растений пшеницы к условиям засухи: Автореф. дис.. канд. биол. наук. М.: МСХА. 2004, 21.
- Прудников П.С., Кривушина Д.А., Голяева О.Д. Влияние селена на активность антиоксидантной системы в условиях гипертермии и некоторые звенья продукционного процесса смородины красной. Плодоводство и ягодоводство России. 2018;(53):176-182.
- Серегина И.И., Верниченко И.В., Ниловская Н.Т., Шумилин А.О. Продуктивность и устойчивость яровой пшеницы в условиях окислительного стресса при применении селена. Агрохимия. 2015;(3):56-63.
- Голубкина Н.А., Добруцкая Е.Г., Новоселов Ю.М. Гормональное регулирование накопления селена растениями. Овощи России. 2015;(3-4):104-107.
- DOI: 10.18619/2072-9146-2015-3-4-104-107
- Schaller, G.E., Street, I.H. and Kieber, J.J. Cytokinin and the cell cycle. Current Opinion in Plant Biology. 2014;(21C):7-15.
- DOI: 10.1016/j.pbi.2014.05.015
- Kieber Joseph J., Schaller G. Eric. Cytokinin signaling in plant development. Development. 2018: 145: dev149344
- DOI: 10.1242/dev.149344
- Jameson, P. E. and Song, J. Cytokinin: a key driver of seed yield. Journal of Experimental Botany. 2016;(67):593-606.
- DOI: 10.1093/jxb/erv461
- Weaver, R.J., Johnson J.O., Relations of Hormones to Nutrient Mobilization and the Internal Environment of the Plant: The Supply of Mineral Nutrients and Photosynthate. Encyclopedia of Plant Physiol. New Ser. V. 11 / еds. R.P. Pharisand, D.M. Reid. Berlin et al.: Springer Verlag. 1985;(3):36.
- Медведев С.С. Физиология растений. СПб.: БХВ-Петербург. 2013: 512.
- Bielach, A., Hrtyan, M. and Tognetti, V.B. Plants under stress: Involvement of auxin and cytokinin. International Journal of Molecular Sciences. 2017;(18).1427.
- DOI: 10.3390/ijms18071427
- Веселов Д.С., Кудоярова Г.Р., Кудрякова Н.В., Кузнецов В.В. Роль цитокининов в стресс устойчивости растений. Физиология растений. 2017,64(1):19-32.
- Причко Т.Г., Яковенко В.В., Германова М.Г. Биохимические показатели качества ягод смородины с учетом сортовых особенностей. Плодоводство и виноградарство Юга России. 2017;(45):1-9.
- Сабарайкина С.М., Брындза Я. Биохимическая оценка и антиоксидантная активность ягод красной смородины Якутии. Международный журнал прикладных и фундаментальных исследований. 2014;(4):202-203.
- Помология. Т. 4. Смородина. Крыжовник. ред. Е.Н. Седов, О.Д. Голяева. Орел: ВНИИСПК. 2009, 468.
- Гавриленко В.Ф., Жигалова Т.В. Большой практикум по фотосинтезу. М.: Издательский центр "Академия". 2003. 256 с.
- Зеленский М.И., Клементьева И.И. Потенциометрический метод исследования фотохимической активности хлоропластов. Методы комплексного изучения фотосинтеза / Под ред. Быкова О.Д. Л.: ВИР. 1969: 127-141.
- Власов П.В., Мазин В.В., Турецкая Р.Х., Гуськов А.В., Комизерко Е.И., Ложникова В.Н., Янина Л.Я., Коф Э.М., Конопская Л.Н., Шарипов Г.Д., Филонова В.П., Кефели В.И. Комплексный метод определения природных регуляторов роста. Первичный анализ незрелых семян кукурузы на активность свободных ауксинов, гиббереллинов и цитокининов. Физиология растений. 1979;(26):648-655.
- Программа и методика сортоизучения плодовых, ягодных и орехоплодных культур. Рос. акад. с.-х. наук. Всерос. науч.-исслед. ин-т селекции плодовых культур. Под общ. ред. Е.Н. Седова и Т.П. Огольцовой. Орел: ВНИИСПК.1999. 606.
- Широкова Н.П. Физиологические особенности засухоустойчивости яровой пшеницы и роль фитогормонов в ее регуляции у сортов Росинка и Омская 23. Автореф. дис.. канд. биол. наук. Красноярск. 2012. 18.
- Кулагина Ю.М., Головацкая И.Ф. Влияние селенита натрия на рост и развитие растений пшеницы в зависимости от способа обработки. Вестник Томского государственного университета. Биология. 2011;(14):56-64
- Pilon-Smits E.A.H., Luttge U., Beyschlag W. Selenium in plants. In "Progress in Botany", Springer International Publishing Switzerland. 2015: 93-107.
- Tamas I.A., Atkins B.D., Ware S.M., Bidvell R.G.S. Indoleacetic acid stimulation of phosphorylation and bicarbonate fixation by chloroplast preparation in light. Canadian Journal of Botany. 1972;(50):1523-1527.
- Акулова Е.А., Мурзаева С.В., Таукелева Ш.Н., Рузиева Р.Х. Влияние ИУК на фотофосфорилирование изолированных хлоропластов гороха. Биохимия. 1975;(40):1205-1209.
- Кренделева Т.Е., Макеев А.В., Мокроносов А.Т. Влияние абсцизовой кислоты на первичные процессы фотосинтеза. Физиология растений. 1998;43(5):988-997.


