Влияние селенита натрия на изоферментные спектры лактатдегидрогеназы и некоторые показатели антиоксидантной системы тканей хищных млекопитающих
Автор: Сергина Светлана Николаевна, Илюха Виктор Александрович, Тютюнник Николай Николаевич, Антонова Екатерина Петровна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-химическая биология
Статья в выпуске: 4 (157), 2016 года.
Бесплатный доступ
Исследовали воздействие нетоксической дозы селенита натрия на изоферментные спектры лактатдегидрогеназы (ЛДГ), активность антиоксидантных ферментов супероксиддисмутазы (СОД) и каталазы, уровень восстановленного глутатиона (GSH) и интенсивность перекисного окисления липидов (ПОЛ) в тканях шести органов (печени, почек, сердца, легких, селезенки и скелетной мышцы) у трех видов хищных млекопитающих (норка, лисица и песец), разводимых в неволе. Введение в рацион норок и лисиц дополнительного количества селена не привело к изменению изоферментных спектров ЛДГ в тканях органов. Тем не менее у песцов в печени, почках и сердце отмечается снижение содержания фракций ЛДГ-1 и ЛДГ-2, обладающих высоким сродством к лактату, а в почках и сердце -увеличение доли ЛДГ-4 и ЛДГ-5, ответственных за превращение пирувата в лактат. У норок под влиянием селенита натрия активности ферментов практически не изменились, но содержание GSH увеличилось в почках, легких и селезенке и снизилось в скелетной мышце. У лисиц, получавших селен, отмечено увеличение активности СОД в печени и почках, каталазы - в почках и легких, снижение уровня GSH в сердце и его увеличение в селезенке. У песцов не выявлено влияния препарата на показатели АОС. Селенит натрия не оказал воздействия на уровень ПОЛ у всех изученных видов животных ни в одном из исследованных органов, кроме почек норок, где зафиксировано его снижение. Результаты свидетельствуют о видо- и тканеспецифичном характере влияния нетоксической дозы селенита натрия на млекопитающих.
Антиоксидантная система, изоферменты лактатдегидрогеназы, селенит натрия, хищные млекопитающие
Короткий адрес: https://sciup.org/14751057
IDR: 14751057 | УДК: 591.8:546.23:599.74
Текст научной статьи Влияние селенита натрия на изоферментные спектры лактатдегидрогеназы и некоторые показатели антиоксидантной системы тканей хищных млекопитающих
Разводимые в неволе хищные звери должны содержаться на рационе, не только сбалансированном по количеству белков, жиров и углеводов, но и включающем достаточное количество минеральных веществ, которые входят в состав тканей и участвуют в обменных процессах, протекающих в организме. Одним из важнейших биологически активных микроэлементов является селен, способный оказывать влияние на жизнедеятельность клетки как через изменение активности селеносодержащих белков, обладающих антиоксидантными свойствами и участвующих в метаболизме тиреоидных гормонов, так и через редокс-регуляцию множества метаболических функций, что, безусловно, отражается и на состоянии иммунной системы организма [10].
Ряд болезней у человека и животных может быть связан с недостаточным поступлением селена с пищей. Так, при его дефиците в рационе
снижается устойчивость организма к окислительному повреждению, что может сопровождаться развитием патологии, вызванной свободными радикалами и аналогичной Е-авитаминозу, которая характеризуется бесплодием, мышечной дистрофией, дегенерацией печени, повышением проницаемости и ломкости капилляров и др. [3]. Для предотвращения селенодефицитных заболеваний в звероводстве широко используется неорганический препарат селена – селенит натрия Na 2 SeO 3 [10], [17]. Токсичными дозами селена в виде селенита натрия считаются уровни 5–10 мг/ кг и выше, тогда как в концентрации 0,1 мг/кг в диете животных селен действует как необходимый микроэлемент [18], [19], [20]. Токсический эффект соединений селена связан с образованием меркаптидов с SH-группами ферментов, играющих важную роль в обменных процессах [27].
Одним из SH-содержащих ферментов, который обратимо конвертирует пируват и НАДН в лактат и НАД+, является лактатдегидрогеназа (ЛДГ). Комбинация 2 субъединиц фермента, обозначаемых как H (от англ. heart – сердце) и M (от англ. muscle – мышца), в разных вариантах дает 5 изоферментов: ЛДГ-1 (НННН), ЛДГ-2 (НННМ), ЛДГ-3 (ННMМ), ЛДГ-4 (HMММ) и ЛДГ-5 (MМММ). Изомеры ЛДГ, в составе которых преобладают M субъединицы, характерны для гликолитических скелетных мышц и в анаэробных условиях, поскольку катализируют превращение пирувата в лактат, тогда как изомеры ЛДГ, содержащие H субъединицы, функционируют в тканях миокарда и в основном в аэробных условиях, конвертируя лактат в пируват.
Регуляторная роль, которая отводится изоферментам ЛДГ, связана с поддержанием в тканях определенного соотношения аэробной и анаэробной продукции АТФ. Изоферменты ЛДГ-1 и ЛДГ-2 обладают сродством к лактату, ЛДГ-4 и ЛДГ-5 – преимущественно к пирувату, тогда как изофермент ЛДГ-3, содержащий равное количество Н и М субъединиц, – к пирувату и лактату в равной степени. Следовательно, соотношение изоферментов ЛДГ служит показателем метаболического состояния клетки, поскольку указывает на то, какой путь синтеза АТФ преобладает в ткани – аэробный или анаэробный [16], [28], [31]. В литературе отсутствуют сведения о влиянии селенита натрия на изоферментные спектры ЛДГ у млекопитающих.
Для регуляции концентрации активных форм кислорода (АФК) клетка использует набор ферментативных и низкомолекулярных антиоксидантов. К их числу относятся супероксиддис-мутазы (СОД), катализирующие дисмутацию супероксида в перекись водорода, каталаза и селен-зависимые глутатионпероксидазы (ГПО), разлагающие последнюю. Среди низкомолекулярных антиокислителей важную роль играют глутатион (GSH), токоферолы, каротиноиды и др. [15]. Селен также способен проявлять аналогичные свойства [10], поскольку отмечено активирующее влияние селенита натрия на синтез ГПО у млекопитающих [25], [35].
Кроме того, селен включается в большинство обменных и иммунных процессов, происходящих в организме [33]. Микроэлемент обнаруживается во многих органах, причем его концентрация варьирует в зависимости от количества потребляемого с пищей элемента, а также определяется тканевой спецификой [32].
Ввиду недостаточной изученности механизмов воздействия селенита натрия на млекопитающих, цель работы состояла в изучении влияния нетоксической дозы препарата на компоненты тканевой антиоксидантной системы (АОС) и изо-ферментные спектры ЛДГ разводимых в неволе норок, лисиц и песцов.
МАТЕРИАЛЫ И МЕТОДЫ
Лабораторные исследования выполнены на научном оборудовании Центра коллективного пользования Института биологии Карельского научного центра РАН с соблюдением международных принципов Хельсинкской декларации о гуманном отношении к животным и правил проведения работ с использованием экспериментальных животных [7]. Объектами исследования явились неполовозрелые представители отряда Carnivora: американские норки ( Mustela vison , Mustelidae) – темно-коричневый тип стандартной породы; лисицы ( Vulpes vulpes , Cani-dae) – тип Пушкинский серебристо-черной породы; песцы ( Alopex lagopus , Canidae) – вуалевая порода. Животные каждого вида были разделены на 2 группы: контрольную и подопытную. Особи подопытных групп получали с кормом селенит натрия (Na 2 SeO 3 ) из расчета по 0,2 мг/животное. Включение препарата в рацион осуществляли по схеме: 10 дней кормление – 10 дней перерыв, начиная с июля до конца октября. Взвешивание зверей проводили ежемесячно, с 1 июля по 1 октября включительно.
В образцах тканей печени, почек, легких, селезенки, сердечной и скелетной мышц были проанализированы изоферментные спектры ЛДГ, активности антиоксидантных ферментов СОД и каталазы, содержание GSH, а также интенсивность перекисного окисления липидов (ПОЛ) (по содержанию соединений, реагирующих с тиобар- битуровой кислотой – ТБК-реактивных продуктов (ТБК-РП)).
Образцы тканей отбирали в период планового забоя животных на звероферме, замораживали и хранили до анализа при –25 °С. Для определения изоферментных спектров ЛДГ, активностей антиоксидантных ферментов, измерения уровня ТБК-РП, а также содержания белка гомогенаты тканей готовили в 0,05 М фосфатном буферном растворе (рН 7,0). После центрифугирования (при 6000 g в течение 15 мин) полученные супернатанты использовали для анализа.
Разделение изоферментов ЛДГ производили методом горизонтального электрофореза на пластинках агарового геля [34] с последующим окрашиванием и сканированием фореграмм для количественной оценки доли каждого изофермента [4].
Активности ферментов измеряли спектрофотометрически: СОД – по модифицированной адренохромной методике [26], каталазы – по количеству разложенной Н 2 О 2 [12]. За 1 усл. ед. активности СОД принимали количество фермента, способное затормозить реакцию автоокисления адреналина на 50 %, а за 1 ед. активности каталазы – количество мкмоль Н2О2, разложенной за 1 мин. Содержание белка определяли по методу Лоури [24] с использованием в качестве стандарта бычьего сывороточного альбумина. Удельную активность антиоксидантных ферментов рассчитывали на 1 мг белка.
Содержание GSH определяли по методу Эл-лмана [29] и выражали в ммоль/100 г ткани. Для этого гомогенаты тканей органов готовили в 0,02 М ЭДТА Nа 2 , после центрифугирования (в течение 15 мин при 5000 g) к супернатантам добавляли 50 % ТХУ для осаждения белков, затем вновь центрифугировали (15 мин при 3000 g). В полученных супернатантах после добавления 0,4 М трис-буферного раствора и реактива Эл-лмана (рН полной реакционной смеси составлял 8,0) спектрофотометрически (λ = 412 нм) определяли уровень GSH.
Уровень ТБК-РП, в число которых входит и малоновый диальдегид – вторичный продукт ПОЛ, измеряли спектрофотометрически при λ = 532 нм и выражали в мкмоль/г ткани [21].
Полученные данные обрабатывали общепринятыми методами вариационной статистики, используя пакеты программ MS Excel и Statgraphics. Для сравнения различий между группами применяли непараметрический критерий (U) Вилкоксо-на – Манна – Уитни. Статистически значимыми считали различия с р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Норки
Почки и сердце норок характеризуются аэробным способом получения энергии, поскольку суммарное содержание ЛДГ-1 и ЛДГ-2 превышает таковое ЛДГ-4 и ЛДГ-5 (табл. 1). В энергообеспечении остальных исследуемых органов, в ЛДГ-спектре которых преобладают изоферменты ЛДГ-4 и ЛДГ-5, либо доминирует анаэробная продукция АТФ, либо в этих органах происходит ресинтез глюкозы из лактата, что характерно для печени и скелетной мускулатуры. Не обнаружено изменений в соотношении изоферментов ЛДГ, кроме снижения доли ЛДГ-3 в печени, у норок, получавших дополнительное количество селена с пищей.
Селенит натрия не привел к изменению активностей антиоксидантных ферментов в тканях органов животных, кроме снижения активности каталазы в печени норок (табл. 2). Это может быть связано с вероятным усилением синтеза селенсодержащего фермента – ГПО – в клетках печени, который обладает более высоким, чем каталаза, сродством к Н2О2 [3]. Отмечают, что активность ГПО печени крыс регулируется селеновым статусом организма [35].
Содержание GSH в тканях норок оказалось наиболее чувствительным к воздействию препарата показателем: в почках, легких и селезенке отмечено его увеличение, а в скелетной мышечной ткани – снижение (рис. 1).
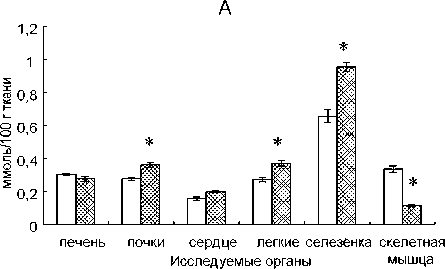
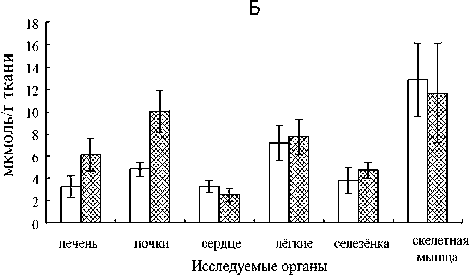
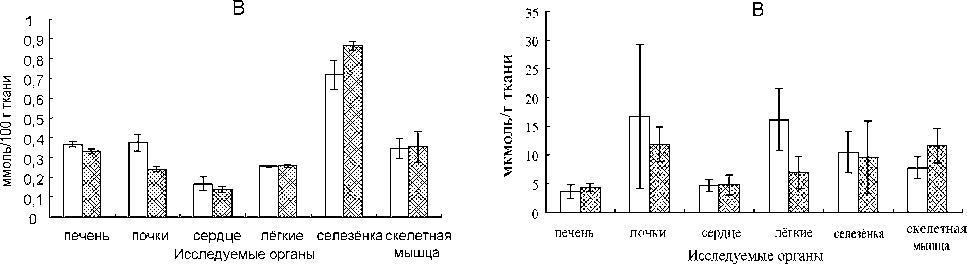
Содержание ТБК-РП не претерпело изменений под влиянием селенита натрия во всех исследованных органах норок, кроме почек, где зафиксировано его снижение (рис. 2). Эти изменения исследуемых показателей под влиянием препарата свидетельствуют об активации антиоксидантной защиты тканей за счет GSH и, возможно, GSH-зависимых ферментов, таких как селен-содержащая ГПО, глутатион-S-трансфераза и глу-татион-редуктаза, которые участвуют в удалении перекиси водорода и восстановлении перекисей липидов, предотвращая их распад до радикалов и продолжения цепи ПОЛ [3]. Активирующее влияние селенита натрия на синтез ГПО, который происходит в почках интенсивнее, чем в других тканях, отмечено также и у других млекопитающих [25], [35].
Таким образом, полученные данные свидетельствуют о слабом воздействии применяемой дозы селенита натрия на исследуемые показатели у норок. Динамика роста и общий привес животных также не претерпели статистически значимых изменений в ходе эксперимента [6].
Таблица 1
Влияние селенита натрия на изоферментные спектры ЛДГ в тканях органов норок, лисиц и песцов
|
Вид |
Группа |
Ткань |
Доля изоферментов ЛДГ, % (М ± sem) |
||
|
ЛДГ-1 + ЛДГ-2 |
ЛДГ-3 |
ЛДГ-4 + ЛДГ-5 |
|||
|
Норка |
контрольная, n = 11 |
печень |
3,21 ± 0,46 |
18,13 ± 0,86 |
78,66 ± 1,23 |
|
почки |
70,42 ± 1,30 |
23,12 ± 1,03 |
6,47 ± 0,37 |
||
|
сердце |
46,40 ± 4,95 |
31,48 ± 3,19 |
22,12 ± 3,73 |
||
|
легкие |
7,64 ± 1,10 |
22,40 ± 1,53 |
69,96 ± 2,54 |
||
|
селезенка |
11,23 ± 0,74 |
39,74 ± 1,30 |
49,02 ± 1,69 |
||
|
ск. м. |
4,37 ± 0,23 |
23,19 ± 1,53 |
72,43 ± 1,57 |
||
|
подопытная, n = 11 |
печень |
3,28 ± 0,41 |
14,85 ± 1,06* |
81,87 ± 1,34 |
|
|
почки |
69,76 ± 0,98 |
24,65 ± 0,61 |
5,59 ± 0,65 |
||
|
сердце |
44,56 ± 5,28 |
33,68 ± 1,52 |
21,76 ± 3,93 |
||
|
легкие |
6,83 ± 1,10 |
22,54 ± 1,64 |
70,63 ± 2,61 |
||
|
селезенка |
12,26 ± 0,85 |
38,69 ± 0,97 |
49,05 ± 1,62 |
||
|
ск. м. |
4,84 ± 0,30 |
22,80 ± 1,35 |
72,36 ± 1,50 |
||
|
Лисица |
контрольная, n = 9 |
печень |
13,44 ± 4,68 |
13,51 ± 0,92 |
73,05 ± 4,97 |
|
почки |
52,35 ± 2,16 |
18,60 ± 0,58 |
29,05 ± 2,43 |
||
|
сердце |
81,48 ± 5,31 |
15,12 ± 4,08 |
3,40 ± 1,24 |
||
|
легкие |
48,08 ± 1,04 |
30,44 ± 0,78 |
21,48 ± 1,27 |
||
|
селезенка |
40,99 ± 1,45 |
42,98 ± 0,96 |
16,03 ± 1,98 |
||
|
ск. м. |
25,87 ± 3,16 |
17,18 ± 2,27 |
56,95 ± 4,38 |
||
|
подопытная, n = 11 |
печень |
12,80 ± 1,49 |
11,55 ± 1,95 |
75,65 ± 2,64 |
|
|
почки |
54,95 ± 2,34 |
20,10 ± 0,79 |
24,95 ± 2,85 |
||
|
сердце |
74,35 ± 6,33 |
19,69 ± 4,67 |
5,96 ± 1,69 |
||
|
легкие |
46,48 ± 2,13 |
30,20 ± 1,01 |
23,32 ± 2,50 |
||
|
селезенка |
42,01 ± 1,79 |
41,76 ± 1,04 |
16,23 ± 1,72 |
||
|
ск. м. |
29,00 ± 4,95 |
13,52 ± 1,52 |
57,48 ± 5,85 |
||
|
Песец |
контрольная, n = 9 |
печень |
5,72 ± 0,38 |
9,26 ± 1,40 |
85,02 ± 1,54 |
|
почки |
63,82 ± 3,16 |
11,45 ± 1,17 |
24,73 ± 3,21 |
||
|
сердце |
87,99 ± 1,15 |
9,30 ± 0,97 |
2,72 ± 0,36 |
||
|
легкие |
40,70 ± 1,71 |
32,51 ± 0,96 |
26,79 ± 2,14 |
||
|
селезенка |
34,13 ± 1,74 |
41,71 ± 1,56 |
24,17 ± 1,39 |
||
|
ск. м. |
30,55 ± 4,25 |
18,09 ± 1,95 |
51,36 ± 3,62 |
||
|
подопытная, n = 8 |
печень |
3,80 ± 0,70* |
10,85 ± 1,45 |
85,35 ± 1,56 |
|
|
почки |
48,06 ± 3,00** |
9,35 ± 1,08 |
42,59 ± 3,08** |
||
|
сердце |
43,84 ± 11,45** |
32,25 ± 5,53** |
23,91 ± 8,27** |
||
|
легкие |
40,47 ± 2,14 |
28,15 ± 1,00** |
31,38 ± 2,63 |
||
|
селезенка |
34,01 ± 0,79 |
41,45 ± 1,04 |
24,54 ± 1,30 |
||
|
ск. м. |
26,00 ± 4,16 |
12,17 ± 1,30 |
61,83 ± 5,02 |
||
Примечание. ск. м. – скелетная мышца; * – различия достоверны по сравнению с контролем в той же самой ткани: * – p < 0,05, ** – p < 0,01.
Таблица 2
Влияние селенита натрия на удельные активности СОД, каталазы в тканях органов норок, лисиц и песцов
|
Вид |
Группа |
Ткань |
Активности антиоксидантных ферментов, М ± sem |
|
|
СОД, у. е./мг белка |
Каталаза, ед./мг белка |
|||
|
Норка |
контрольная, n = 16 |
печень |
1,77 ± 0,36 |
4,38 ± 0,33 |
|
почки |
1,20 ± 0,09 |
0,47 ± 0,04 |
||
|
сердце |
1,03 ± 0,12 |
0,21 ± 0,03 |
||
|
легкие |
0,73 ± 0,04 |
0,13 ± 0,02 |
||
|
селезенка |
0,76 ± 0,06 |
0,15 ± 0,02 |
||
|
ск. м. |
1,28 ± 0,11 |
0,27 ± 0,03 |
||
|
подопытная, n = 11 |
печень |
1,83 ± 0,10 |
3,06 ± 0,34* |
|
|
почки |
1,21 ± 0,10 |
0,45 ± 0,03 |
||
|
сердце |
1,10 ± 0,11 |
0,17 ± 0,02 |
||
|
легкие |
0,95 ± 0,12 |
0,11 ± 0,03 |
||
|
селезенка |
0,73 ± 0,05 |
0,34 ± 0,21 |
||
|
ск. м. |
1,44 ± 0,20 |
0,43 ± 0,10 |
||
|
Лисица |
контрольная, n = 10 |
печень |
1,03 ± 0,13 |
5,18 ± 0,48 |
|
почки |
2,98 ± 0,36 |
0,65 ± 0,08 |
||
|
сердце |
1,81 ± 0,13 |
0,27 ± 0,05 |
||
|
легкие |
0,55 ± 0,03 |
0,05 ± 0,01 |
||
|
селезенка |
0,65 ± 0,07 |
0,16 ± 0,03 |
||
|
ск. м. |
1,57 ± 0,23 |
0,32 ± 0,12 |
||
|
подопытная, n = 11 |
печень |
3,26 ± 0,89* |
6,15 ± 1,32 |
|
|
почки |
5,97 ± 0,40*** |
1,79 ± 0,20*** |
||
|
сердце |
1,96 ± 0,13 |
0,17 ± 0,03 |
||
|
легкие |
0,53 ± 0,05 |
0,10 ± 0,01** |
||
|
селезенка |
0,59 ± 0,05 |
0,19 ± 0,04 |
||
|
ск. м. |
1,27 ± 0,08 |
0,27 ± 0,03 |
||
|
Песец |
контрольная, n = 9 |
печень |
7,19 ± 2,95 |
9,61 ± 2,16 |
|
почки |
1,37 ± 0,16 |
0,91 ± 0,08 |
||
|
сердце |
1,64 ± 0,13 |
0,19 ± 0,01 |
||
|
легкие |
0,14 ± 0,04 |
0,15 ± 0,02 |
||
|
селезенка |
0,56 ± 0,05 |
0,19 ± 0,02 |
||
|
ск. м. |
1,64 ± 0,62 |
0,27 ± 0,08 |
||
|
подопытная, n = 8 |
печень |
4,11 ± 0,71 |
7,11 ± 3,15 |
|
|
почки |
1,51 ± 0,11 |
0,96 ± 0,07 |
||
|
сердце |
2,01 ± 0,42 |
0,29 ± 0,09 |
||
|
легкие |
0,19 ± 0,04 |
0,11 ± 0,01 |
||
|
селезенка |
0,43 ± 0,04 |
0,13 ± 0,02 |
||
|
ск. м. |
0,82 ± 0,14 |
0,19 ± 0,04 |
||
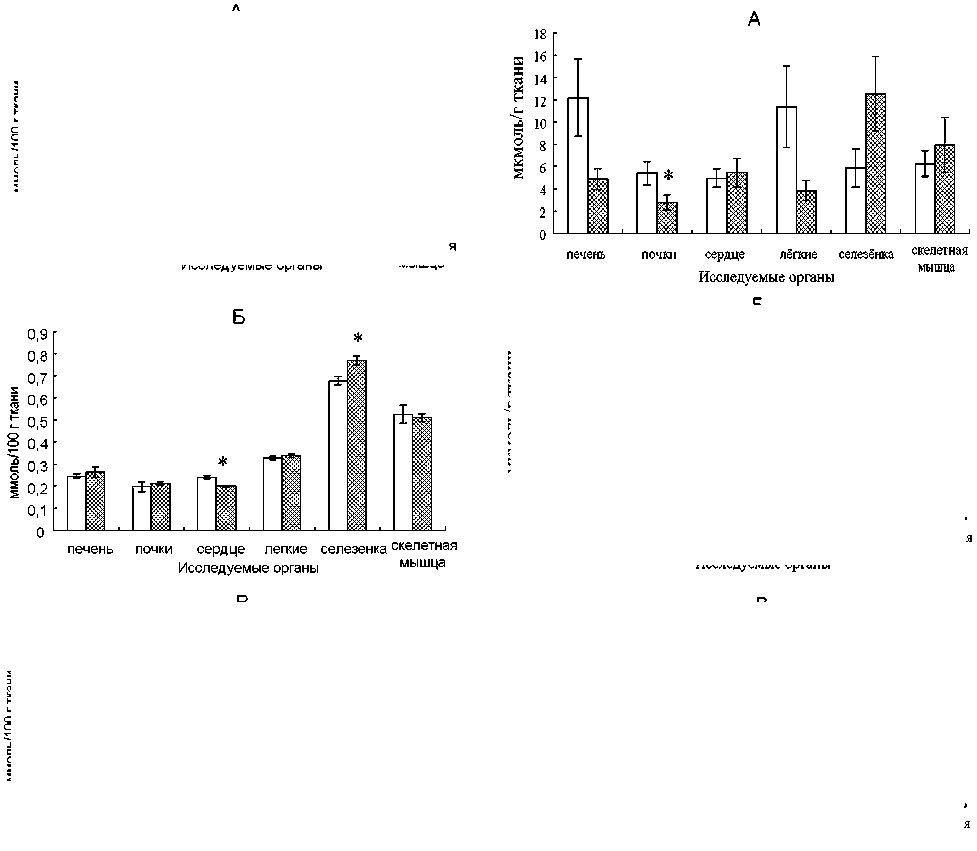
Рис. 1. Влияние селенита натрия на уровень GSH в тканях органов норок (А), лисиц (Б) и песцов (В). Условные обозначения: * – различия достоверны по сравнению с контролем в той же самой ткани (p < 0,05)
Группы:
□ контрольная @ подопытная
Группы:
□ контрольная ® подопытная
Рис. 2. Влияние селенита натрия на уровень ТБК-РП в тканях органов норок (А), лисиц (Б) и песцов (В). Условные обозначения: * – различия достоверны по сравнению с контролем в той же самой ткани (p < 0,05)
Лисицы
В отличие от норок, у которых изофермент-ные спектры ЛДГ только двух из шести органов (почки и сердце) характеризуются преобладанием фракций ЛДГ-1 и ЛДГ-2 над ЛДГ-4 и ЛДГ-5, у лисиц то же самое свойственно изоферментным спектрам ЛДГ четырех из шести органов (почки, сердце, легкие и селезенка) (см. табл. 1). Напротив, печень и скелетная мышца отличаются доминированием ЛДГ-4 и ЛДГ-5, что характерно для этих тканей большинства млекопитающих [16]. Так же как и у норок, селенит натрия не оказал воздействия на содержание изоферментов ЛДГ в тканях у лисиц (см. табл. 1).
У животных, получавших селен, отмечено увеличение активности СОД в печени и почках и увеличение активности каталазы в почках и легких по сравнению с контрольными особями (см. табл. 2). Эти антиоксидантные ферменты являются индуцибельными: синтез СОД определяется уровнем потребляемого О2 [11], а синтез каталазы активируется Н2О2 [8], образующейся как в реакции дисмутации О–2, так и в реакциях, катализируемых различными оксидазами. Зафиксированные нами изменения активности ферментов, скорее всего, связаны с увеличением количества их субстратов в соответствующих тканях органов. Почки наряду с печенью являются основ- ными депо селена в организме млекопитающих, причем если печень содержит лабильные запасы селена, то почки – органы, где преимущественно концентрируется селен при питании бездефицитной по микроэлементу диетой [9], [23]. Почки также являются местом синтеза и запасания некоторых высокоактивных селенопротеинов с последующим высвобождением их в кровяное русло, а также служат в качестве резерва селена в организме после гломерулярной фильтрации и реарбсорбции [14]. Легкие наряду с печенью и почками также характеризуются высокой скоростью обмена селена [23].
Уровень GSH снизился в сердечной мышце и увеличился в селезенке лисиц, получавших препарат с кормом, по сравнению с контрольными особями (см. рис. 1). Вероятно, это объясняется тесной связью GSH, главного внутриклеточного низкомолекулярного антиоксиданта, с метаболизмом селена и проявлением им биологической активности [30].
Содержание ТБК-РП не претерпело изменений под влиянием селенита натрия во всех исследованных органах лисиц, что говорит о том, что препарат не оказал воздействия на интенсивность ПОЛ (см. рис. 2). Перекисное окисление липидов является физиологическим процессом, который происходит в нормальных условиях жизнедеятельности, тем не менее его чрезмерное усиление может привести к деструктивным изменениям в клетках. Это связано с накоплением продуктов, способных инактивировать ферменты мембран, нарушать взаимодействия между белками и липидами в мембранах, образовывать межмолекулярные ковалентные сшивки между молекулами липидов или липидов и белков, изменять вязкость липидной фракции, что препятствует образованию фермент-субстратных комплексов, и т. д. [3].
У подопытных 3-месячных (август) и 4-месячных (сентябрь) самцов лисиц отмечено увеличение прироста живой массы, тогда как у 5-месячных (октябрь) лисиц обоих полов наблюдалась меньшая прибавка живой массы, при этом самцы отличались более низкой массой тела по сравнению с контрольными особями [6]. Известно [22], что как высокие, так и низкие дозы пищевого селена могут вызвать нарушения роста и развития организма млекопитающих. Избыточное потребление селена ведет к ингибированию синтеза гормона роста, недостаточное поступление микроэлемента с пищей вызывает изменение соотношения тиреоидных гормонов – повышение уровня Т4 и снижение Т3 [22]. Возможно, запаз- дывание в росте лисиц указывает на необходимость изменения дозы препарата.
Песцы
При исследовании особенностей изофермен-тных спектров ЛДГ тканей органов песцов выявлено, что, как и у лисиц, 4 из 6 исследованных органов (почки, сердце, легкие и селезенка) характеризуются преимущественно аэробным способом получения энергии, тогда как остальные (печень и скелетная мышца) – анаэробным (см. табл. 1). Воздействие селенита натрия выразилось в снижении суммарного содержания фракций ЛДГ-1 и ЛДГ-2 в печени, почках и сердце, увеличении суммарного содержания фракций ЛДГ-4 и ЛДГ-5 в почках и сердце, а также увеличении доли ЛДГ-3 в сердце и ее снижении в легких. Эти результаты могут объясняться тем, что действие селена на обмен веществ в организме основано на замедлении интенсивности аэробного окисления глюкозы [1].
В отличие от норок и лисиц, у песцов не зафиксировано воздействия селенита натрия на показатели антиоксидантной защиты тканей и уровень ПОЛ (содержание ТБК-РП) ни в одном из исследуемых органов (см. табл. 2, рис. 1, 2). Высокая устойчивость АОС песцов наряду с чувствительностью системы изоферментов ЛДГ к действию препарата отражает видовые черты функционирования физиологических систем и может быть связана с экологическими особенностями, в которых формировался вид. Песцы приспособлены к условиям Арктики, тогда как лисицы имеют самый обширный географический ареал среди представителей отряда Carnivora [13], в связи с чем обладают высоким адаптивным потенциалом, что, вероятно, и обуславливает различия реакции физиологических систем этих двух видов семейства Canidae на препараты.
Выявлено некоторое сходство влияния селенита натрия на прирост массы тела лисиц и песцов: увеличение этого показателя отмечалось у подопытных 4-месячных самцов песцов по сравнению с контрольными животными [6]. Поскольку в процессе роста организма ведущая роль принадлежит белковому обмену [5], то результаты нашего исследования указывают на интенсификацию синтеза белка у 4-месячных (сентябрь) самцов песцов, получавших селенит натрия. Со второй половины сентября у животных происходит интенсификация углеводного обмена, обусловленная энергетическими тратами на формирование зимнего опушения и отложением подкожного жира, за счет которого в основном и обеспечивается прирост живой массы в осенний период [2].
Как и у 5-месячных (октябрь) лисиц обоих полов, у самцов песцов того же возраста, получавших с кормом селенит натрия, наблюдался меньший привес, подопытные самцы обоих видов отличались более низкой массой тела по сравнению с контрольными особями [6].
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о том, что у трех видов хищных млекопитающих наблюдается различная реакция на дополнительное количество селена в рационе. У норок микроэлемент в исследуемой дозе не оказал воздействия на привес и динамику роста, практически не повлиял на систему изоферментов ЛДГ, интенсивность ПОЛ и активности антиоксидантных ферментов, но вызвал изменения содержания важного внутриклеточного антиокислителя GSH. Несмотря на то что у представителей семейства Canidae лисиц и песцов, получавших селенит натрия, наблюдались сходные изменения веса тела, реакция остальных изученных показателей различалась у этих двух видов. У лисиц более чувствительной к действию селена оказалась система антиоксидантной защиты, чем система изоферментов ЛДГ, тогда как у песцов – наоборот.
Тканеспецифичность реакции исследованных показателей животных на селенит натрия обусловлена особенностями влияния препарата на метаболизм определенных тканей и функциональной ролью органа. В таких органах, как печень, почки и легкие, которые участвуют в выведении продуктов метаболизма селена из организма млекопитающих [23], отмечено наибольшее количество изменений исследованных показателей. Тогда как для мышечных тканей выявлена низкая чувствительность показателей АОС и системы изоферментов ЛДГ к действию препарата.
Таким образом, при применении селенита натрия, как и других биологически активных веществ, необходимо учитывать видовые особенности экспериментальных животных, в соответствии с которыми подбирать дозировку препаратов для обеспечения наибольшего проявления ожидаемых результатов.
БЛАГОДАРНОСТИ
Авторы выражают глубокую благодарность доктору биологических наук, ведущему научному сотруднику ИБ КарНЦ РАН Льву Павловичу Смирнову за ценные рекомендации, высказанные при доработке окончательного варианта статьи.
* Работа выполнена на средства федерального бюджета, выделенные на выполнение государственного задания (темы № 50.1, № г. р. 01201358732), и при финансовой поддержке гранта Президента РФ для Ведущей научной школы 1410.2014.4.
Список литературы Влияние селенита натрия на изоферментные спектры лактатдегидрогеназы и некоторые показатели антиоксидантной системы тканей хищных млекопитающих
- Балакирев Н. А. Отбор пушных зверей по эволюционно несвойственным видам кормов и низкопротеиновому кормлению//Информационный вестник ВОГиС. 2007. Т. 11. № 1. С. 212-220.
- Берестов В. А., Кожевникова Л. К. Ферменты крови пушных зверей. Л.: Наука, 1981. 184 с.
- Зенков Н. К., Ланкин В. З., Менщикова Е. Б. Окислительный стресс. Биохимический и патофизиологический аспекты. М.: МАИК Наука Интерпериодика, 2001. 343 с.
- Кожевникова Л. К., Тютюнник Н. Н., Унжаков А. Р., Мелдо Х. И. Изоферменты лактатдегидрогеназы при сезонных адаптациях хищных пушных зверей//Журнал эволюционной биохимии и физиологии. 2000. Т. 36. № 1. С. 24-29.
- Перельдик Н. Ш., Милованов Л. В., Ерин А. Т. Кормление пушных зверей. М.: Колос, 1981. 335 с.
- Сергина С. Н., Ильина Т. Н., Илюха В. А., Фатышева М. В., Подлепина Л. Г. Особенности функционирования антиоксидантной системы хищных млекопитающих под влиянием селенита натрия//Сельскохозяйственная биология. 2009. № 6. С. 66-72.
- Этическая экспертиза биомедицинских исследований: Практические рекомендации/Под ред. Ю. Б. Белоусова. М.: Российское общество клинических исследователей, 2005. 156 с.
- Aebi H. E., Wyss S. R. Acatalasemia//The metabolic basis of metabolic disease. N.-Y.: McGraw-Hill, 1978. P. 1792-1807.
- Adamowicz A., Trafikowska U., Trafikowska A., Zachara B., Manitius J. Effect of erythropoietin therapy and selenium supplementation on selected antioxidant parameters in blood of uremic patients on long-term hemodialysis//Med. Sci. Monit. 2002. Vol. 8(3). P. CR202-5.
- Arthur J. R., McKenzie R. C., Beckett G. J. Selenium in the immune system//J. Nutr. 2003. Vol. 133. P. 1457S-1459S.
- Autor A. P., Stevens J. B. Mechanism of oxygen detoxication in neonatal rat lung tissue//Protochem. and Photobiol. 1978. Vol. 28. P. 775-780.
- Bears R. F., Sizes I. N. A spectral method for measuring the breakdown of hydrogen peroxide by catalase//J. Biol. Chem. 1952. Vol. 195(1). P. 133-140.
- Canids: foxes, wolves, jackals and dogs/Edited by C. Sillero-Zubiri, M. Hoffmann, D. W. Macdonald. IUCN -The World Conservation Union, 2004. 430 p.
- Cases J., Vacchina V., Napolitano A., Caporiccio B., Besançon P., Lobinski R., Rouanet J.-M. Selenium from selenium-rich spirulina is less bioavailable than selenium from sodium selenite and selenomethionine in selenium-deficient rats//J. Nutr. 2001. Vol. 131. P. 2343-2350.
- Halliwell B., Gutteridge J. M. C. Free Radicals in Biology and Medicine. Oxford: Oxford University Press, 1999. 888 p.
- Hochachka P. W., Somero G. N. Biochemical adaptation: mechanism and process in physiological evolution. Oxford: Oxford University Press, 2002. 466 p.
- Ip C. Lessons from basic research in selenium and cancer prevention//J. Nutr. 1998. Vol. 128. P. 1845-1854.
- Jacobs M., Frost C. Toxicological effects of sodium selenite in Sprague-Dawley rats//J. Toxicol. Environ. Health. 1981. Vol. 8. P. 575-585.
- Kim Y. Y., Mahan D. C. Comparative effects of high dietary levels of organic and inorganic selenium on selenium toxicity of growing-finishing pigs//J. Anim. Sci. 2001. Vol. 79. P. 942-948.
- Kim Y. Y., Mahan D. C. Effect of dietary selenium source, level, and pig hair color on various selenium indices//J. Anim. Sci. 2001. Vol. 79. P. 949-955.
- Kitabchi A. E., Challoner D. R., Williams R. H. Respiration and lipid peroxidation in tocopherol deficient rat hearts//Proc. Soc. Exp. Biol. Med. 1968. Vol. 127. P. 647-650.
- Köhrle J., Jakob F., Contempré B., Dumont J. E. Selenium, the thyroid, and the endocrine system//Endocrine Reviews. 2005. Vol. 26(7). P. 944-984.
- Lopez P. L., Preston R. L., Pfander W. H. Whole-body retention, tissue distribution and excretion of selenium-75 after oral and intravenous administration in lambs fed varying selenium intakes//J. Nutr. 1969. Vol. 97. P. 123-132.
- Lowry O. H., Rosenbrough N. J., Farr A. L., Randan R. J. Protein measurement with the Folin phenol reagent//J. Biol. Chem. 1951. Vol. 193(1). Р. 265-275.
- Mahan D. C., Cline T. R., Richert B. Effects of dietary levels of selenium-enriched yeast and sodium selenite as selenium sources fed to growing-finishing pigs on performance, tissue selenium, serum glutathione peroxidase activity, carcass characteristics, and loin quality//J. Anim. Sci. 1999. Vol. 77. P. 2172-2179.
- Misra H. P., Fridovich F. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase//J. Biol. Chem. 1972. Vol. 247(10). Р. 3170-3175.
- Nogueira C. W., Zeni G., Rocha J. B. T. Organoselenium and organotellurium compounds//Toxicol. Pharmacol. Chem. Rev. 2004. Vol. 104. P. 6255-6285.
- Philp A., Macdonald L. A., Watt P. W. Lactate -a signal coordinating cell and systemic function//J. Exp. Biol. 2005. Vol. 208. P. 4561-4575.
- Sedlak J., Lindsay R. H. Estimation of total, protein-bound and non-protein sulfhydryl groups in tissue with Ellman’s reagent//Anal. Biochem. 1968. Vol. 25. P. 192-205.
- Shen H., Yang C., Liu J., Ong C. Dual role of glutathione in selenite-induced oxidative stress and apoptosis in human hepatoma cells//Free Rad. Biol. Med. 2000. Vol. 28(7). P. 1115-24.
- Stambaugh R., Post D. Substrate and product inhibition of rabbit muscle lactic dehydrogenase heart (H4) and muscle (M4) isozymes//J. Biol. Chem. 1966. Vol. 241(7). P. 1462-1467.
- Tiwary A. K., Stegelmeier B. L., Panter K. E., James L. F., Hall J. O. Comparative toxicosis of sodium selenite and selenomethionine in lambs//J. Vet. Diagn. Invest. 2006. Vol. 18. P. 61-70.
- Tos-Luty S., Obuchowska-Przebirowska D., Latuszynska J., Musik I., Tokarska-Rodak M. Comparison of histological and ultrastructural changes in mice organs after supplementation with inorganic and organic selenium//Ann. Agric. Environ. Med. 2003. Vol. 10. P. 87-91.
- Wieme R. Studies on agar-gel electrophoresis. Brussel: Arscia N. V., 1959. 519 p.
- Yeh J.-Y., Gu Q. -P., Beilstein M. A., Forsberg N. E., Whanger P. D. Selenium influences tissue levels of sele noprotein W in sheep//J. Nutr. 1997. Vol. 127. P. 394-402.


