Влияние содержания Fe3O4 в наночастицах Fe3O4-Fe со структурой ядро-оболочка на их противоопухолевую активность in vitro
Автор: Бакина О.В., Ложкомоев А.С., Казанцев С.О., Августинович А.В., Афанасьев С.Г., Спирина Л.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.21, 2022 года.
Бесплатный доступ
Введение. В настоящее время основное число препаратов, применяемых в терапии опухолей, имеют высокую токсичность. Применение магнитных наночастиц оксидов железа в качестве противоопухолевых агентов позволяет предотвратить нецелевую цитотоксичность и другие побочные эффекты традиционной химиотерапии. Однако оно в значительной степени ограничено их низкой эффективностью. Применение в наночастицах гальванической пары Fe3o4-Fe позволит контролировать выделение токсичных ионов железа и, соответственно, активность наночастиц. Целью исследования явилась разработка наночастиц Fe3o4-Fe с противоопухолевой активностью in vitro . Материал и методы. Для достижения поставленной цели синтезированы наночастицы (НЧ), содержащие от 5 до 90 % железа, проведено систематическое исследование структурных, текстурных, зарядовых, морфологических и магнитных свойств наночастиц, а также их активности in vitro в отношении опухолевых линий mcF-7 и Hela. Для получения наночастиц Fe3o4-Fe использовали электрический взрыв проволоки. Физико-химические свойства исследованы при помощи рентгенофазового анализа, тепловой десорбции азота, просвечивающей электронной микроскопии, микроэлектрофореза. Противоопухолевую активность исследовали при помощи МТТ-теста. Результаты. В результате электрического взрыва железной проволоки в газовой смеси аргон + кислород, содержащей кислород в диапазоне 1-5 об. %, были получены НЧ Fe3o4-Fe с 5-90 % масс. Fe3o4 соответственно. Исследование физико-химических свойств наночастиц показало, что зета-потенциал не зависит от содержания Fe3o4 в НЧ и составляет -30 мВ. Средний размер частиц проходит через максимум (минимум величины удельной поверхности) при содержании Fe3o4 W=20 %, что можно объяснить механизмом образования оксидной фазы при элек-трическом взрыве. При помощи МТТ-теста установлено, что наибольшей цитоксичностью обладают наночастицы, содержащие 5 % масс. Fe3o4, в присутствии которых в концентрации 1 мг/мл количество живых клеток снижалось до 16 % относительно контроля. Заключение. Впервые показано, что частицы Fe3o4-Fe можно использовать в качестве противоопухолевого агента. Возможность регулирования магнитных свойств НЧ можно использовать для нацеливания на определенный участок опухолевой ткани с помощью внешнего магнитного поля, а установленная взаимосвязь магнитного момента с активностью НЧ в отношении клеточной линии mcF-7 имеет большие перспективы для клинического применения.
Железо, оксид железа, опухолевые клетки, наночастицы
Короткий адрес: https://sciup.org/140295755
IDR: 140295755 | УДК: 616-006:546.72:57.085.23 | DOI: 10.21294/1814-4861-2022-21-4-80-89
Текст научной статьи Влияние содержания Fe3O4 в наночастицах Fe3O4-Fe со структурой ядро-оболочка на их противоопухолевую активность in vitro
Противоопухолевые препараты имеют высокую токсичность и провоцируют различные побочные эффекты. Применение наночастиц (НЧ) со средним размером менее 100 нм обусловлено их уникальными свойствами, такими как большая площадь поверхности, возможность диффузии в ткани и более низкая скорость осаждения [1]. В связи с этим разрабатываются новые материалы на основе НЧ железа и оксидов железа, позволяющие доставить лекарственные средства к месту поражения и сами по себе обладающие противоопухолевой активностью [2].
Разработанные системы доставки на основе магнитных НЧ позволили значительно улучшить результаты лечения, благодаря направленному воздействию на очаг поражения, способности регулировать скорость распада препарата и обеспечивать высвобождение лекарства с постоянной скоростью [3]. НЧ железа и его оксидов, в отличие от других магнитных металлов (кобальта и никеля), не обладают выраженной цитотоксичностью [4] и чаще всего используются как противоопухолевые агенты, а также для диагностики и визуализации [5].
Среди оксидов железа (гематит α-Fe2O3, магнетит Fe3O4 и маггемит γ-Fe2O3) для биомедицинского применения наиболее приемлемым является магнетит (Fe3O4) благодаря его биосовместимости, способности к биорезорбции и химической стабильности [6]. Уникальные магнитные свойства Fe3O4 объясняются тем, что он является ферримагнетиком и имеет кубическую структуру шпинели с плотной упаковкой, образующей гранецентрированную кубическую решетку [7]. Исследование возможности применения НЧ Fe3O4 в качестве самостоятельных противоопухолевых агентов проводится сравнительно недавно. Так, группа авторов [8] обнаружила пероксидазную активность НЧ Fe3O4 в условиях клеточного микроокружения. Данный механизм был подтвержден в работе [9] на примере клеточных линий HepG2 и A549. Авторы показали, что в основе механизма противоопухолевой активности наночастиц Fe3O4 лежит их способность генерировать активные формы кислорода (АФК), вызывая окислительный стресс и последующий апоптоз раковых клеток. Возможность применения НЧ Fe3O4 для генерации АФК в системе Фентона, содержащей перекись водорода H2O2, при терапии опухолей и химический механизм процесса продемонстрированы в работе [10]. Ионизация наночастиц оксида железа в слабокислой среде с выделением Fe2+ и их взаимодействие по реакции диспропорционирования с H2O2 приводили к образованию АФК, в основном в виде радикалов OH•, которые значительно снижали жизнеспособность опухолевых клеток за счет перекисного окисления липидов, разрыва цепей ДНК, мутации или транслокации на уровне ядер клеток [11]. Фотокаталитическая терапия опухолей с применением НЧ Fe3O4 также описана в работах [12, 13], однако в данном направлении необходимо проведение дополнительных исследований механизмов апоптоза в условиях клеточного микроокружения [14].
Важным параметром, обусловливающим противоопухолевую активность НЧ Fe3O4, является их размер. Установлено, что НЧ с размером 5 нм способны накапливаться в ядре клеток благодаря более быстрому высвобождению ионов железа Fe2+ [15]. Однако повышенная концентрация ионов железа Fe2+, проникающих в митохондрии, способствует клеточному апоптозу [11], что обеспечивает их выраженную цитотоксичность и в отношении нормальных клеток. Накопление ионов железа также способствует нейродегенеративным заболеваниям, связанным с агрегацией белков Аβ и α-синуклеина [16]. Таким образом, возможность контроля выделения ионов Fe2+ является важным критерием при разработке противоопухолевых агентов на основе НЧ Fe3O4.
Цель исследования – разработка наночастиц Fe3O4-Fe с противоопухолевой активностью in vitro .
В работе были получены магнитные НЧ Fe3O4-Fe с различным содержанием оксида Fe3O4. Применение такой системы, образующей гальваническую пару в физиологических жидкостях, позволит контролировать выделение токсичных ионов железа и, соответственно, активность наночастиц. Исследованы физико-химические свойства полученных наночастиц и их противоопухолевая активность в отношении клеточных линий MCF-7 и HeLa.
Материал и методы
Наночастицы Fe3O4-Fe получали электрическим взрывом железной проволоки в смешанной атмосфере аргон + кислород по ранее описанной методике [17]. Регулирование содержания оксида железа в наночастицах Fe3O4-Fe осуществляли изменением содержания кислорода и аргона в газовой смеси в соответствии с табл. 1.
Для исследования структуры НЧ использовали метод рентгеноструктурного анализа (РСА), рентгеновский дифрактометр Shimadzu XRD 6000, Япония. Размер частиц исследовали седиментационным методом с применением дисковой центрифуги CPS 24000 (CPS Disc Instruments, США). Текстуру НЧ исследовали методом тепловой десорбции азота на анализаторе Сорбтометр М, Россия. Удельную поверхность рассчитывали методом БЭТ [18]. Для оценки морфологии НЧ использовали просвечивающую электронную микроскопию (JEM-2100, Япония) со встроенной
Таблица 1/Table 1
Условия получения НЧ Fe-Fe3O4
Conditions for obtaining Fe-Fe3O4 nanoparticles
|
Образец/ Sample |
Содержание Fe3O4, масс. %/ Fe3O4, mass ratio, % |
Содержание O2в газовой смеси, об. %/ O2 content of in the gas mixture), vol. % |
Содержание Ar в газовой смеси, об. %/ Ar content of in the gas mixture), vol. % |
|
Fe3O4(5)-Fe |
4 |
1,00 |
99,00 |
|
Fe3O4(20)-Fe |
20 |
1,30 |
98,70 |
|
Fe3O4(40)-Fe |
35 |
1,75 |
98,25 |
|
Fe3O4(90)-Fe |
91 |
5,00 |
95,00 |

Рис. 1. Электронно-микроскопическое изображение НЧ Fig. 1. TEM-image of nanoparticles
приставкой энергодисперсионного анализа XMax. Измерения дзета-потенциала образцов проводили методом микроэлектрофореза с использованием анализатора Zetasizer Nano ZSP, Великобритания.
Противоопухолевую активность НЧ исследовали при помощи МТТ-теста на эпителиоподобной культуре клеток аденокарциномы протоков молочной железы MCF-7 (ATCC HTB-22) и клеточной линии HeLa, выделенной из опухоли шейки матки, предоставленных ФБУН ГНЦ ВБ «Вектор» (Россия). Предварительно получали экстракты НЧ после деградации в течение 24 ч при 37 °Ϲ в физиологическом растворе NaCl (0,9 масс. %) в соответствии с ГОСТом [19]. Клетки предварительно культивировали при 37 °Ϲ в атмосфере 5 % CO2/95 % воздуха (СО2-инкубатор Sanyo, Япония) в среде DMEM (HiClone) с добавлением 5 % сыворотки эмбрионов коров и гентамицина. После инкубирования клетки помещали в 12-луночные культуральные планшеты в количестве 500 тыс. клеток/лунка и добавляли экстракты из расчета 10 мкл экстракта на 1000 мкл среды. Через 24 ч инкубирования цитотоксичность экстрактов оценивали при помощи МТТ-теста. Процедура проведения МТТ-теста детально описана в протоколе [20], определение оптической плотности проводили при длине волны 540 нм с использованием планшетного спектрофотометра (Multiscan FC, Thermo Scientific, США).
Результаты
В результате электрического взрыва железной проволоки в газовой смеси аргон + кислород, содержащей кислород в диапазоне 1‒5 об. %, были получены НЧ Fe3O4-Fe с 5‒90 масс %. Fe3O4 соответственно. Характерные электронномикроскопические изображения НЧ приведены на рис. 1.
В образце Fe3O4(5)-Fe наблюдалось небольшое число частиц, имеющих шестиугольную и прямоугольную формы, все частицы в основном были сферическими. Увеличение содержания кислорода при получении НЧ до 1,3 об. % (образец Fe3O4(20)-Fe) приводило к резкому увеличению количества НЧ с отклонениями от сферической формы, наблюдалось большое количество частиц шестиугольной и прямоугольной формы. Дальнейшее увеличение содержания Fe3O4 в НЧ приводило к увеличению количества сферических НЧ. Основные физикохимические характеристики синтезированных НЧ приведены в табл. 2.
Противоопухолевую активность НЧ Fe3O4-Fe исследовали на линиях клеток HeLa и MCF-7. Клеточная линия HeLa выделена из опухоли шейки матки. MCF-7 – это эпителиоподобная культура клеток аденокарциномы протоков молочной железы. Данными, полученными при помощи МТТ-теста, установлено, что с увеличением концентрации НЧ происходит равномерное снижение количества жи-
Таблица 2/Table 2
Удельная поверхность (Sуд), средний размер частиц (an), фазовый состав и дзета-потенциал ( ζ ) НЧ Fe3O4-Fe
Specific Surface area (SSA), average particle size (an), phase composition and zeta-potential (ζ) of Fe3O4-Fe Nps
|
Образец/ Sample |
Sуд, м2×г-1/ SSуA, m2×g-1 |
an , нм/ an , nm |
Фазовый состав, a Fe |
масс. %/Phase co Fe3O4 |
mposition wt. % FeO |
ζ, мВ/ ζ, mV |
|
Fe3O4(5)-Fe |
10,3 ± 0,4 |
68 ± 2 |
95,7 |
4,3 |
– |
-29,4 ± 0,2 |
|
Fe3O4(20)-Fe |
7,5 ± 0,7 |
81 ± 5 |
80,3 |
19,2 |
0,4 |
-30,7 ± 0,5 |
|
Fe3O4(40)-Fe |
8,2 ± 0,7 |
78 ± 3 |
60,4 |
38,9 |
0,7 |
-28,5 ± 0,3 |
|
Fe3O4(90)-Fe |
11,4 ± 0,1 |
65 ± 2 |
8,3 |
90,7 |
1 |
-28,2 ± 0,3 |
Примечание: ± стандартное отклонение для n=3 при определении удельной поверхности (Sуд) и дзета-потенциала (ζ) образцов; n=5, для определения среднего размера частиц ( an ).
Note: ±SD n=3 for SSA and zeta-potential of samples; n=3 for average particle size ( an ).
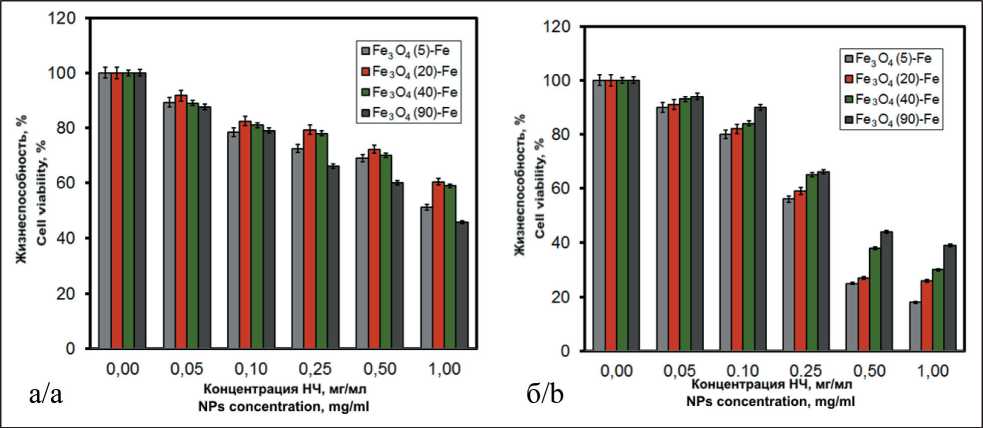
Рис. 2. Жизнеспособность клеточных линий HeLa (a) и MCF-7 (б) в присутствии НЧ Fe3O4-Fe, рассчитанная в % относительно контроля.
Примечание: вертикальные линии обозначают ±стандартное отклонение, n=5 для всех протестированных образцов Fig. 2. HeLa (a) and MCF-7 (b) cell viability in the presence of Fe3O4-Fe NPs, calculated in % relative to control.
Note: vertical lines represent ±SD, n=5 for all tested samples
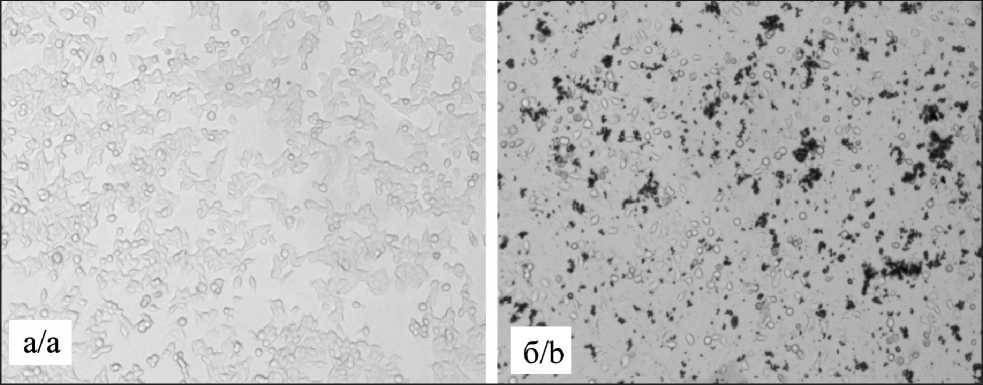
Рис. 3. Фотографическое изображение клеточной линии MCF-7 до (а) и после (б) контакта с НЧ Fe3O4(5)-Fe Fig. 3. MCF-7 cell line images before (a) and after (b) Fe3O4(5)-Fe NPs contact
вых клеток. При концентрации наночастиц 1 мг/мл количество живых клеток линии HeLa составляло около 60 % относительно контрольного образца, не обработанного экстрактом НЧ (рис. 2а).
Линия MCF-7 проявила большую чувствительность к воздействию НЧ (рис. 2б). В отличие от линии HeLa, наименьшей цитотоксичностью обладали НЧ Fe3O4(90)-Fe. При концентрации наночастиц 1 мг/мл наблюдалось снижение жизнеспособности клеток до 40 % относительно контроля. Наибольшей цитотоксичностью обладали наночастицы Fe3O4(5)-Fe, в присутствии которых в концентрации 1 мг/мл количество живых клеток снижалось до 16 % относительно контроля. Фотографические изображения клеточной культуры MCF-7 до (рис. 3а) и после (рис. 3б) контакта с НЧ демонстрируют значительное снижение количества распластанных клеток, что подтверждает негативное воздействие НЧ на клетки.
Обсуждение
Исследование структурных характеристик НЧ показало, что основными фазами в НЧ Fe3O4-Fe являются магнетит Fe3O4, который является двойным оксидом (Fe2O3×FeO) со структурой шпинели, и металлическое железо. Кроме того, в образцах обнаруживаются следовые (менее 1 %) количества оксида железа (II) FeO (вюстита), который является термодинамически нестабильной фазой и при температурах менее 560 °С претерпевает эвтектоидный распад с образованием Fe и Fe3O4 [21]. Наличие вюстита в образцах, вероятно, объясняется быстрым охлаждением расширяющихся продуктов электрического взрыва со скоростью до 107–109 К/с [22].
Дзета-потенциал НЧ не зависел от содержания Fe3O4 в НЧ и составлял ≈ -30 мВ. Зависимости основных физико-химических параметров НЧ (удельная поверхность S уд, средний размер an ) от массовой доли Fe3O4 W в НЧ приведены на рис. 4.
Такое изменение физико-химических свойств НЧ с экстремумом при содержании Fe3O4 W=20 % можно объяснить механизмом образования оксидной фазы при электрическом взрыве. При малом содержании кислорода в газовой смеси (1,0 об. %) экзотермический эффект реакции окис-
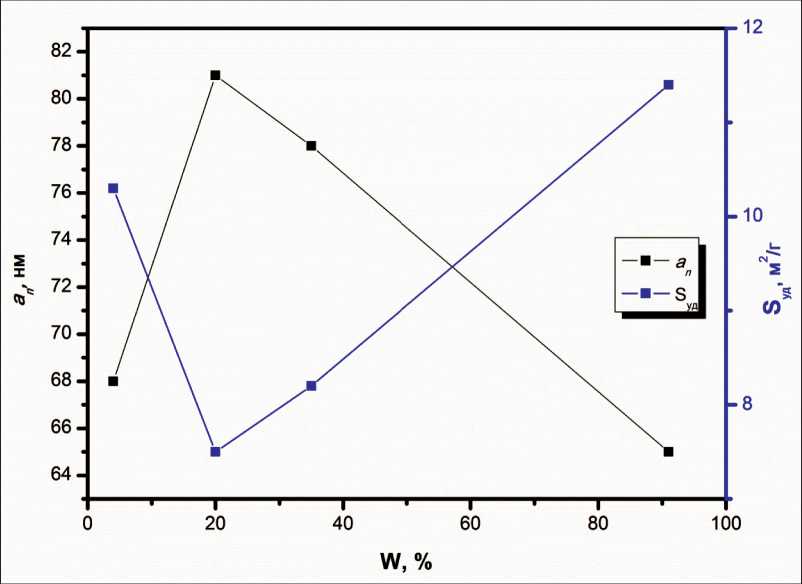
Рис. 4. Экспериментальные зависимости удельной поверхности ( S уд) и среднего размера ( an ) НЧ от массовой доли (W) Fe3O4 в НЧ Fe3O4-Fe
Fig. 4. Experimental curves of dependence of specific surface (SSA) and average particle size (an) on Fe3O4 mass ratio (W)
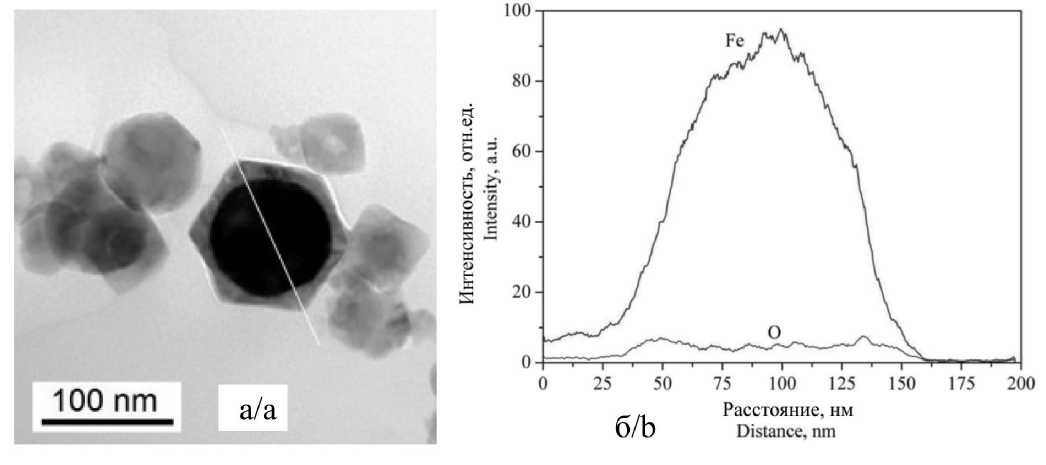
Рис. 5. ПЭМ-изображение (a) и энергодисперсионный анализ (б) в режиме картирования по линии НЧ Fe3O4(20)-Fe Fig. 5. TEM image (a) and energy-dispersive analysis (b) in the mode of mapping along line of Fe3O4(20)-Fe NPs
ления железа был небольшим, формирование Fe3O4 в образце Fe3O4(5)-Fe в основном происходило за счет диффузии кислорода в объем металла. Содержание Fe3O4 в данном образце было наименьшим. Увеличение содержания кислорода до 1,3 об. % при получении образца Fe3O4(20)-Fe приводило к испарению железа с поверхности основной массы жидких наночастиц. Взаимодействие железа с кислородом происходило в данных условиях в тонком слое газовой фазы, прилегающем к поверхности наночастиц. На поверхности железных наночастиц формировался слой FeO, который при охлаждении дисперсной системы, согласно фазовой диаграмме, распадался на α-Fe и Fe3O4. Для данного образца наблюдались изменение морфологии НЧ и наибольшее количество НЧ ограненной и квадратной формы. Структура ядро-оболочка для данных НЧ была также подтверждена при помощи энергодисперсионного анализа, приведенного на рис. 5.
Дальнейший рост содержания кислорода до 1,75 об. % увеличивал экзотермический эффект реакции и приводил к полному испарению наиболее мелких наночастиц. В данном случае формирование наночастиц происходило в соответствии с двумя механизмами: 1) часть НЧ формировалась непосредственно из газовой фазы, что обеспечивает их сферическую форму, и была представлена только Fe3O4; 2) другая часть наночастиц образовывалась при формировании оболочки из FeO вокруг металлического ядра из газовой фазы, которое распадалось при охлаждении на α-Fe и и Fe3O4. С увеличением содержания кислорода до 5 об. % количество НЧ, формирующихся по первому механизму, увеличивалось. Таким образом, увеличение содержания кислорода в газовой смеси приводит сначала к росту количества НЧ со структурой ядро-оболочка. Их максимальное содержание достигалось для НЧ Fe3O4(20)-Fe. Дальнейшее увеличение содержания кислорода приводило к увеличению содержания НЧ оксида железа Fe3O4.
Влияние НЧ на жизнеспособность опухолевых клеточных линий определяли в широком диапазоне
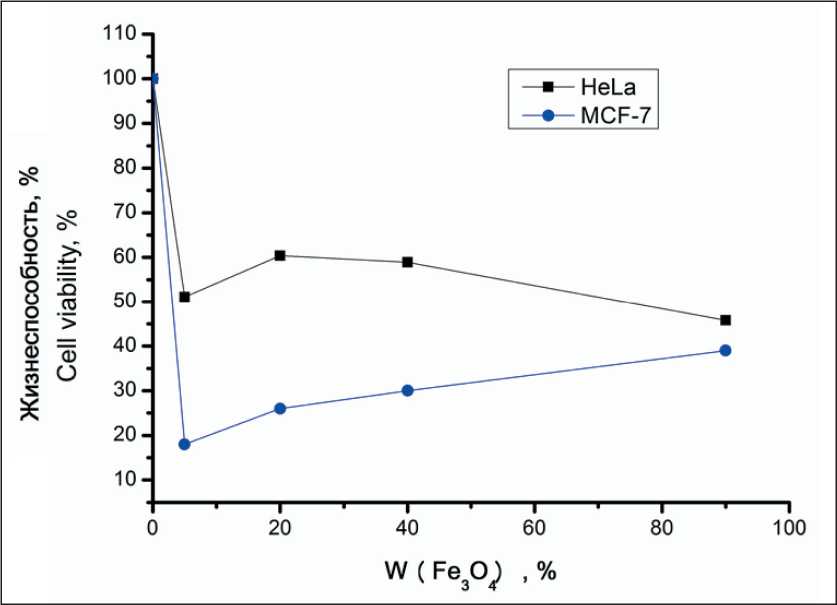
Рис. 6. Влияние массовой доли Fe3O4 в НЧ Fe3O4-Fe на жизнеспособность клеточных линий
-
Fig. 6. Effect of Fe3O4 mass ratio on the cell viability
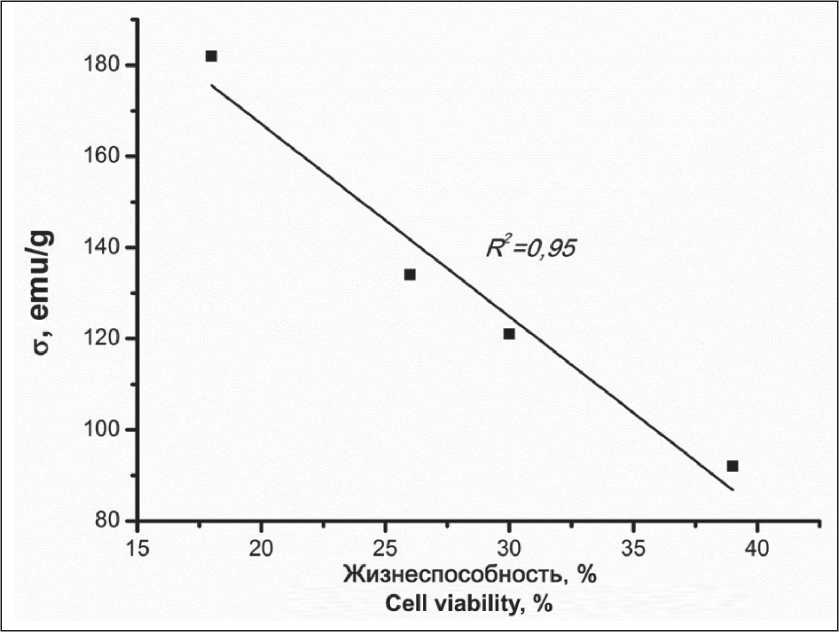
Рис. 7. Влияние магнитного момента (σ) НЧ Fe3O4-Fe на жизнеспособность клеточной линии MCF-7
-
Fig. 7. Effect of the Fe3O4-Fe NP magnetic moment (σ) on the MCF-7 cell viability
концентраций наночастиц в течение 24 ч инкубирования при помощи МТТ-теста. МТТ является основным методом оценки цитотоксичности биоматериалов [23]. Метод основан на способности дегидрогеназы митохондрий живых клеток восстанавливать бромид тетразолия до пурпурных кристаллов формазана, количество которых коррелирует с количеством живых клеток.
Как показали проведенные исследования, в присутствии НЧ наблюдалось снижение пролиферации, которое нелинейно зависело от содержания Fe3O4в НЧ. Зависимость жизнеспособности клеточных линий от содержания Fe3O4 в образцах приведена на рис. 6.
R.A. Petros et al. установлено, что транспорт НЧ через мембрану опухолевых клеток в значительной степени определяется их размером и оптимальными являются НЧ с размером 50–70 нм [24]. Помимо эффективного поглощения НЧ важна также возможность их удержания, частицы менее 50 нм подвергаются экзоцитозу в течение 24 ч по- сле поглощения [25]. Полученные нами данные по жизнеспособности культуры HeLa (рис. 6) хорошо коррелировали со средним размером НЧ (рис. 4). Снижение размера частиц приводит и к увеличению выделения ионов Fe2+, которые, по данным [26], нарушают синтез ДНК опухолевых клеток, что вносит основной вклад в снижение их пролиферации.
Однако подобной корреляции не наблюдалось в отношении клеточной линии MCF-7. Как показано на рис. 6, данная линия обладала высокой чувствительностью к НЧ при высоких концентрациях НЧ. Жизнеспособность клеточной линии снижалась с уменьшением количества в Fe3O4 НЧ. При построении зависимости магнитных свойств НЧ (магнитного момента) наблюдалась практически линейная зависимость с высоким коэффициентом корреляции (рис. 7).
Насколько нам известно, такая зависимость наблюдалась впервые и требует проведения дополнительных исследований в экспериментах in vivo .
Чувствительность клеточной линии HeLa к магнитному моменту НЧ не носила линейного характера, однако для НЧ с наибольшим магнитным моментом (182 emu/g) характерно наибольшее подавление жизнеспособности клеток (48 %). Полученный в работе эффект позволит регулировать свойства синтезированных НЧ под действием внешнего магнитного поля и делает их перспективными при использовании в качестве медиаторов гипертермии при лечении онкологических заболеваний.
Заключение
С каждым годом все больше растет интерес исследователей к применению магнитных НЧ оксидов железа в различных биомедицинских приложениях, включая разделение клеточных смесей, выделение антител, создание биосенсоров и биочипов, магнитно-резонансную томографию и т. д. Способность железа к комплексообразованию
Список литературы Влияние содержания Fe3O4 в наночастицах Fe3O4-Fe со структурой ядро-оболочка на их противоопухолевую активность in vitro
- Park J., An K, Hwang Y., Park J.G., Noh H.J., Kim J.Y., Park J.H., Hwang N.M., Hyeon T. Ultra-large-scale syntheses of monodisperse nano-crystals. Nat Mater. 2004; 3(12): 891-5. doi: 10.1038/nmat1251.
- SoetaertF., KorangathP., SerantesD., Fiering S., Ivkov R. Cancer therapy with iron oxide nanoparticles: Agents of thermal and immune therapies. Adv Drug Deliv Rev. 2020. doi: 10.1016/j.addr.2020.06.025.
- Ebadi M., Buskaran K., Bullo S., Hussein M.Z., Fakurazi S., Pastorin G. Drug delivery system based on magnetic iron oxide nanoparticles coated with (polyvinyl alcohol-zinc/aluminium-layered double hydroxide-sorafenib). Alexandria Eng J. 2021. 60(1): 733-47. doi: 10.1016/j. aej.2020.09.061.
- Hernández-Hernández A.A., Aguirre-Alvarez G., Cariño-CortésR., Mendoza-Huizar L.H., Jiménez-Alvarado R. Iron oxide nanoparticles: synthesis, functionalization, and applications in diagnosis and treatment of cancer. Chem Papers. 2020.74(11): 3809-24. doi: 10.1007/s11696-020-01229-8.
- Yalcin S., Gündüz U. Iron oxide-based polymeric magnetic nano-particles for drug and gene delivery: in vitro and in vivo applications in cancer. Handbook Polym Ceram Nanotechnol. 2021: 1271-92. doi: 10.1007/978-3-030-10614-0_38-1.
- ReviaR.A., ZhangM. Magnetite nanoparticles for cancer diagnosis, treatment, and treatment monitoring: recent advances. Mater Today (Kidlington). 2016; 19(3): 157-68. doi: 10.1016/j.mattod.2015.08.022.
- Pinna N., Grancharov S., Beato P., Bonville P., Antonietti M., Niederberger M. Magnetite nanocrystals: nonaqueous synthesis, characterization, and solubility. Chem Mater. 2005. 17(11): 3044-9. doi: 10.1021/cm050060+.
- Chen Z., Yin J.J., Zhou Y.T., Zhang Y., Song L., Song M., Hu S., Gu N. Dual enzyme-like activities of iron oxide nanoparticles and their implication for diminishing cytotoxicity. ACS Nano. 2012; 6(5): 4001-12. doi: 10.1021/nn300291r.
- AhamedM., Alhadlaq H.A., MajeedKhanM.A., JavedAkhtar M. Selective killing of cancer cells by iron oxide nanoparticles mediated through reactive oxygen species via p53 pathway. J Nanopart. Res. 2013. 15(1): 1-11 doi: 10.1007/s11051-012-1225-6.
- Zhang C., Bu W., Ni D., Zhang S., Li Q., Yao Z., Zhang J., Yao H., Wang Z., Shi J. Synthesis of iron nanometallic glasses and their application in cancer therapy by a localized Fenton reaction. Angewandte Chemie. 2016. 128(6): 2141-6. doi: 10.1002/anie.201510031.
- Yarjanli Z., Ghaedi K., Esmaeili A., Rahgozar S., Zarrabi A. Iron oxide nanoparticles may damage to the neural tissue through iron accumulation, oxidative stress, and protein aggregation. BMC Neurosci. 2017; 18(1): 51. doi: 10.1186/s12868-017-0369-9.
- Buiculescu R., Stefanakis D., Androulidaki M., Ghanotakis D., Chaniotakis N.A. Controlling carbon nanodot fluorescence for optical biosensing. Analyst. 2016. 141(13): 4170-80. doi: 10.1039/c6an00783j.
- Huo M., Wang L., Chen Y., Shi J. Tumor-selective catalytic nano-medicine by nanocatalyst delivery. Nat Commun. 2017; 8(1): 357. doi: 10.1038/s41467-017-00424-8.
- Saeed M., Ren W., Wu A. Therapeutic applications of iron oxide based nanoparticles in cancer: basic concepts and recent advances. Biomater Sci. 2018. 6(4): 708-25. doi: 10.1039/c7bm00999b.
- TianX., RuanL., Zhou S., Wu L., Cao J., QiX., ZhangX., Shen S. Appropriate size of Fe3O4 nanoparticles for cancer therapy by ferroptosis. ACS App Bio Mater 2022. 5(4): 1692-9. doi:10.1021/acsabm.2c00068.
- Niu X., Chen J., Gao J. Nanocarriers as a powerful vehicle to overcome blood-brain barrier in treating neurodegenerative diseases: Focus on recent advances. Asian J Pharm Sci. 2019; 14(5): 480-96. doi: 10.1016/j.ajps.2018.09.005.
- Lozhkomoev A.S., Pervikov A.V., Kazantsev S.O., Sharipova A.F., Rodkevich N.G., Toropkov N.E., Suliz K.V., Svarovskaya N.V., Kondrano-va A.M., Lerner M.I. Synthesis of Fe/Fe3O4 core-shell nanoparticles by electrical explosion of the iron wire in an oxygen-containing atmosphere. J Nanopart Res. 2021. 23(3): 1-12. doi: 10.1007/s11051-021-05180-x.
- HwangN., BarronA.R. BET surface area analysis of nanoparticles. The Connexions project. 2011: 1-11.
- ГОСТ ISO 10993-5-2011. Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro». 2013. [GOSTISO 10993-5-2011. Medical devices. Biological evaluation of medical devices. Part 5. Tests for in vitro cytotoxicity. 2013. (in Russian)].
- vanMeerloo J., Kaspers G.J., Cloos J. Cell sensitivity assays: the MTT assay. Methods Mol Biol. 2011; 731: 237-45. doi: 10.1007/978-1-61779-080-5_20.
- Hussey R.J., Cohen M. The oxidation of Fe in the temperature range 450-550 °C. II. The pressure range 10-3-760 Torr. Corrosion Sci. 1971. 11(10): 713-21. doi:10.1016/S0010-938X(71)80004-5.
- Sindhu T.K., Sarathi R., Chakravarthy S.R. Understanding nano-particle formation by a wire explosion process through experimental and modelling studies. Nanotechnology. 2008; 19(2). doi: 10.1088/0957-4484 /19/02/025703.
- ChenD., Tang Q., LiX., ZhouX., Zang J., Xue W.Q., Xiang J.Y., Guo C.Q. Biocompatibility of magnetic Fe3O4 nanoparticles and their cytotoxic effect on MCF-7 cells. Int J Nanomedicine. 2012; 7: 4973-82. doi: 10.2147/IJN.S35140.
- Petros R.A., DeSimone J.M. Strategies in the design of nano-particles for therapeutic applications. Nat Rev Drug Discov. 2010; 9(8): 615-27. doi: 10.1038/nrd2591.
- Popescu R.C., Savu D., Dorobantu I., Vasile B.S., Hosser H., BoldeiuA., TemelieM., StraticiucM., IancuD.A., AndronescuE., WenzF., Giordano F.A., Herskind C., Veldwijk M.R. Efficient uptake and retention of iron oxide-based nanoparticles in HeLa cells leads to an effective intracellular delivery of doxorubicin. Sci Rep. 2020; 10(1). doi: 10.1038/ s41598-020-67207-y.
- Ye P., Ye Y., Chen X., Zou H., Zhou Y., Zhao X., Kong X. Ultrasmall Fe3O4 nanoparticles induce S-phase arrest and inhibit cancer cells proliferation. Nanotechnol. Rev. 2020; 9(1): 61-9. doi: 10.1515/ntrev-2020-0006.


