Влияние совместного применения медного хлорофиллина, глутатиона и гидролизата плаценты на физиологические параметры и выживаемость мышей при остром облучении
Автор: Ромодин Л.А., Никитенко О.В., Бычкова Т.М., Московский А.А., Тюкалова О.М., Ильязов Р.Г.
Рубрика: Научные статьи
Статья в выпуске: 2 т.34, 2025 года.
Бесплатный доступ
Поиск эффективных и безопасных способов коррекции лучевого синдрома остаётся актуальным направлением исследований. В ходе многочисленных работ, проведённых ранее, не удалось обнаружить одновременно эффективный и безопасный противолучевой препарат. Поэтому перспективным представляется разработка терапевтических схем лечения лучевой болезни, предполагающих совместное использование нескольких препаратов. В настоящей работе на самцах мышей ICR (CD-1), подвергнутых разовому воздействию рентгеновским излучением в дозе 6,5 Гр, мы оценили эффективность терапевтической схемы, предполагающей применение медного хлорофиллина в дозировке 100 мкг/г массы тела за 20-30 мин до облучения, глутатиона в дозировке 200 мкг/г через 30 мин после облучения и препарата «Лаеннек» (гидролизат плаценты человека) в дозировке 560 мкг/г через 1, 2, 3 и 4 сут после облучения и в дозировке 112 мкг/г через 8, 9, 10 и 11 сут после облучения. Эффективность применения данной схемы оценивали на основании 30-суточной выживаемости и следующих показателей через 4 и 7 сут после облучения: массы тимуса и селезёнки, гематологических показателей (лейкоциты, эритроциты, тромбоциты, гемоглобин, гематокрит, тромбокрит), количества ядросодержащих клеток в костном мозге. Применение данной схемы не способствовало облегчению течения лучевой болезни. Хотя в литературе и в наших более ранних исследованиях данные препараты по отдельности проявляли радиозащитные свойства. Полученный результат мы объясняем несовместимостью фармакологических эффектов исследуемых препаратов. По нашему мнению, это связано с токсическими свойствами медного хлорофиллина. Таким образом, настоящая работа актуализирует дальнейшие исследования возможности совместного применения различных веществ для коррекции лучевого синдрома с изучением вклада каждого вещества в складывающуюся в итоге общую клиническую картину.
Ионизирующее излучение, рентгеновское излучение, хлорофиллин, глутатион, гидролизат плаценты, лаеннек, мыши, гематология, выживаемость, радиобиология
Короткий адрес: https://sciup.org/170209564
IDR: 170209564 | УДК: 539.1.047:599.323.4 | DOI: 10.21870/0131-3878-2025-34-2-50-62
Текст научной статьи Влияние совместного применения медного хлорофиллина, глутатиона и гидролизата плаценты на физиологические параметры и выживаемость мышей при остром облучении
Поиск эффективных и безопасных способов коррекции лучевого синдрома продолжает оставаться актуальным направлением исследований. В ходе многочисленных работ в этой области, проведённых ранее и посвящённых изучению радиозащитных свойств различных препаратов по отдельности, не удалось обнаружить безопасный препарат, который бы эффективно защищал от воздействия радиации и не проявлял при этом токсического действия [1-3]. Поэтому перспективным представляется разработка терапевтических схем лечения лучевой болезни, предполагающих совместное использование нескольких препаратов с различными свойствами и механизмом действия.
В последнее время в литературе всё больше сообщений о том, что при разработке противолучевых средств целесообразно использовать малотоксичные, так называемые природные,
соединения, многие из которых являются естественными метаболитами [1-3]. По причине высокой роли естественной антиоксидантной системы клеток в защите клеточных структур от различных свободнорадикальных реакций [4, 5], играющих ключевую роль в реализации биологического действия ионизирующего излучения [5, 6], перспективным представляется использование антиоксидантов для облегчения течения лучевой болезни.
В естественной системе антиоксидантной защиты клетки большую роль играет глутатион. Данное соединение обеспечивает восстановление биомолекул, подвергшихся атаке свободных радикалов [7, 8]. В норме его концентрация в цитоплазме настолько высока, что позволяет восстанавливать любую окисленную HS-группу [8]. Однако при действии ионизирующего излучения наблюдается резкий спад антиоксидантного потенциала клеток за счёт снижения концентрации антиоксидантов [5]. И в этой связи введение глутатиона для коррекции лучевого синдрома выглядит оправданным. Тем более, что в литературе имеются сведения о радиозащитном эффекте экзогенного глутатиона [9].
В литературе достаточно много информации о радиозащитных свойствах водорастворимого производного зелёного пигмента растений хлорофилла – хлорофиллина [10, 11]. В нашей недавней работе [12] для медного хлорофиллина мы определили значение фактора изменения дозы (ФИД) – отношения дозы ионизирующего излучения для получивших данный радиозащит-ный препарат животных к равноэффективной дозе для животных, не получавших препарат, – при профилактическом внутрибрюшинном (в/б) введении мышам в дозировке 100 мкг/г массы тела. Оно составило 1,1. Данное значение нельзя считать высоким. Однако полагаем, что радиозащит-ный эффект хлорофиллина можно усилить за счёт применения других соединений, обладающих радиозащитными свойствами. И в первую очередь мы решили изучить возможность совместного использования глутатиона и хлорофиллина.
Данная терапевтическая схема предполагает введение хлорофиллина в дозировке 100 мкг/г массы тела до облучения, аналогично тому, как это было работе [12], и введение глутатиона в дозировке 200 мкг/г после облучения. При составлении данной схемы руководствовались тем, что введение восстановленного глутатиона после облучения приведёт к росту его концентрации в пострадавших от облучения клетках с пониженной его концентрацией. А это, в свою очередь, должно привести к более эффективной работе антиоксидантной системы защиты клеток. Дозировка глутатиона, равная 200 мкг/г, составляет примерно двадцатую часть от ЛД 50 глутатиона при в/б введении мышам, поэтому указанную дозировку можно считать безопасной с точки зрения химической токсичности данного вещества [13].
В информационном поле, правда, в большей степени в рекламной и публицистической его части, много информации о целебных свойствах плаценты и различных произведённых из неё препаратов. В описании терапии препаратом «Лаеннек» производства Japan Bio Products на сайтах ряда клиник прямо указывается, что он был разработан как средство лечения лучевой болезни. По данной причине мы включили указанный препарат в тестируемую в настоящем исследовании схему терапии лучевого синдрома.
В научной литературе также есть сообщения о радиозащитных свойствах гидролизата плаценты. Так, авторы исследования [14] изучали защитные свойства гидролизата плаценты при применении против энтеропатий, вызванных облучением в дозе 10 Гр. Указанный эксперимент проводился на мышах C57BL/6, которым один раз в день в течение 5 дней в/б вводили гидролизат плаценты, облучая их через 1 ч после последней инъекции. И в описываемом исследовании гидролизат плаценты дозозависимо снижал число апоптотических клеток, смягчая действие радиации на крипты Либеркюна в тощей кишке мышей. Данный эффект авторы [14] связывают со способностью гидролизата плаценты стимулировать регенерацию тканей, ссылаясь на работу авторов [15], показавших интенсификацию регенерации повреждённых аксонов седалищного нерва за счёт усиления синтеза белковых факторов: GAP-43, обеспечивающего развитие нейронов и синапсов, и циклин-зависимой киназы 2 (Cdc2). Последняя играет ключевой роль при переходе от G2-фазы клеточного цикла к делению [15].
Авторы работы [16] сообщают о выраженных гепатопротекторных свойствах препарата гидролизата плаценты при неалкогольном поражении печени: концентрации аспартатаминотрансферазы, аланинаминотрансферазы и гамма-глутамилтрансферазы возвратились к нормальным значениям. Пациенты, получавшие гидролизат плаценты, свидетельствовали об улучшении общего самочувствия. В случае алкогольного или лекарственного поражения печени гепато-протекторные свойства гидролизата плаценты сохраняются [17]. О снижении выраженности жировой дистрофии печени на фоне применения препарата Лаеннек сообщают авторы работы [18]. Нефропротекторные свойства данного препарата проявляются в снижении воспаления, анти-стрессорных эффектах и предотвращении фибротических изменений ткани почек за счёт наличия в его составе фрагментов нефропротекторных адреномедуллинов, пептидов-ингибиторов ряда киназ (FYN, SHH, WNK1/4, SGK1, IRAK4, ROCK1/2) и фиброгенных рецепторов (PDGFR, TGFB1I1) [19]. Описанные эффекты препарата гидролизата плаценты могут обуславливать его способность смягчать постковидный синдром [20], а также синдром хронической усталости, что сопровождается снижением ситуативных депрессии и тревоги, улучшением субъективных оценок качества жизни, а также достоверным повышением значений индикаторов физической работоспособности: максимального потребления кислорода, анаэробного порога, времени нагрузки до отказа [21].
Анализируя эти данные, мы больше склоняемся к определению гидролизата плаценты не как классического радиопротектора, применяемого непосредственно разово перед облучением, а радиомодулятора-адаптогена, повышающего регенеративный потенциал организма, а потому способного проявить защитный эффект и после облучения [22]. А, так как особенностью адапто-генов является «накопительный эффект», обуславливающий рекомендацию применять данные препараты многократно, курсом [22, 23], мы вводили гидролизат плаценты на протяжении нескольких дней.
Целью настоящего исследования была оценка радиозащитного эффекта совместного применения медного хлорофиллина, глутатиона и гидролизата плаценты (коммерческий препарат Лаеннек) при разовом воздействии на самцов мышей рентгеновского излучения в дозе 6,5 Гр. Применяемая схема предполагала введение медного хлорофиллина перед облучением для возможности проявления им показанных нами ранее радиопротекторных свойств [12], глутатиона - после облучения, что может способствовать исправлению выведенного радиацией из равновесия баланса прооксидантов и антиоксидантов в пользу последних [7, 8], гидролизата плаценты - на протяжении нескольких дней после облучения (табл. 1), это должно было способствовать общему укреплению организма и ускорению его восстановления после облучения, в соответствии с представленными в литературе данными [14, 15, 18, 20].
Материалы и методы
Эксперименты были выполнены на аутбредных самцах мышей линии ICR (CD-1) SPF-категории (массой 34,6 ± 0,2 г), полученных из питомника лабораторных животных Российской академии наук (Пущино). Однократное кратковременное одностороннее тотальное облучение мышей осуществляли на рентгеновской биологической установке РУБ РУСТ-М1 (Россия), мощность дозы в контейнере с мышами составляла 0,85 Гр/мин ± 10%, анодное напряжение – 200 кВ, алюминиевый фильтр – 1,5 мм, доза излучения – 6,5 Гр.
В качестве изучаемых препаратов в составе терапевтической схемы использовали: медный хлорофиллин (Macklin, Китай) при в/б введении в объёме 0,32 мл, глутатион (препарат Гла-тион производства Шаньдун Луи Фармасьютикал, Китай) при в/б введении в объёме 0,32 мл, гидролизат плаценты человека (препарат Лаеннек, Japan Bio Products, Япония, приобретён у поставщика ООО «ТД-Фарм») при в/б введении в объёме 0,32 мл. Мышам из группы облучённого контроля вводили 0,2% раствор уротропина, который выступал в роли среды для растворения всех используемых препаратов, в объёме 0,32 мл.
В табл. 1 приведены сведения о дозировках и сроках введения используемых препаратов, а также о времени эвтаназии животных для проведения гематологического исследования. На основании информации о низкой токсичности препарата гидролизата плаценты во всех источниках [14-20] применяли его в относительно высоких дозировках, указанных в табл. 1.
Таблица 1
Схема введения препаратов с указанием дней эвтаназии некоторых мышей из экспериментальных групп для проведения гематологического исследования
|
Дни после облучения |
Группа I Виварный контроль |
Группа II Облучённый контроль |
Группа III Экспериментальная группа |
|
0 |
- |
Раствор уротропина за 15-20 мин до облучения; облучение в дозе 6,5 Гр |
Медный хлорофиллин, 100 мкг/г, за 20-30 мин до облучения; облучение в дозе 6,5 Гр; глутатион, 200 мкг/г, 30 мин после облучения |
|
1 |
- |
- |
Лаеннек, 560 мкг/г |
|
2 |
- |
- |
Лаеннек, 560 мкг/г |
|
3 |
- |
- |
Лаеннек, 560 мкг/г |
|
4 |
Эвтаназия 5 мышей |
Эвтаназия 5 мышей |
Эвтаназия 5 мышей; Лаеннек, 560 мкг/г |
|
5 и 6 |
- |
- |
- |
|
7 |
Эвтаназия 5 мышей |
Эвтаназия 5 мышей |
Эвтаназия 5 мышей |
|
8-11 |
- |
- |
Лаеннек, 112 мкг/г |
Выживаемость мышей оценивали в течение 30 сут после облучения. Кумулятивную долю выживших животных рассчитывали по Каплану-Майеру [24]. Кривые выживаемости были проанализированы log-rank тестом – сравнение выживаемости групп с учётом всего периода наблюдения. Статистически значимыми считали различия при p(log-rank test)<0,05.
В эксперименте было задействовано 90 мышей: 60 – для оценки 30-суточной выживаемости, 30 – для оценки изучаемых физиологических показателей. Последнее проводилось посредством эвтаназии 5 мышей из каждой экспериментальной группы с использованием следующих показателей: массы тимуса и селезёнки, параметров крови (содержания лейкоцитов, эритроцитов, тромбоцитов, уровня гемоглобина, процента гематокрита, тромбокрита), количества ядросодержащих клеток в костном мозге – через 4 и 7 дней после облучения.
Определение массы тимуса и селезёнки производили взвешиванием на электронных весах OHAUS Adventurer AR3130 (OHAUS Corporation, Швейцария) с ценой деления 1 мг. Определение форменных элементов крови производилось с помощью ветеринарного гематологического анализатора Mindray BC-2800 Vet (Китай).
Определение количества кариоцитов в костном мозге (п х 10 6 ядросодержащих клеток на бедро) проводили следующим образом. Очищенную от мышцы бедренную кость животного промывали 5% раствором уксусной кислоты объёмом 4 мл, вымывая содержимое кости шприцем, а затем подсчитывали число ядросодержащих клеток в камере Горяева. Считали клетки костного мозга при малом увеличении (объектив х 8 или х 9, окуляр х 10 или х 15). Подсчёт производился в 5 больших квадратах, разделённых на 16 маленьких. Полученное число умножали на 0,2. Так получали число клеток костного мозга в бедренной кости мыши [25].
Статистический анализ полученных результатов проводили общепринятыми методами вариационной статистики (U-критерий Манна-Уитни). Данные представлены в виде среднего зна-чения ± ошибка среднего (M ± m). Различия считали значимыми при p<0,01.
Результаты и их обсуждение
Изучаемая нами схема коррекции лучевого синдрома не дала положительных результатов. Её применение не смогло повысить количество ядросодержащих клеток костного мозга, лейкоцитов и тромбоцитов в крови, по сравнению с группой облучённого контроля.
Рис. 1 иллюстрирует данные по количеству ядросодержащих клеток в костном мозге бедренной кости, числу лейкоцитов и тромбоцитов в крови через 4 и 7 дней после облучения в дозе 6,5 Гр. В табл. 2 представлены сведения о массе селезёнки и тимуса, гематокрите, тромбокрите и концентрации гемоглобина в крови мышей в указанные сроки после радиационного воздействия.
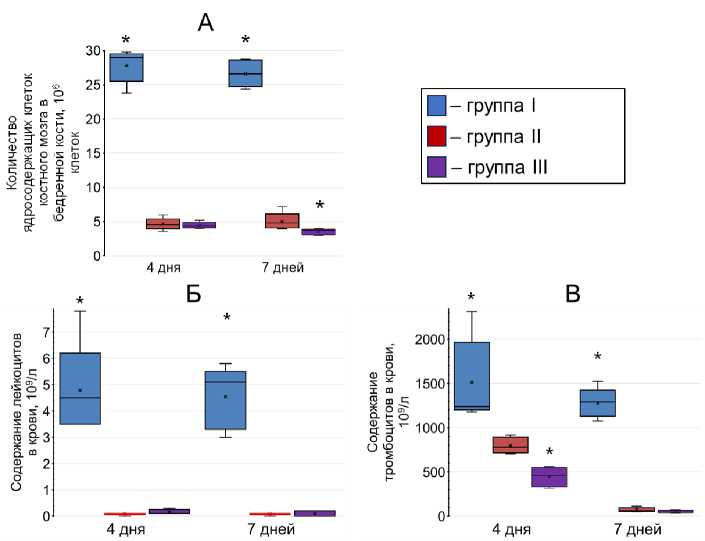
Рис. 1. Сравнение различающихся изучаемых физиологических параметров через 4 и 7 дней после воздействия рентгеновским излучением в дозе 6,5 Гр на мышей из групп виварного (синие прямоугольники) и облучённого (красные прямоугольники) контролей и облучённых мышей, которым вводили хлорофиллин перед облучением, глутатион через 30 мин после облучения с последующими суточными интервалами четырьмя введениями гидролизата плаценты в дозировке 560 мкг/г (фиолетовые прямоугольники).
* – статистически значимое (U-критерий Манна-Уитни, p<0,01) отличие от группы облучённого контроля.
Таблица 2
Сведения о массе тимуса и селезёнки, гематокрите, тромбокрите и уровне гемоглобина у экспериментальных животных через 4 и 7 дней после воздействия рентгеновским излучением в дозе 6,5 Гр
|
Группа |
Число дней, прошедших с момента облучения |
Масса селезёнки, мг |
Масса тимуса, мг |
Гематокрит, % |
Тромбокрит, % |
Концентрация гемоглобина, г/л |
|
1 |
4 |
191,8±37,4 |
49,8±9,8 |
43,3±1,5 |
0,5±0,006 |
135±4,6 |
|
7 |
136,2±15,9 |
65,8±10,1 |
43±0,4 |
0,5±0,03 |
145,4±1,8 |
|
|
II |
4 |
32,2±3,0 |
13,6±2,7 |
41,2±0,7 |
0,3±0,02 |
130,4±2,4 |
|
7 |
29,4±1,6 |
23±2,3 |
39,6±1,6 |
0,04±0,01 |
132,6±5,4 |
|
|
III |
4 |
40,8±3,1 |
9,6±1,7 |
40,4±2,6 |
0,2±0,03 |
126,8±8,6 |
|
7 |
31,2±3,2 |
15±1,9* |
34,2±0,8 |
0,03±0,004 |
111±3,3** |
Примечание: * – статистически значимая разница с группой II (в соответствующие сутки), p≤0,05;
** – статистически значимая разница по сравнению с группой II (в соответствующие сутки), p≤0,01.
На основании представленных в табл. 2 и на рис. 1 данных можно говорить, что острое воздействие рентгеновским излучением в дозе 6,5 Гр привело к статистически значимому снижению массы тимуса и селезёнки, числа ядросодержащих клеток костного мозга в бедренной кости, количества лейкоцитов и тромбоцитов, а также уровня гематокрита, тромбокрита и гемоглобина в периферической крови по сравнению с группой виварного контроля. По показателю уровня тромбоцитов на 4-е сут после облучения отмечено статистически значимое снижение в группе III по сравнению с группой II (U-критерий Манна-Уитни, p ≤ 0,01). На 7-е сут после облучения в дозе 6,5 Гр было отмечено статистически значимое снижение в группе III по сравнению с группой II по количеству ядросодержащих клеток костного мозга в бедренной кости (U-критерий Манна-Уитни, p ≤ 0,01). Отмечено статистически значимое снижение по концентрации гемоглобина в крови в группе III по сравнению с группой облучённого контроля (II, U-критерий Манна-Уитни, p ≤ 0,01) на 7-е сут после облучения. В остальных случаях статистически значимой разницы отмечено не было.
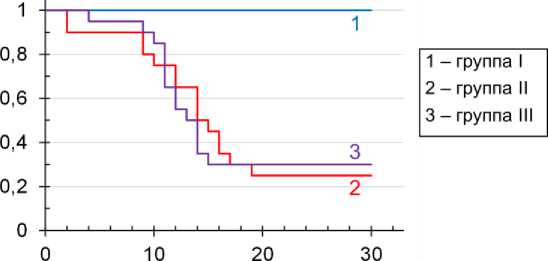
В рамках настоящей работы было проведено исследование влияния изучаемой терапевтической схемы на выживаемость мышей, подвергнутых воздействию рентгеновского излучения в дозе 6,5 Гр в течение 30 сут после облучения. Полученные сведения о доле выживших животных и средней продолжительности жизни погибших облучённых мышей можно считать адекватными, т.к. к концу периода наблюдения выжили все животные из группы виварного контроля, а на протяжении всего этого времени не было зафиксировано каких-либо признаков ухудшения их самочувствия.
Изучаемая в настоящей работе терапевтическая схема коррекции лучевого синдрома, вызванного облучением мышей в летальной (6,5 Гр) дозе, не обеспечила повышения выживаемости мышей по сравнению с группой облучённого контроля (рис. 2, log-rank test, p=0,86).
При этом, ранее мы установили, что медный хлорофиллин при аналогичном для настоящего исследования способе применения обладает хоть и незначительными, но достоверными радиопротекторными свойствами: ФИД для данного вещества равен 1,1 [12]. Т.е. на основании полученных в настоящей работе данных можно говорить о том, что применение глутатиона или гидролизата плаценты после использования медного хлорофиллина убирает радиозащитный эффект последнего.
Как уже указывалось выше, применение гидролизата плаценты [14] и экзогенного глутатиона [9] по отдельности также характеризуется радиозащитным эффектом. Но данный эффект исчезает при введении медного хлорофиллина перед облучением, т.е. при совместном применении данных веществ их фармакологическое взаимодействие приводит к потере тех радиоза-щитных свойств, которые проявляют данные препараты по отдельности. Под фармакологическим взаимодействием мы понимаем не столько непосредственные химические реакции между веществами, введёнными в организм (хотя этот аспект тоже входит в это понятие), сколько результат от совокупности реакций организма на введённые препараты.
Время после облучения, сутки
Рис. 2. Динамика выживаемости самцов мышей ICR (CD-1) по Каплану-Майеру после воздействия рентгеновского излучения в дозе 6,5 Гр.
В препарате гидролизата плаценты содержится большое число различных веществ, среди которых много олигопептидов, витаминов и антиоксидантов, сигнальных ростовых факторов [15]. Глутатион является одним из главных, если не основным, антиоксидантом клетки [7, 8]. По логике в препарате гидролизата плаценты также должно содержаться относительно много глутатиона. Поэтому весьма маловероятно, что сочетание гидролизата плаценты и чистого препарата глутатиона могло снижать до нуля радиозащитные свойства обоих препаратов.
Отсутствие радиозащитного эффекта изучаемой терапевтической схемы, скорее всего, обусловлено фармакологическим взаимодействием медного хлорофиллина и глутатиона или хлорофиллина и суммарно глутатиона и гидролизата плаценты. Однако не исключено, что при ином способе применения, например, в случае существенно более длительного курса, гидролизат плаценты может оказать некоторый защитный эффект. Но, тем не менее, уже на основании нашего исследования понятно, что величина данного эффекта будет незначительной и существенно более низкой, чем у табельных радиопротекторов.
Согласно паспорту безопасности медного хлорофиллина данное вещество при пероральном применении является практически нетоксичным: ЛД 50 при в/б введении мышам составляет 7000 мкг/г массы тела. На основании данной информации можно сделать вывод о полной безопасности применения медного хлорофиллина с точки зрения химической токсичности. Однако результаты нашего недавнего исследования [26] токсичности данного вещества при в/б введении мышам показали, что ЛД 50 медного хлорофиллина при данном способе применения составляет всего лишь 633 ± 37,2 мкг/г. Скорее всего, данный относительно высокий показатель химической токсичности обусловлен наличием в составе молекулы данного вещества атома меди. Однако конкретные механизмы реализации токсического действия медного хлорофиллина не изучались. Поэтому говорить о возможных путях его фармакологического взаимодействия с другими препаратами невозможно. В то же время, именно данное взаимодействие, скорее всего, приводит к потере радиозащитных свойств и медного хлорофиллина, и других изучаемых в настоящей работе препаратов.
Совместное влияние данных препаратов на фоне облучения усугубляет тромбоцитопению через 4 дня после него (рис. 1В), а через 7 дней после облучения наблюдается снижение числа ядросодержащих клеток в костном мозге бедренной кости по сравнению с группой облучённого контроля (рис. 1А). Это можно объяснить негативными эффектами фармакологического взаимодействия изучаемых препаратов.
Тем не менее, поиск эффективных комбинаций различных веществ для терапии лучевой болезни, в том числе вызванной внешним облучением, является перспективным направлением исследований. Например, авторы работы [27] смогли добиться повышения радиозащитного эффекта солей кальция в рационе за счёт дополнительного включения в него рыбьего жира. В обзоре [28] обобщены сведения относительно перспективности совместного использования мелатонина и витамина D для облегчения побочных эффектов лучевой терапии онкологических заболеваний. В качестве ещё одного примера можно привести нашу недавнюю работу [29], в которой была разработана схема совместного применения веществ с различным механизмом радиоза-щитного действия. Данная схема обеспечила полную выживаемость мышей, облучённых в дозе 6,5 Гр, т.е. в условиях, аналогичных таковым в настоящей работе. К слову, в той же работе можно найти примеры фармакологической несовместимости некоторых веществ. Так, например, добавление рибоксина в схему, подразумевающую применение хлорофиллина и тролокса, способствовало бо́льшей смертности мышей даже по сравнению с группой облучённого контроля. Хотя сам рибоксин может проявлять некоторые радиозащитные свойства [22].
Подводя итог вышеизложенного, считаем необходимым указать на актуальность проведения работ по изучению эффекта совместного применения нескольких препаратов для лечения лучевой болезни. Как показала настоящая работа, не всегда совместное использование препаратов с радиозащитными свойствами способно облегчить течение острого лучевого синдрома. Именно поэтому необходимо в дальнейших исследованиях детально изучать эффекты, имеющие место при поступлении в организм различных веществ на фоне воздействия ионизирующего излучения. При этом, необходимо иметь в виду, что при различных режимах воздействия излучения (острое, хроническое, фракционированное, различные дозы и мощности дозы и т.п.) эффект от совместного применения различных веществ может быть различным, не исключено, что даже противоположным.
Заключение
Таким образом, схема комбинированного применения медного хлорофиллина до облучения, глутатиона после облучения в день облучения и препарата гидролизата плаценты через 1, 2, 3, 4, 8, 9, 10 и 11 дней после облучения не обеспечила смягчения течения лучевой болезни. При этом, показанные нами ранее радиопротекторные свойства медного хлорофиллина в случае применения его в составе указанной терапевтической схемы терялись. Полученные нами данные не свидетельствуют в пользу целесообразности применения гидролизата плаценты против облучения. По крайней мере, применение данного препарата после облучения и профилактического введения медного хлорофиллина в используемых нами условиях абсолютно бессмысленно.
Исследование выполнено за счёт гранта Российского научного фонда № 23-24-00383,


