Влияние способа хранения на функциональные параметры пыльцы свеклы столовой
Автор: Козарь Е.Г., Ветрова С.А., Федорова М.И.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 4 (42), 2018 года.
Бесплатный доступ
Важным условием при работе с пыльцой, является сохранение ее функциональных параметров в течение определенного времени, для чего необходимо подобрать оптимальные условия, позволяющие сохранять жизне- и оплодотворяющую способность микрогаметофита. С этой целью изучено влияние двух способов сбора и хранения пыльцы инбредных растений свеклы столовой на ее функциональные характеристики при проращивании на искусственной питательной среде в условиях in vitro. В первом варианте пыльцу собирали с распустившихся цветков в герметично закрываемые бюксы, во втором - отделяли от соцветия небольшие веточки с цветками и крупными бутонами, помещали их бумажные, а затем в полиэтиленовый пакеты и хранили до проращивания в хладотермостате при 10...12°С (контроль - свежесобранная пыльца). Показано, что при хранении пыльцы в бюксах уже на вторые-третьи сутки жизнеспособность (ЖСП) в зависимости от образца снижалась в 3-10 раз по сравнению с исходным значением, а после недельного хранения она слипалась в конгломераты, и увеличивалось число лопнувших пыльцевых зерен в препарате. При хранении в цветках и бутонах на веточках снижение ЖСП на седьмые-восьмые сутки хранения составляло не более 30% от контроля, а скорость роста пыльцевой трубки у большинства образцов оставалась на уровне контрольной. При этом характер распределения образцов по уровню ЖСП микрогаметофита сохранялся. Коэффициент ковариации линейной зависимости между значениями ЖСП до и после недельного хранения составил R2=0,94. То есть, для оценки функциональных параметров микрогаметофита инбредных растений свеклы столовой рекомендуется хранение пыльцы непосредственно на цветущих веточках, помещенных в бумажные, а затем в полиэтиленовый пакеты, при пониженной положительной температуре 10-12°С. Это имеет важное значение при работе с большим набором образцов, когда нет возможности провести их сравнительный анализ единовременно.
Свекла столовая, микрогаметофит, условия хранения, пыльца, пыльцевая трубка, жизнеспособность
Короткий адрес: https://sciup.org/140223817
IDR: 140223817 | УДК: 635.11:631.527.823.3 | DOI: 10.18619/2072-9146-2018-4-51-54
Текст научной статьи Влияние способа хранения на функциональные параметры пыльцы свеклы столовой
Актуальной задачей при селекции на гетерозис двулетних овощных культур является ускорение создания линейного материала. Длительность селекционного процесса обусловлена отсутствием доступных и надежных методов отбора ценных генотипов на различных его этапах. В решении данного вопроса немаловажная роль отводится отбору на микрогаметофитном уровне. Микроскопические размеры пыльцы предоставляют возможность анализировать большой набор селекционного материала, а гаплоидное состояние генома, в отличие от диплоидного, позволяет обнаружить редкие рецессивные аллели [1]. Возможность проведения такого отбора основывается на значительной выраженности части спорофитного генома в гаплоидной фазе развития растения [2].
В результате исследований выявлены взаимосвязи между функциональными параметрами пыльцы свеклы столовой и проявлением признака ЦМС. Так, с увеличением степени стерильности инбредных растений I1-I2 уменьшаются диаметр и жизнеспособность фертильной пыльцы mf-цветков (r = -0,84 и r = -0,88 соответственно), снижается скорость роста пыльцевых трубок (r =-0,85) [3]. Учитывая существующие взаимосвязи, селекционер имеет возможность уже на стадии цветения выделять наиболее ценные генотипы для дальнейшей работы.
Известно, что препараты с проросшей пыльцой, зафиксированные дифференциальным красителем, можно хранить в течение нескольких месяцев, поскольку вещества, входящие в его состав, предохраняют препарат от высыхания, бактерий и грибов [4]. Это облегчает проведение полного анализа функциональных параметров пыльцы (жизнеспособность, длина и скорость роста пыльцевой трубки, стерильность) после окончания цветения. Однако при одновременном изучении большого количества исследуемых образцов и растений свеклы столовой актуальна проблема хранения пыльцы до момента ее проращивания на питательной среде и фиксации препаратов.
Известно, что прорастание пыльцы in vitro в большой степени зависит не только от генотипа, условий формирования, но и от условий хранения, которые способствуют как повышению жизнеспособности пыльцы, так и ее снижению [5, 6, 7]. То есть, важным условием при работе с пыльцой, является сохранение ее функциональных параметров в течение определенного времени, для чего необходимо создавать оптимальные условия, позволяющие сохранять жизне- и оплодотворяющую способность микрогаметофита. При массовом цветении растений расширяется временной интервал для проведения сравнительной оценки, что одновременно затруднительно из-за большого объема, а также для проведения скрещиваний между растениями, несовпадающими по времени цветения.

Рис. 1. Способы сбора и хранения пыльцы свеклы столовой:
А – свежесобранная в закрытом бюксе (1 вариант); Б – в цветках на веточке в бумажном пакете (2 вариант).
Fig. 1. Methods of collecting and storing pollen beet canteen:
A – fresh in eppendorf tube (option 1); B – in flowers on a twig in a paper bag (2 option).
Цель исследований – изучение влияния различных способов хранения пыльцы свеклы столовой на ее функциональные параметры при проращивании в условиях in vitro .
Материалы и методы
Материал исследований – пыльца фертильных растений инбредных потомств I1-I4 свеклы столовой, полученных на основе сортопопуляции Нежность.
Для изучения реакции микрогаметофита свеклы столовой на хранение при пониженной положительной температуре (10…12°С), пыльцу закладывали на хранение двумя способами: 1 – в закрытых бюксах, куда собирали пыльцу с раскрывшихся цветков; 2 – непосредственно в пыльниках, помещая
Таблица. Функциональные параметры микрогаметофита инбредных потомств свеклы столовой в контроле
(К) и после хранения (О) в течение семи суток при температуре 10...12 ° С в пыльниках (2 способ) Table. Functional parameters of microhametophyte of inbred offspring of beetroot in control
(K) and after storage (O) for seven days at a temperature of 10...12 ° C in anthers (2 method)
|
Селекционный номер |
Жизнеспособность, % |
Длина пыльцевой трубки, mkm |
||||
|
К |
О |
отклонение от контроля |
К |
О |
отклонение от контроля |
|
|
490 |
15,7 |
13,5 |
-2,2 |
3,0 |
3,1 |
+0,1 |
|
527 |
21,2 |
17,3 |
-3,9 |
4,3 |
4,1 |
-0,2 |
|
458 |
25,5 |
25,4 |
-0,1 |
4,8 |
3,5 |
-1,3 |
|
523 |
29,9 |
27,2 |
-2,7 |
3,8 |
3,9 |
+0,1 |
|
492 |
36,9 |
28,7 |
-8,3 |
3,4 |
2,7 |
-0,8 |
|
529 |
46,0 |
38,3 |
-7,6 |
3,6 |
3,4 |
-0,2 |
|
НСР 05 |
4,7 |
1,2 |
||||
|
ISSN 2618-7132 (online) научно-практический журнал |
[ 52 ] |
овощи россии № |
4 (42) 2018 ISSN |
2072-9146 (Print) |
||
на третьи сутки хранения на седьмые сутки хранения
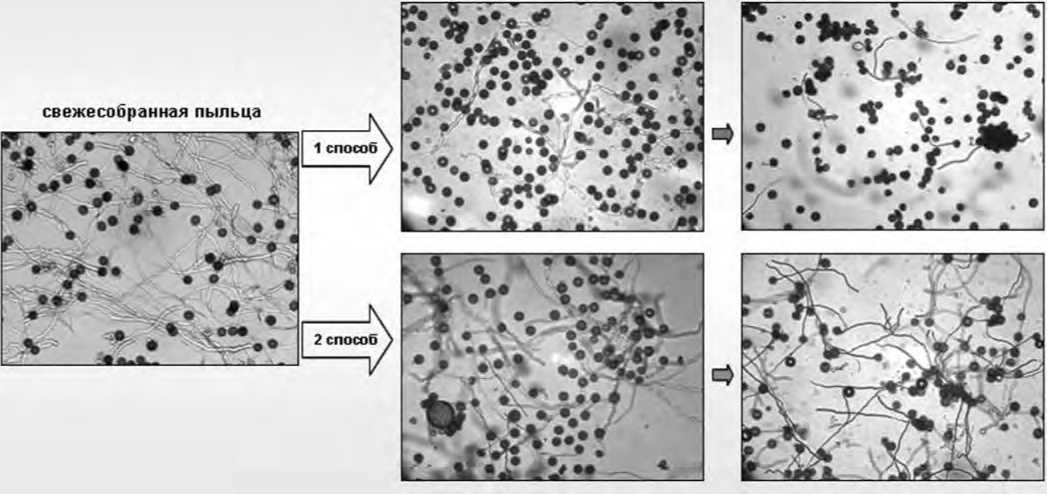
Рис. 2. Прорастание пыльцы свеклы столовой in vitro (№ 529): перед закладкой на хранение (контроль); после хранения в бюксе (1 способ) и в пыльниках на веточках (2 способ) в течение трех и семи суток при температуре 10…12°С.
Fig. 2. Germination of beet pollen canteen in vitro (№529): before laying on the storage (control); after bucks storage (1 method) and in the anthers on the twigs (2 method) for three and seven days at a temperature of 10 ... 12°C.
небольшие цветущие веточки соцветия в бумажные пакеты, которые затем герметично упаковывали в полиэтиленовый пакет (рис. 1).
Перед закладкой на хранение (контроль) и после него проверяли уровень жизнеспособности пыльцы, проращивая ее in vitro в условиях влажной камеры [8] при температуре 24…25оС в течение двух часов на модифицированной питательной среде следующего состава (на 100 мл): ПЭГ-6000 – 25 г, сахароза – 15 г, H3BO3 – 5 мг, Са(NO 3 ) 2 .4H 2 O – 15 мг, рН 5,8-6,5.
Препараты с пыльцой после проращивания фиксировали дифференциальным красителем [9]. Микрофотосъемку проводили на микроскопе Micros с использованием цифровой камеры Canon A560. Подсчет проросших и лопнувших пыльцевых зерен, измерение длины пыльцевых трубок (Lpt) осуществляли с помощью программы «Scope Photo». Жизнеспособность (ЖСП) определяли как процент проросшей пыльцы от общего числа пыльцевых зерен в пробе; скорость роста пыльцевых трубок (Vpt) рассчитывали отношением средней длины пыльцевых трубок к временному интервалу проращивания. Объем выборки для подсчетов и измере- ний в одной повторности составлял 300-500 пыльцевых зерен (ПЗ), повторность – трехкратная. Статистическую обработку данных проводили по общепринятым методикам [10].
Результаты и обсуждение
Способность пыльцы инбредных растений свеклы столовой прорастать при невысоких положительных температурах [11] дает основание предположить, что свежесобранная пыльца при хранении в схожих температурных условиях может долго оставаться жизнеспособной.
Однако у пыльцы, хранящейся в бюксах (1 способ), наблюдали быстрое снижение жизнеспособности – уже на вторые-третьи сутки этот параметр в зависимости от образца снижался в 3-10 раз относительно исходного значения свежесобранной пыльцы (контроль). На седьмые сутки наблюдалось очень слабое прорастание, пыльца слипалась в конгломераты, и существенно увеличивалось число лопнувших ПЗ во всех изученных образцах (рис.2). Процент лопнувших пыльцевых зерен в анализируемой пробе является важной характеристикой состояния пыльцевой популяции, который с одной стороны связан с разнокачественностью ПЗ по степени зре-
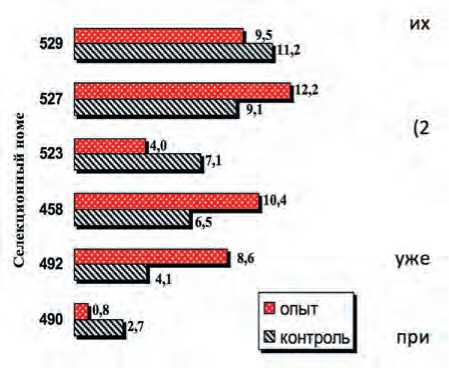
Рис. 3. Доля лопнувших ПЗ (%): исходно (контроль);
после недельного хранения в пыльниках при 10 ° С (опыт).
Fig. 3. Share of burst pollen grain (%):
initial (control); after a week of storage in anthers at 10 ° C (experience).
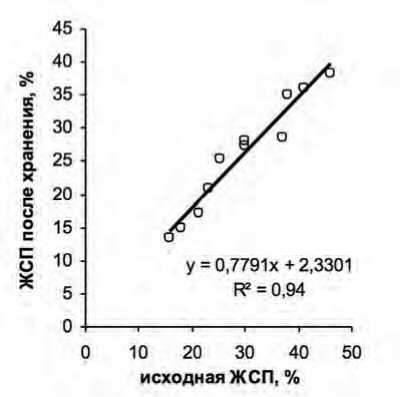
Рис.4. Зависимость между ЖСП пыльцы до и после недельного хранения в пыльниках при 10...12 ° С.
Fig. 4. The relationship between the germination of pollen before and after storage in anthers at 10-12 ° C.
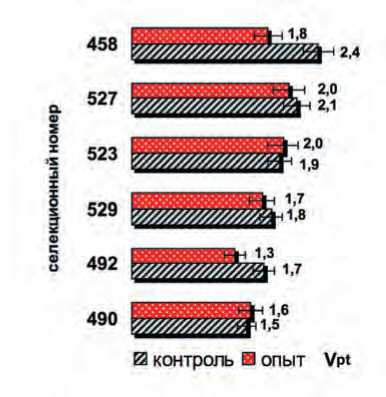
Рис.5. Скорость роста пыльцевых трубок (mkm/час): исходно (контроль); после недельного хранения (опыт) при 10 ° С в пыльниках.
Fig. 5. Growth rate of pollen tubes (mkm/h): initial (control); after a week of storage (experience) at 10°C in anthers.
лости, а с другой – является результатом их реакции на внешнее воздействие, в том числе и на условия хранения.
Доля лопнувших ПЗ, после недельного хранения в пыльниках цветков на веточках (2 способ), у одних образцов снижалась относительно контроля, у других, наоборот, увеличивалась (рис. 3). Возможно, это связано с разнонаправленными процессами «дозаривания» в бутонах и «старения» ПЗ в уже раскрывшихся цветках, которые в отдельных пыльниках разных инбредных растений протекают с разной скоростью. Но в целом, при хранении в пыльниках, пыльца более длительное время сохраняла способность к прорастанию на достаточно высоком уровне (рис. 2).
На седьмые-восьмые сутки хранения жизнеспособность пыльцы разных генотипов снижалась на 0,1-8,3%, при этом характер распределения образцов по уровню жизнеспособности сохранялся (табл.). Используя уравнение линейной зависимости между значениями показателей до и после хранения, можно с высокой вероятностью (R2=0,94) определить близкий к исходному уровень жизнеспособности микрогаметофита после недельного выдерживания собранных веточек в холодильнике (рис. 4). Это имеет важное значение при работе с большим набором образцов, когда нет возможности провести их сравнительный анализ единовременно.
При анализе изменения длины пыльцевых трубок такой тесной зависимости не отмечено (R2=0,33), и скорость роста трубки у большинства образцов после хранения оставалась практически на уровне контрольной, кроме образцов 492 и 458 с депрессией по обоим показателям (Lpt и Vpt) около 25% (табл.; рис.5).
Следует отметить, что после длительного хранения веточек для проведения анализа лучше брать пыльцу с выполненных пыльников крупных бутонов, в которых уже завершился процесс спорогенеза, и пыльца готова к прорастанию. Это связано с тем, что в цветках, раскрывшихся до закладки на хранение, резко снижается активность гидролитических ферментов, ответственных за прорастание и начинаются процессы старения ПЗ [12].
Таким образом, для сравнительного анализа жизнеспособности пыльцы инбредных растений свеклы столовой при оценке большого набора образцов рекомендуется хранение цветущих веточек в бумажных пакетах при пониженной температуре (10...12°С). Данный способ хранения позволяет сохранить жизне- и оплодотворяющую способность микрогаметофита в течение семи-восьми суток. Такая необходимость часто возникает на первых этапах создания ms- и mf-линий для селекции на гетерозис, когда проводится инбридинг большого числа растений свеклы столовой.
-
• Литература
-
1. Hormaza J.I., Herrero M. Pollen selection // Theor. Appl Genet., 1992. – Vol 83. – P.663-672.
-
2. Ottaviano E., Mulcahy D.L. Genetics of angiosperm pollen // Advances in genetics, 1989. – Vol.2. – P.61-64.
-
3. Ветрова С.А. Исходный материал для селекции на гетерозис свеклы столовой / Автореф. дисс… канд. с.-х. наук: 06.01.05. Москва, 2011. – 24 с.
-
4. Бунин М.С., Шмыкова Н.А., Бочарникова Н.И., Пышная О.Н., Джос Е.А. Методические рекомендации по определению жизнеспособности пыльцы рода Capsikum annuum L. – Москва. – 2004. – С.9.
-
5. Методические указания по гаметной селекции сельскохозяйственных растений (методология, результаты и перспективы) / под ред. Пивоварова В.Ф. М. 2001. – 390с.
-
6. Козарь Е.Г., Беспалько Л.В.; Балашова Н.Н.; Балашова И.Т.; Пышная О.Н., Енгалычева И.А. Влияние условий хранения на жизнеспособность пыльцы перца сладкого // Материалы международной научно-практической конференции "Инновационные технологии в селекции и семеноводстве с.-х. культур" посвященной 125-летию С.И. Жегалова. М: ВНИИССОК. – 2006. – Т.2. – С.139-145.
-
7. Жужжалова Т.П. Эмбриология сахарной свеклы. Развитие мужского гаметофита / Энциклопедия рода Beta: биология, генетика, селекция свеклы /отв. ред. Малецкий С.И. –Новосибирск. –2010. – С.87-93.
-
8. Паушева З.П. Практикум по цитологии растений. М.: Агропромиздат, 1988. – 271 с.
-
9. Данвелл Д.М. Культура гаплоидных клеток // Биотехнология растений: культура клеток / Пер. с анг. под ред. Р. Г. Бутенко. М.: Агропромиздат, 1989. – С.33-51.
-
10. Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М: Агропромиздат, 1985. – 351 с.
-
11. Козарь Е.Г., Заячковский В.А., Федорова М.И., Балашова И.Т. Влияние температуры на прорастание пыльцы свеклы столовой в условиях in vitro // Научный аль-манах:сельскохозяйственные науки. – Тамбов. – 2015. – №11(4/13). – С.322-327.
-
12. Brewbaker J. L., Kwack B. H. The essential role of calcium ion in pollen germination and pollen tube grоwth //American Journal of Botany. – 1963. – V.50. – P.239-263.
-
-
• References
-
1. Hormaza J.I., Herrero M. Pollen selection // Theor. Appl Genet., 1992. Vol 83. P.663-672.
-
2. Ottaviano E., Mulcahy D.L. Genetics of angiosperm pollen // Advances in genetics, 1989. Vol.2. P. 61-64.
-
3. Vetrova S.A. Source material for breeding for heterosis beetroot / Avtoref. Diss.... kand. of agricultural Sciences: 06.01.05. Moscow, 2011. 158 p.
-
4. Bunin M.S., Shmykova N.A., Bocharnikova N.I., Pyshnaya O.N., Dzhos Y.A. Methodical recommendations on determination of germination pollen of the Capsikum annuum L. Moscow. 2004. P.9.
-
5. Methodological guidelines for gametes breeding of agricultural plants (methodology, results and perspectives) / ed. Pivovarov V.F. M.2001. 390p.
-
6. Kozar E.G., Bespalko L.V.; Balashova N.N., Balashova I.T., Pyshnaya O.N., Engalycheva I.A. Influence of storage conditions on germination of pollen of Capsikum annuum L. // Materials of international scientific-practical conference "Innovative technologies in plant breeding and seed growing of agricultural cultures" devoted to 125th anniversary of S.I. Zhegalov. M: VNIISSOK. 2006. T.2. P.139-145.
-
7. Zhuzhzhalova T.P. Embryology of sugar beet. The development of microgametophyte / Encyclopedia of the genus Beta: biology, genetics, breeding beets /resp. edited by Maletskii S.I. –Novosibirsk. 2010. P.87-93.
-
8. Pausheva Z.P. Practicum on plant Cytology. Moscow: Agropromizdat, 1988. 271 p.
-
9. Danvell D.M. Culture of haploid cells // Plant Biotechnology: cell culture / English. edited By R. G. Butenko. Moscow: Agropromizdat, 1989. P.33-51.
-
10. Dospehov B.A. Methodology of field experience (with the basics of statistical processing of research results). M: Agropromizdat, 1985. 351 p.
-
11. Kozar E.G., Zayachkovskiy V.A., Fedorova M.I., Balashova I.T., The Influence of temperature on the germination of pollen beetroot in vitro // Science almanac: agricultural science. Tambov. 2015. No.11(4/13). P.322-327.
-
12. Brewbaker J.L., Kwack B.H. The essential role of calcium ion in pollen germination and pollen tube grоwth //American Journal of Botany. 1963. V.50. P.239-263.
-
I 54 ]
Список литературы Влияние способа хранения на функциональные параметры пыльцы свеклы столовой
- Hormaza J.I., Herrero M. Pollen selection//Theor. Appl Genet., 1992. -Vol. 83. -P. 663-672.
- Ottaviano E., Mulcahy D.L. Genetics of angiosperm pollen//Advances in genetics, 1989. -Vol. 2. -P.61-64.
- Ветрова С.А. Исходный материал для селекции на гетерозис свеклы столовой/Автореф. дисс.. канд. с.-х. наук: 06.01.05. Москва, 2011. -24 С.
- Бунин М.С., Шмыкова Н.А., Бочарникова Н.И., Пышная О.Н., Джос Е.А. Методические рекомендации по определению жизнеспособности пыльцы рода Capsikum annuum L. -Москва. -2004. -С. 9.
- Методические указания по гаметной селекции сельскохозяйственных растений (методология, результаты и перспективы)/под ред. Пивоварова В.Ф. М. 2001. -390с.
- Козарь Е.Г., Беспалько Л.В.; Балашова Н.Н.; Балашова И.Т.; Пышная О.Н., Енгалычева И.А. Влияние условий хранения на жизнеспособность пыльцы перца сладкого//Материалы международной научно-практической конференции "Инновационные технологии в селекции и семеноводстве с.-х. культур" посвященной 125-летию С.И. Жегалова. М.: ВНИИССОК. -2006. -Т. 2. -С. 139-145.
- Жужжалова Т.П. Эмбриология сахарной свеклы. Развитие мужского гаметофита/Энциклопедия рода Beta: биология, генетика, селекция свеклы/отв. ред. Малецкий С.И. -Новосибирск. -2010. -С. 87-93.
- Паушева З.П. Практикум по цитологии растений. М.: Агропромиздат, 1988. -271 С.
- Данвелл Д.М. Культура гаплоидных клеток//Биотехнология растений: культура клеток/Пер. с анг. под ред. Р. Г. Бутенко. М.: Агропромиздат, 1989. -С. 33-51.
- Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М: Агропромиздат, 1985. -351 С.
- Козарь Е.Г., Заячковский В.А., Федорова М.И., Балашова И.Т. Влияние температуры на прорастание пыльцы свеклы столовой в условиях in vitro//Научный альманах: сельскохозяйственные науки. -Тамбов. -2015. -№ 11(4/13). -С. 322-327.
- Brewbaker J. L., Kwack B. H. The essential role of calcium ion in pollen germination and pollen tube growth//American Journal of Botany. -1963. -V. 50. -P. 239-263.


