Влияние способов лесовозобновления на генетическую структуру популяций ели финской Picea x fennica (Regel) Kom
Автор: Ильинов Алексей Алексеевич, Политов Дмитрий Владиславович, Раевский Борис Владимирович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 4 (109), 2010 года.
Бесплатный доступ
Лесные культуры, коренной древостой, производный древостой, формовое разнообразие, изоферменты, генетическая структура, генетическое разнообразие
Короткий адрес: https://sciup.org/14749724
IDR: 14749724
Текст статьи Влияние способов лесовозобновления на генетическую структуру популяций ели финской Picea x fennica (Regel) Kom
Для поддержания устойчивости популяций лесных древесных видов решающее значение имеет сохранение оптимального уровня внутрипопу-ляционного генетического разнообразия, и это должно учитываться при проведении различных лесохозяйственных мероприятий [1]. В то же время многие вопросы влияния хозяйственной деятельности на уровень генетического разнообразия популяций древесных видов остаются еще слабо изученными.
Целью исследования явилась сравнительная оценка фенотипической и генетической структуры малонарушенных и подвергшихся антропогенному воздействию популяций ели финской Picea x fennica (Regel) Kom.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования служили еловые древостои среднетаежной подзоны, представлен- ные главным образом елью гибридной или финской Picea x fennica (Regel) Kom., интрогрессивным гибридом ели европейской Picea abies (L.) Karst. и ели сибирской Picea obovata Ledeb. В Кондопожском и Пудожском районах Карелии были заложены 3 пробные площади (ПП). Первая, ПП-1 (Шуйско-Виданский лесхоз, Речинское лесничество, вблизи Галлезеро), размером 0,11 га – в лесных культурах ели, созданных посевом в 1966 году. Почва – супесчаный сильнокаменистый бурозем. Вторая, ПП-2 (Кондопожский лесхоз, Кончезерское лесничество, п. Кончезеро), 0,25 га, заложена в производном ельнике, сформировавшемся преимущественно из сохранившегося после рубки подроста. Давность рубки – 50– 55 лет. Участок характеризуется аналогичными с первой ПП почвами. Тип леса в обоих случаях – ельник черничный. Третья, ПП-3, 0,49 га, заложена в коренном ельнике черничном свежем, произрастающем на территории НП «Водлозер-
ский» (Водлозерское лесничество). Данная ПП была заложена в 1999 году В. А. Ананьевым и Б. В. Раевским в качестве элемента сети лесного мониторинга в НП «Водлозерский». В настоящей работе она служила эталоном малонарушенной климаксовой ценопопуляции ели европейской. Почва подзолисто-оглеенная, выложена тяжелыми глинами, очень влажная. Древостой по структуре близок к абсолютно разновозрастному. Пробные площади закладывались в соответствии с ОСТ 56-69-83 [3].
Для оценки уровня фенотипического разнообразия использовали анализ формового состава популяций по габитуальным признакам ели – типу ветвления и структуре коры [6]. В исследуемых древостоях были отобраны модельные деревья в количестве 41, 41 и 30 в лесных культурах, производном и коренном древостоях соответственно. Для анализа генетической структуры с каждого модельного дерева со средней и верхней третей кроны со стороны, ориентированной на юг, секатором отбирали побеги текущего года с почками (20–40 штук с дерева). Статистическая обработка материала проводилась с использованием MS Excel 2003. Основные показатели генетической изменчивости определяли с помощью программы GenAlЕx 6.2 [18].
Изучение генетической структуры популяций ели финской проводили на базе лаборатории популяционной генетики Института общей генетики им. Н. И. Вавилова РАН (г. Москва) с помощью метода электрофоретического анализа изоферментов вегетативных почек ели в полиакриламидном геле по разработанной ранее методике [4]. Изученные ферментные системы, их сокращенное обозначение, буферные системы и зоны активности приведены в табл. 1.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Фенотипическое разнообразие коренных и производных древостоев и лесных культур. Основные таксационные характеристики пробных площадей даны в табл. 2. Исследованные пробы характеризуются примерно одинаковыми условиями произрастания (один тип леса – ельник-черничник). Густота насаждений (число стволов на гектар) увеличивается от коренного ельника к лесным культурам, соответственно этому увеличивается и полнота насаждения. Усложнение возрастной структуры идет в обратном направлении (рис. 1) – от лесных культур (одновозрастные деревья) к коренному ельнику (абсолютно разновозрастный древостой).
Таблица 1
|
Изученные ферментные системы ели финской |
|||||
|
Фермент |
Сокращенное обозначение |
Номер по К. Ф. |
Буферная система |
Число зон активности |
|
|
наблюдаемых |
интерпретируемых |
||||
|
Флуоресцентная эстераза |
FE |
3.1.1.1 |
B, C |
2 |
1 |
|
Формиатдегидрогеназа |
FDH |
1.2.1.2 |
C |
1 |
1 |
|
Глутаматдегидрогеназа |
GDH |
1.4.1.2 |
B, C |
1 |
1 |
|
Глутаматоксалоацетаттрансаминаза |
GOT |
2.6.1.1 |
C |
3 |
3 |
|
Изоцитратдегидрогеназа |
IDH |
1.1.1.42 |
A |
2 |
2 |
|
Лейцинаминопептидаза |
LAP |
3.4.11.1 |
C, B |
2 |
2 |
|
Малатдегидрогеназа |
MDH |
1.1.1.37 |
A |
3 |
3 |
|
Фосфоeнолпируваткарбоксилаза |
PEPCA |
4.1.1.31 |
A |
1 |
1 |
|
6-фосфоглюконатдегидрогеназа |
PGD |
1.1.1.44 |
A |
3 |
2 |
|
Фосфоглюкоизомераза |
PGI |
5.3.1.9 |
С |
2 |
2 |
|
Фосфоглюкомутаза |
PGM |
2.7.5.1 |
B, A |
2 |
2 |
|
Шикиматдегидрогеназа |
SKDH |
1.1.1.25 |
A |
2 |
2 |
|
Супероксиддисмутаза |
SOD |
1.15.1.1 |
B |
3 |
1 |
Примечание. Буферные системы: A – морфолин-цитратная, pH 7,8 [9]; B – трис-ЭДТА-боратная, pH 8,6 [15]; C – трис-цитрат-LiOH-боратная [19].
Таблица 2
Таксационные характеристики нативной и нарушенной популяций и лесных культур ели финской
|
№ п/п |
Древостой |
Тип леса |
Структура древостоя |
Бонитет |
Диаметр средний, см |
Высота средняя, м |
Число стволов, шт./га |
Запас, м3/га |
Относительная полнота |
|
1 |
ПП-1, лесные культуры |
черничный |
10Е40 |
IV |
8,5 |
9,2 |
3771 |
142,06 |
0,85 |
|
2 |
ПП-2, производный ельник |
черничный |
5Е1404Е100 1Ос+Б, С |
IV |
18,0 |
17,2 |
868 |
226,28 |
0,85 |
|
3 |
ПП-3, коренной ельник |
черничный |
4,6Е2402,3Е1901,1Е120 1С1Ос+Б |
IV |
27,0 |
21,0 |
660 |
242,5 |
0,76 |
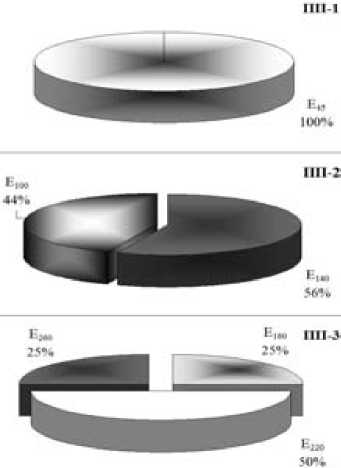
Рис. 1. Возрастная структура древостоев по основной породе – ели (Е): в подстрочнике показан возраст группы растений
Результаты изучения формового состава и структуры насаждений по строению коры представлены на рис. 2. Анализ формовой структуры производного древостоя и культур выявил у них однообразие по типу строения коры – практически все деревья были представлены чешуйчатокорой формой. Данные о формовом составе коренного ельника, взятые из более ранней работы [7], показали, что здесь представлены все три формы, причем также доминируют чешуйчатокорые деревья (75 %). Трещиноватокорые деревья составляют около 24 %, а гладкокорые встречаются единично (0,6 %). С помощью дисперсионного анализа (АNOVA) была показана статистически значимая связь между типом коры и возрастом дерева – трещиноватокорые ели выявлены главным образом среди старших по возрасту деревьев [7]. В коренном ельнике возраст деревьев варьирует от 23 до 308 лет. По-видимому, этим и объясняется его более сложный формовый состав.
Вследствие значительной сопряженности изменчивости по типу коры с возрастом дерева данный признак используется главным образом для глазомерной оценки возрастной структуры древостоя.
Оценка фенотипического разнообразия по типу ветвления показала (рис. 3), что культуры отличаются наименьшим разнообразием: подавляющее большинство деревьев были плосковетвистыми, щетковидные составили всего 6 %. Скорее всего, это связано с высокой густотой данного насаждения (табл. 2) и молодостью деревьев. В производном ельнике, так же как и в коренном, обнаружены 4 основных типа ветвления – плоский, шетковидный, компактный и гребенчатый. Отличия заключаются в процентном соотношении этих форм – 29 %, 67 %, 1 % и 3 % в производном ельнике; 58 %, 20 %, 21 % и 1 % – в коренном.
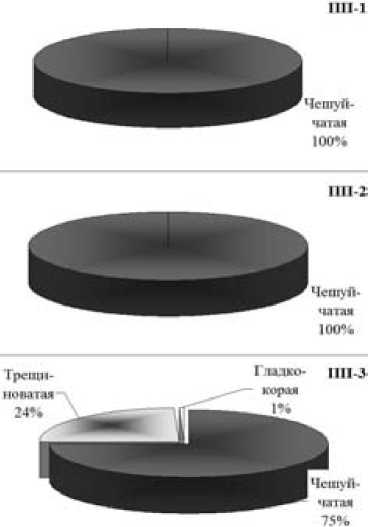
Рис. 2. Формовый состав лесных культур (ПП1), производного (ПП2) и коренного (ПП3) древостоев по строению коры
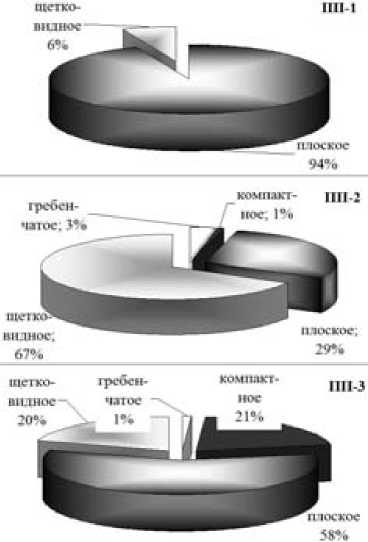
Рис. 3. Формовый состав лесных культур (ПП1), производного (ПП2) и коренного (ПП3) древостоев по типу ветвления
Таким образом, результаты анализа формового состава коренного и производного древостоев и лесных культур по типу ветвления свидетельствуют о разном уровне фенотипической изменчивости в исследованных популяциях ели финской. Более бедный формовой состав лесных культур говорит о невысокой степени фенотипического разнообразия в них по сравнению с нативной и нарушенной популяциями ели финской.
Генетическая структура и уровень генетического разнообразия коренных и производных
Аллельная структура нативной и лесных культур
древостоев и лесных культур. С помощью электрофоретического анализа изоферментов вегетативных почек изучена генетическая структура коренного и производного древостоев и культур. Изоферментный анализ 13 ген-ферментных систем выявил 53 аллельных варианта 24 локусов в выборке ели из коренного древостоя, 51 – в культурах ели и 47 – в производном древостое (табл. 3). Мономорфными во всех популяциях оказались 5 локусов (Got-2, Idh-2, Mdh-1, Pgi-1 и Sod-1), остальные – полиморфные.
Таблица 3
и нарушенной популяции ели финской
|
Локус |
Аллель |
Лесные культуры |
Производный древостой |
Коренной древостой |
Локус |
Аллель |
Лесные культуры |
Производный древостой |
Коренной древостой |
|
Fdh |
n |
82 |
82 |
60 |
Mdh-3 |
n |
82 |
82 |
60 |
|
В |
0,793 |
0,695 |
0,717 |
B |
0,000 |
0,012 |
0,000 |
||
|
С |
0,207 |
0,305 |
0,283 |
C |
1,000 |
0,988 |
1,000 |
||
|
Fe |
n |
82 |
82 |
60 |
Pepca |
N |
82 |
82 |
60 |
|
A |
0,000 |
0,024 |
0,000 |
A |
0,073 |
0,061 |
0,050 |
||
|
В |
1,000 |
0,963 |
1,000 |
B |
0,927 |
0,939 |
0,950 |
||
|
С |
0,000 |
0,012 |
0,000 |
6-Pgd-2 |
N |
82 |
82 |
60 |
|
|
Gdh |
n |
82 |
82 |
60 |
D |
0,538 |
0,512 |
0,600 |
|
|
A |
0,622 |
0,610 |
0,517 |
F |
0,462 |
0,488 |
0,400 |
||
|
B |
0,378 |
0,390 |
0,483 |
6-Pgd-3 |
N |
82 |
82 |
60 |
|
|
Got-1 |
n |
82 |
82 |
60 |
B |
0,641 |
0,775 |
0,850 |
|
|
A |
0,000 |
0,000 |
0,017 |
E |
0,359 |
0,225 |
0,150 |
||
|
B |
1,000 |
1,000 |
0,983 |
Pgi-1 |
N |
82 |
82 |
60 |
|
|
Got-2 |
n |
82 |
82 |
60 |
B |
1,000 |
1,000 |
1,000 |
|
|
B |
1,000 |
1,000 |
1,000 |
Pgi-2 |
N |
82 |
82 |
60 |
|
|
Got-3 |
n |
82 |
82 |
60 |
B |
0,232 |
0,256 |
0,200 |
|
|
A |
0,451 |
0,366 |
0,433 |
D |
0,756 |
0,732 |
0,800 |
||
|
C |
0,537 |
0,634 |
0,567 |
F |
0,012 |
0,012 |
0,000 |
||
|
Е |
0,012 |
0,000 |
0,000 |
Pgm-1 |
N |
82 |
82 |
60 |
|
|
Idh-1 |
n |
82 |
82 |
60 |
B |
1,000 |
1,000 |
0,950 |
|
|
B |
0,085 |
0,037 |
0,033 |
C |
0,000 |
0,000 |
0,050 |
||
|
C |
0,915 |
0,963 |
0,967 |
Pgm-2 |
N |
82 |
82 |
60 |
|
|
Idh-2 |
n |
82 |
82 |
60 |
A |
0,049 |
0,073 |
0,033 |
|
|
B |
1,000 |
1,000 |
1,000 |
B |
0,732 |
0,622 |
0,817 |
||
|
Lap-1 |
n |
82 |
82 |
58 |
C |
0,220 |
0,305 |
0,150 |
|
|
C |
0,000 |
0,000 |
0,017 |
Skdh-1 |
N |
82 |
82 |
60 |
|
|
D |
0,195 |
0,183 |
0,190 |
A |
0,037 |
0,000 |
0,000 |
||
|
E |
0,780 |
0,817 |
0,776 |
B |
0,012 |
0,000 |
0,000 |
||
|
F |
0,024 |
0,000 |
0,017 |
C |
0,902 |
0,878 |
0,933 |
||
|
Lap-2 |
n |
82 |
82 |
58 |
F |
0,049 |
0,122 |
0,067 |
|
|
B |
0,134 |
0,110 |
0,086 |
Skdh-2 |
N |
82 |
82 |
60 |
|
|
C |
0,195 |
0,159 |
0,276 |
C |
0,976 |
0,988 |
1,000 |
||
|
D |
0,622 |
0,659 |
0,586 |
D |
0,024 |
0,012 |
0,000 |
||
|
E |
0,049 |
0,073 |
0,052 |
Sod-1 |
N |
82 |
82 |
60 |
|
|
Mdh-1 |
n |
82 |
82 |
60 |
A |
1,000 |
1,000 |
1,000 |
|
|
B |
1,000 |
1,000 |
1,000 |
Sod-2 |
N |
82 |
82 |
60 |
|
|
Mdh-2 |
n |
82 |
82 |
60 |
A |
0,024 |
0,049 |
0,100 |
|
|
C |
1,000 |
1,000 |
0,983 |
B |
0,963 |
0,951 |
0,900 |
||
|
D |
0,000 |
0,000 |
0,017 |
C |
0,012 |
0,000 |
0,000 |
Примечание. n – число исследованных гаплотипов.
Таблица 4
Генетическая изменчивость ели финской по 24 изоферментным локусам в коренном и производном древостое и лесных культурах
|
Выборка |
N |
а |
a<5% |
аУ |
А |
ne |
Р99%, % |
Р95%, % |
Н Е |
Н О |
F |
|
ПП-1, лесные культуры |
29 |
53 |
9 |
8 |
1,96 ± 0,20 |
1,35 ± 0,08 |
60,00 |
52,00 |
0,199 ± 0,042 |
0,213 |
–0,070 |
|
ПП-2, производный |
41 |
47 |
6 |
– |
1,80 ± 0,15 |
1,35 ± 0,08 |
64,00 |
52,00 |
0,197 ± 0,042 |
0,188 |
0,046 |
|
ельник |
|||||||||||
|
ПП-3, коренной ельник |
41 |
51 |
13 |
5 |
2,12 ± 0,19 |
1,35 ± 0,08 |
80,00 |
56,00 |
0,202 ± 0,039 |
0,197 |
0,025 |
|
Picea x fennica [5] |
175 |
– |
– |
– |
1,96 ± 0,03 |
1,34 |
64,00 |
64,00 |
0,182 ± 0,006 |
0,192 ± 0,006 |
–0,055 |
Примечание. N – число изученных деревьев; а, а <5% и а У – количество выявленных в популяции аллелей – всех, с частотой встречаемости менее 5 % и уникальных соответственно; А – число аллелей на локус; Р 99% и Р 95% – полиморфность по 99 % и 95 % критерию соответственно; Н Е и Н О – гетерозиготность ожидаемая и наблюдаемая соответственно; F – коэффициент инбридинга (индекс фиксации Райта).
Для всех изученных локусов наиболее распространенные аллели (с частотой более 0,05) являются общими для всех выборок. Своеобразие выборок выявляется при рассмотрении редких (с частотой не более 0,05) аллелей. Лесные культуры характеризуются максимальным числом редких аллелей (25,5 % от общего числа), превзойдя по этому показателю даже коренной ельник (17,0 %). Другой показатель – количество уникальных, выявленных только в одной выборке аллелей. По нему на первом месте находится коренной ельник (8 аллелей), на втором – культуры (5 аллелей). В производном ельнике уникальных аллелей не обнаружено.
Результаты, характеризующие уровень генетической изменчивости в изученных популяциях ели финской, представлены в табл. 4. По такому основному параметру, как наблюдаемая гетерозиготность (Нo = 0,213), выделилась выборка из лесных культур. Производное насаждение уступает культурам и коренному ельнику по уровню гетерозиготности и среднему числу аллелей на локус. При этом максимальные значения среднего числа аллелей на локус (А = 2,12), уровня полиморфизма (Р99% = 80 %) и ожидаемой гетерозиготности (Нe = 0,202) были выявлены в коренном древостое. Однако обнаруженные между популяциями различия в средних значениях параметров генетической изменчивости оказались статистически незначимы. В целом уровень генетического разнообразия исследованных выборок оказался довольно высоким и был близок к значениям, полученным другими исследователями для популяций большинства хвойных, в частности видов рода Picea [12].
Коэффициент фиксации Райта указывает на соотношение гомозиготных и гетерозиготных особей в популяциях [21]. В коренном и производном древостое выявлен небольшой избыток гомозигот (F = 0,046 и F = 0,025 соответственно), в то время как лесные культуры характеризовались избытком гетерозиготных особей (F = –0,070). Тем не менее значения этого параметра свидетельствуют о незначимом отклонении от равновесия Харди–Вайнберга в исследованных популяциях ели (табл. 4).
Проведенные исследования показали, что различия в генетической структуре между корен- ным и производным ельниками и лесными культурами касались только встречаемости редких и уникальных аллелей. Не выявлено значимого влияния изученных способов лесовозобновления на уровень генетической изменчивости сформировавшихся насаждений. Обнаруженный уровень внутрипопуляционного генетического разнообразия оказался довольно высоким как в коренном малонарушенном древостое, так и в производном насаждении и лесных культурах. В ряде работ, касающихся антропогенного влияния на генетическую структуру насаждений, также отмечено отсутствие заметного изменения уровня генетического разнообразия в нарушенных популяциях по сравнению с нативными [2], [13], [20]. В то же время S. E. Macdonald с соавторами обнаружили, что насаждения, возникшие после рубок, характеризовались значительно меньшим средним уровнем ожидаемой гетерозиготности по сравнению с естественными насаждениями [14].
Что касается лесных культур, одни авторы отмечают значительное снижение генетической изменчивости в искусственных древостоях [8], [10], [16] и др., другие указывают на отсутствие потерь в генетическом разнообразии при плантационном выращивании [11], [17], [22] и др. Одной из причин разногласий по этому вопросу могут быть различия в исследуемых объектах (например, условия и способы создания плантаций, наличие и виды ухода за ними и т. п.). В нашем случае выявленный для лесных культур высокий уровень генетической изменчивости является, по-видимому, следствием метода их создания – посева с использованием большого количества местных семян.
ВЫВОДЫ
-
1. Лесные культуры уступают производному и коренному древостою в уровне фенотипического разнообразия, выявленного по типу ветвления, что можно объяснить молодостью культур и высокой густотой насаждения.
-
2. Для всех изученных локусов наиболее распространенные аллели (с частотой более 0,05) являются общими для всех выборок. Своеобразие выборок выявляется при рассмотрении редких и уникальных аллелей.
В то же время не обнаружено статистически значимых различий в уровне генетического разнообразия между коренным ельником, производным древостоем, сформировавшимся из подроста, и лесными культурами, созданными методом посева. В лесных культурах обнаружена тенденция к эксцессу, а в производном ельнике – к дефициту гетерозигот.
Наибольшим уровнем внутрипопуляционного генетического разнообразия характеризовался коренной древостой. Лесные культуры отличались более высоким уровнем генетического разнообразия по сравнению с производным древостоем. Причиной этого, по всей видимости, является метод их создания – посев, когда в формировании насаждения участвует большое количество деревьев (генотипов).
Список литературы Влияние способов лесовозобновления на генетическую структуру популяций ели финской Picea x fennica (Regel) Kom
- Ирошников А. И. Влияние концентрированных рубок на генофонд и продуктивность новых поколений лесообразователей//Проблемы развития лесного комплекса северо-западного региона. Петрозаводск, 1996. С. 25-27.
- Камалова И. И. Генетические последствия влияния хозяйственной деятельности на популяционную структуру осны обыкновенной в средней подзоне европейской тайги//Биологическое разнообразие лесных экосистем.., 1995. С. 88-89.. ОСТ 56-69-83. Площади пробные лесоустроительные. Методы закладки. Порядок рассмотрения и утверждения воз-астов рубок главного пользования лесом. Приказ Рослесхоза от 28.05.93 № 134.
- Политов Д. В., Крутовский К. В. Клинальная изменчивость и интрогрессивная гибридизация в популяциях европейской и сибирской елей//Жизнь популяций в гетерогенной среде. Йошкар-Ола: Периодика Марий Эл, 998. С. 78-89.
- Потенко В. В., Ильинов А. А., Гончаренко Г. Г. Изучение генетической дифференциации популяций ели в Карелии с использованием метода изоферментного анализа//Селекция и семеноводство в Карелии.Петрозаводск: Карельский НЦ РАН, 1993. С. 66-76.
- Правдин Л. Ф. Ель европейская и ель сибирская в СССР. М.: Наука, 1975. 180 с.
- Раевский Б. В., Ананьев В. А., Ильинов А. А. Формовая структура популяций ели в коренных есах средней подзоны тайги//Человек и окружающая среда Баренц-региона в начале ХХI века: Материалы междунар. конф. Петрозаводск, 2001. С. 115-121.
- Brown A. H. D. Enzyme polymorphism in plant populations//Theor. Popul. Boil. 1979. Vol. 15. P. 1-42.
- Clayton J. W., Tretiak D. N. Amino-citrate buffer for pH control in starch gel electrophoresis//J. Fisheries Research oard Canada. 1972. Vol. 29. P. 1169-1172.
- Conkle M. T. Isozyme variation and linkage in six conifer species//Proc. of Symp. on Isozymes of North Amer. For. rees and For. Insects. USDA For. Serv. Gen. Tech. Rep. PSW-48. 1981. P. 11-17.
- Eckert R. T., Joly R. J., Neale D. B. Genetics of isozyme variants and linkage relationships among allozyme oci in 35 eastern white pine clones//Canad. J. Forest Res. 1981. Vol. 11. № 3. P. 573-579.
- Hamrick J. L., Godt M. J. W., Sherman -Broyls S. L. Factors influencing levels of genetic diversity n woody plant species//New Forest. 1992. Vol. 6. P. 95-12.
- Knowles P. Comparison of isozyme variation among natural stands and populations: jack pine and black spruce//Canad.J. Forest Res. 1985. Vol. 15. № 5. P. 902-908.
- Macdonald S. E., Thomas B. R., Cherniawsky D. M., Purdy B. G. Managing genetic resources f lodgepole pine in west-central Alberta: patterns of isozyme variation in natural populations and effects of forest anagement//Forest Ecology and Management. 2001. Vol. 152. P. 45-58.
- Markert C. L.,Faulhaber I. Lactate dehydrogenase isozyme patterns of fish//J. Exptl. Zool. 1965. Vol. 159.. 319-324.
- Moran G. F., Bell J. C., Matheson A. C. The genetic structure and levels of inbreeding in a Pinus radiata
- D. Don seed orchard//Silvae Genet. 1980. Vol. 29. № 1. P. 190-193.
- Muona O., Harju O. Effective population size, genetic variability, and mating system in natural stands and seed orchards f Pinus sylvestris//Silvae Genet. 1989. Vol. 38. P. 221-228.
- Peakall R. and Smouse P. E. GENALEX 6: genetic analysis in Excel. Population genetic software for teaching nd research//Molecular Ecology Notes. 2006. Vol. 6. 288-295.
- Ridgway S. H., Simpson, J. G., Patton G. S., Gilmartin W. G. Hematologic findings in certain mall cetaceans//J. Am. Vet. Med. Assoc. 1970. Vol. 157. P. 566-575.
- Thomas B. R., Macdonald S. E., Hicks M., Adams D. L. Hodgetts R. B. Effects of reforestation ethods on genetic diversity of lodgepole pine: an assessment using microsatellite and randomly amplified polymorphic NA markers//Theor. Appl. Genet. 1999. Vol. 98. P. 793-801.
- Wright S. The genetical structure of populations//Ann. Eugenics. 1951. Vol. 15. P. 323-354.
- Yow Т. Н., Wagner M. R., Wommack D. E., Tuskan G. A. Influence of selection for volume rowth on the genetic variability of southwestern рonderosa рine//Silvae Genet. 1992. Vol. 41. P. 326-333.


