Влияние стимуляции спинного мозга на хроническую модель фибрилляции предсердий в эксперименте на мини-свиньях
Автор: Шабанов В.В., Филиппенко А.Г., Белобородов В.В., Халхожаев Т.У., Муртазин В.И.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4 т.27, 2023 года.
Бесплатный доступ
Актуальность. Несмотря на стремительное развитие интервенционных методов лечения фибрилляции предсердий, эффективность катетерных технологий остается невысокой, особенно у пациентов с персистирующей и длительно персистирующей формами. Это заставляет ученых продолжать поиски новых методов лечения. Проблема экспериментальных исследований влияния спинальной стимуляции на фибрилляцию предсердий главным образом обусловлена отсутствием оптимальных алгоритмов стимуляции спинного мозга в эксперименте у животных с хронической моделью патологии. Это определяет актуальность разработки таких алгоритмов в эксперименте.
Модель хронической фибрилляции предсердий у животных, нарушение ритма сердца, спинальная стимуляция, эксперимент на животных
Короткий адрес: https://sciup.org/142240111
IDR: 142240111 | DOI: 10.21688/1681-3472-2023-4-43-51
Текст научной статьи Влияние стимуляции спинного мозга на хроническую модель фибрилляции предсердий в эксперименте на мини-свиньях
Фибрилляция предсердий (ФП) занимает лидирующую позицию среди всех нарушений ритма сердца в мировой популяции. Согласно Global Burden of Disease Study, в 2010 г. насчитывалось порядка 33,5 млн больных данной патологией. Однако всего за 6 лет эта цифра увеличилась на 30 % (до 43,6 млн человек) и продолжает расти [1; 2]. Такие темпы роста заболеваемости обусловлены преимущественно старением населения и совершенствованием методов выявления и диагностики ФП [3]. По прогнозам специалистов, к 2050 г. в США этим заболеванием будут страдать 6–12 млн человек, к 2060 г. в Европе — 17,9 млн [4; 5]. Согласно статистическим данным, в Российской Федерации доля пациентов с фибрилляцией и трепетанием предсердий составляет около 8 % от общего числа лиц с заболеваниями сердечно-сосудистой системы [6], что соответствует распространенности ФП, равной 2 536 случаев на 100 тысяч человек [7].
Медикаментозная терапия и способы хирургического лечения хорошо изучены, определена их эффективность, и каждый метод занял свое место в рекомендациях. Стоит отметить, что эффективность антиаритмической терапии у пациентов с ФП через 1 год применения составляет порядка 50 % [8–10]. Исходя из этого, разработка методов контроля ритма у больных ФП остается одним из приоритетных направлений клинической аритмологии. Так, у пациентов, рефрактерных к медикаментозной терапии, катетерная аблация является методом выбора согласно рекомендациям Европейского общества кардиологов (англ. European Society of Cardiology) и Российского кардиологического общества [11; 12]. Однако ее эффективность у пациентов с пароксизмальной формой составляет 50–80 %, тогда как при длительно персистирующей форме стабильный синусовый ритм после однократной катетерной процедуры сохраняется лишь у 32–40 % [11; 12].
Современный подход к лечению ФП катетерным методом основан на том, что в устьях легочных вен сгруппированы ганглионарные сплетения, которые являются источником триггерной активности. Однако сегодня имеются данные о таких скоплениях также в области задней стенки левого предсердия, вокруг верхней и нижней полых вен, аорты, в области пограничного гребня правого предсердия [13]. Более новые исследования по попыткам их аблации не показали увеличения свободы от ФП, но в ранних работах такие вмешательства были эффективными [14; 15].
Все вышеописанное указывает на вовлеченность автономной нервной системы (АНС) в патогенез развития ФП. Соответственно, попытки влиять на нервную систему на различных ее уровнях могут привести к увеличению свободы от ФП. Так, имеются исследования, в которых после инициации стимуляции спинного мозга (ССМ) снижалась индуцибель-ность ФП в эксперименте [16]. В настоящий момент нет работ, которые бы однозначно подтвердили или опровергли данное наблюдение.
Проблема экспериментальных исследований заключается в разработке алгоритмов ССМ для создания хронической модели ФП, не вызывающих гемодинамических изменений в организме животных. Такой алгоритм был разработан и описан ранее [17]. Используя его в совокупности с данными о влиянии ССМ на электрофизиологические свойства миокарда предсердий, мы можем следующим логическим этапом изучить влияние ССМ на хроническую ФП у животных.
Цель — оценить влияние ССМ на хроническую модель ФП у мини-свиней породы минисибс.
Методы
В исследование с хронической моделью ФП и ССМ было набрано 6 мини-свиней минисибс. Исследование проводилось в соответствии с директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей, приказом Минздрава России от 1 апреля 2016 г. № 199н «Об утверждении Правил надлежащей лабораторной практики», межгосударственным стандартом ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики» (введен в действие приказом Рос-стандарта от 20 ноября 2014 г. № 1700-ст). Содержали животных в соответствии с Руководством по уходу и использованию лабораторных животных. Локальный экспертный совет НМИЦ им. ак. Е.Н. Ме-шалкина одобрил исследование (протокол № 12 от 8 июня 2021 г.).
Вечером накануне операции животных не кормили, в воде не ограничивали. Анестезиологическое пособие на всех этапах ведения осуществляли совместно анестезиолог и ветеринарный врач, сертифицированные в соответствии со стандартами надлежащей лабораторной практики (англ. Good Laboratory Practice). Модель создания хронической ФП в рамках данного исследования была опубликована ранее [17]. Гипотеза состоит в том, что ССМ
способна препятствовать возникновению и прогрессированию фибрилляции предсердий.
Первым этапом каждому животному имплантировали электрокардиостимулятор (ЭКС) по представленной ранее технологии [17]. Всем испытуемым выполняли электрофизиологическое исследование сердца (ЭФИ) после имплантации ЭКС до инициации ССМ, после чего создавали модель хронической ФП. Далее животных поделили на две равные группы с включением алгоритма 1 спинальной стимуляции в группе А и алгоритма 2 в группе Б. Раз в 7 дней проводили ЭФИ с определением исходных параметров (ритм, базовая частота сердечных сокращений (ЧСС), точка Венкебаха, эффективный рефрактерный период (ЭРП) правого предсердия, индуцибель-ность ФП). Если при контроле во время отключения постоянной стимуляции предсердий сохранялась ФП, то оценивали только ЧСС с последующим включением стимуляции предсердий еще на 7 дней. Спустя две недели проводили кроссовер со сменой алгоритма ССМ на алгоритм 2 в группе А и на алгоритм 1 в группе Б. Таким образом исследовали разницу течения хронической модели ФП при двух различных алгоритмах спинальной стимуляции. Дизайн исследования представлен на рис. 1.
После успешной имплантации ЭКС выполняли ЭФИ, где оценивали: ЧСС, точку Венкебаха, ЭРП, ин-дуцибельность ФП сверхчастой и программной стимуляцией, после чего ЭКС включали на постоянную стимуляцию в режиме DOO с заданной частотой и атриовентрикулярной задержкой для создания хронической модели ФП. Расположение
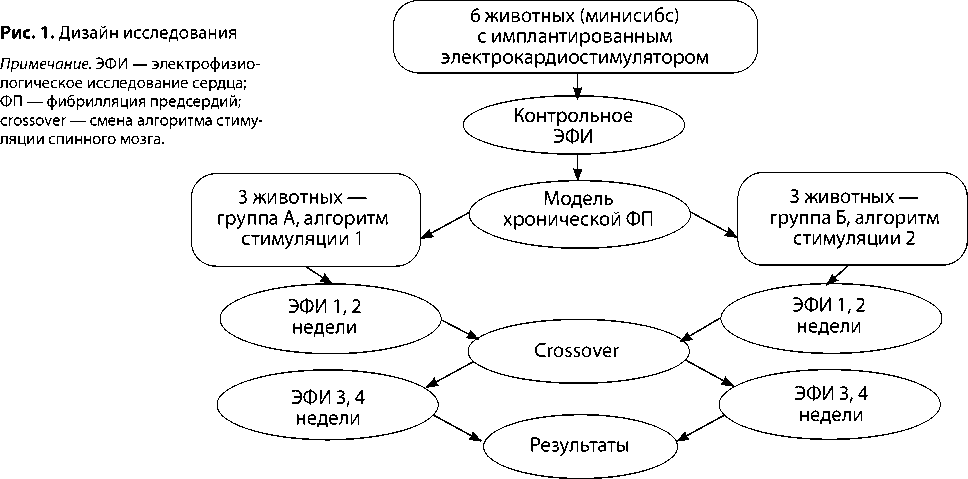
Рис. 2. Пример расположения электродов в правом предсердии (A), расположения ложа электрокардиостимулятора (B)
Примечание. 1 — электрод в области боковой стенки правого предсердия, 2 — электрод в области ушка правого предсердия, 3 — электрод в спинномозговом канале, 4 — расположение ложа электрокардиостимулятора.
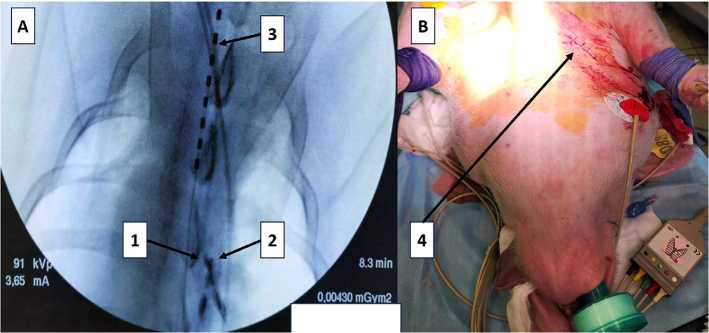
Рис. 3. Пример сверхчастой стимуляции с последующей индукцией фибрилляции предсердий
Примечание. 1 — сверхчастая стимуляция правого предсердия с частотой 600 уд/мин, 2 — индуцированная фибрилляция предсердий.
электродов в предсердии и спинномозговом канале отражено на рис. 2. На рис. 3 представлен пример сверхчастой стимуляции правого предсердия с последующей индукцией ФП. После ЭФИ каждому животному имплантировали устройство для спинальной нейростимуляции. Под флюороскопическим контролем пункционным путем помещали временный 8-контактный цилиндрический электрод (Linear 3-6, Boston Scientific, LTD, Мальборо, США) в заднее эпидуральное пространство на уровень, соответствующий спинальным сегментам Th1–Th4.
После удаления проводника электрод фиксировали и соединяли с временным внешним нейростимулятором. Всем животным имплантация устройства выполнена без осложнений. Для оценки влияния ССМ определили следующие параметры:
-
• амплитуда тока импульсов (мА);
-
• частота импульсов (Гц);
-
• ширина импульсов (мкс);
-
• вектор направления стимуляции.
Исследовали две комбинации c изменением амплитуды, частоты и ширины импульсов, а также сменой полюсов анода и катода от дистальных контактов к центру и в противоположном направлении. Во время острого эксперимента выполнили стимуляцию области задних столбов спинного мозга на уровне Th1–Th4, соответствующую расположению зоны межъядерного интраспинального переключения на симпатические ганглии АНС. Параметры частоты и ширины импульсов определялись рамками низкочастотной нейростимуляции, характерной для основного клинического применения ССМ у пациентов с рефрактерной стенокардией, и в подавляющем большинстве случаев находились в пределах 60 Гц и 450–550 мкс. Лимит уровня амплитуды тока устанавливали в пределах 1 мА и аргументировали появлением нежелательной миофасцикуляции конечностей при повышении силы тока. Основные векторы направления стимуляции характеризова- лись созданием электрического поля в виде диполя (катод–анод) на различных контактах электрода. Как было указано выше, электрод имеет 8 контактов, на которых возможно запрограммировать либо анод, либо катод. Рострально располагается первый контакт, каудальнее — второй и так далее вплоть до восьмого. Тем самым возможно создать диполи различной направленности и локализации, чтобы добиться электростимуляции различных участков спинного мозга с соответствующим клиническим представлением.
Варианты характеристик нейростимуляции представлены ниже.
|
Параметр |
Алгоритм 1 |
Алгоритм 2 |
|
Частота, Гц |
60 |
60 |
|
Ширина импульсов, мкс |
520 |
510 |
|
Амплитуда тока, мА |
1 |
0,9 |
|
Вектор нейростимуляции |
2+ 3+ 4– 5– 6+ 7+ |
2+ 7– |
После четвертого контроля животное выводили из исследования.
Статистический анализ
Для сравнения параметрических данных применяли t-критерий Стьюдента. Бинарные переменные сравнивали с помощью точного критерия Фишера.
Результаты
В серии экспериментальных работ осложнений при имплантации нейростимулятора и последующей стимуляции задних столбов спинного мозга не было. Всем объектам эксперимента успешно имплантировали двухкамерные ЭКС с позиционированием одного электрода в ушко правого предсердия, второго в свободную стен-
Показатели электрофизиологического исследования: исходно и после каждого алгоритма спинальной стимуляции; сравнение алгоритмов 1 и 2
|
Показатель |
Исходные данные, n = 6 |
Алгоритм 1 ССМ в течение 2 недель, n = 6 |
Алгоритм 2 ССМ в течение 2 недель, n = 6 |
p*,** (разница средних) |
p # (разница средних) |
|
Частота сердечных сокращений, уд/мин |
91,7 ± 4,8 |
118,5 ± 11,6 |
86,8 ± 2,5 |
0,0018* (-26,8 [95% ДИ -38,2; -15,5]) 0,11** (4,8 [95% ДИ -1,65; 11,30]) |
0,017 # (31,7 [95% ДИ 18,3; 45,0]) |
|
Точка Венкебаха, уд/мин |
190,0 ± 8,4 |
213,0 ± 11,8 |
165,0 ± 8,4 |
0,0097* (-23 [95% ДИ -37,5; -8,5]) 0,001** (25 [95% ДИ 15,5; 34,4]) |
0,006 # (48 [95% ДИ 31,8; 64,1]) |
|
Эффективный рефрактерный период правого предсердия, мс |
288,3 ± 9,3 |
225,0 ± 34,5 |
283,3 ± 40,8 |
0,0034* (63,3 [95% ДИ 32,2; 94,4]) 0,8** (5 [95% ДИ -44,4; 54,4]) |
0,07 # (-58,3 [95% ДИ -123,5; -6,8]) |
|
Индукция ФП СС, n (%) |
3 (50) |
0 (0) |
6 (100) |
0,18* 0,18** |
0,002 # |
|
Индукция ФП ПС, n (%) |
2 (33) |
1 (17) |
6 (100) |
> 0,99* 0,061** |
0,015 # |
Примечание. ССМ — стимуляция спинного мозга; ДИ — доверительный интервал; ФП СС — результат попытки индукции фибрилляции предсердий трехминутной сверхчастой стимуляцией правого предсердия; ФП ПС — результат попытки индукции фибрилляции предсердий программной стимуляцией правого предсердия; * — сравнение исходных данных с алгоритмом 1; ** — сравнение исходных данных с алгоритмом 2; # — сравнение между алгоритмами 1 и 2.
ку правого предсердия. В двух случаях (по одному в каждой группе) второй электрод имплантировали в перегородку правого предсердия. При проведении исходной ЭФИ (до инициации спинальной стимуляции) средняя базовая ЧСС составила 91,7 ± 4,8 уд/мин, средний ЭРП 288,3 ± 9,3 мс ( таблица ). Трем животным удалось индуцировать устойчивые пароксизмы ФП сверхчастой стимуляцией правого предсердия, которые купировались в течение 1–2 мин во всех случаях. Программной стимуляцией правого предсердия индуцировали пароксизмы устойчивой ФП в двух случаях с восстановлением синусового ритма в течение 1–2 мин.
После применения алгоритма 1 ССМ в течение двух недель во всех 6 случаях успешно выполнили полноценное контрольное ЭФИ. После двух недель применения алгоритма 2 на контрольном ЭФИ в 4 случаях из 6 сохранялась ФП, что не позволило провести весь алгоритм исследования. Во время теста сверхчастой стимуляции в течение 3 мин при применении алгоритма 1 в течение 14 дней индуцировать устойчивый пароксизм ФП не удалось ни в одном из 6 ЭФИ, а при применении алгоритма 2 это оказалось возможным во всех случаях. При программированной стимуляции правого предсердия ФП индуцировали у 1 (17 %) животного с алгоритмом 1 и у 6 (100 %) — с алгоритмом 2.
Оценивали разницу значений показателей ЭФИ, полученных исходно и после применения каждого из алгоритмов ССМ. Средняя ЧСС была значимо выше при использовании алгоритма 1 (р = 0,0018; разница средних -26,8 [95% доверительный интервал -38,2; -15,5]), алгоритм 2 достоверных различий не показал (р = 0,11; разница средних 4,8 [95% доверительный интервал -1,65; 11,30]). Точка Венкебаха при обоих алгоритмах значимо отличалась от исходной: при алгоритме 1 была выше (213,0 ± 11,8 против 190,0 ± 8,4 уд/мин; р = 0,0097), при алгоритме 2 — ниже первоначальной (165,0 ± 8,4 уд/мин; р = 0,001). При исследовании ЭРП значимое отличие от исходных показателей продемонстрировал алгоритм 1 (225,0 ± 34,5 против 288,3 ± 9,3 мс; р = 0,0034), при алгоритме 2 разница не достигла статистической значимости (283,3 ± 40,8 мс; р = 0,8). Индуцибельность ФП при алгоритме ССМ 1 была ниже исходной как при сверхчастой стимуляции, так и при программной стимуляции правого предсердия без достоверной разницы (р = 0,18; р > 0,99 соответственно). Показатели индуцибельности ФП при алгоритме 2 были выше исходных, но также без статистически значимых различий (р = 0,18; р = 0,061 соответственно).
При сравнении двух алгоритмов ССМ между собой получена достоверная разница по всем показателям, кроме ЭРП (p = 0,07). При применении алгоритма 1 средняя ЧСС и точка Венкебаха были значимо выше (p = 0,017; p = 0,006 соответственно), а индуцибельность ФП — значимо ниже как при сверхчастой стимуляции, так и при программной стимуляции правого предсердия (р = 0,002; р = 0,015 соответственно).
Обсуждение
Поиск новых методов лечения ФП и увеличения их эффективности остается приоритетным направлением клинической аритмологии. В многочисленных исследованиях показано существенное влияние АНС на электрофизиологические свойства сердца. В частности, дисбаланс между звеньями симпатической и парасимпатической нервной системы ассоциирован с развитием и поддержанием фибрилляции предсердий [18].
ССМ на протяжении последних десятилетий применяется для лечения различных заболеваний, включая хроническую нейрогенную боль, патологии периферических артерий и стенокардию [19–23]. Однако данные о действии стимуляции на ФП в мировой литературе немногочисленны. S.A. Bernstein и соавт. показали, что ССМ влияет на продолжительность ЭРП предсердий и предотвращает индуцируемость ФП у животных [24]. В нашем исследовании мы получили сходные данные по протективному от ФП влиянию ССМ при алгоритме 1, а алгоритм 2 такой тенденции не продемонстрировал. Тем не менее достоверной разницы по индуцибельности ФП в сравнении с исходными показателями ЭФИ не получено ни в одном из алгоритмов. Возможно, это связано с небольшой выборкой животных в нашем исследовании и с тем, что S.A. Bernstein и соавт. использовали в качестве испытуемых собак. Более того, удлинения ЭРП не наблюдалось при алгоритме ССМ 2, а алгоритм 1 продемонстрировал укорочение ЭРП, что противоречит данным указанных авторов.
В нашем исследовании при сравнении алгоритмов ССМ 1 и 2 была получена значимая разница по всем параметрам ЭФИ, кроме ЭРП. Это может быть связано с тем, что полноценное ЭФИ было недоступно в случае сохранявшейся ФП после отключения стимуляции предсердий, что наблюдалось в 4 случаях из 6 при применении алгоритма 2.
Данные о влиянии спинальной стимуляции на АНС в литературе противоречивы, а оптимальные параметры ССМ не определены [25; 26]. В нашем исследовании алгоритм 1 был более эффективным для ингибирования ФП и акселерации ЧСС. Косвенно это может указывать на то, что этот алгоритм оказывает более выраженный эффект на автономную нервную систему.
В экспериментальных работах по созданию хронической модели ФП свиньи редко присутствуют, в отличие от собак и овец, так как требуется седация для оценки нарушений ритма сердца. Изучение алгоритмов ССМ на модели ФП у свиней может способствовать разработке оптимального алгоритма стимуляции, который будет наиболее актуален для применения в клинических исследованиях. Во-первых, анатомия свиного сердца близка к человеческой. Во-вторых, наблюдается сходство электрофизиологических свойств свиных сердец с человеческими.
Заключение
ССМ у животных с моделью хронической ФП безопасна и, в зависимости от алгоритма, значимо изменяет базовую ЧСС, точку Венкебаха и ЭРП, что доказывает ее воздействие на АНС. Также ССМ показывает тенденцию к снижению индуцибельности ФП в зависимости от выбранного алгоритма. Серия экспериментов указывает на модифицирующее влияние ССМ на АНС, выраженное в снижении продолжительности и индуцибельности ФП у животных с хронической моделью ФП. Требуются дальнейшие исследования с большей выборкой животных.
Список литературы Влияние стимуляции спинного мозга на хроническую модель фибрилляции предсердий в эксперименте на мини-свиньях
- Chugh S.S., Havmoeller R., Narayanan K., Singh D., Riens-tra M., Benjamin E.J., Gillum R.F., Kim Y.-H., McAnulty J.H. Jr, Zheng Zh.-J., Forouzanfar M.H., Naghavi M., Mensah G.A., Ez-zati M., Murray C.J.L. Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014;129(8):837-847. PMID: 24345399; PMCID: PMC4151302. https://doi.org/10.1161/CIRCULATI0NAHA.113.005119
- Madhavan M., Hu T.Y., Gersh B.J., Roger V.L., Killian J., Weston S.A., Graff-Radford J., Asirvatham S.J., Chamberlain A.M. Efficacy of warfarin anticoagulation and incident dementia in a community-based cohort of atrial fibrillation. Mayo Clin Proc. 2018;93(2):145-154. PMID: 29329798; PMCID: PMC5814135. https://doi.org/10.1016/j.mayocp.2017.09.021
- Staerk L., Sherer J.A., Ko D., Benjamin E.J., Helm R.H. Atrial fibrillation: epidemiology, pathophysiology, and clinical outcomes. Circ Res. 2017;120(9):1501-1517. PMID: 28450367; PMCID: PMC5500874. https://doi.org/10.1161/CIRCRESA-HA.117.309732
- Krijthe B.P., Kunst A., Benjamin E.J., Lip G.Y.H., Franco O.H., Hofman A., Witteman J.C.M., Stricker B.H., Heeringa J. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart J. 2013;34(35):2746-2751. PMID: 23900699; PMCID: PMC3858024. https://doi.org/10.1093/eurheartj/eht280
- Patel N.J., Deshmukh A., Pant S., Singh V., Patel N., Arora Sh., Shah N., Chothani A., Savani G.T., Mehta K., Parikh V., Rath-od A., Badheka A.O., Lafferty J., Kowalski M., Mehta J.L., Mitra-ni R.D., Viles-Gonzalez J.F., Paydak H. Contemporary trends of hospitalization for atrial fibrillation in the United States, 2000 through 2010: implications for healthcare planning. Circulation. 2014;129(23):2371-2379. PMID: 24842943. https://doi. org/10.1161/CIRCULATI0NAHA.114.008201
- Serdechnaya E., Tatarsky B., Urieva S. Epidemiology. Atrial fibrillation in the Russian north. 25 years follow up. Europace Supplements. 2007;9(Suppl 3):iii22.
- Филатов А.Г., Тарашвили Э.Г. Эпидемиология и социальная значимость фибрилляции предсердий. Анналы аритмо-логии. 2012;9(2):5-13.; Filatov A.G., Tarashvili E.G. Epidemiology and social significance of atrial fibrillation. Annaly arrhythmologii = Annals of Arrhythmology. 2012;9(2):5-13. (In Russ.)
- Olshansky B., Rosenfeld L.E., Warner A.L., Solomon A.J., O'Neill G., Sharma A., Platia E., Feld G.K., Akiyama T., Brodsky M.A., Greene H.L. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) study: approaches to control rate in atrial fibrillation. J Am Coll Car-diol. 2004;43(7):1201-1208. PMID: 15063430. https://doi. org/10.1016/j.jacc.2003.11.032
- Ganesan A.N., Shipp N.J., Brooks A.G., Kuklik P., Lau D.H., Lim H.S., Sullivan T., Roberts-Thomson K.C., Sanders P. Long-term outcomes of catheter ablation of atrial fibrillation: a systematic review and meta-analysis. J Am Heart Assoc. 2013;2(2):e004549. PMID: 23537812; PMCID: PMC3647286. https://doi.org/10.1161/JAHA.112.004549
- Packer D.L., Mark D.B., Robb R.A., Monahan K.H., Bahnson T.D., Moretz K., Poole J.E., Mascette A., Rosenberg Y., Jeffries N., Al-Khalidi H.R., Lee K.L.; CABANA Investigators. Catheter Ablation versus Antiarrhythmic Drug Therapy for Atrial Fibrillation (CABANA) trial: study rationale and design. Am Heart J. 2018;199:192-199. PMID: 29754661; PMCID: PMC6517320. https://doi.org/10.1016/j.ahj.2018.02.015
- Hindricks G., Potpara T., Dagres N., Arbelo E., Bax J.J., Blom-ström-Lundqvist C., Boriani G., Castella M., Dan G.-A., Dilaveris P.E., Fauchier L., Filippatos G., Kalman J.M., La Meir M., Lane D.A., Lebeau J.-P., Lettino M., Lip G.Y.H., Pinto F.J., Thomas G.N., Valgimigli M., Van Gelder I.C., Van Putte B.P., Wat-kins C.L., ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. Erratum in: Eur Heart J. 2021;42(5):507; Eur Heart J. 2021;42(40):4194. PMID: 32860505. https://doi.org/10.1093/eurheartj/ehaa612
- Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю., Голицын С.П., Голухова Е.З., Горев М.В., Давтян К.В., Драпкина О.М., Кро-пачева Е.С., Кучинская Е.А., Лайович Л.Ю., Миронов Н.Ю., Мишина И.Е., Панченко Е.П., Ревишвили А.Ш., Рзаев Ф.Г., Татарский Б.А., Уцумуева М.Д., Шахматова О.О., Шлевков Н.Б., Шпектор А.В., Андреев Д.А., Артюхина Е.А., Барбараш О.Л., Галявич А.С., Дупляков Д.В., Зенин С.А., Лебедев Д.С., Михайлов Е.Н., Новикова Н.А., Попов С.В., Филатов А.Г., Шляхто Е.В., Шубик Ю.В. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. https://doi. org/10.15829/1560-4071-2021-4594; Arakelyan M.G., Bockeria L.A., Vasilyeva E.Yu., Golitsyn S.P., Golukhova E.Z., Gorev M.V., Davtyan K.V., Drapkina O.M., Kropacheva E.S., Kuchinskaya E.A., Layovich L.Yu., Miro-nov N.Yu., Mishina I.E., Panchenko E.P., Revishvili A.Sh., Rzaev F.G., Tatarsky B.A., Utsumueva M.D., Shakhmatova O.O., Shlevkov N.B., Shpektor A.V., Andreev D.A., Artyukhina E.A., Barbarash O.L., Galyavich A.S., Duplyakov D.V., Zenin S.A., Lebedev D.S., Mikhailov E.N., Novikova N.A., Popov S.V., Filatov A.G., Shlyakhto E.V., Shubik Yu.V. 2020 Clinical guidelines for Atrial fibrillation and atrial flutter. Rossiiskii kardiologiches-kiyj jurnal = Russian Journal of Cardiology. 2021;26(7):4594. (In Russ.) https://doi.org/10.15829/1560-4071-2021-4594
- Hanna P., Buch E., Stavrakis S., Meyer C., Tompkins J.D., Ar-dell J.L., Shivkumar K. Neuroscientific therapies for atrial fibrillation. Cardiovasc Res. 2021;117(7):1732-1745. PMID: 33989382; PMCID: PMC8208752. https://doi.org/10.1093/cvr/cvab172
- Katritsis D.G., Pokushalov E., Romanov A., Giazitzoglou E., Siontis G.C.M., Po S.S., Camm A.J., Ioannidis J.P.A. Autonomic denervation added to pulmonary vein isolation for paroxysmal atrial fibrillation: a randomized clinical trial. J Am Coll Cardiol. 2013;62(24):2318-2325. PMID: 23973694. https://doi. org/10.1016/j.jacc.2013.06.053
- Driessen A.H.G., Berger W.R., Krul S.PJ., van den Berg N.W.E., Neefs J., Piersma F.R., Chan Pin Yin D.R.P.P., de Jong J.S.S.G., van Boven W.P., de Groot J.R. Ganglion Plexus Ablation in Advanced Atrial Fibrillation: The AFACT Study. J Am Coll Cardiol. 2016;68(11):1155-1165. PMID: 27609676. https://doi. org/10.1016/j.jacc.2016.06.036
- Yu L., Huang B., He W., Wang S., Liao K., Zhou X., He B., Lu Z., Jiang H. Spinal cord stimulation suppresses focal rapid firing-induced atrial fibrillation by inhibiting atrial ganglionated plexus activity. J Cardiovasc Pharmacol. 2014;64(6):554-559. PMID: 25165998. https://doi.org/10.1097/FJC.0000000000000154
- Лосик Д.В., Белобородов В.В., Фишер Е.В., Муртазин В.И., Филиппенко А.Г., Михеенко И.Л., Шабанов В.В., Романов А.Б. Новая эндокардиальная би-электродная стимуляция правого предсердия у мини-свиней для создания модели фибрилляции предсердий. Патология кровообращения и кардиохирургия. 2023;27(1):47-53. https://dx.doi. org/10.21688/1681-3472-2023-1-47-53; Losik D.V., Beloborodov V.V., Fisher E.V., Murtazin V.I., Filip-penko A.G., Mikheenko I.L., Shabanov V.V., Romanov A.B. New atrial fibrillation model with endocardial approach by CRT bi-electrode atrial pacing in mini-pigs. Patologiya krovo-obrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2023;27(1):47-53. (In Russ.) https://dx.doi. org/10.21688/1681-3472-2023-1-47-53
- Chen J., Wasmund S.L., Hamdan M.H. Back to the future: the role of the autonomic nervous system in atrial fibrillation. Pacing Clin Electrophysiol. 2006;29(4):413-421. PMID: 16650271. https://doi.org/10.1111/j.1540-8159.2006.00362.x
- Augustinsson L.E., Carlsson C.A., Holm J., Jivegard L. Epidural electrical stimulation in severe limb ischemia. Pain relief, increased blood flow, and a possible limb-saving effect. Ann Surg. 1985;202(1 ):104-110. PMID: 3874610; PMCID: PMC1250845. https://doi.org/10.1097/00000658-198507000-00017
- Jacobs M.J., Jörning P.J., Beckers R.C., Ubbink D.T., van Kleef M., Slaaf D.W., Reneman R.S. Foot salvage and improvement of microvascular blood flow as a result of epidural spinal cord electrical stimulation. J Vasc Surg. 1990;12(3):354-360. PMID: 2398593.
- DeJongste M.J. Spinal cord stimulation for ischemic heart disease. Neurol Res. 2000;22(3):293-298. PMID: 10769823. https:// doi.org/10.1080/01616412.2000.11740673
- Fanciullo G.J., Robb J.F., Rose R.J., Sanders J.H. Jr. Spinal cord stimulation for intractable angina pectoris. Anesth Analg. 1999;89(2):305-306. PMID: 10439736. https://doi. org/10.1097/00000539-199908000-00009
- Jessurun G.A., DeJongste M.J., Hautvast R.W., Tio R.A., Brou-wer J., van Lelieveld S., Crijns H.J. Clinical follow-up after cessation of chronic electrical neuromodulation in patients with severe coronary artery disease: a prospective randomized controlled study on putative involvement of sympathetic activity. Pacing Clin Electrophysiol. 1999;22(10):1432-1439. PMID: 10588144. https://doi.org/10.1111/j.1540-8159.1999. tb00346.x
- Bernstein S.A., Wong B., Vasquez C., Rosenberg S.P., Rooke R., Kuznekoff L.M., Lader J.M., Mahoney V.M., Budylin T., Älvstrand M., Rakowski-Anderson T., Bharmi R., Shah R., Fowler S., Holmes D., Farazi T.G., Chinitz L.A., Morley G.E. Spinal cord stimulation protects against atrial fibrillation induced by tachypacing. Heart Rhythm. 2012;9(9):1426-1433.e3. PMID: 22554859; PMCID: PMC3634125. https://doi.org/10.1016XI. hrthm.2012.04.038
- Olgin J.E., Takahashi T., Wilson E., Vereckei A., Steinberg H., Zipes D.P. Effects of thoracic spinal cord stimulation on cardiac autonomic regulation of the sinus and atrioven-tricular nodes. J Cardiovasc Electrophysiol. 2002;13(5):475-481. PMID: 12030530. https://doi.org/10.1046/U540-8167.2002.00475.x
- Cardinal R., Page P., Vermeulen M., Bouchard C., Ardell J.L., Foreman R.D., Armour J.A. Spinal cord stimulation suppresses bradycardias and atrial tachyarrhythmias induced by mediastinal nerve stimulation in dogs. Am J Physiol Regul Integr Comp Physiol. 2006;291 (5):R1369-R1375. PMID: 16778070. https:// doi.org/10.1152/aIpregu.00056.2006


