Влияние структуры хлоропластов на плотность фотонных состояний и эффективность преобразования солнечной энергии
Автор: Шабанова К. А., Логинов Ю. Ю., Буханов Е. Р., Волочаев М. Н., Пятина С. А.
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Технологические процессы и материалы
Статья в выпуске: 4 т.22, 2021 года.
Бесплатный доступ
Благодаря поглощению солнечной энергии в хлоропластах - зелёных пластидах - происходит преобразование солнечной энергии в энергию химических связей. Изучение процессов фотосинтеза и увеличение его эффективности актуально для разработки замкнутых систем жизнеобеспечения, в том числе, при длительных полетах в космосе. Хлоропласты в свою очередь наполнены стопками высокоупорядоченных тилакоидных мембран (гранами). На границе этих мембран и располагаются пигмент-белковые фотосинтетические комплексы. Долгое время структурным характеристикам хлоропластов не уделялось должного внимания и они изучались как изотропные вещества, однако в последние годы было показано, что они обладают анизотропными свойствами и высоким коэффициентом преобразования при разделении зарядов. В данной работе был предложен подход к более точному пространственному определению гран в хлоропластах растений и определению размеров единичного блока. Тилакоидные мембраны и границы состоящей из них граны отчетливо видны в электронном микроскопе, если пучок электронов направлен строго перпендикулярно. Было замечено, что при повороте столика разные области мембран становятся либо расплывчатыми, либо более четкими, что говорит о том, что граны в хлоропластах располагаются не в одной плоскости. Также проведено сравнение влияния разных внешних условий на структуру хлоропласта растения не только через сравнение морфологических характеристик, но и посредством численного моделирования и сравнения спектральных свойств объектов. Для численного моделирования были определены периодические решетки для основных структурных единиц хлоропластов разных образцов. На основе этих решеток были рассчитаны спектры пропускания с помощью метода трансфер матриц. Также полученные значения электромагнитной волны вдоль решетки позволили рассчитать графики плотности фотонных состояний. Результаты расчетного метода графиков плотности фотонных состояний на основе структуры хлоропластов позволили не просто оценить * Исследования были выполнены на оборудовании центра коллективного пользования ФИЦ КНЦ СО РАН. The studies were performed on the equipment of Resource sharing center of the FRC KSC of the SB RAS. возможную эффективность фотосинтеза, но и напрямую связать эти модели с внешними условиями, влияющими на растение.
Биофотонный кристалл, плотность фотонных состояний, электронная микроскопия, фотосинтез
Короткий адрес: https://sciup.org/148323934
IDR: 148323934 | УДК: 620.187.3, | DOI: 10.31772/2712-8970-2021-22-4-708-717
Текст научной статьи Влияние структуры хлоропластов на плотность фотонных состояний и эффективность преобразования солнечной энергии
В процессе фотосинтеза энергия поглощения солнечного света преобразуется в энергию химических связей. Фотосинтез является единственным космическим процессом в биосфере, обеспечивающим увеличение ее свободной энергии за счет внешнего источника [1; 2]. Этот процесс обеспечивает атмосферу кислородом и всеми жизненно необходимыми продуктами.
К фотосинтезирующим организмам относятся высшие растения, водоросли, а также специфические группы бактерий. Все вышеприведенные организмы имеют свое строение, находятся в разнообразных природных условиях, но тем не менее обладают рядом общих свойств. В любом из них фотосинтетическое устройство преобразует энергию световой волны в химическую по схеме: световая → электронная → электрическая → химическая [3; 4].
Для описания этих процессов наиболее распространенной является следующая модель. Свет собирает антенны и возбуждает части молекул, электроны которых за счет переноса образуют электрический ток, а создаваемый при этом электрический потенциал обеспечивает процесс переноса протона и связанные с ними химические реакции. КПД разделения зарядов высоко ~ 95 % [5; 6], не достигнуто в искусственных преобразователях. Столь высокий КПД обусловлен, в том числе, строением хлоропластов, в которых располагаются основные элементы фотопреобразующей системы [7–9].
В настоящее время одним из самых перспективных структурных методов является электронная микроскопия [10–14]. Эти методы позволяют исследовать структуру образцов, их морфологию, оценивать размеры микрообъектов, упорядочение и ориентацию их относительно друг друга. Поэтому разработка новых подходов исследования для растровой и просвечивающей электронной микроскопии биологических объектов представляет собой значительный научный интерес.
Целью данной работы является исследование методом просвечивающей электронной микроскопии влияния структурных особенностей хлоропластов высших растений на примере полевой пшеницы и ячменя, выращенных в лабораторных и естественных условиях, на плотность фотонных состояний и эффективность преобразования солнечной энергии.
Методы. Пробоподготовка образцов
Одинаковые растения ячменя были выращены в двух разных условиях. В первом случае (лабораторном) растения росли в фитотроне, где параметры, воздействующие на образец, такие как вода, питание, интенсивность и время света, регулировались с помощью компьютера и растение оптимально обеспечивалось. Во втором случае растения росли на полях, где происходили регулярные общие поливы, а за все остальное отвечали естественные природные условия. Таким же образом выращивались растения пшеницы. На этапе колошения были собраны флаговые листы.
Структурные исследования проводили на небольших срезах листьев, фиксированных 2,5 % глутаральдегидом в фосфатно-солевом буфере с последующей дофиксацией 1 % тетроксидом осмия. После обезвоживания с помощью серии возрастающих концентраций спирта и ацетона образцы заливали эпоксидной смолой. Для исследования получали ультратонкие срезы на ультрамикротоме Leica EM UC7, контрастировали уранилацетатом и цитратом свинца [15; 16].
Цифровые изображения срезов получали в цифровом виде на просвечивающем электронном микроскопе Hitachi HT7700. Этот прибор позволяет рассматривать биологические объекты без их существенной деградации под действием электронного пучка. Образцы были рассмотрены при ускоряющем напряжении 100 кВ. Чтобы оценить положение тилакоидных мембран относительно друг друга, съемка изображений проводилась под разными углами.
Численное моделирование
За счёт разницы в показателях преломления слоёв, при прохождении света происходит его многократное переотражение на границах. Из-за этого в каждом слое существуют волны, движущиеся во встречных направлениях с амплитудами соответственно ( A i и B i ).
Метод трансфер-матриц позволяет упростить компьютерный расчёт амплитуд стационарных (устоявшихся во времени) волн в каждом из слоёв. Зная A i и B i , можно рассчитать A i –1 и B i –1 . Для этого необходимо знать показатели преломления ( ni и ni –1), толщину слоя ( Zi ) и частоту волны.
Можно написать, что
( A i –1 , B i –1 ) = Fn ( A i , B i , Z i , n i -1 , n i , ω).
Функция Fn одинакова для каждых пар слоёв. Используя её, за N +1 циклов можно при заданных начальных условиях ( A out = 1, B out = 0) найти ( A 0 , B 0 ), т. е. амплитуды падающей и отражённой волн.
Зная, что на выходе из структуры существует только исходящая волна ( A out = 1; B out = 0), проведя численные расчеты, можно получить массив относительных значений амплитуд в каждом из слоев ФК. Это позволяет найти распределение электромагнитного поля в слоистой структуре и спектр её пропускания.
Коэффициент пропускания T [17] (обязательное условие: показатели преломления сред до и после образца – одинаковы):
T = 1 -
B 0
A 0
Для определения плотности фотонных состояний использовалась формула, полученная в работе [18]:
pm
L S
2 L Л
sm (z )IEJ2 + -2 to
dE m dz
dz
- | E to^
где E ω – амплитуда электрической составляющей электромагнитного поля, E ωI – амплитуда падающей волны, ε ω ( z ) – диэлектрическая проницаемость от координаты, L Σ – общая толщина структуры.
График плотности фотонных состояний представляет собой набор точек. Каждая точка соответствует максимуму квадрата амплитуды электромагнитной волны при заданной частоте.
Результаты и обсуждение
На рис. 1 представлены изображения срезов хлоропластов ячменя, выращенного в лабораторных и полевых условиях.

Рис. 1. Электронные микрофотографии срезов хлоропластов ячменя: а – выращенного в лабораторных условиях; б – выращенного в полевых условиях
-
Fig. 1. Electron micrographs of chloroplast sections barley: a – grown in laboratory conditions; b – grown in field conditions
Темные включения представляют собой зерна крахмала, размер которых варьируется от 100 до 250 нм, полосы – тилакоидные мембраны. Тилакоиды внутри хлоропластов представляют собой ограниченные мембраной участки клетки, в которых происходят светозависимые реакции фотосинтеза.
Из снимков видно, что у растения, выращенного в лабораторных условиях, тилакоидные мембраны более упорядочены. Характер упаковки и степень ее выраженности отличаются, несмотря на то что генетически растения являются одинаковыми. Мембраны второго растения выглядят неоднородными и деформированными. Это говорит о том, что начальные условия, в которых выращивались растения, сильно влияют на внутреннюю структуру.
Также, при проведении наших исследований, было установлено, что при изменении угла наклона столика, на котором расположен образец, выраженность мембран становится различной, что говорит о том, что граны в хлоропластах находятся не в одной плоскости (рис. 2).

Рис. 2. Наблюдение тилакоидных мембран ячменя, выращенного в полевых условиях под разными углами
-
Fig. 2. Observation of the thylakoid membranes of field-grown barley from different angles
Из рис. 2 видно, что при изменении угла обзора на 15° меняется и четкость изображения мембран. Те же самые участки, что были четко выраженными (рис. 2, а ), стали расплывчатыми или совсем не различимыми (рис. 2, б ) после незначительного наклона столика, и наоборот.
Таким образом, расположение образца относительно пучка электронного микроскопа может влиять на видимую картину. Далее теорию проверяли на совсем другом образце. На рис. 3 изображены снимки структуры хлоропласта пшеницы Красноярская 12 под разными углами.

Рис. 3. Изображения тилакоидных мембран пшеницы под разными углами
Pic. 3. Images of wheat thylakoid membranes from different angles
Из рис. 3, а видно, что тилакоиды образуют длиннопериодическую структуру на протяжении всего хлоропласта и размер одной граны варьируется от 200 до 400 нм. Повернув образец, тем самым изменив угол обзора, мы увидели, что одна большая грана представляет собой 2 граны (рис. 3, б) размерностью около 130 нм.
Таким образом, при изучении морфологических характеристик образцов, если не смотреть образец под разными углами, можно получить искаженную картину отличную от реальной. Для оценки расположения гран на протяжении всего хлоропласта необходимо посмотреть его под разными углами и выделить граны, которые изменяются в разных направлениях. Также при отклонении образцов относительно пучка на разные углы, можно увидеть «слипшиеся» граны, которые в определенных случаях могут казаться как одна на просвечивающем микроскопе. Благодаря этому методу, мы не только можем разделить их, но и оценить истинный размер единого блока.
Поскольку размеры тилакоидов (и расстояние в стопках между ними) крайне малы по отдельности для проявления спектральной активности в области видимого диапазона, целесообразно считать целую стопку тилакоидов (грану) за единичный слой, усреднив их показатель преломления. И соответственно стромальное расстояние между гранами будет являться вторым слоем в структуре, состоящей из двух периодов, повторяющихся друг за другом. Таким образом, в такой структуре период может быть соизмерим с длиной волны света видимого диапазона.
По оценкам с изображений микроскопа (рис. 3, а ), ширина хлоропласта в поперечном срезе составляет около 2,7 мкм. Толщина единой граны ~150 нм, а стромального расстояния между гранами ~80 нм. Показатели преломления были взяты из литературных данных: 1,48 для гран и 1,33 для стромы [19; 20]. Это позволило смоделировать кристалл, состоящий из 24 чередующихся слоев. Для случая с растениями, выращенными в естественных условиях, где на рисунке мы наблюдали искажение строгой упорядоченности тилакоидов в гранах, мы использовали случайное отклонение ширин слоев фотонного кристалла до 20 % относительно лабораторного случая. Согласно литературным данным, размеры гран могут изменяться до 30 % в зависимости от внешних условий [21]. Таким образом, установлена разница между снимками разных случаев в первом приближении, позволяющая оценить потенциальную возможность эффективного фотосинтеза в данных растениях.
Расчеты проводились с использованием метода трансфер матриц [17]. Этот метод позволяет рассчитывать спектр пропускания и отражения периодических, квазипериодических и неупорядоченных структур. На основе этого методы были получены графики пропускания и плотности фотонных состояний для обоих случаев (рис. 4).
Из рис. 4 отчетливо видно, что в случае с моделью полевых растений селективная зона отражения менее выражена и её края более размыты. Также максимумы плотности фотонных состояний, приходящиеся на края стоп-зоны, на порядок ниже, что свидетельствует о менее эффективной возможности возникновения реакции фотосинтеза. Согласно золотому правилу Ферми – плотность фотонных состояний прямо пропорциональна вероятности реакции. Исходя из этих расчетов в первом приближении, можно сказать, что второе растение будет расти на порядок хуже, чем первое, что и наблюдалось в реальных условиях.
Данная методика исследования с помощью ПЭМ представляет интерес для изучения морфологических изменений генетически одинаковых, но выращенных в разных условиях, биологических образцов. Эти методы будут полезны при исследовании процессов, проходящих в замкнутых экосистемах при случайных деструкционных воздействиях, которые характерны для условий космоса, например, в условиях отсутствия магнитного поля Земли, земного тяготения и при усиленном радиационном воздействии.
К тому же более ясное понимание процессов фотосинтеза напрямую позволит перенести полученные знания на искусственные устройства, основанные на фотовольтаике, которые жизненно необходимы для беспилотных аппаратов, находящихся на орбите.
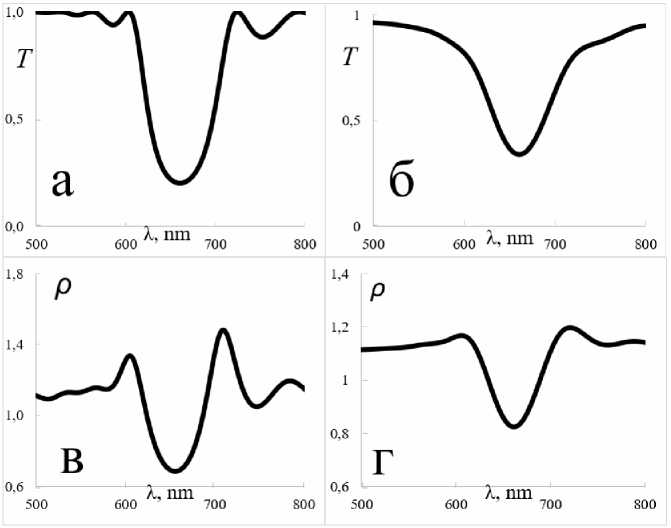
Рис. 4. Рассчитанные спектры для обеих моделей:
а – спектр пропускания для модели растения, выросшего в лабораторных условиях;
б – спектр пропускания для модели растения, выросшего в полевых условиях;
в – график плотности фотонных состояний для модели растения, выросшего в лабораторных условиях; г – график плотности фотонных состояний для модели растения, выросшего в полевых условиях
Fig. 4. Calculated spectra for both models:
a – transmission spectrum for a model of a plant grown in laboratory conditions;
b – transmission spectrum for a model of a plant grown in the field; c – a graph of the density of photon states for a model of a plant grown in laboratory conditions;
d – a graph of the density of photon states for a model of a plant grown in the field
Полученные результаты согласуются с хемиосмотической теорией Митчела [22] о механизмах преобразования энергии в биологических мембранах. Запасание энергии в АТФ происходит вследствие предварительного накопления зарядов на стенках мембраны. Разность электрохимического потенциала ионов водорода на сопрягающих мембранах (внутренних мембранах митохондрий, тилакоидов, хлоропластах) возникает за счёт поглощённых квантов света.
Заключение
-
1. Методом просвечивающей электронной микроскопии с высокой точностью определены размеры тилакоидов в различных хлоропластах образцов ячменя и пшеницы.
-
2. Обнаружено, что ансамбль гран и стромы образуют длиннопериодическую структуру с периодом сравнимым с длиной волны света (биофотоннокристаллическая структура).
-
4. Установлена зависимость упорядоченности тилакоидов в хлоропластах от условий внешней среды.
-
5. Высокая однородность размеров тилакоидов и резонансное взаимодействие брэгговских и спектральных полос поглощения фотосинтезирующих пигментов безусловно способствует высокому КПД разделения зарядов.
-
6. Установлено, что увеличение упорядоченности хлоропластов способствует росту плотности фотонных состояний и повышению эффективности фотосинтеза.
Список литературы Влияние структуры хлоропластов на плотность фотонных состояний и эффективность преобразования солнечной энергии
- Jacquemoud S., Ustin S. Leaf Optical Properties. Cambridge University Press: Cambridge, UK, 2019.
- Rabinowitch E. Photosynthesis and Related Processes. Interscience Publishers: New York, NY, USA, 1945.
- Blankenship R. E. Molecular Mechanisms of Photosynthesis. Wiley-Blackwell: New York, NY, US, 2014. 312p.
- Буханов Е., Коршунов М., Шабанов А. Оптические процессы в фотосинтезе // Сибирский лесной журнал. 2018. № 5. С. 19-32.
- Light absorption and energy transfer in the antenna complexes of photosynthetic organisms / T. Mirkovic, E. E. Ostroumov, J. M. Anna et al. // Chemical Reviews, 2017. Vol. 117, Is. 2. P. 249-293.
- Тихонов А. Н. Трансформация энергии в хлоропластах - энергопреобразующих органеллах растительной клетки // Соросовский образовательный журнал. 1996. № 4. C. 24-32.
- Garab G. Self-assembly and structural-functional flexibility of oxygenic photosynthetic machineries: personal perspectives // Photosynth Res. 2016. Vol. 127(1). P. 131-50.
- Rantala M., Rantala S., Aro E. Composition, phosphorylation and dynamic organization of photosynthetic protein complexes in plant thylakoid membrane. Photochem. Photobiol. Sci., 2020. P. 604-619.
- The ultrastructure and flexibility of thylakoid membranes in leaves and isolated chloroplasts as revealed by small-angle neutron scattering. R. Unnep, O. Zsiros, K. Solymosi et al. // Biochimia et Biophysica Acta (BBA) - Bioenergetics. 2014. Vol. 1837, Is. 9. P. 1572-1580.
- Photonic multilayer structure of Begonia chloroplasts enhances photosynthetic efficiency / M. Jacobs, M. Lopez-Garcia, O. P. Phrathep et al. Nat. Plants, 2016.
- Characterization of chloroplast iridescence in Selaginella erythropus / N. J. Masters, M. LopezGarcia, R. Oultonet al. Int., 2018.
- Bukhanov E. R., Gurevich Y. L., Shabanova K. A. A Study of Wheat Wax Optical Properties // In Proceedings of the 2019 Photonics & Electromagnetics Research Symposium-Fall (PIERS-Fall), Xiamen, China, 20 August 2019. P. 2890-2897.
- The Role of Periodic Structures in Light Harvesting / E. R. Bukhanov, A. V. Shabanov, M. N. Volochaev, S. A. Pyatina. Plants, 2021.
- Light-induced dynamic structural color by intracellular 3D photonic crystals in brown algae / M. Lopez-Garcia, N. Masters, H. E. O'Brien et al. Sci. Adv., 2018.
- Karnovsky M. J. Simple methods for «staining with lead» at high pH in electron microscopy // J. Biophys. Biochem. Cyt., 1961. P. 729-732.
- Semenova G. A., Romanova A. K. Crystals in sugar beet (Beta vulgaris L.) leaves. Cell and Tissue Biology, 2011. P. 74-80.
- Шабанов В. Ф., Ветров С. Я., Шабанов А. В. Оптика реальных фотонных кристаллов. Жидкокристаллические дефекты, неоднородности. Новосибирск : Издательство СО РАН, 2005. 209 c.
- Density of modes and tunneling times in finite one-dimensional photonic crystals: A comprehensive analysis / G. D'Aguanno, N. Mattiucci, M. Scalora et al. Phys. Rev., 2004.
- Bossard J. A., Lin L., Werner D. H. Evolving random fractal Cantor superlattices for the infrared using a genetic algorithm. J. R. Soc. Interface, 2016.
- Nanophotonics of higher-plant photosynthetic membranes / A. Capretti, A. K. Ringsmuth, J. F. van Velzen et al. Light Sci. Appl., 2019.
- Granal stacking of thylakoid membranes in higher plant chloroplasts: The physicochemical forces at work and the functional consequences that ensue / W. S. Chow, E. Kim, P. Horton, J. M Anderson. Photochem. Photobiol. Sci., 2005. P. 1081-1090.
- Холл Д., Рао К. Фотосинтез : пер. с англ. М. : Мир, 1983. 132 с.


