Влияние субстрата селекции на полихлорбифенил-деградативную активность аэробных почвенных бактериальных ассоциаций
Автор: Егорова Д.О., Первова М.Г., Демаков В.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
В результате накопительного культивирования с использованием в качестве селективного фактора ордао-фталата, нафталина или бифенила, получены шесть аэробных бактериальных ассоциаций. Установлено, что все ассоциации, достигнув стабильного состава, активно растут на селективном субстрате. Однако ассоциации, выделенные с применением в качестве селективного фактора орто-фталата, не обладают способностью использовать бифенил в качестве источника углерода. Ассоциации R24, R63, R26 и R62 эффективно растут в минеральной среде с бифенилом, а также осуществляют разложение коммерческих смесей ПХБ по классическому пути окисления бифенила. Уровень деструкции Трихлорбифенила данными ассоциациями составил 99.7 - 99.8%, а Совола -99.6 - 99.8% за 8 сут. При этом не выявлено существенной разницы в показателях биодеструкции между ассоциациями R24 и R63, селектированными на бифениле, и ассоциациями R26 и R62, изолированными на нафталине.
Полихлорированные бифенилы, бактериальные ассоциации, селекция, деструкция
Короткий адрес: https://sciup.org/147229665
IDR: 147229665 | УДК: 579.222 | DOI: 10.17072/1994-9952-2020-4-294-302
Текст научной статьи Влияние субстрата селекции на полихлорбифенил-деградативную активность аэробных почвенных бактериальных ассоциаций
Полихлорированные бифенилы (ПХБ) входят в первоначальный список стойких органических загрязнителей (СОЗ) и подлежат полному выводу из производства и применения, а также должны быть уничтожены [Final act …, 2001]. Помимо существенных объемов, находящихся на захоронении, значительные количества ПХБ оказались в почвах, донных отложениях и других объектах окружающей среды [Devi, 2020].
По химической структуре ПХБ представляют собой два ароматических кольца, соединенных С-С-связью с заместителями – атомами хлора. Количество заместителей в молекуле может быть от 1 до 10. В промышленности выпускались смеси ПХБ, включающие в себя 40–70 конгенеров ПХБ с разным количеством хлора в молекулах. Наиболее распространенные торговые марки ПХБ – Арок-лор, Делор, Клофен, Совол, Трихлорбифенил (ТХБ) [Murinova, Dercova, 2014; Reddy, Moniruz-zaman, Aminabhavi, 2019; Devi, 2020].
Вследствие эволюционной пластичности, ряд почвенных бактерий не только адаптировались к присутствию ПХБ, но и оказались способны осуществлять биотрансформацию данных поллютантов [Su et al., 2015; Hoostal, Bouzat, 2016]. Разложение ПХБ осуществляется как анаэробными, так и аэробными бактериями [Parales, Resnik, 2006; Kolar et al., 2007; Ilori, Robinson, Adebusoye, 2008; Liz et al., 2009; Chang et al., 2013; Jia et al., 2019; Pathirajia et al., 2019]. Анаэробному восстановлению подвергаются высокохлорированные конгенеры ПХБ, в результате чего образуются средне- и низкохлорированные конгенеры [Matturro et al., 2016; Pathirajia et al., 2019]. Аэробные бактерии осуществляют окислительное расщепление молекулы ПХБ, что приводит к образованию хлорбензойных кислот с последующей их утилизацией [Parales, Resnik, 2006; Kolar et al., 2007; Ilori, Robinson, Adebusoye, 2008; Liz et al., 2009; Chang et al., 2013; Jia et al., 2019]. Биодеструкцию ПХБ осуществляют как индивидуальные штаммы бактерий, так и ассоциации [Kolar et al., 2007; Liz et al., 2009; Chang et al., 2013; Cervantes-González et al., 2019].
В большинстве случаев, химическое загрязнение почв носит смешанный характер. Наряду с ПХБ, в почве присутствуют и другие органиче-ские/хлорорганические загрязнители [Revich, Shelepchikov, 2008]. Типичным примером являются почвы г. Чапаевска Самарской обл., Россия. В них обнаруживаются в высоких концентрациях такие загрязнители группы СОЗ, как ПХБ, линдан, ДДТ [Revich et al., 2001; Назаров и др., 2016]. Вследствие чего в почвах таких районов формируются микробоценозы, обладающие широким диапазоном биодеградативной активности [Shah et al., 2013; Wu et al., 2013; Su et al., 2015; Hoostal, Bouzat, 2016].
Цель настоящего исследования – выделение из почв, загрязненных несколькими соединениями группы СОЗ, микробные ассоциации, обладающие полихлорбифенил-деградативным потенциалом, при использовании в качестве селективного субстрата различные ароматические соединения.
Материалы и методы исследования
Почвенные образцы
Образцы почв RS1 и RS2 были отобраны на территории ОАО «Средне-Волжский завод химикатов» (г. Чапаевск Самарской обл.) в летний период 2018 г. Отбор почв производили согласно ГОСТ 17.4.4.02-84. Далее транспортировались с соблюдением температурного режима в г. Пермь для дальнейшего исследования в стационарных условиях. Ранее было установлено, что почвы данного района загрязнены такими соединениями группы СОЗ как линдан, гексахлорбензол, ДДТ и ПХБ [Назаров и др., 2016].
Среда культивирования, реактивы
Минеральная среда К1, состава (г/л): K 2 HPO 4 *3H 2 O – 3.2, NaH 2 PO 4 *2H 2 O – 0.4, (NH 4 ) 2 SO 4 – 0.5, MgSO 4 *7H 2 O – 0.15, Ca(NO 3 ) 2 – 0.01. Для получения плотных питательных сред вносили агар-агар до конечной концентрации 1.5%.
В работе использовали аналитически чистые химические реактивы, бифенил (>98%), нафталин (>98%), орто -фталат (>98%) фирмы Sigma-Aldrich (Steinheim, Germany), ТХБ (ОСТ 6-01-2485), Совол (ОСТ 6-01-24-75) – коммерческие смеси полихлорированных бифенилов, Россия.
Накопительное культивирование
-
10 г почвенного образца помещали в колбу Эр-ленмейера объемом 250 мл, содержащую 100 мл среды К1 и 1 г/л соответствующего селективного субстрата ( орто -фталат, нафталин, бифенил). Колбы выдерживали в термостате (ТС-1/80 СПУ, Россия) при +28˚С 30 дней.
Стабильные бактериальные ассоциации
-
10 мл бактериальной культуры, полученной при накопительном культивировании с селективным субстратом, помещали в колбу Эрленмейера объемом 250 мл, содержащую 90 мл среды К1 и 100 мг соответствующего субстрата ( орто -фталат, нафталин, бифенил). Культивирование проводили на термостатируемой круговой качалке (Environmental Shaker-Incubator ES 20/60, “BioSan”, Латвия) при 120 об/мин и +28˚С в течение 14 дней. Последующие пересевы (на среду К1 и соответствующий субстрат в концентрации 1 г/л) производили через каждые 7 дней. Бактериальное сообщество считали стабильным, если при 10 последовательных пересевах морфологические и физиологические характеристики сообщества не изменялись.
Периодическое культивирование, анализ ростовых параметров
-
10 мл стабильной бактериальной культуры помещали в колбу Эрленмейера объемом 250 мл, содержащую 90 мл среды К1 и 100 мг соответствующего субстрата выделения ( орто -фталат, нафталин, бифенил) или субстрата деструкции (бифенил). Культивирование проводили на термостатируемой круговой качалке (Environmental ShakerIncubator ES 20/60, “BioSan”, Латвия) при 120 об/мин и +28˚С в течение 4–14 дней. Каждые 24 ч. производили измерение оптической плотности культуры на спектрофотометре BioSpec-mini, «Shimadzu», Япония, при длине волны 600 нм.
Удельную скорость роста рассчитывали по классической методике согласно формуле
μ = (LnC x ‒LnC 0 )/ (t x ‒t 0 ), где C x – концентрация культуры в высшей точке роста, C 0 – концентрация культуры в начальный момент роста, t 0 и t x – время в начале и конце логарифмической фазы роста культуры.
Деструкция смесей ПХБ
При исследовании деструкции смесей полихлорбифенилов (ТХБ, Совол) 1 мл отмытых дважды в среде К1 клеток (ОД 600 = 1.5–2.0), выращенных на бифениле (1 г/л) до середины логарифмической фазы, переносили во флаконы объемом 5 мл с тефлоновыми крышками, добавляя субстраты до конечной концентрации ТХБ – 13.8 мг/л, Совол – 55 мг/л и инкубировали на шейкере (Environmental Shaker-Incubator ES 20/60, “BioSan”, Латвия) 200 об/мин при 28˚С. Для анализа пробы отбирали в начальный момент времени, а также на 4- и 8-е сут.
Аналитические процедуры
Количественный анализ ПХБ проводили в условиях ГХ-ПИД: газовый хроматограф “Shimadzu GC 2010” с пламенно-ионизационным детектором и кварцевой капиллярной колонкой ZB-5 (длина 30 м, диаметр 0.25 мм), толщина пленки неподвижной фазы составляла 0.25 мкм (Shimadzu, Япония). Начальная температура колонки ‒ 40°С (3 мин.) с последующим её повышением 10°/мин до конечной температуры 280°С (изотерма 15 мин.). Температура испарителя ‒ +250°С, детектора – +300°С.
Расчет содержания ПХБ в каждом исследуемом образце проводили методом внутренней нормализации, рассчитывая вклад отдельных соединений в суммарную площадь пиков. На основании полученных расчетных площадей пиков оценивали содержание исходных ПХБ после процесса биодеструкции.
Продукты деградации хлорбифенилов определяли спектрофотометрически и методом ВЭЖХ. Для анализа культуральную жидкость очищали от бактериальных клеток центрифугированием (9660 g в течение 3 мин. на центрифуге miniSpin («Eppendorf», Германия)). Образование продуктов мета- расщепления ароматического кольца хлорбифенилов – 2-гидроксо-6-оксо-(хлорфенил)гекса-2,4-диеновые кислоты (ГОФДК) анализировали в надосадочной жидкости на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при Х макс от 390 нм до 440 нм.
Наличие ионов хлора в супернатанте определяли на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при Х макс от 460 нм до 540 нм через 5 мин. после внесения в супернатант
5%-ного азотнокислого серебра. Количественную оценку проводили согласно калибровочной кривой. Наличие в супернатанте хлорбензойных (ХБК) кислот определяли на хроматографе LC-20A («Shimadzu», Япония) с колонкой Discovery C18 (150 х 4.6 мм или 250 х 4.6 мм) («Supelco», «Sig-ma-Aldrich», США) и УФ-детектором при 205 нм. Анализ проводили в системе ацетонитрил-0.1%-ный Н 3 РО 4 (70:30). Идентификация осуществлялась с помощью сравнения времени удержания на колонке исследуемых и стандартных соединений. Количество образовавшихся продуктов оценивали по величине площади и высоты пиков на хроматограмме относительно данных величин стандартных соединений.
Скорость деструкции ПХБ
Скорость деструкции субстрата рассчитывали по формуле
V=(С0 – Ci)/((ti – t0)·Ccell), где C0 – концентрация смеси ПХБ в начальный момент времени, мг/л, Сi – концентрация смеси ПХБ в конечный момент времени, мг/л, ti – конечный момент времени, сут., t0 – начальный момент времени, сут.,·Ccell – концентрация клеток бактериальной ассоциации, г.
Концентрацию клеток рассчитывали исходя из того, что 0.432 мг сухих клеток соответствует 1 мл бактериальной суспензии с ОП 600 = 1.0 о.е.
Статистический анализ
Все эксперименты проводили в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных пакетов компьютерных программ Microsoft Excel и Statistica 6.0.
Результаты и их обсуждение
В результате селекции на ароматическом субстрате ( орто -фталат, нафталин, бифенил) были получены 6 бактериальных ассоциаций (табл. 1).
Таблица 1 Бактериальные ассоциации, селектированные из загрязненных почв
|
Почвенный образец |
Субстрат селекции |
||
|
орто -фталат |
бифенил |
нафталин |
|
|
RS1 |
R21 |
R24 |
R26 |
|
RS2 |
R65 |
R63 |
R62 |
При периодическом культивировании на субстрате выделения данные ассоциации характеризовались стабильной удельной скоростью роста и достигали за 4 сут. сходных значений плотности культуры при многократных пересевах (табл. 2).
Наибольшей удельной скоростью роста характеризовались ассоциации R24 и R63, изолированные с применением бифенила в качестве селективного фактора. Вероятно, ферментативные системы бактерий, входящих в микробоценоз почв территории ОАО «СВЗХ» г. Чапаевска, более адаптированы к окислению соединений группы ПХБ, чем соединений груп- пы полиароматических углеводородов (ПАУ). Подобное явление может быть обусловлено длительным загрязнением данных почв полихлорированными бифенилами.
Таблица 2
Ростовые показатели бактериальных ассоциаций
|
Бактериальная ассоциация |
Субстрат селекции |
Субстрат деструкции |
||
|
ОП 600 , о.е. |
μ, сут-1 |
ОП 600 , о.е. |
μ, сут-1 |
|
|
R21 |
0.407±0.002 |
0.136 |
0.001±0.0002 |
‒ |
|
R65 |
0.428±0.001 |
0.142 |
0.001±0.0004 |
‒ |
|
R24 |
0.854±0.002 |
0.284 |
1.018±0.002 |
0.339 |
|
R63 |
0.704±0.003 |
0.234 |
0.727±0.001 |
0.242 |
|
R26 |
0.562±0.002 |
0.187 |
0.546±0.002 |
0.182 |
|
R62 |
0.664±0.002 |
0.221 |
0.488±0.005 |
0.162 |
Анализ биодеградативного потенциала выделенных бактериальных ассоциаций в отношении бифенила показал, что при периодическом культивировании ассоциации R21 и R65, селектированные на орто-фталате, не способны использовать бифенил в качестве источника углерода и энергии (табл. 2). Ассоциации R26 и R62, изолированные на нафталине, демонстрируют близкие ростовые параметры как в случае применения в качестве ростового субстрата нафталина, так и бифенила. Ассоциации R24 и R63 обладают наибольшей скоростью роста и достигают более высокой плотности культуры (табл. 2). Следует отметить, что все изолированные в настоящем исследовании бактериальные ассоциации, проявившие способность расти на бифениле как источнике углерода, обладают более высокой удельной скоростью роста по сравнению с ассоциацией, выделенной из почв штата Веркруз (Мексика), загрязненных трансформаторным маслом, но уступают по данному параметру штаммам, изолированным из донных отложений, загрязненных коммерческими смесями ПХБ (Словакия) [Liz et al., 2009; Horváthová, Lászlová, Derkova, 2018]. Ассоциации R24 и R63 при культивировании на бифениле обладают плотностью культуры, сопоставимой с аналогичным показателем штамма Pseudomonas aeruginosa TMU56 [Hatamian-Zarmi et al., 2009]. Ассоциации R26 и R62 характеризуются более низкой плотностью культуры как при культивировании на нафталине, так и при культивировании на бифениле, чем штамм P. aeruginosa TMU56. Стоит отметить, что штамм P. aeruginosa TMU56 более активно растет при использовании бифенила в качестве ростового субстрата, а не нафталина. У изолированных в настоящем исследовании бактериальных ассоциаций подобной закономерности не выявлено.
Установлено, что ассоциации R26, R62, R24 и R63 осуществляют разложение коммерческих смесей ПХБ – ТХБ и Совол (рис. 1, 2, табл. 3). За 8 сут. инкубации деструкция ТХБ бактериальными ассоциациями составила 99.7–99.8%. Аналогичный показатель в случае трансформации Совола составил 99.6–99.8%. В ряде работ описаны бактериальные сообщества и индивидуальные штаммы, способные разлагать коммерческие смеси ПХБ. Так штаммы рода Rhodococ-cus , выделенные из смешанных культур ПХБ-загрязнённых донных отложений (Хорватия), осуществляют деструкцию Ароклора 1248 (близок по составу конгенеров к Соволу) на 5–61% [Kolar et al., 2007], а штаммы, изолированные в Норвегии, разлагают Ароклор 1242 (аналог ТХБ) на 50% [Papale et al., 2017]. Большая деградативная активность в отношении Ароклора 1242 описана для штамма P. aeruginosa TMU56 – 73.3% [Hatamian-Zarmi et al., 2009]. Бактериальные сообщества, состоящие из штаммов-деструкторов бифенила (Словакия), осуществляют разложение Делора 103 (аналог ТХБ) на 73–85%, тогда как деградативная активность в отношении Ароклора 1242 бактериальной ассоциации 1-2Mix (Южная Корея) составляет 63.0–71.1% [Kwon et al., 2008; Horváthová, Lászlová, Derkova, 2018]. Стоит отметить, что активность сообщества, описанного G. Pathiraja с коллегами [2019] в отношении Ароклора 1260, содержащего большее число высокохлориро-ванных конгенеров, чем смеси ТХБ и Совол, составляет 49.2%. Таким образом, изолированные в настоящем исследовании бактериальные ассоциации эффективно разлагают коммерческие смеси ПХБ.
Таблица 3
Образование хлорбензойных кислот при разложении смесей ПХБ бактериальными ассоциациями, мг
|
Бактериальная ассоциация |
ТХБ |
Совол |
||
|
4 сут. |
8 сут. |
4 сут. |
8 сут. |
|
|
R24 |
0.064±0.001 |
0.109±0.001 |
0.018±0.002 |
0.028±0.004 |
|
R63 |
0.078±0.001 |
0.106±0.002 |
0.028±0.002 |
0.027±0.003 |
|
R26 |
0.039±0.002 |
0.146±0.001 |
0.046±0.002 |
0.058±0.002 |
|
R62 |
0.085±0.001 |
0.321±0.001 |
0.011±0.003 |
0.016±0.002 |
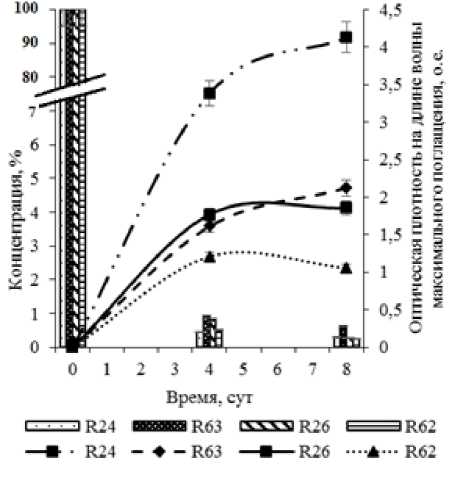
Рис. 1 . Деструкция ТХБ и выделение метаболита (ГОФДК) бактериальными ассоциациями
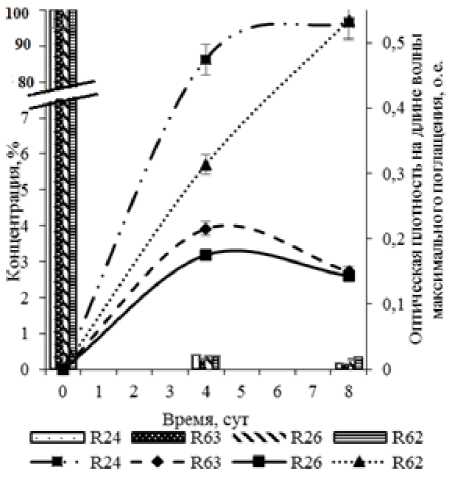
Рис. 2. Деструкция Совола и выделение метаболита (ГОФДК) бактериальными ассоциациями
Анализ образующихся метаболитов показал, что биодеструкция конгенеров ПХБ происходит по классическому окислительному пути. При этом в среде фиксируется образование таких промежуточных продуктов, как гидрокси-оксо-фенилгек-садиеновые кислоты (ГОФДК) и хлорбензойные кислоты (рис. 1, 2, табл. 3). Динамика накопления ГОФДК в среде при деструкции ТХБ имеет схожий характер у всех исследуемых ассоциаций (рис. 1). Напротив, при разложении Совола, динамика накопления ГОФДК ассоциацией R62 приближает- ся к линейной, чем существенно отличается от аналогичного показателя остальных ассоциаций (рис. 2). Совол является более токсичным для бактериальных клеток, чем ТХБ, так как содержит большее количество пента- и гексахлорированных конгенеров. Вероятно, в данном случае проявляется токсическое действие образующихся полихлорированных ГОФДК на клетки штаммов ассоциации R62 и замедляет процесс дальнейшего окисления ГОФДК до хлорбензойных кислот. Данная гипотеза подтверждается и более низкой концентраций ХБК в среде у ассоциации R62 при разложении Совола, чем при разложении ТХБ, а также по сравнению с концентрацией ХБК в культуральной среде остальных исследуемых бактериальных ассоциаций (табл. 3).
Стоит отметить, что при анализе концентраций, отражающих содержание в среде как исходного субстрата, так и образующихся метаболитов, не выявлено различий в деградативной активности между ассоциациями, изолированными на нафталине, и ассоциациями, изолированными на бифениле.
Для дальнейшего анализа был произведен расчет скорости деструкции смесей ПХБ бактериальными ассоциациями, с учетом веса биомассы (табл. 4).
Таблица 4
Скорость деструкции смесей ПХБ бактериальными ассоциациями, мг ПХБ сут-1 г сух биомассы-1
|
Бактериальная ассоциация |
ТХБ |
Совол |
|
R24 |
42.82 |
15.21 |
|
R63 |
59.89 |
13.32 |
|
R26 |
35.40 |
15.61 |
|
R62 |
35.55 |
15.23 |
Установлено, что скорость деструкции ТХБ ассоциациями, селектированными на бифениле, превышает аналогичный показатель ассоциаций, изолированных на нафталине в 1.2–1.7 раза. Напротив, скорость деструкции Совола у всех ассоциаций была сопоставима друг с другом. Вероятно, в данном случае, существенную роль оказывает состав смеси ПХБ, а не первоначальный субстрат селекции, оказывавший давление на формирование бактериальной ассоциации.
Заключение
В результате проведенных исследований получены шесть бактериальных ассоциаций с разным биодеградативным потенциалом. Установлено, что в случае, если селективным субстратом выделения ассоциации является моноароматическое соедине- ние, то сформировавшиеся бактериальные сообщества не проявляют активности к ПХБ. Напротив, при использовании в качестве селективного субстрата бифенила и нафталина, сформировались сообщества аэробных бактерий с близкими биоде-градативными характеристиками в отношении коммерческих смесей ПХБ. Описанные ассоциации могут служить основой для биоремедиацион-ных технологий, направленных на очистку окружающей среды от полихлорированных бифенилов.
Работа выполнена в рамках НИОКР АААА-А19-119112290009-1 «Молекулярные механизмы адаптации микроорганизмов к факторам среды». Анализ методом газовой хроматографии выполнен с использованием оборудования Центра коллективного пользования «Спектроскопия и анализ органических соединений» (ЦКП «САОС»).
Список литературы Влияние субстрата селекции на полихлорбифенил-деградативную активность аэробных почвенных бактериальных ассоциаций
- ГОСТ 17.4.3.01-82. Охрана природы. Почвы. Общие требования к отбору проб. М.: Госстандарт, 1983. 8 с.
- Назаров А.В. и др. Эколого-микробиологическая оценка грунтов, загрязненных полихлориро-ванными бифенилами // Экология человека. 2016. № 3. С. 3-8.
- Cervantes-González E. et al. Microbial diversity assessment of polychlorinated biphenyl-contaminated soils and the biostimulation and bioaugmentation processes // Environmental Monitoring and Assessment 2019. Vol. 191. P. 118. https://doi.org/10.1007/s10661-019-7227-4.
- Chang Y.-C. et. al. Isolation of biphenyl and poly-chlorinated biphenyl-degrading bacteria and their degradation pathway // Applied Biochemistry and Biotechnology. 2013. Vol. 170. P. 381-398 https://doi.org/10.1007/s12010-013-0191-5.
- Devi N.L. Persistent Organic Pollutants (POPs): Environmental Risks, Toxicological Effects, and Bioremediation for Environmental Safety and Challenges for Future Research // Bioremediation of Industrial Waste for Environmental Safety / eds. G. Saxena, R. Bharagava. Singapore: Springer, 2020. P. 53-76. https://doi.org/10.1007/978-981-13-1891-7_4.
- Final act of the Conference of Plenipotentiaries on the Stockholm convention on persistent organic pollutants, Stockholm, 22-23 May // UNEP/POPS/ CONF/4. United Nations Environment Programme. Geneva. 2001. 44 р.
- Hatamian-Zarmi A. et al. Extensive biodegradation of highly chlorinated biphenyl and Aroclor 1242 by Pseudomonas aeruginosa TMU56 isolated from contaminated soils // International Biodeteriora-tion and Biodegradation. 2009. Vol. 63. P. 788794. https://doi.org/10.1016/jibiod.2009.06.009.
- Hoostal M.J., Bouzat J.L. Spatial patterns of bphA gene diversity reveal local adaptation of microbial communities to PCB and PAH contaminants // Microbiol. Ecology. 2016. Vol. 72. P. 559-570. https://doi.org/10.1007/s00248-016-0812-y.
- Horvathova H., Laszlova K., Derkova K. Bioremediation of PCB-contaminated shallow river sed-iments:the efficacy of biodegradation using individual bacterial strains and their consortia // Chemosphere. 2018. Vol. 193. P. 270-277. https://doi.org/10.1016/j.chemosphere.2017.11.012.
- Ilori M.O., Robinson G.K., Adebusoye S.A. Aerobic mineralization of 4,4'-dichlorobiphqnyl and 4-chlorobenzoic acid by a novel natural bacterial strain that grows poorly on benzoate and biphenyl // World Journal of Microbiology Biotechnology. 2008. Vol. 24. P. 1259-1265. https://doi.org/10.1007\s11274-007-9597-y.
- Jia Y. et al. Identification and characterization of a meta-cleavage product hydrolase involved in biphenyl degradation from Arthrobacter sp. YC-RL1 // Applied Microbiol. Biotechnology. 2019. Vol. 103, № 16. P. 6825-6836. https://doi.org/10.1007/s00253-019-09956-z
- Kolar A.B. et al. PCB-degrading potential of aerobic bacteria enriched from marine sediments // International Biodeterioration and Biodegradation. 2007. Vol. 60. P. 16-24. https://doi.org/10.16/j.ibiod.2006.11.004.
- Kwon S.-H. et al. Bioremediation of Aroclor 1242 by a consortium culture in marine sediment microcosm // Biotechnology and Bioprocess Engineering. 2008. Vol. 13. P. 730-737. https://doi.org/10.1007/s12257-008-0111-7.
- Liz J.A.Z.E. et al. Degradation of polychlorinated biphenyl (PCB) by a consortium obtained from a contaminated soil composed of Brevibacte-rium, Pandoraea and Ochrobactrum // World Journal of Microbiology and Biotechnology. 2009. Vol. 25. P. 165-170. https://doi.org/10.1007/s11274-008-9875-3.
- Matturro B. et al. Polychlorinated biphenyl (PCB) anaerobic degradation in marine sediments: microcosm study and role of autochthonous microbi-al communities // Environmental Science Pollution Research. 2016. Vol. 23. P. 12613-12623. https://doi.org/10.1007/s11356-015-4960-2.
- Murinova S., Dercova K. Potential Use of newly isolated bacterial strain Ochrobactrum anthropi in bioremediation of polychlorinated biphenyls // Water Air Soil Pollution. 2014. Vol. 225. P. 1980. https://doi.org/10.1007/s11270-014-1980-3
- Papale M. et al. Enrichment, isolation and biodegradation potential of psychrotolerant polychlorinated-biphenyl degrading bacterial from the Kongsfjorden (Svalbard Islands, High Arctic Norway) // Marine Pollution Bulletin. 2017. Vol. 114. P. 849-859.
- Parales R.E., Resnick S.M. Aromatic Ring Hydroxylat-ing Dioxygenases // Pseudomonas / eds. J.L. Ramos, R.C. Levesque. Boston: Springer, 2006. P. 287-340. https://doi.org/10.1007/0-387-28881-3_9.
- Pathiraja G. et al. Effective degradation of poly-chlorinated biphenyls by a facultative anaerobic bacterial consortium using alternating anaerobic aerobic treatments // Science of Total Environment. 2019. Vol. 659. P. 507-514. https://doi.org/10.1016/scitotenv.2018.12.385.
- Reddy A.V.B., Moniruzzaman M., Aminabhavi T.M. Pol-ychlorinated biphenyls (PCBs) in the environment: recent updates on sampling, pretreatment, cleanup technologies and their analysis // Chemical Engineering Journal. 2019. Vol. 358. P. 11860-01207. https://doi.org/10.1016/j.cej.2018.09.205.
- Revich B., Shelepchikov A. Persistent organic pollutants (POPs) hot spots in Russia // The Fate of Persistent Organic Pollutants in the Environment / eds. E. Mehmetli, B. Koumanova. Springer, 2008. P. 113126.
- Revich B. et al. Dioxin exposure and public health in Chapaevsk, Russia // Chemosphere. 2001. Vol. 43. P. 951-966.
- Shah V. et al. Taxonomic profiling and metagenome analysis of a microbial community from a habitat contaminated with industrial discharges // Microbiol. Ecology. 2013. Vol. 66. P. 533-550. https://doi.org/10.1007/s00248-013-0253-9.
- Su X. et al. Enhanced degradation of biphenyl from PCB-contaminated sediments: the impact of extracellular organic matter from Micrococ-cus luteus // Applied Microbiology and Biotechnology. 2015. Vol. 99. P. 1989-2000. https://doi.org/10.1007/s00253-014-6108-6.
- Wu M. et al. Degradation of polycyclic aromatic hydrocarbons by microbial consortia enriched from three soils using two different culture media // Environmental Pollution. 2013. Vol. 178. P.152-158. https://doi.org/10.1016/j.envpol.2013.03.004.


