Влияние сверхэкспрессии гена mitf на продолжительность жизни Drosophila melanogaster
Автор: Е.Н. Прошкина, М.В. Шапошников, Е.В. Щеголева, Д.О. Чернышова, А.А. Москалев
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Статья в выпуске: 3 (43), 2020 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/149129514
IDR: 149129514
Текст статьи Влияние сверхэкспрессии гена mitf на продолжительность жизни Drosophila melanogaster
Аутофагия является одним из основных процессов внутриклеточной деградации и необходима для оборота макромолекул и органелл в клетке. Кроме того, она связывает метаболические и про-теостатические сигналы, определяя ключевые физиологические стратегии клетки и детерминируя старение и продолжительность жизни (ПЖ) организма [1, 2]. Аутофагия усилена у многих долгоживущих модельных организмов и биологических видов (например, у голого землекопа) и в целом способствует долголетию [1,3].
Транскрипционный фактор ЕВ (TFEB) является центральным регулятором биогенеза и функционирования лизосом, лизосомального протеоста-за и экзоцитоза. TFEB координирует аутофагический поток и активирует экспрессию генов, обеспечивающих все этапы процесса аутофагии, от образования везикул и аутофагосом до разрушения перевариваемого материала. Он также отвечает за регуляцию (р-окисления липидов, биогенеза и функционирования митохондрий, участвует в иммунном ответе [1,4, 5, 6]. Предполагается, что TFEB является одним из эволюционно консервативных белков долголетия. Он опосредует связанные со старением сигнальные пути и необходим для увеличения ПЖ при геропротекторных интервенциях [1,2].
Лизосомы являются основным местом деградации и утилизации поврежденных органоидов, липидов, модифицированных белков и белковых агрегатов. Старение клетки сопряжено с накоплением внутри лизосом неразлагаемого материала, называемого липофусцин [7]. Среди транскрипционных мишеней TFEB выявлены лизосомальные кислые гидролазы, участвующие в деградации субстрата [8]. Возможно, TFEB играет ключевую роль в регуляции кислотности лизосом и, следовательно, в расщеплении липофусцина.
У Drosophila melanogaster идентифицирован ортолог TFEB - MITF. Он регулирует экспрессию генов, кодирующих субъединицы V-АТФазы, и многих генов, участвующих в лизосомально-аутофа-гийном механизме. Кроме того, он опосредует сигнальный путь mTOR [9, 10]. Мы предположили, что повышенная активность гена Mitf приведет к снижению уровня неразлагаемого материала в лизосомах, замедлению скорости клеточного старения, вызовет увеличение ПЖ и замедлит возрастзави-симые изменения физиологических показателей. Цель данной работы - изучить влияние сверхэкспрессии Mitf на ПЖ, плодовитость и двигательную активность Drosophila melanogaster.
Материал и методы
Линии дрозофил и условия содержания
UAS-Mitf (генотип: w1118, P(UAS-Mitf)) - трансгенная линия, в которой экспрессия дополнительной копии гена Mitf находится под контролем промотора UAS. Предоставлена Ф. Пигнони (Университет Ап-стейт, США).
Act5C-GS-GAL4 (генотип: P{Act5C(-FRT) GAL 4. Switch.PR3}/TM6B, ТЫ) - линия, у которой экс прессируется драйвер GAL4 во всех клетках организма в присутствии мифепристона (RU486). Получена из коллекции дрозофилиного центра в Блумингтоне (Университет штата Индиана, Блумингтон, США).
Elav-GS-GAL4 (генотип: P{elav-GeneSwitch}) - линия с мифепристон-индуцибельным драйвером GAL4 в нервной системе (НС) дрозофилы. Предоставлена X. Кешишаном (Йельский университет, Нью-Хейвен, США).
Дрозофил содержали в 20 мл пробирках с 5 мл питательной среды, содержащей манную крупу, дрожжи, сахар и агар-агар [11], при 25 °C, 60 % влажности воздуха, 12-часовом режиме освещения. Для поддержания стабильных условий использовали климатическую камеру Binder KBF720-ICH (Binder, Германия).
Активация сверхэкспрессии
Активацию экспресии гена Mitf проводили с помощью GAL4-UAS системы [12]. Для получения экспериментальных особей производили скрещивание самцов с трансгеном UAS-Mitf с девственными самками драйверных линий Act5C-GS-GAL4 и elav-GS-GAL4. Родительских особей рассаживали по 10 пар на пробирку (не менее 10 пробирок на каждый вариант скрещивания) и оставляли на 24 ч для откладки яиц. Так как потомство от скрещивания линий UAS-Mitf и Act5C-GS-GAL4 оказалось нежизнеспособным, дальнейшую работу проводили только с потомками скрещивания UAS-Mitf и elav-GS-GAL4 (анализировали эффекты нейрон-спе-цифической сверхэкспрессии гена Mitf). Для активации сверхэкспрессии экспериментальных особей помещали на питательную среду, смазанную дрожжевой пастой с 25 мкг/мл RU486 (Mifepritone, Sigma) [13]. Для этого в пасту добавляли стоковый раствор мифепристона с концентрацией 2,5 мг/мл в 100 %- ном этаноле в соотношении 1:100. На среду для контрольных мух наносили дрожжевую пасту с эквивалентным количеством этилового спирта.
Анализ продолжительности жизни
Для анализа ПЖ дрозофил отбирали 150-200 особей на вариант эксперимента (по 30 мух в пробирке). Самцы и самки жили раздельно. Начиная с первого дня жизни имаго, ежедневно вели подсчет числа умерших особей, два раза в неделю мух переносили на свежую среду. По полученным данным строили кривые дожития по методу Каплана-Мейера [14] и рассчитывали показатели ПЖ. Статистическую значимость различий между выборками оценивали с помощью непараметрических критериев Колмогорова-Смирнова [15], Мантеля-Кокса [16], Геха-на-Бреслоу-Вилкоксона [17]. Достоверность различий по максимальной ПЖ оценивали методом Ванг-Аллисона [18]. Анализ статистических данных выполняли с помощью программы Statistica, версия 6.1 (StatSoft, США) и статистической среды R, версия 2.15.1 (The R Foundation).
Оценка показателей репродукции
Для каждого варианта эксперимента использовали по 50 самок со сверхэкспрессией гена Mitf и без активации сверхэкспрессии. До начала анализа их содержали в течение 24 ч с молодыми самцами линии дикого типа Canton-S для оплодотворения.
Далее самок рассаживали в отдельные пробирки с питательной средой, подкрашенной с помощью активированного угля, на 24 ч для откладки яиц. Подсчитывали количество яиц, отложенных самками за суп<и (фекундностъ), и количество имаго, развившихся из яиц на 10-15 сут после кладки (фертильность). Фекундность и фертильность учитывали раз в неделю до возраста 59 сут. Статистическую значимость различий оценивали с помощью 1-критерия Стьюдента и критериях2. Статистическую обработку данных проводили с помощью программы Excel (Microsoft, США).
Анализ двигательной активности
Анализ двигательной активности у самцов и самок со сверхэкспрессией Miff и без сверхэкспрессии проводили раз в неделю до возраста 42 сут. Для каждого варианта эксперимента отбирали по три пробирки с 30 мухами. Изучаемые показатели оценивали с помощью аппаратно-программного комплекса Locomotor Activity Monitor (TriKinetics Inc., США). Данные с монитора активности собирали в течение 24 ч и представляли как среднесуточную активность .в пересчете на одну особь. Для оценки статистической значимости различий локомоторной активности использовали t-критерий Стьюдента и критерий X2 Статистическую обработку данных проводили с помощью программы Excel (Microsoft, США). ’
Результаты и обсуждение
Влияние сверхэкспрессии гена Mitf на продолжительность жизни Drosophila meiano-gaster
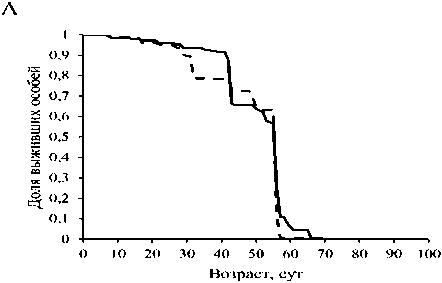
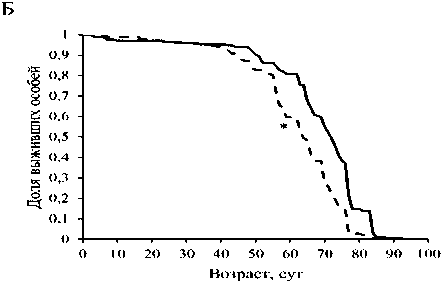
Кондиционная сверхэкспрессия гена Mitf в НС привела к уменьшению средней и медианной ПЖ самок на 10 и 11 %, соответственно (р < 0 001). Кроме того, она вызывала снижение показателя максимальной ПЖ (возраста 90 % смертности) как у самцов, так и у самок на 3 и 8 %, соответственно (р < 0.001) (рис. 1, табл.). Таким образом, активация гомолога гена транскрипционного фактора ЕВ в НС дрозофил не только не оказала геропротекторного действия, а напротив, вызвала негативный эффект.
Показатели продолжительности жизни у особей Drosophila melanogaster со сверхэкспрессией гена MITF и без сверхэкспрессии
Indicators of life expectancy in Drosophila melanogaster individuals with MITF gene overexpression and without overexpression
|
Генотип |
Пол |
X ± дт, сут |
М, сут. |
90%, сут |
п |
|
UAS-Mitf>elav-GS-GAL4 (контроль) |
Д |
50.4±0.9 |
56 |
59 |
154 |
|
UAS-Mitf>elav-GS-GAL4 + RU486 (сверхэкспрессия) |
Д |
48.7±0.9 |
56 |
57* |
175 |
|
UAS-Mitf>elav-GS-GAL4 (контроль) |
68.3±1.2 |
72 |
84 |
174 |
|
|
UAS-Mitf>elav-GS-GAL4 + RU486 (сверхэкспрессия) |
62±1 * |
64* |
77* |
188 |
Примечание. §- самцы, S - самки, X ± Am - средняя ПЖ и ошибка средней, М - медианная ПЖ, 90% - возраст 90 % смертности, п - количество особей в выборке, * - различия между особями со сверхэкспрессией Mitf и без активации сверхэкспрессии достоверны при р < 0.001, критерий Мантеля-Кокса (третий столбец), критерий Гехана-Бреслоу-Вилкоксона (четвертый столбец) и тест Ванг-Аллисона (пятый столбец).
Note. 6- males, ф - females, Х± Дт - average life span and error of the average, M - median life span, 90% - age of 90 % mortality, n - number of individuals in the sample, * - differences between individuals with Mitf overexpression and without activation of overexpression are significant at p < 0.001, the Mantel-Cox test (third column), the Gehan-Breslow-Wilcoxon test (fourth column) and the Wang-Allison test (fifth column).
----UAS—Milf>elav—GS—GAL4 (контроль)
---UAS—Mitf>elav—GS—GAL4 + RU486 (сверхэкспрессия)
Рис. 1. Кривые выживаемости самцов (А) и самок (Б) Drosophila, melanogaster со сверхэкспрессией гена Mitf в нервной системе и без сверхэкспрессии; * - р<0.001, критерий Колмогорова-Смирнова.
Тем не менее, ген Tfeb млекопитающих и его ортолог hlh-ЗО у Caenorhabditis elegans ранее были идентифицированы как гены долголетия [1, 5]. Сверхэкспрессия hlh-ЗО достаточна для активации аутофагии и умеренного увеличения ПЖу нематод. Ген hlh-ЗО необходим для долгожительства нематод с ингибированным mTOR [19]. TFEB опосредует сигнальные пути, определяющие клеточный метаболизм и старение организма, в частности, mTOR, АМРК, PPARa/PGCa и митоген-активируемых про-теинкиназ, а также взаимодействует с транскрипционным фактором FOXO [1,2, 5].
У дрозофил снижение функции Mitf приводит к формированию аномальных лизосом, ухудшает слияние аутофагосом и расщепление липидов в условиях голодания, нарушает работу митохондрий. Напротив, повышение активности Mitf в жировом теле вызывает увеличение количества лизосом, аутофагосом и аутолизосом и уменьшение размера липидных капель [9]. У мушек с нокаутом Cdk5a мягкая сверхэкспрессия гена Mitf в нервной ткани восстанавливает аутофагию и предотвращает потерю допаминовых нейронов [20]. Ингибирование TORC1 дрозофилы индуцирует транслокацию MITF в ядро, подчеркивая консервативные регуляторные механизмы между системами дрозофилы и млекопитающих [9]. Аналогичные данные были получены и в исследованиях на нематодах [6]. С другой стороны, экспрессия экзогенного Mitf приводит к повышению активности TORC1, способствуя перемещению MITF в цитоплазму [10]. Более того, сильная тканеспецифическая активация данного гена может вызывать грубые структурные и функциональные нарушения в соответствующих тканях дрозофил [Ю].
Нарушение аутофагии зачастую связано с развитием возрастзависимых заболеваний. Особенно это касается нарушения работы слабо пролиферирующих тканей, чувствительных к накоплению поврежденных макромолекул и неразлагаемо-го материала в лизосомах [1,2]. Например, у крыс с моделью болезни Паркинсона нейродегенератив-ные процессы сопровождались снижением активности TFEB и изменением функционирования лизосом. При этом избыточная экспрессия TFEB обеспечивала нейропротекцию путем деградации олигомеров а-синуклеина, а репрессия усугубляла патологические симптомы [21]. В то же время чрезмерная активация аутофагии может иметь отрицательные последствия, провоцируя клеточную гибель. Данный механизм связан с утратой нейронов при нейродегенеративных заболеваниях, в частности, при болезни Альцгеймера [2].
Наблюдаемое нами снижение ПЖ дрозофил со сверхэкспрессий гена Mitf могло быть связано с нарушениями функционирования НС или активцией гибели нейронов. Для проверки данного предположения нами оценены возрастзависимые изменения двигательной активности как показателя физиологического состояния НС дрозофил.
Влияние сверхэкспрессии гена Mitf на возрастзависимые изменения двигательной активности дрозофил
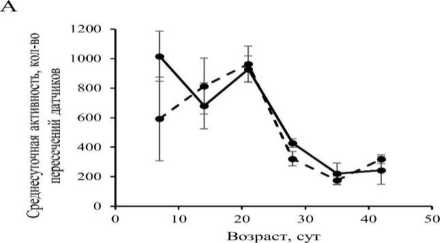
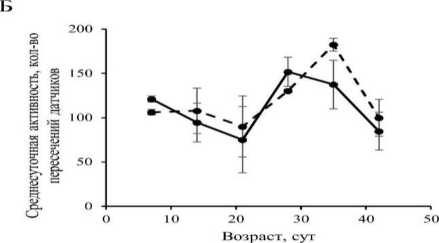
Активация экспрессии гена Mitf в НС не оказала статистически значимого влияния (р > 0.05) на двигательную активность дрозофил обоих полов (рис. 2). Таким образом, нами не обнаружено экспериментального подтверждения нашего предположения о нейродегенеративном эффекте сверхэкспрессии гена Mitf.
Так как ПЖ тесно взаимосвязана с репродуктивной функцией, нами оценено возрастзависи-мое изменение ее показателей у самок со сверхэкспрессией Mitf.
Влияние сверхэкспрессии гена Mitf на возрастзависимые изменения показателей репродукции дрозофил
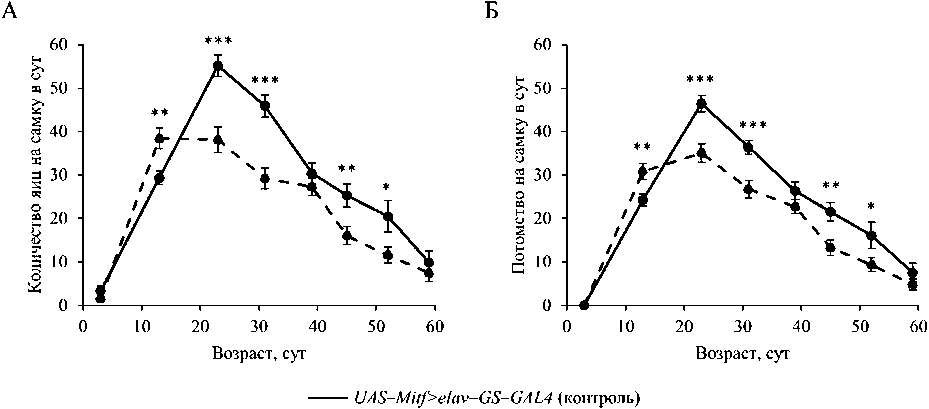
Сверхэкспрессия гена Mitf в НС самок дрозофил привела к увеличению в молодом возрасте (13 сут) фекундности и фертильности на 30 и 27 %, соответственно (р < 0.01). Однако в целом у мух с повышенной активностью Mitf наблюдалось подавление плодовитости (р < 0.001). В возрасте 23-52 сут снижение фекундности и фертильности составило 10-44 и 14-42 %, соответственно (р < 0.05) (рис. 3).
У нематод HLH-ЗО является регулятором репродуктивной диапаузы у взрослых особей [22]. Соответственно, повышенная активность гена Mitf может быть связана со снижением плодовитости и у самок дрозофил. Стоит отметить, что наблюдаемое угнетение репродуктивных способностей самок со
--UASMitf>elavGSGAL4 (контроль)
---UAS—Mitf>elav—GS—GAL4 + RU486 (свсрхэкспрсссия)
Рис. 2. Возрастная динамика двигательной активности у самцов (А) и самок (Б) Drosophila, melanogaster со сверхэкспрессией гена Mitf в нервной системе и без сверхэкспрессии.
Fig. 2. Age dynamics of motor activity in males (A) and females (B) of Drosophila melanogaster with Mitf gene overexpression in the nervous system and without overexpression.
---UAS-Mitf>elav-GS-GAL4 + RU486 (сверхэкспрессия)
Рис. 3. Возрастная динамика фекундности (А) и фертильности (Б) у дрозофил со сверхэкспрессией гена Mitf в нервной системе и без сверхэкспрессии; - р •. 0.05, ** - р '. 0.01, *** - р < 0.001, t - критерий Стьюдента.
Fig. 3. Age dynamics of fecundity (A) and fertility (Б) in fruit flies with Mitf gene overexpression in the nervous system and without overexpression; * - p < 0.05, ** - p« 0.01, *** - p *i 0.001, Student’s t- test.
сверхэкспрессией Mitf может быть также вызвано действием мифепристона, используемого для активации кондиционного драйвера [23]. Как правило, снижение репродуктивных функций связано с увеличением ПЖ. Однако сверхэкспрессия Mitf ведет к нарушению этой закономерности, что может указывать на важную роль данного гена в регуляции компромисса между ПЖ и репродукцией.
Заключение
В экспериментах in vivo нами исследована роль гена Mitf, кодирующего гомолог транскрипционного фактора TFEB и контролирующего лизосо-мально-аутофагийный механизм клеточного гомеостаза, в регуляции ПЖ и физиологических показателей у Drosophila melanogaster. Показано, что кондиционная сверхэкспрессия Mitf в НС приводит к снижению ПЖ самок и самцов и угнетению репродуктивной функции самок, не оказывая эффекта на двигательную активность особей обоих полов. В то же время, основываясь на данных, полученных для млекопитающих и Caenorhabditis elegans, ортологи данного гена определяют долгожительство организма и являются потенциальными мишенями для геро-протекторных вмешательств, направленных на замедление старения за счет стимуляции функционирования лизосом и аутофагийного потока. Следовательно, требуется проведение более детальных исследований для выявления механизмов, лежащих в основе эффектов активности гена Mitf и его ортологов, и поиск подходов к увеличению ПЖ.
Исследования выполнены в рамках государственного задания по темам «Молекулярно- генетические механизмы старения, продолжительности жизни и стрессоустойчивости Drosophila melanogaster» № АААА-А18-118011120004-5 и «Разработка геропротекторных и радиопротекторных препаратов» № АААА-А19- 119021590022-2.


