Влияние света разной интенсивности на рост и развитие артемии (Artemia salina) в искусственной экосистеме
Автор: Шленкина Т.М., Романова Е.М., Романов В.В., Фазилов Э.Б.У., Любомирова В.Н., Свешникова Е.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 2, 2023 года.
Бесплатный доступ
Науплии артемии являются лучшим стартовым кормом для большинства объектов современной аквакультуры. Живые стартовые корма - науплии артемии - содержат ингредиенты, необходимые для выживаемости гидробионтов в критические периоды раннего постэмбрионального онтогенеза. В связи с этим актуальным является совершенствование биотехнологии культивирования артемии в искусственной экосистеме. Цель работы - исследование влияния режимов освещенности на морфологические особенности артемии на разных стадиях ее жизненного цикла. Материалы и методы. В ходе исследования были использованы различные режимы освещенности: 1,5; 2,5 и 4 клк, чтобы определить наиболее эффективный. Результаты. Использованные режимы освещенности по-разному влияют на развитие артемии. Наиболее эффективной на этапе эмбрионального развития и начальных стадиях постэмбрионального онтогенеза была освещенность, равная 4 клк
Искусственно созданная экосистема, аквакультура, артемия, условия культивирования, режимы освещенности
Короткий адрес: https://sciup.org/14128725
IDR: 14128725 | УДК: 639.51 | DOI: 10.34014/2227-1848-2023-2-166-180
Текст научной статьи Влияние света разной интенсивности на рост и развитие артемии (Artemia salina) в искусственной экосистеме
Введение. Артемии – жаброногие ракообразные, населяющие морские мелководья и гипергалинные озера. Это планктонные организмы, которые питаются фитопланктоном, фильтруя воду с помощью грудных конечностей. Наиболее известный вид – Artemia salina .
Артемия имеет большое значение для развития мировой аквакультуры. Представители этого рода являются общепризнанным кормовым объектом, который используется в качестве живых стартовых кормов для рыб, ракообразных, моллюсков и других гидробионтов в аквакультуре [1].
Науплии жаброногого рачка рода Artemia содержат уникальные биологически активные вещества, обеспечивающие выживаемость, рост и развитие рыб и других гидробионтов на критических стадиях развития, когда предли-чинки переходят на экзогенное питание после истощения запасов желтка.
Однако мировая добыча цист артемии в естественных природных экосистемах удовле- творяет мировой спрос всего на 40 %. Спрос настолько высок, что 95 % добываемой в России артемии экспортируется в Европу и страны Азии, прежде всего в Китай. Цены на цисты артемии в России находятся на уровне мировых, и этот природный продукт мало доступен для отечественных рыбоводных предприятий, в первую очередь для фермерских хозяйств [2]. Поэтому, учитывая высокий спрос на жаброногих рачков, культивирование артемии в искусственной экосистеме актуально для развития аквакультуры в целом, имеет большую практическую значимость и является важным звеном в системе искусственного воспроизводства и выращивания гидробионтов.
На цикл развития артемии и ее морфологические параметры в естественной и искусственной экосистеме оказывает влияние комплекс абиотических факторов среды.
Рачки рода Artemia проявляют высокую адаптационную пластичность, имеют широ- кую экологическую валентность. Они обладают способностью противостоять неблагоприятным факторам среды, однако это противостояние не проходит бесследно. В неблагоприятных условиях артемии снижают свою плодовитость, количество циклов воспроизводства и продолжительность жизни [3, 4].
При культивировании артемии есть все возможности создать максимально благоприятную среду для наиболее полной реализации ее генетического потенциала продуктивности.
В России ареал артемии ограничен гипер-галинными водоемами Алтая, Сибири, Крыма, заливами и лиманами Каспийского, Азовского и Черного морей. Все эти районы – места промысла цист артемии.
Однако видовой состав артемии на территории России до сих пор не изучен, принято условно выделять Artemia salina и ее расы (экоморфы) в зависимости от особенностей абиотических факторов места их обитания [5].
К числу основных абиотических факторов, оказывающих влияние на цикл развития и репродуктивный потенциал артемии, можно отнести температуру, рН, соленость и освещенность среды обитания.
В природных экосистемах артемии обладают высокой устойчивостью к химическому загрязнению, в частности к высоким концентрациям сероводорода. Известно, что сероводород для остальных гидробионтов смертелен даже в незначительных количествах. Поэтому артемии являются единственными обитателями (кроме микроорганизмов) богатых сероводородными илами озер [6].
В каждом из мест обитания артемии существует единый устоявшийся комплекс абиотических факторов, обусловленных климатическими условиями и сезонностью, вызывающей их циклические колебания.
В искусственной экосистеме имеются необходимые условия, чтобы избежать колебаний абиотических факторов среды и оптимизировать их, устранить сезонность, повысить возможность наиболее полной реализации генетического потенциала организма артемии. Это позволяет получать науплии и цисты артемии круглогодично, а не только в летний период.
Артемии теплолюбивы, оптимальная для разных рас температура лежит в пределах 20–30 °С [7], но рачки могут существовать и при температуре от 2 до 35–37 °С. Однако некоторые таиландские и вьетнамские расы артемий адаптированы и к более высокой температуре, близкой к 40 °С [8]. При температуре ниже 5 °С движение рачков замедляется и прекращается их рост.
Артемия считается достаточно хорошо изученным природным объектом. Но это касается артемии из естественных природных ги-пергалинных водных экосистем. По отношению к артемии, выращиваемой в искусственной экосистеме, этого утверждать нельзя. Культивируемая артемия используется преимущественно в качестве живых стартовых кормов на личиночных стадиях онтогенеза рыб и других гидробионтов. При этом и, как правило, in situ используется методология культивирования, максимально приближенная к усредненным условиям внешней среды естественных экосистем без учета сезонных особенностей. На практике условия искусственного круглогодичного разведения артемии в аквакультуре, как показали исследования, по большинству абиотических факторов не оптимизированы [9]. Особенно отчетливо это проявляется при разведении артемии по замкнутому циклу [10]. Как оказалось, факторы среды, обеспечивающие размножение артемии по типу живорождения в аквакультуре, отличаются от условий, необходимых и достаточных для продуцирования цист [11]. Поэтому процесс культивирования артемии нуждается в оптимизации абиотических факторов, что сделало бы его максимально эффективным. Световой фактор в этом процессе играет ведущую роль.
Анализ современных литературных источников показывает, что искусственное воспроизводство артемии по замкнутому циклу находится на недостаточно высоком уровне [12]. Пока продуктивность артемии в условиях аквакультуры остается низкой.
Культивирование и воспроизводство артемии по замкнутому циклу, по сравнению с традиционным получением науплий артемии, – не до конца изученный процесс. По- этому оптимизация абиотических факторов среды в условиях искусственного разведения артемии относится к числу актуальных проблем, требующих решения [13, 14].
Наша работа посвящена исследованию влияния одного из абиотических факторов среды – света разной интенсивности – на этапы метаморфоза определенной расы (экоморфы) артемии – А. var. Principalis – в искусственно созданной экосистеме.
Цель исследования. Оценить влияние режимов освещенности на особенности метаморфоза А. var. Principalis в искусственной экосистеме.
Материалы и методы. Для исследования использовалась артемия расы А. var. Principalis из Алтайских гипергалинных озер, поставщиком цист являлось предприятие «Барром». Цвет цист был бежево-коричневым с преобладанием коричневого.
Для получения науплий цисты артемии культивировались в аппарате Вейса в искусственно созданной экосистеме со следующими параметрами: соленость воды – 30 г/л (NaCl), температура воды – 26–28 °С, рН – 8,2, плотность посадки цист – 2,5 г/л, насыщение воды кислородом – 80–90 %. Применялись разные режимы освещенности.
Для изучения влияния света на онтогенез и продуктивность артемии в аквакультуре были заложены три серии опытов. Освещение в 1-м и 2-м опытах обеспечивалось блоками с лампами дневного света OSRAM L 18w/765, световой поток и цветовая температура каждой из которых составляли 1050 Лм и 5000 К соответственно. Для освещения в третьем опыте использовался светодиодный источник света IEK CDO 06-100 6500K со световым потоком 8000 Лм. Измерение освещенности выполнялось фотометром/люксометром MASTECH MS6610 с выносным датчиком измерения освещенности.
В первом опыте, который служил контролем, освещенность (E) культивируемой артемии составляла 1,5 клк, во втором опыте – 2,5 клк, в третьем – 4 клк.
Морфометрические показатели изучались по стандартным методикам. Для исследования рачки фиксировались в 4 % растворе форма- лина. Измерение проводилось с помощью микроскопа МБС-10, оборудованного окулярным микрометром.
При работе использовались также микроскоп «Микромед 2» (вар. 3-20), аналитические весы ViBRA HT-224RCE с точностью до 0,0001 г, чашки Петри, бинокуляр Levenhuk 3ST, компрессор Resum AIR-3000, препаровальные иглы.
Достоверность различий выборок оценивалась по критерию Стьюдента. Проводилась традиционная биометрическая обработка данных.
Результаты и обсуждение. На первом этапе работы исследовалось влияние разных режимов освещенности на развитие эмбриона и ранних личинок артемии – науплий; изучались морфометрические параметры артемии в раннем онтогенезе.
Перед загрузкой цист (рис. 1) артемии в аппарат Вейса определялось их качество. При микроскопии было установлено, что доля цист с вмятинами в исследованных образцах достигала 20–30 %.
Исследование размеров сухих цист артемии показало, что средний диаметр цист составил 0,227±0,016 мм. Полученные результаты достаточно хорошо согласуются с данными других исследований, по результатам которых диаметр сухих цист колеблется от 230 до 400 мкм [15–17]. Разброс размеров цист был достаточно высоким. Неоднородность цист артемии обусловлена колебаниями факторов среды естественных экосистем в местах их добычи.
Artemia salina в зависимости от факторов среды обитания формирует определенные расы (экоморфы), характеризующиеся морфологическими различиями.
Известно, что эмбрион в цисте находится в стадии недифференцированной гаструлы и полностью неметаболичен при влажности ниже 10 %.
Если же влажность превышает 10 % и кислород присутствует в достаточном количестве, то к эмбриону возвращается жизнеспособность [18]. Вылупившиеся эмбрионы артемии и их метаморфоз в науплии изображены на рис. 2.
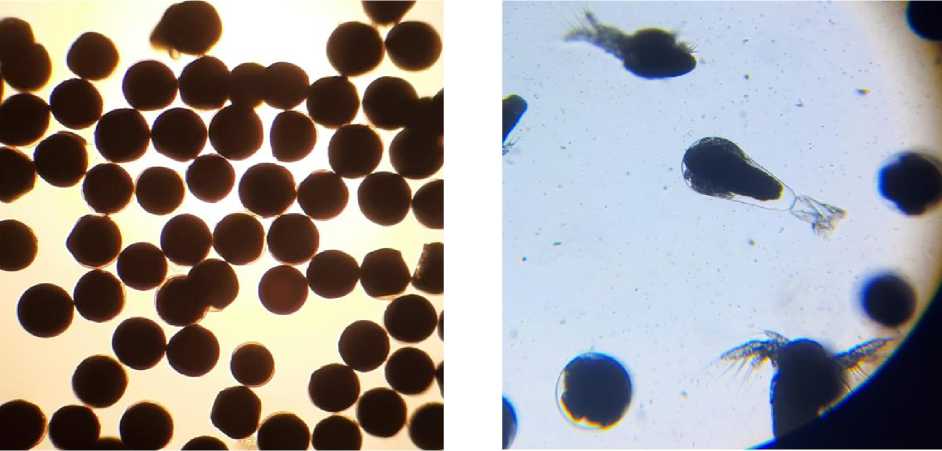
Рис. 2. Свободные эмбрионы и появление науплий
Fig. 2. Free embryos and nauplii formation
Рис. 1. Сухие цисты артемии
Fig. 1. Dry artemia cysts
Морфометрия вылупившихся эмбрионов показала, что абсолютные значения их размеров в контрольной (освещенность 1,5 клк) и экспериментальных группах (2-я группа – ос- вещенность 2,5 клк; 3-я группа – освещенность 4 клк) находились в пределах 236– 288 мкм (рис. 3).
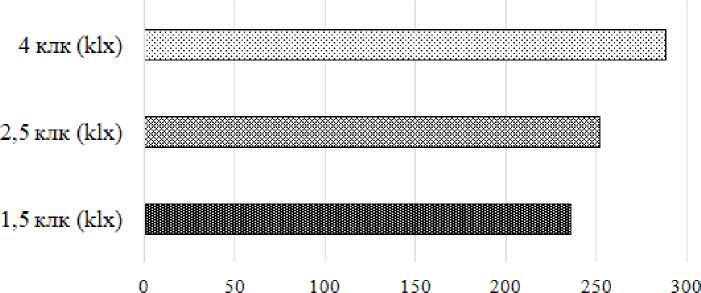
Рис. 3. Усредненный размер свободного эмбриона, мкм
Fig. 3. Average size of a free embryo, microns
При сравнительном анализе размеров эмбриона было установлено, что во второй экспериментальной группе они на 6,3 %, а в третьей на 11,03 % превышали показатели контроля.
Таким образом, увеличение уровня освещенности оказало положительное влияние на размер эмбриона.
На начальных этапах развития, на стадии ортонауплий, артемии быстро растут за счет резервов желтка. Науплии I личиночной стадии находятся на эндогенном питании и не способны потреблять корма, их пищеварительная система не функционирует, так как рот и анус еще закрыты.
Спустя 8–12 ч после первой линьки завершается науплиальный период и личинки артемий переходят в метанауплиальную стадию. У личинок I метанауплиальной стадии начинает функционировать пищеварительный тракт и появляется возможность отфильтровывать частицы размером 1–40 мкм.
В течение последующих 8–10 дней рачки проходят три следующие метанауплиальные стадии, характеризующиеся различной степенью сегментации тела. После пятой линьки ме-танауплиальный период заканчивается и начинается ювенальный с семью стадиями развития, сопровождающийся преобразованием антенн и развитием торакопод (грудных ножек).
После тринадцатой линьки начинается предвзрослый период, состоящий из пяти стадий развития. Этот период характеризуется формированием генитальных структур: вторая пара антенн претерпевает половую диффе- ренциацию. У самцов развиваются крючковатые хвататели, в то время как у самок антенны редуцируются в сенсорные придатки.
При длине рачка 6 мм и более уже можно различить будущих самцов и самок. После семнадцатой линьки завершается постэмбриональное развитие, рачки имеют все половые признаки.
Наблюдения за динамикой выклева науп-лий в искусственной среде в зависимости от освещенности приведены в табл. 1.
Из культивируемой артемии из групп с разным освещением через 8, 12, 18, 25, 30, 34, 38, 42, 48 ч отбирались образцы, которые фиксировались формалином и исследовались под микроскопом.
Индивидуальная масса только что вылупившихся науплий колебалась в пределах 0,01–0,023 мг (рис. 4), что согласуется с литературными данными [19].
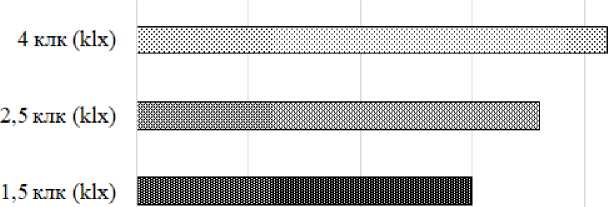
О О.ОО5 0.01 0.015 0.02 0.025 мг (mg)
Рис. 4. Индивидуальная масса только что вылупившихся науплий в зависимости от освещенности
Fig. 4. Individual weight of newly hatched nauplii depending on illumination
Динамика выклева науплиусов в зависимости от уровня освещенности
Таблица 1
Table 1
Dynamics of nauplii hatching, depending on illumination level
|
Период наблюдения Observation period |
I группа (контрольная) (освещенность 1,5 клк) Group I (control) Illumination 1,5 klx |
II группа (экспериментальная) (освещенность 2,5 клк) Group II (experimental) Illumination 2,5 klx |
III группа (экспериментальная) (освещенность 4 клк) Group III (experimental) Illumination 4 klx |
|
Через 8 ч 8 hours later |
Изменений не происходит No changes |
Циста начинает трескаться. Доля таких цист 0,18–0,24 % The cyst begins cracking. The proportion of such cysts is 0.18–0.24 % |
Цисты напитываются водой и раздуваются, активируется развитие эмбриона. Хорион у 0,24–0,28 % цист начинает трескаться |
|
Период наблюдения Observation period |
I группа (контрольная) (освещенность 1,5 клк) Group I (control) Illumination 1,5 klx |
II группа (экспериментальная) (освещенность 2,5 клк) Group II (experimental) Illumination 2,5 klx |
III группа (экспериментальная) (освещенность 4 клк) Group III (experimental) Illumination 4 klx |
|
Cysts are saturated with water and inflate; embryo development is activated. Chorion in 0.24–0.28 % of cysts begins to crack. |
|||
|
Через 12 ч 12 hours later |
Изменений не происходит No changes |
Хорион разрывается, появляются эмбрионы, которые все еще завернуты в инкубационную мембрану. В течение нескольких часов эмбрионы остаются сцепленными с оболочкой цисты. Доля таких форм составляет 12,7 % The chorion ruptures, leaving the embryos still wrapped in the incubation membrane. For several hours, the embryos remain linked to the cyst membrane. The proportion of such forms is 12.7 % |
Оболочки цист продолжают растрескиваться, и эмбрион выходит из хориона. В течение определенного времени эмбрионы остаются сцепленными с оболочкой. Доля таких форм достигает 16,6 % Cysts continue to crack; the embryo leaves the chorion. For some time, the embryos are still linked to the shell. The proportion of such forms is 16.6 % |
|
Через 18 ч 18 hours later |
Хорион лопается Chorion ruptures |
Часть особей (21,9 %) находятся на стадии «парашютика» Hatchling (21.9 %) is at a “parachute” stage |
Часть особей (28,7 %) находятся на стадии «парашютика» Hatchling (28.7 %) is at a “parachute” stage |
|
Через 25 ч 25 hours later |
Хорионы лопаются, эмбрионы выходят из цисты, их доля составляет 1,8 % Chorions rupture, embryos leave the cyst. The proportion of such cysts is 1.8 % |
Выклюнувшиеся из хориона личинки I стадии развития (прозрачные ортонауплии) составляют 33,1 %, в длину достигают 0,5 мм. Доля более развитых, свободно плавающих науплий составляет 7,6 % The larvae hatched from the chorion, 1st stage of development (transparent orthonauplii), make up 33.1 %. Their length is up to 0.5 mm. The proportion of more developed, free-swimming nauplii is 7.6 % |
Вылупившиеся из хориона личинки, завершившие эмбриональную стадию, составляют 38,1 %. Они прозрачные, их длина 0,5 мм. Более развитые, свободно плавающие науплии составляют 9,1 % The larvae hatched from the chorion, which completed the embryonic stage, account for 38.1 %. They are transparent, their length is 0.5 mm. More developed, free-swimming nau-plii account for 9.1 % |
|
Период наблюдения Observation period |
I группа (контрольная) (освещенность 1,5 клк) Group I (control) Illumination 1,5 klx |
II группа (экспериментальная) (освещенность 2,5 клк) Group II (experimental) Illumination 2,5 klx |
III группа (экспериментальная) (освещенность 4 клк) Group III (experimental) Illumination 4 klx |
|
Через 30 ч 30 hours later |
Появились выклюнувшиеся науплии. На их долю приходится 24,8 % The proportion of hatched nauplii is 24.8 % |
Доля выклюнувшихся науплий возросла до 52,7 %. Науплии имеют прозрачное тело, две антенны, усики по бокам головы. На голове расположен примитивный глаз, различающий свет от тени. Проявляется положительный фототаксис The proportion of hatched nauplii is 52.7 %. Their bodies are transparent; they have two antennae and antennules. On the head there is a primitive eye that distinguishes light from shadow. Positive phototaxis is observed |
Доля вылупившихся науплий составляет 59,3 %. Они имеют небольшое продолговатое тело и две антенны, на голове расположен примитивный глаз. Проявляют положительный фототаксис The proportion of hatched nau-plii is 59.3 %. They have a small elongated body and two antennae, there is a primitive eye on the head. Positive phototaxis is observed |
|
Через 34 ч 34 hours later |
Доля выклюнувшихся науплий составляет 36,2 % The proportion of hatched nauplii is 36.2 % |
Доля выклюнувшихся науплий составляет 61,1 % The proportion of hatched nauplii is 61.1 % |
Доля выклюнувшихся науплий составляет 69,4 % The proportion of hatched nauplii is 69.4 % |
|
Через 38 ч 38 hours later |
Доля выклюнувшихся науплий составляет 53,7 % The proportion of hatched nauplii is 53.7 % |
Доля выклюнувшихся науплий составляет 68,5 % The proportion of hatched nauplii is 68.5 % |
Доля выклюнувшихся науплий составляет 77,8 % The proportion of hatched nauplii is 77.8 % |
|
Через 42 ч 42 hours later |
Доля выклюнувшихся науплий составляет 68,2 % The proportion of hatched nauplii is 68.2 % |
Доля выклюнувшихся науплий составляет 79,6 % The proportion of hatched nauplii is 79.6 % |
Доля выклюнувшихся науплий составляет 82,4 % The proportion of hatched nauplii is 82.4 % |
|
Через 48 ч 48 hours later |
Итоговый выклев – 70,3 % Final hatch is 70.3 % |
Итоговый выклев – 81,9 % Final hatch is 81.9 % |
Итоговый выклев – 84,5 % Final hatch is 84.5 % |
Необходимо отметить, что спустя 8 ч после начала инкубации в контрольной группе изменений не произошло. Во второй группе на яйцах начали появляться трещины. Количество треснувших яиц в пробах составило от 0,18 % до 0,24 %. В третьей группе отмечены первые цисты с треснувшим хорионом (рис. 5). Их количество составило 0,24–0,28 %. Раз- ница между экспериментальными группами по количеству цист с треснувшим хорионом составила 33,3 %. Это говорит о том, что в небольшом количестве цист эмбриогенез завершился и начался процесс выхода науплий из хориона.
Через 12 ч после начала инкубации в контрольной группе изменений также не произо- шло. В экспериментальных группах количество цист с треснувшим хорионом увеличилось и составило во второй группе 12,7 %, в третьей – 16,6 %.
Через 18 ч в контрольной группе цисты начинали лопаться. В экспериментальных группах процесс усилил свою интенсивность: доля особей на стадии «парашютика» во второй группе составила 21,7 %, в третьей – 28,7 % (рис. 6). Таким образом, количество цист с треснувшим хорионом в третьей группе было больше, чем во второй, на 32,3 %.
Через 25 ч после начала инкубации в кон- трольной группе наблюдался процесс растрескивания хорионов (рис. 7), эмбрион появлялся из скорлупы в 1,8 % случаев. Во второй группе на долю выклюнувшихся науплий приходилось 33,1 %. Отмечены первые свободно плавающие науплии (7,6 %) (рис. 7, 8). В третьей группе эти показатели составили соответственно 38,1 % и 9,1 %. Таким образом, в обеих экспериментальных группах встречались вылупившиеся науплии, однако их количество было разным, что свидетельствует о влиянии интенсивности освещенности на скорость выклева науплий.
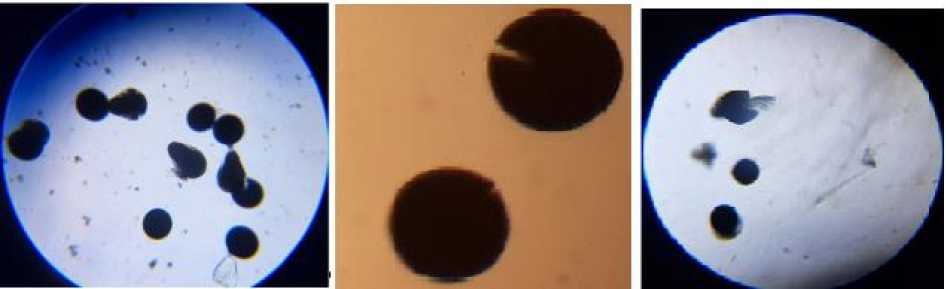
Рис. 5. Цисты с треснувшим хорионом и свободные эмбрионы
Fig. 5. Cysts with a cracked chorion and free embryos
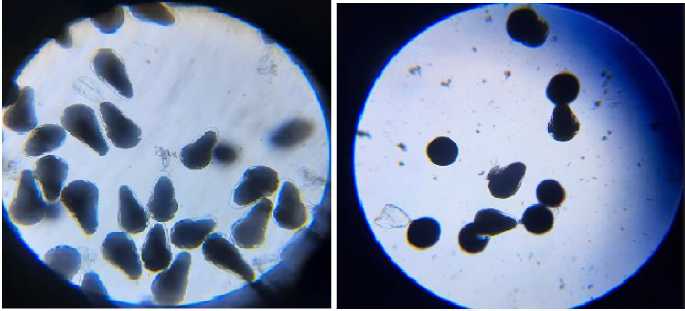
Рис. 6. Интактные и треснувшие цисты, стадия «парашютика»
Fig. 6. Intact and cracked cysts, “parachute” stage
Спустя 30 ч количество выклюнувшихся науплий в контрольной группе достигло 24,8 %, во второй группе – 52,7 % (в 2,7 раза больше, чем в контроле), в третьей – 59,3 % (почти в 3 раза больше, чем в контроле). Таким образом, через 30 ч после начала инкуба- ции в экспериментальных группах отмечался массовый выход эмбрионов (рис. 7), при этом разница между второй и третьей группами составила 12,5 %.
Итоговый выклев науплий в зависимости от освещенности представлен на рис. 9.

Рис. 7. Треснувшие хорионы и свободно плавающие науплии, массовый выклев науплий
Fig. 7. Cracked chorions and free-floating nauplii, mass nauplii hatch

Рис. 8. Науплии
Fig. 8. Nauplii
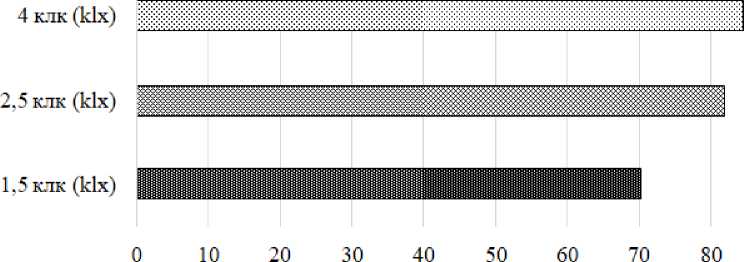
Рис. 9. Итоговый выклев науплий в зависимости от освещенности
Fig. 9. Final nauplii hatch depending on the illumination
Полученные в результате исследования данные свидетельствуют об активирующем влиянии освещенности на динамику и интенсивность выклева, а также развитие артемии на начальных этапах. Наиболее выраженный эффект отмечался при освещенности 4 клк.
Наблюдение за артемиями в процессе их метаморфоза показало, что варьирование условий культивирования цист позволяет добиться различных результатов: от ускорения вылупления науплий до получения более развитых и крепких рачков.
Как показали результаты исследований, высокая интенсивность освещения не только повышает скорость выклева, но и достоверно увеличивает выход личинок, а также влияет на скорость метаморфоза в личиночном периоде.
Таким образом, полученные данные свидетельствуют о том, что освещение является активирующим фактором для инкубации цист артемии и ее последующего культивирования. Установлено, что уровень освещенности приобретает наибольшее значение на заключительных стадиях эмбриогенеза и начальных этапах постэмбрионального развития. В эти периоды артемия наиболее чувствительна к световому воздействию.
Для получения максимального выхода науплий повышенную освещенность необходимо поддерживать на протяжении всего периода инкубации.
Заключение. В перечне стратегических направлений развития РФ отдельно отмечен переход к развитию экологически чистой аквакультуры. Развитие и совершенствование биотехнологий культивирования гидробионтов в искусственно созданной экосистеме – это основное направление развития современной аквакультуры.
Важность выбранного нами направления исследований обусловлена тем, что артемия, в частности живые науплии, является признанным лидером в числе стартовых кормов для рыб и других гидробионтов в мировом рыбоводстве. Живые науплии – короткоживущий объект, поэтому их необходимо получать in situ в каждом из предприятий аквакультуры, занимающихся разведением и выращиванием рыбы, ракообразных или моллюсков. Поэтому технология культивирования артемии должна быть оптимизирована по всему спектру абиотических факторов, необходимых и достаточных для ее выращивания в искусственно созданной среде.
Наше внимание было сосредоточено на таком абиотическом факторе, как интенсивность освещения, который мы варьировали, стабилизировав при этом соленость, рН и температуру среды.
Результаты наших исследований показали, что интенсивность освещения оказывала влияние на эмбриогенез, стадии метаморфоза личинок и рост науплий артемии. В частности, было установлено, что для максимального проявления генетического потенциала продуктивности, реализующегося в количестве выклюнувшихся науплий, при культивировании артемии в аквакультуре важно на начальных этапах ее онтогенеза использовать режим освещенности 4 клк.
Исследование выполнено при поддержке программы развития Саратовского государственного университета генетики, биотехнологии и инженерии им. Н.И. Вавилова «Приоритет – 2030».
Список литературы Влияние света разной интенсивности на рост и развитие артемии (Artemia salina) в искусственной экосистеме
- Мухитова М.Э., Романова Е.М., Любомирова В.Н., Романов В.В., Шленкина Т.М., Шадыева Л.А. Проблемы культивирования стартовых живых кормов для аквакультуры. Международный научно-исследовательский журнал. 2017; 1 (55): 13-15.
- Костромин Е.А. Влияние факторов среды (соленость, температура, освещение) на инкубацию Artemia salina в эксперименте. Известия Санкт-Петербургского государственного аграрного университета. Санкт-Петербург; 2016: 164-168.
- Litvinenko L.I., Litvinenko A.I., Boyko E. G. Brine shrimp Artemia in Western Siberia lakes. Novosibirsk; 2016. 295.
- Рожков А.Г. Артемия салина (Artemia salina), особенности и применение. Современные технологии в деятельности особо охраняемых природных территорий: материалы II Международной молодежной научно-практической конференции. Омск; 2020: 44-45.
- Старовойтова Д.А., Бурмистрова О.С. Размеры цист популяций артемии разнотипных озер Ку-лундинской низменности. Известия АО РГО. 2017; 4 (47): 84-92.
- Литвиненко Л.И. Жаброногие рачки рода Artemia Leach, 1819 в гипергалинных водоемах Западной Сибири (география, биоразнообразие, экология, биология и практическое использование): ав-тореф. дис. ... д-ра биол. наук. Пермь; 2009. 46.
- Asem A., Rastegar-Pouyani N. Sexual dimorphism in Artemia urmiana Günther, 1899 (Anostraca: Arte-miidae) from the Urmia Lake (West Azerbaijan, Iran). Journal of Animal and Veterinary Advances. 2007; 6 (12): 1409-1415.
- Разова Л.Ф. Оценка биологических и репродуктивных особенностей артемии сибирских популяций: дис. ... канд. биол. наук. Тюмень; 2022. 172.
- Романова Е.М., Романов В.В., Любомирова В.Н., Фазилов Э.Б. Факторы, регулирующие онтогенез A. salina и ее продуктивность при культивировании IN VITRO. Вестник Ульяновской государственной сельскохозяйственной академии. 2022; 3 (59): 148-153.
- Романова Е.М., Романов В.В., Любомирова В.Н., Фазилов Э.Б. У. Технология обогащения ранних науплий Артемии и результативность их использования в качестве стартовых кормов. Вестник Ульяновской государственной сельскохозяйственной академии. 2022; 4 (60): 150-155.
- Макаров А.В., Мишвелов А.В. Сведения о перспективах хозяйственного применение Artemia salina и продуктов ее жизнедеятельности. 2021; 19-2 (195): 85-86.
- Mazhibaeva Zh.O., Barakbayev T.T., Shalgimbaeva G.M., Isbekov K.B., Asylbekova S.Zh., Fefelov V.V. Populations of Artemia crustaceans of Karabassky floods of Pribalkhashye. Vestnik of Astrakhan State Technical University. Series: Fishing Industry. 2021; 3: 47-54.
- Садчиков А.П. Культивирование водных и наземных беспозвоночных (принципы и методы). Москва: Изд-во Московского государственного университета им. М.В. Ломоносова: МАКС Пресс; 2009. 272.
- Жигин А.В. Артемия - объект аквакультуры. Доклады ТСХА. 03-05 декабря 2019. Выпуск 292, часть IV. Москва: Российский государственный аграрный университет - МСХА им. К. А. Тимирязева; 2020: 277-281.
- Руднева И.И., Залевская И.Н., Шайда В.Г., Щерба А.В., Завьялов А.В. Экологические особенности Артемии соленых озер Евпаторийской группы (Республика Крым). Экология водных беспозвоночных: тезисы Международной конференции, посвященной 110-летию со дня рождения Ф.Д. Мордухай-Болтовского. 09-13 ноября 2020. Борок; Ярославль; 2020: 70.
- Тимошенко Ю.А. Характеристика морфологических показателей артемии из некоторых озер Крыма. Международный академический вестник. 2019; 5 (37): 5-8.
- Мухитова М.Э., Романова Е.М., Любомирова В.Н., Шленкина Т.М. Оценка синхронности метаморфоза Artemia salina в лабораторных условиях. Аграрная наука и образование на современном этапе развития: опыт, проблемы и пути их решения: материалы VIII Международной научно-практической конференции. Ульяновск; 2017: 155-158.
- Мухитова М.Э., Романова Е.М. Технологические особенности выращивания живых кормов для аквакультуры. Современные научные исследования и разработки. 2017; 2 (10): 363-364.
- Белых О.А., Розанов С.Е. Особенности выращивания живого корма Artemia salina в аквакультуре. Известия Байкальского государственного университета. 2021; 31 (3): 400-406.


