Влияние температурного стресса на спектр жирных кислот штаммов Vibrio cholerae
Автор: Шипко Елена Сергеевна, Дуванова Ольга Викторовна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2022 года.
Бесплатный доступ
В условиях смоделированного температурного стресса методом газовой хроматографии в сочетании с масс-спектрометрией был изучен спектр жирных кислот штаммов Vibrio cholerae O1, О139, non O1/non O139 серогрупп с различным набором детерминант патогенности, выделенных от больных и из проб воды поверхностных водоемов. Выявлены достоверные отличия в составе жирных кислот при холодовом и тепловом стрессах в клетках возбудителя холеры относительно контрольных образцов. Штаммы, выделенные из воды поверхностных водоемов, отличались по спектру жирных кислот при холодовом стрессе от штаммов, выделенных от больных. У штаммов, выделенных из воды, снижение температуры культивирования до 23°С сопровождалось синтезом докозановой, тетракозановой и гексакозановой кислот, а до 4°С - увеличением количества тетрадекановой и гексадекановой кислот. Тогда как у штаммов, выделенных от больных, снижение температуры культивирования вызывало закономерное увеличение гексадеценовой и октадеценовой кислот. Реакция на тепловой стресс у большинства изученных штаммов, независимо от набора детерминант патогенности и источника выделения, имела общую тенденцию: увеличение суммарного количества насыщенных жирных кислот, синтез trans-изомеров ненасыщенных жирных кислот, появление ω-алициклических и iso-разветвленных жирных кислот. Помимо ремоделирования жирно-кислотного состава мембраны под действием температурного стресса отмечен синтез оксилипинов, фенилпропаноидов, терпеноидов, возможно, играющих роль адаптогенов.
Vibrio cholerae, жирные кислоты, холодовой стресс, тепловой стресс
Короткий адрес: https://sciup.org/147238653
IDR: 147238653 | УДК: 579.843.1:577.115.3:577.1 | DOI: 10.17072/1994-9952-2022-2-143-154
Текст научной статьи Влияние температурного стресса на спектр жирных кислот штаммов Vibrio cholerae
Глобальное распространение Vibrio cholerae за пределами эндемичных территорий, постоянное эволюционирование и совершенствование внутри- и межвидовых стратегий сохранения возбудителя в разных биоценозах с широким диапазоном экологических факторов, диктуют необходимость изучения механизмов, формирующих адаптационный/персистентный потенциал возбудителя и пути его реализации – на генетическом, протеомном, метаболомном уровнях.
Одним из наиболее значимых экологических факторов, с которым сталкиваются бактерии в процессе своей жизнедеятельности, является воздействие температуры. Учитывая два стиля жизни холерного виб-риона– водное окружение и кишечник человека, ему необходимо адаптироваться к широкому диапазону температур.
Температурная адаптация на клеточном уровне осуществляется за счет общих стрессовых реакций, которые включают адаптацию механизмов трансляции и транскрипции, структурную перестройку энзимов, экспрессию специфических белков, а также изменение текучести мембран.
Клеточные мембраны играют ключевую роль в устойчивости бактерий к действию абиотических и биотических факторов среды, осуществляя динамическое взаимодействие клетки и окружающей среды: обеспечивают избирательную проницаемость для ионов, метаболитов, генерацию трансмембранного потенциала, восприятие, обработку и передачу информации в виде химических и электрических сигналов.
Модулирование текучести мембраны – один из центральных процессов, лежащих в основе формирования адаптационного ответа бактериальной клетки на термический стресс. Известно, что при изменении температуры липиды могут претерпевать несколько фазовых переходов. Наиболее важными из них являются переходы кристалл (гель) – жидкий кристалл и жидкий кристалл – изотропное состояние. Поддержание жидкокристаллического состояния мембраны осуществляется за счет гомеовязкостной адаптации, в которую вовлечены следующие липидные модуляции – температурные вариации липида А молекулы липополисахарида, изменение типа этерификации фосфолипидов [Vigh, Landry, Nakamoto, 2007; Watson, 2015].
Изменение жирнокислотного состава липидов, как наиболее лабильной их части, может быть достигнуто несколькими путями: в результате синтеза жирных кислот (ЖК) de novo либо ремоделированием – удлинением, разветвлением, циклизацией, десатурацией цепей. Недавние исследования выявили способность патогенных вибрионов извлекать жирные кислоты из источников окружающей среды и ассимилировать их в собственные клеточные мембраны. Включение экзогенных длинноцепочечных полиненасы-щенных жирных кислот в фосфолипиды оказывало влияние на проницаемость мембран, повышая стрес-соустойчивость микроорганизмов [Moravec et al., 2017; Smith et al., 2021].
Резкая смена температур (при попадании патогена в организм теплокровного хозяина или его выход в окружающую среду) требует срочной ответной/адаптивной реакции клеток возбудителя на стресс. Основные механизмы, обеспечивающие данный процесс – это cis-trans -изомеризация ННЖК, циклопропанирование ЖК, а также iso - и anteiso -метилирование ацильных цепей.
Циклопропановые ЖК обладают уникальными физическими и химическими характеристиками – проявляют высокую окислительную стабильность, способны к самополимеризации и т.д. Они формируют первую линию защиты клетки от термического стресса и действия агрессивных сред, оказывая влияние на структуру и динамику липидного бислоя. Показано, что включение циклопропановых ЖК способствует возникновению гош-эффекта в ацильных цепях (углеродная цепь изгибается под углом 120º), что приводит к увеличению латеральной диффузии липидов и повышению текучести мембран при холодовом стрессе [Poger, Mark, 2015]. В то же время ω-алициклические ЖК с крупными циклогексильными, циклогептильными кольцами способствуют большей упорядоченности ацильных цепей, снижению диффузии липидов и увеличению вязкости мембран при действии высоких температур [Poger, Caron, Mark, 2015].
Механизм cis-trans-изомеризации ННЖК, запускаемый при экстремальной смене температурного режима, обусловливает быструю ригидизацию клеточной мембраны, препятствуя избыточному ее разжижению при высоких температурах либо проникновению внутрь клеток токсичных веществ [Heipieperm, Hachicho, 2014]. Данный механизм присущ лишь тем представителям грамотрицательных бактерий, ко- торые способны существовать в широком диапазоне экосистем, как например, представители родов Pseudomonas и Vibrio [Heipieper, Meinhard, Segura, 2003]. В trans-ННЖК, по сравнению с cis-изомерами, ацильные цепи более тесно взаимодействуют, подобно остаткам насыщенных жирных кислот, что позволяет эффективно снижать текучесть мембраны, когда это необходимо [Eberlein et al., 2018]. Было предложено считать увеличение соотношения trans- к cis-изомерам ЖК более 0.1 биомаркером стресса, переживаемого бактериальной клеткой [Heipieper, Hachicho, 2014].
Одной из реакций на холодовой стресс у многих микроорганизмов, помимо увеличения доли ННЖК и короткоцепочечных вариантов, является синтез anteiso -разветвленных ЖК, повышающих текучесть мембраны и снижающих температуру фазового перехода. Аnteiso -метильное разветвление имеет тенденцию уменьшать толщину липидного бислоя при одновременном снижении упорядоченности ацильных цепей с эффектом повышения текучести мембран за счет образования перегибов в точке ветвления [Poger, Caron, Mark, 2014]. Напротив, в ответ на действие теплового шока, помимо увеличения средней длины цепи ЖК и доли cis -изомеров ЖК, отмечено увеличение соотношения iso - к anteiso -разветвленным ЖК. Iso -разветвленные цепи имеют точки плавления существенно выше, чем anteiso -разветвленные, как, например, точки плавления туберкулостеариновой кислоты (13.2°С) и стеариновой кислоты (69.6°C) [Janse, 1997].
Важно отметить, что термические модификации липидного состава мембран тесно связаны с синтезом и секрецией ключевых факторов патогенности и для ряда патогенов могут являться инструментом модулирования степени их вирулентности [Бахолдина, Соловьева, 2009; Rowe, Hantley, 2015; Seydlova et al., 2017]. Таким образом, механизмы выживания бактерий при различных температурах тесно связаны не только с адаптацией/персистенцией в окружающей среде, но и с формированием их патогенетического потенциала.
Анализ отечественной и зарубежной литературы показал ограниченное количество публикаций, посвященных роли изменений композиций ЖК в процессе адаптации/персистенции холерных вибрионов. Единичные исследования посвящены в основном характеристике жирнокислотного состава штаммов с позиций поиска хемотаксономических маркеров для дифференциации представителей рода Vibrio [Кузьменко, Головня, Вронова, 1980; Lambert et al., 1983; Urdaci, Marchand, Grimont, 1990]. Тогда как качественное и количественное определение спектров ЖК у штаммов возбудителя холеры (разных серо-групп), при стандартных и вариабельных условиях культивирования не проводилось.
Цель данной работы – изучение влияния температурного стресса на спектр штаммов V. cholerae O1, О139, non O1/non O139 серогрупп с различным набором детерминант патогенности, выделенных от больных и из проб воды поверхностных водоемов с использованием метода газовой хроматографии в сочетании с масс-спектрометрией (ГХ/МС).
Материалы и методы
В работе использовали штаммы V. cholerae с различным набором детерминант патогенности: 2 штамма V. сholerae O1 El Tor (18332 ctx+ tcp+; P-20000 Δctx Δtcp), выделенных от больных и из воды поверхностных водоемов; 2 штамма V. cholerae Сlassical (13603, 680 ctx+ tcp+); 4 штамма V. cholerae О139 серогруппы, из которых 2 (P-16064, Р-16131 ctx+ tcp+) были выделены от больных и 2 атоксиген-ных (17682, 17678 Δctx Δtcp) – из проб воды поверхностных водоемов; 2 штамма V. cholerae nonO1/nonO139 серогрупп (P-20453, 20283 Δctx Δtcp), выделенных от больного и из балластных вод. Штаммы получали из Музея живых культур с центром патогенных для человека вибрионов ФКУЗ Ро-стовского-на-Дону противочумного института Роспотребнадзора, где их хранили в лиофилизированном состоянии.
Температурную характеристику роста исследуемых культур проводили в диапазоне от 4 до 45°С. Для этого взвесь холерных вибрионов вносили в 3 мл 1%-ной пептонной воды (рН 7.8) до конечной концентрации 109 м.к./мл по отраслевому стандарту мутности (ОСО-42-25-59-86 П) ГИСК им. Л.А. Тарасевича (в настоящее время – ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России) и инкубировали в течение 24 ч. Работу проводили в соответствии с требованиями биологической безопасности1. Оптическую плотность обеззараженных культур определяли на спектрофотометре фирмы Beckman (США) при 600 нм. Жизнеспособность оценивали по наличию роста после контрольного высева на чашки с агаром Мартена (рН 7.6, 37°С, 24 ч.). Учет КОЕ проводили по стандартной методике.
Для анализа влияния температурного стресса на спектр жирных кислот штаммов холерных вибрионов методом ГХ/МС клетки после выращивания осаждали центрифугированием при 14 000 об/мин в течение 10 мин. на холоду. Надосадочную жидкость отбрасывали, а осадок отмывали дважды от компонентов среды физиологическим раствором, забуференным фосфатным буфером рН 7.2. Препараты жирных кислот из бактериальных клеток получали по стандартной методике [Sherlock. MIS., 2012], включающей следующие этапы: сапонификацию, кислый метанолиз, экстракцию метиловых эфиров жирных кислот гексаном. Известно, что ЖК состав микроорганизмов более специфичен, если он дополнен другими липидными компонентами, такими как, оксикислоты, спирты, альдегиды, углеводороды и стерины. Поэтому с целью расширения спектра анализируемых соединений пробоподготовка включала дополнительный этап – обработку гексановой фракции O-бис(триметилсилил)-трифлуороацетамидом (BSTF). Данный реагент высоко активен в отношении гидроксильных, карбоксильных, тиоловых и аминогрупп, которые плохо подвергаются метилированию [Осипов, 2010; Moldoveanu, David, 2019].
Метиловые и триметилсилильные эфиры ЖК анализировали методом ГХ-МС на приборе «Маэстро 27802» (ИнтерЛаб, Москва), при помощи программного обеспечения «MSD ChemStation» и библиотеки масс-спектров NIST17.
Хроматографическое разделение проб осуществляли на капиллярной колонке Rtx-5MS (5% diphenyl/95% dimethyl polysiloxane) длиной 30 м, внутренний диаметр 0.25 мм, толщина слоя неподвижной фазы 0.25 µm в режиме линейного программирования температуры от 80 до 320°С со скоростью 4.8°С/мин. Ввод пробы проводили с помощью автосамплера в режиме без деления потока. Объем вводимой пробы 5 мкл. Газ-носитель – водород. Время цикла 47.013 мин. Идентификацию индивидуальных жирных кислот выполняли сравнением времен удержания анализируемых веществ с коммерческими стандартами ЖК: каприновая (ICN Pharmaceuticals), додекановая (ICN Pharmaceuticals), тетрадекановая (ICN Pharmaceuticals), гексадекановая (ICN Pharmaceuticals), стеариновая (ICN Pharmaceuticals), эйкозановая Serva), доказановая (ICN Pharmaceuticals), 2-гидроксидоказановая (Serva); холестерол (концентрация 1 мг/мл).
Полученные хроматограммы обрабатывали автоматически, пользуясь соответствующей опцией штатной программы обработки данных. Частично данные автоматической обработки требовали ручной проверки измерения пиков. Это относится к неполностью разделенным на хроматограмме пикам или малым пикам, находящимся в соседстве с более интенсивными. Эти пики находят, руководствуясь закономерностями их появления на хроматограмме – т. е. временем удержания, подтверждением ионами.
Содержание индивидуальных ЖК оценивали в относительных величинах (в процентах от общей суммы площадей пиков всех индивидуальных ЖК) и представляли в виде средних арифметических значений, полученных в трех экспериментах. Результаты оформлены в виде диаграмм, дополненных полосами погрешностей для рядов данных. Среднее значение и стандартное отклонение рассчитывали с помощью программы Microsoft Office Excel 2010. Статистическую значимость различий сравниваемых средних значений оценивали с помощью критериев Фридмана и Кендалла c использованием пакета прикладных программ «Statistica v. 6.1 for Microsoft Windows». Критический уровень значимости принимался равным 0.05.
Результаты и их обсуждение
Для изучения феномена толерантности и механизма, лежащего в основе адаптации клеток штаммов холерного вибриона к температурному стрессу, штаммы холерного вибриона культивировали в диапазоне температур от 4 до 45°С.
В результате изучения температурных характеристик роста исследуемых культур было выявлено, что у всех штаммов холерного вибриона диапазон роста составлял от 23 до 45°С, с оптимумом в области 28– 37°С. При 4°С рост практически отсутствовал, при сохранении жизнеспособности культуры (рис. 1). Таким образом, были определены температурные условия дальнейших экспериментов: оптимальная температура 37°С (контрольный вариант), 4°С – для моделирования холодового шока и 45°С – для моделирования теплового шока. Также изучался спектр ЖК при 23°С – средней температуре речной воды в летний период.
С помощью высокочувствительного и селективного метода ГХ/МС был изучен спектр ЖК штаммов: V. cholerae O1 El Tor, V. cholerae Сlassical, V. cholerae О139, V. сholerae non O1/non воды поверхностных водоемов. Анализ с набором выделенных от больных и из проб держания липидных компонентов проводили через 2 и 24 ч. инкубации. O139 серогрупп с различным детерминант патогенности.
У контрольных образцов штаммов холерных вибрионов, взятых в исследование (37°С, 24 ч. инкубации), детектировались следующие насыщенные жирные кислоты (НЖК): тетрадекановая (С14:0), гексадекановая (С16:0), гептадекановая (С17:0), октадекановая (С18:0). ННЖК были представлены гексадеце-новой (С16:1) – С16:1Δ7, С16:1Δ9, С16:1Δ11; гептадеценовой – С17:1Δ9, С17:1Δ10; октадеценовой (С18:1) – С18:1Δ6, С18:1Δ9, С18:1Δ11. У всех штаммов детектировалась 3-гидроксимиристиновая кислота (3-ОН14:0).
Анализ спектров ЖК, выявленных у исследованных штаммов V. cholerae, показал преимущественное содержание гексадекановой и гексадеценовой жирных кислот. Суммарное количество этих кислот варьировало от 50.4 до 62.9%. Исключение составили штамм V. сholerae nonO1/nonO139 20453, в ЖК-составе которого доминировали С16:1 (31.6%) и С18:1 (22.92%) ННЖК, и штамм V. сholerae О139 17682 с преобладанием С16:0 (46.65%) и С18:0 (19.8%) НЖК. Ранее рядом отечественных и зарубежных авторов [Кузьменко, Головня, Вронова, 1980; Lambert et al., 1983; Urdaci, Marchand, Grimont, 1990] проводился анализ спектров ЖК у штаммов бактерий, принадлежащих к семейству Vibrionaceae. Авторами отмечена высокая степень гомологии ЖК состава у представителей семейства. Основное различие заключалось в содержании С12:0 (додекановой), С14:0, С15:0 (пентадекановой) НЖК и некоторых разветвленных ЖК. Профили доминантных ЖК были аналогичны полученным в настоящем исследовании. Отношение НЖК к ННЖК у контрольных образцов штаммов, взятых в исследование, в среднем составило (47.41:44.77), у штамма 20453 – (27.07:59.74).
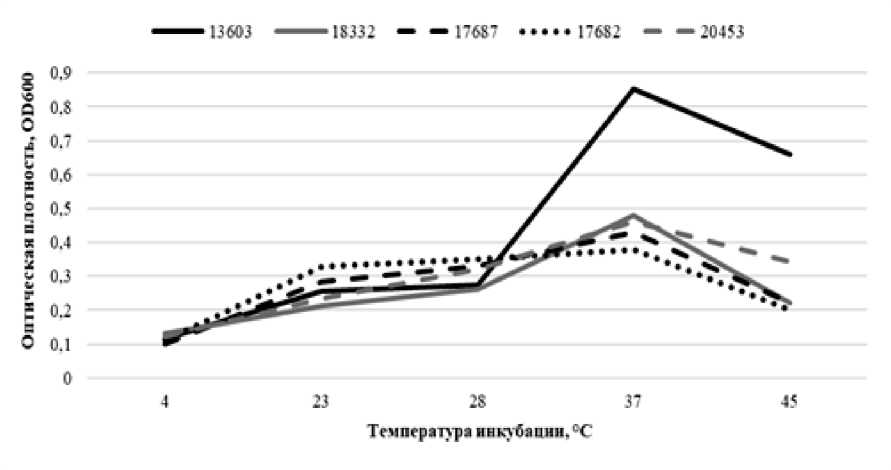
Рис. 1. Температурная характеристика роста штаммов V. cholerae [Temperature characteristics of the growth of V. cholerae strains]
Через 2 ч. инкубации в условиях холодового стресса значимых изменений в основных группах ЖК выявлено не было – С16:0 и С16:1 оставались доминатными ЖК. Тем не менее, в первые часы инкубации отмечено появление пиков соединений, необычных для возбудителя холеры – жасмоновой кислоты и фарнезола. Согласно литературным данным оксилипин – жасмоновая кислота, синтезируется и накапливается в клетках преимущественно при действии на организм повреждающего фактора и играет центральную роль в формировании адаптационного ответа на действие абиотических и биотических стрессов [Васюкова, Озерецковская, 2009]. Максимальный синтез жасмоновой кислоты отмечался у штаммов холерного вибриона классического биовара, достигая 5% от суммарной площади пиков соединений, детектируемых в клетке, что косвенно указывает на то, что данное соединение, возможно, играет роль в реакции холерных вибрионов на температурный (холодовой) стресс. В то же время у штаммов О139 се-рогруппы увеличение синтеза данного оксилипина наблюдали и при повышенной температуре культивирования – 45°С.
Для растений и некоторых микроорганизмов описана роль жасмоновой кислоты в качестве мобильной сигнальной молекулы, которая индуцирует экспрессию защитных генов, стимулирует накопление различных вторичных метаболитов, непосредственно участвующих в защитных реакциях [Wang, Wu, 2013].
Фарнезол, детектируемый в клетках штаммов холерных вибрионов классического биовара, является звеном в биосинтезе тритерпенов (через этап образования сквалена). Для ряда микроорганизмов показана его роль в качестве QS-молекулы в осуществлении внутри- и межвидовой хемокоммуникации [Сачивки-на, Подопригора, Марахова, 2020].
Через 24 ч. инкубации в условиях гипотермии у большинства штаммов содержание НЖК закономерно уменьшалось, а количество ННЖК увеличивалось. Отношение НЖК к ННЖК при 23°С составляло в среднем (40.61:51.85), а при 4°С – уже (26.24:63.46). Отмечены достоверные изменения в содержании С16:0, С15:0, С17:0, С16:1 и С18:1 по сравнению с контрольными образцами. Так, содержание пальмитиновой кислоты было снижено на 20–60%, а нечетные нормальные ЖК С15:0 и С17:0 полностью отсутствовали. В то же время содержание С16:1 увеличивалось на 25–40% (16:1), а С18:1 на 7–35%.
Помимо моноеновых ННЖК, у штаммов О1 серогруппы отмечалось появление полиеновых ЖК – С18:3, С20:5. Как известно из литературы, увеличение доли ННЖК является основным механизмом адаптации грамотрицательных бактерий к низким температурам. Накопление в мембранах моно- и полиеновых ЖК в cis-конфигурации способствует поддержанию ее активного – жидкокристаллического состояния, препятствуя переходу в фазу кристалл-гель за счет снижения температуры плавления. Так, температура плавления С16:0 (доминантной ЖК у холерных вибрионов при 37 и 45°С) составляет 62.5°С, а температура плавления С16:1 (доминантной ЖК при 4°С) – всего 1°С. Небезынтересно отметить, что при более длительной инкубации (7–10 дней) клеток в условиях холодового стресса наблюдался обратный процесс – значительное снижение содержания основных ННЖК – С16:1, С18:1 (в 2–8 раз) и увеличение НЖК. Рядом авторов высказано предположение, что подобная модификация липидного состава в сочетании с изменением мембранного потенциала и уровня гидрофобности приводит к снижению текучести мембраны, индуцируя переход в некультивируемое состояние (крайнюю форму адаптации) при длительной инкубации в условиях низких температур [Day, Oliver, 2004; Yoon, Lee, 2020].
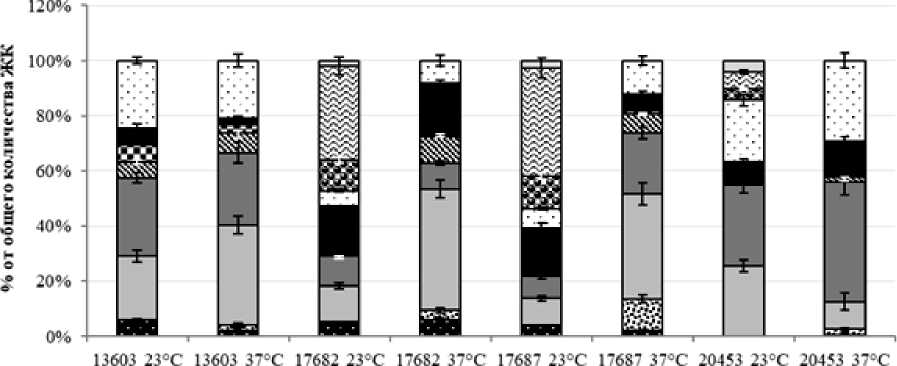
У штаммов холерного вибриона О139 и nonO1/nonO139 серогрупп, выделенных из воды, наблюдали альтернативные реакции на холодовой шок. Так, у штамма V. сholerae nonO1/nonO139 20453 через сутки инкубации в условиях холодового стресса детектировали семикратное увеличение С16:0 – с 5.32% до 41%. У штамма V. сholerae О139 Р-17682 и Р-17687 на фоне снижения С16:0, отмечалось увеличение содержания более короткоцепочечной С14:0 в среднем до 30% (рис. 2).
Вяе1с15оЖК ВС14:0 ВО5:0 006:0 BO6:1 0C17:O 807:1 108:0 008:1
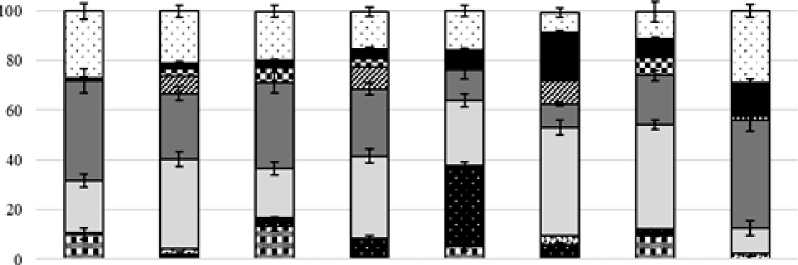
136034®€’ 13603 37®€ 183314®€ 18332 37®€ 17682 4®€ 17682 37®€ 20453 4®€ 20453 37®€ ШтяммыТ. сЬокгяе
Рис. 2. Спектр жирных кислот штаммов V. cholerae в условиях холодового стресса (4°С, 24 ч.) [Fatty acid spectrum of V. cholerae strains under cold stress conditions (4°С, 24 h)]
Помимо вариаций ЖК состава при пониженных температурах культивирования, у ряда штаммов V. choleraе регистрировали увеличение количества ненасыщенных жирных спиртов.
Необходимо отметить, что оптимальной для синтеза ЖК (температура, при которой площадь пиков и число отдельных представителей ЖК было максимальным) для большинства штаммов была температура 37°С. Исключение составляли штаммы V. choleraе О139 серогруппы, выделенные из воды. У водных штаммов Р-17682 и Р-17678 при температуре 23°С детектировались необычные для холерных вибрионов длинноцепочечные НЖК – бегеновая (С22:0), тетракозановая (С24:0), гексакозановая (С26:0), которые отсутствовали у контрольных образцов. Причем содержание С24:0 достигало 40%, конкурируя с С16:0, а количество С22:0 составляло 10–11%, конкурируя с С18:0 (рис. 3).
Воздействие теплового стресса приводило к значительным изменениям в ЖК составе V . choleraе . При сублетальных значениях температуры (45°С) детектировали появление trans -изомеров ННЖК, доля которых спустя 24 ч. достигала 26.14–77.3% от всего количества ННЖК. У штаммов О1 серогруппы по данному механизму изомеризовались как С16:1, так и С18:1 ННЖК, тогда как у штаммов V. choleraе О139 серогруппы (как водных, так и клинических), и у штаммов V. choleraе nonO1/nonO139 детектировались преимущественно trans-изомеры С18:1 ЖК. Необходимо отметить, что у некоторых штаммов детектировали наличие trans- изомеров и при пониженных температурах культивирования. Данный феномен может указывать на наличие альтернативных функций у trans -ННЖК при термическом стрессе, либо об индивидуальных особенностях штаммов.
Повышенная температура культивирования служила сигналом также для активации путей синтеза соединений класса фенилпропаноидов – гликолевой, салициловой, пиперониловой, фенил(бен-зен)пропановой, бензойной и толуиновой кислот, кумаринов, циннаматов – пики которых детектировали через 2 ч. инкубации клеток возбудителя холеры в условиях теплового стресса. У вибрионов О1 серо-группы они составляли 7–13% от всех детектируемых соединений.
■ С14;0 СС15Д OC16:0 0C16:1 HC17;0 0C17J «CIS:» DC18:1 ЯС22Л ЭС24Л DC26;0
Штаммы Г. cholerae
Рис. 3. Спектр жирных кислот штаммов V. cholerae при пониженной температуре (23°С, 24 ч.) [The spectrum of fatty acids of V. cholerae strains at a reduced temperature (23°С, 24 h)]
Биосинтез ароматических соединений является важным метаболическим путем для жизнедеятельности микроорганизмов, растений и некоторых эукариотических организмов. Этот путь включает большое разнообразие соединений, участвующих в таких важных биологических процессах, как образование структурных блоков для синтеза белка, сидерофоров, вторичных метаболитов, таких как пигменты и антимикробные вещества. Некоторые продукты этого пути оказывают цитотоксический эффект в отношении эукариотических клеток [Díaz-Quiroz et al., 2014]. Промежуточные продукты синтеза коричной кислоты – салициловая и бензойная кислоты – в настоящее время рассматриваются как эндогенные поли-функциональные биорегуляторы фенольной природы, принимающие участие в клеточном сигналинге, ростовых процессах, формировании адаптивных реакций организмов [Колупаев, Ястреб, 2013]. Летучий метил салицилат играет также важную роль в аллелопатических взаимоотношениях в биоценозах наряду с летучими производными липоксигеназного метаболизма (метилжасмонат, ноненали и др.) [Васюкова, Озерецковская, 2007]. Пиперониловая кислота, синтезируемая штаммами классического биовара при повышенной температуре, является аналогом транс-метоксикоричной. Существуют данные, что молекулы пиперониловой кислоты участвуют в репарации клеточных повреждений, вызванных действием стрессирующих факторов [Shalk et al., 1998; Lee et al., 2018].
Азелаиновая кислота, накапливаемая в клетках V. cholerae при 45°С, участвует в межвидовом взаимодействии и в реакции на стрессовые условия [Javvadi et al., 2018; Palmieri et al., 2019].
Через 24 ч. инкубации в условиях гипертермии регистрировали резкое увеличение содержания НЖК, обусловленное в первую очередь синтезом пальмитиновой и стеариновой кислот, доля которых составляла 37–62% и 20–34%, соответственно. Отношение НЖК к ННЖК в среднем составляло (75.87:19.59) (рис. 4).
Начиная с 37°С, у возбудителя холеры детектировался синтез ω-циклических жирных кислот – циклопентанундекановой (cycl11:0) и циклопентантридекановой (cycl13:0), количество которых достигало 3–5% в условиях теплового стресса (45°С). Как следует из литературных данных, введение циклопентанового кольца в молекулу жирной кислоты способствует стабилизации мембраны, препятствуя ее избыточному разжижению, тем самым обеспечивая ее функционирование в стрессовых условиях уже через несколько часов после воздействия высоких температур [Li et al., 2002].
Помимо нормальных прямоцепочечных ЖК у холерных вибрионов детектировались также разветвленные ЖК – в iso - и anteiso -конфигурациях. При 4°С разветвленные ЖК были представлены в основном anteiso -изомерами, а при 37 и 45°С – iso -изомерами.
Аnteiso-разветвленные ЖК у холерных вибрионов были представлены 12-метил миристиновой (а15:0), 13-метил пентадекановой (а16:0), 14-метил пальмитиновой (а17:0), 15-метил гептадекановой ЖК(а18:0). Количество их колебалось от 0 до 36%. Iso-разветвленные ЖК были представлены – 12-метил тридекановой (i14:0), 13-метил миристиновой (i15:0), 14-метил пентадекановой (i16:0), 16-метил гептадекановой (i18:0). Содержание их варьировало от 0 до 12.2% в зависимости от штамма, времени и температуры инкубации. Известно, что разветвленные ЖК благодаря особенностям химического строения мо- гут выполнять адаптивную функцию, сохраняя оптимальную текучесть и пластичность мембраны при резких изменениях температуры окружающей среды [Siliakus, Oost, Kengen, 2017].
Рис. 4. Спектр жирных кислот штаммов V. cholerae в условиях теплового стресса (45°С, 24 ч.) [Fatty acid spectrum of V. cholerae strains under heat stress conditions (45°С, 24 h)]
Для оценки достоверности различий в содержании основных (мажорных) групп ЖК в клетках возбудителя холеры при изменении температуры культивирования были использованы непараметрические критерии Фридмана и Кендалла. Полученные результаты позволяют говорить о статистической значимости различий в содержании следующих доминантных ЖК в исследованных штаммах V. cholerae при пониженной (4°С), стандартной (37°С) и повышенной температурах культивирования (45°С): С16:0 (р = 0.0141), С16:1 (р = 0.012860), С17:0 (р = 0.0275), С18:0 (р = 0.00002), С18:1 (р = 0.00027).
Таким образом, температурный стресс влияет на спектр ЖК штаммов V. сholerae . Можно предположить, что изменения в ЖК составе являются одним из механизмов термической адаптации холерных вибрионов и маркерами температурного стресса.
Заключение
Методом ГХ/МС у штаммов V. cholerae O1, O139, nonO1/nonO139 серогрупп был изучен спектр ЖК в широком диапазоне температур: от 4 до 45°С. Детектированы качественные и количественные изменения в составе ЖК у штаммов холерных вибрионов под влиянием температурного стресса. Выявлены отличия в реакции на холодовой стресс у штаммов, выделенных от больных и из воды поверхностных водоемов. Реакция штаммов, выделенных от больных, на гипотермию заключалась в увеличении содержания ННЖК – С16:1, С18:1, синтезе аnteiso- разветвленных ЖК. Штаммы, выделенные из воды поверхностных водоемов, напротив, реагировали увеличением синтеза НЖК – С14:0, С16:0. Реакция на тепловой стресс у большинства изученных штаммов, независимо от набора детерминант патогенности и источника выделения, имела общую тенденцию: увеличение суммарного количества НЖК, синтез trans-изомеров ННЖК, появление ω-алициклических и iso-разветвленных ЖК. Помимо ремоделирования жирнокислотного состава мембраны, под действием температурного стресса отмечен синтез оксилипинов, фенилпропаноидов, терпеноидов.
Характер и динамика наблюдаемых изменений в спектрах жирных кислот под влиянием термического стресса свидетельствуют о наличии «запаса» экологической пластичности у холерного вибриона, способствующей сохранению возбудителя в разных биоценозах.
Список литературы Влияние температурного стресса на спектр жирных кислот штаммов Vibrio cholerae
- Бахолдина С.И., Соловьева Т.Ф. Экологические аспекты вирулентности бактерий псевдотуберкулеза // Вестник ДВО РАН. 2009. № 3. С. 85-89. URL: https: //cyberleninka.ru/artide/n/ecologicheskie-aspekty-virulentnosti-bacteriy-pseudotuberculeza (дата обращения: 11.09.2020).
- Васюкова Н.И., Озерецковская О.Л. Индуцированная устойчивость растений и салициловая кислота (обзор) // Прикладная биохимия и микробиология. 2007. Т. 43, № 4. С. 405-411. URL: https://elibrary.ru/download/elibrary_9534588_50848214.pdf.
- Васюкова Н.И., Озерецковская О.Л. Жасмонат-зависимая защитная сигнализация в тканях растений. // Физиология растений. 2009. Т. 56, № 5. С. 643-653. URL: http://elibrary.ru /item.asp?id =12900977.
- Колупаев Ю.Е., Ястреб Т.О. Стресс-протекторные эффекты салициловой кислоты и ее структурных аналогов // Физиология и биохимия культ. растений. 2013. Т. 45, № 2. С. 113-126. URL: http://dspace.nbuv.gov.ua/bitstream/handle/123456789/66470/ 03Kolupaev.pdf?sequence= 1.
- Кузьменко Т.Е., Головня Р.В., Вронова Е.А. Исследование состава высших жирных кислот свободных липидов V. cholerae // Биоорганическая химия. 1980. Т. 1, № 6. С. 90-98.
- Осипов Г.А. Хромато-масс-спектрометрический анализ микроорганизмов и их сообществ, в клинических пробах при инфекциях и дисбиозах // Химический анализ в медицинской диагностике. М.: Наука, 2010. С. 293-368.
- Сачивкина Н.П., Подопригора И.В., Марахова А.И. Фарнезол: свойства, роль и перспективы использования при регулировании пленкообразования у грибов рода Candida // Фармация. 2020. Т. 69, № 6. С. 8-12. https://doi.org/10.29296/25419218-2020-06-02.
- Day A.P., Oliver J.D. Changes in membrane fatty acid composition during entry of Vibrio vulnificus into the viable but nonculturable state // J. Microbiol. 2004. Vol. 42, № 2. P. 69-73. PMID: 15357297.
- Diaz-Quiroz D.C. et al. Current perspectives on applications of shikimic and aminoshikimic acids in pharmaceutical chemistry // Research and Reports in Medicinal Chemistry. 2014. № 4. Р. 35-46. DOI: http://doi.org /10.2147/RRMC.S46560
- Eberlein C. et al. Immediate response mechanisms of gram-negative solvent-tolerant bacteria to cope with environmental stress: cis-trans isomerization of unsaturated fatty acids and outer membrane vesicle secretion // Appl. Microbiol. Biotechnol. 2018. Vol. 102. P. 2583-2593. DOI: http: //doi.org/10.1007/ s00253-018-8832-9.
- Heipieper H.J., Hachicho N. Bacterial solvent responses and tolerance: ris-trans isomerization // Hydrocarbon and lipid. Microbiology Protocols. / eds McGenity T., Timmis K., Nogales B. Berlin; Heidelberg: Springer, 2014. DOI: http://doi.org/10.1007/8623_2014_16.
- Heipeiper H.J., Meinhard F., Segura A. The cis-trans isomerase of unsaturated fatty acids in Pseudomonas and Vibrio: biochemistry, molecular biology and physiological function of a unique stress adaptive mechanism // Fems Microbiol. Let. 2003. Vol. 229, № 1. P. 1-7. DOI: http://doi.org /10.1016 /S0378-1097(03) 00792-4.
- Janse J.D. Fatty acid analysis in the identification, taxonomy and ecology of (plant pathogenic) Bacteria // Diagnosis and Identification of Plant Pathogens. Developments in Plant Pathology / eds Dehne H.W., Adam G., Diekmann M., Frahm J., Mauler-Machnik A., van Halteren P. Dordrecht: Springer, 1997. № 11. DOI: https://doi.org/10.1007/978-94-009-0043-1_13.
- Javvadi S.G. et al. The spent culture supernatant of Pseudomonas syringae contains azelaic acid // BMC Microbiol. 2018. Vol. 18. P. 1-11. DOI: http://doi.org/10.1186/s12866-018-1352-z.
- Lambert M.A. et al. Differentiation of Vibrionaceae species by their cellular fatty acid composition // Int. J. Syst. Bacteriol. 1983. Vol. 33, № 4. P. 777-792. DOI: http://doi.org/10.1099/00207713-33-4-777.
- Lee D.et al. Piperonylic acid stimulates keratinocyte growth and survival by activating epidermal growth factor receptor (EGFR) // Sci. Rep. 2018. Vol. 9. P. 8. DOI: http://doi.org /10.1038/s41598-017-18361-3.
- Li J. et al. Temperature- and surfactant-induced membrane modifica tions that alter Listeria monocytogenes nisin sensitivity by different mechanisms // Appl. Environ. Microbiol. 2002. Vol. 68, № 12. P. 5904-5910. DOI: http://doi.org/10.1128/ aem.68.12 5904 -5910. 2002.
- Moldoveanu S.B., David V. Derivatization Methods in GC and GC/MS // Gas Chromatography / ed. Peter Kusch. 2019. 142 p. DOI: 10.5772/intechopen.81954.
- Moravec A.N. et al. Exogenous polyunsaturated fatty acids impact membrane remodeling and affect virulence phenotypes among pathogenic Vibrio species // Appl. Environ. Microbiol. 2017. Vol. 83, № 22. P. 1-16. doi: 10.1128/AEM.01415-17.
- Palmieri F. et al. Chapter two-oxalic acid, a molecule at the crossroads of bacterial-fungal interactions // Advan. Appl. Microbiol. 2019. Vol. 106. P. 49-77. DOI: http://doi.org/10.1016 /bs.aambs.2018.10.001.
- Poger D., Caron B., Mark A.E. Effect of methyl-branched fatty acids on the structure of lipid bilayers // J. Physical. Chem. 2014. Vol. 118, № 48. P. 13838-13848. DOI: http: //doi.org/10.1021 /jp503910r.
- Poger D., Caron B., Mark A.E. Ring to rule them all: the effect of cyclopropane fatty acids on the fluidity of lipid bilayers // J. Physical. Chem. B. 2015. Vol. 119, № 17. P. 5487-5495. DOI: http: //doi.org /10.1021/acs.jpcb.5в00958.
- Poger D., Mark A.E. Effect of ring size in ю-alicyclic fatty acids on the structural and dynamical properties associated with fluidity in lipid bilayers // Langmuir. 2015. Vol. 31, № 42. P. 11574-11582. DOI: http://doi.org/10.1021/acs.langmuir.5b02635.
- Rowe H.M., Hantley J.F. From the outside - in: The Francisella tularensis envelope and virulence // Front Cell Infect. Microbiol. 2015. № 5. P. 94. DOI: http://doi.org/10.3389/fcimb.2015.00094.
- Seydlova G. et al. The extent of the temperature-induced membrane remodeling in two closely related Bordetella species reflects their adaptation to diverse environmental niches // J. Biol. Chem. 2017. Vol. 292, № 19. P. 8048-8058. DOI: http://doi.org /10.1074/jbc.M117.781559.
- Shalk M. et al. Piperonylic acid, a selective, mechanism-based inactivator of the trans-cinnamate 4-hydroxylase: a new tool to control the flux of metabolites in the phenylpropanoid pathway // Plant Physiol. 1998. Vol. 118. P. 209-218. DOI: http://doi.org /10.1104/ pp.118.1.209.
- Sherlock. Microbial Identification System. V 6.2. MIS Operating Manual. Newark: Sandy Dr, 2012.
- Siliakus M.F., Oost J., Kengen S.W.M. Adaptations of archeal and bacterial membranes to variations in temperture, pH and pressure // Extremophiles. 2017. Vol. 21. P. 651-670. DOI: http://doi.org /10.1007/s00792-017-0939-x.
- Smith D.S. et al. Polyunsaturated fatty acids cause physiological and behavioral changes in Vibrio algino-lyticus and Vibrio fischeri // Microbiologyopen. 2021. Vol. 10, № 5. P. 1-16. doi: 10.1002/mbo3.1237.
- Urdaci M.C., Marchand M., Grimont P.A. Characterization of 22 Vibrio species by gas chromatography analysis of their cellular fatty acids // Res. Microbiol. 1990. Vol. 141, № 4. P. 437-452. DOI: http://doi.org/10.1016/0923-2508(90)90070-7
- Vigh L., Landry J., Nakamoto H. Membrane regulation of the stress response from prokaryotic models to mammalian cells // Ann. NY Acad. Sci. 2007. Vol. 1113, № 1. P. 40-51. DOI: http://doi.org /10.1196/annals.1391.027.
- Wang L., Wu J. The essential role of jasmonic acid in plant herbivore interactions using the wild tobacco Nicotiana attenuate as a model // J. Gen. Genomics. 2013. Vol. 40. P. 597-606. DOI: http://doi.org /10.1016 /j.jgg.2013.10.001.
- Watson H. Biological membranes // Essays Biochem. 2015. Vol. 59. P. 43-69. DOI: http://doi.org/10.1042/bse0590043.
- Yoon J-H, Lee S-Y. Characteristics of viable-but-nonculturable Vibrio parahaemolyticus induced by nutrient-deficiency at cold temperature // Crit. Rev. Food Sci. Nutr. 2020. Vol. 60, № 8. P. 1302-1320. DOI: 10.1080/ 10408398.2019.1570076.


