Влияние температуры и рН на фазообразование в системе FeSO 4-H 2O-NaOH-H 2O 2
Автор: Клещева Регина Раисовна, Жеребцов Дмитрий Анатольевич, Мирасов Вадим Шафикович, Клещев Дмитрий Георгиевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 (260), 2012 года.
Бесплатный доступ
Исследованы закономерности фазообразования при окислении в квазистационарных условиях (рН = const) водных растворов FeSO 4 и (или) суспензий Fe(OH) 2 пероксидом водорода с использованием в качестве щелочного агента гидроксида натрия. Уточнены области рН и температуры преимущественного формирования фаз «ферригидрит», Fe 3O 4, α-, γ- и δ-FeOOH. Анализируется вопрос о влиянии температуры и величины рН на фазовый и дисперсный составы формирующегося осадка.
Окисление, пероксид водорода, фазообразование
Короткий адрес: https://sciup.org/147160212
IDR: 147160212 | УДК: 544.41
Текст научной статьи Влияние температуры и рН на фазообразование в системе FeSO 4-H 2O-NaOH-H 2O 2
При окислении водных растворов солей железа (II) и (или) суспензий гидроксида железа (II) (система Fe(II)R „ -Н 2 О-МеОН-О 2 (О); R=Cl-, (NO 3 ) - , (SO 4 )2 - ; Me=Li + , Na + , K+, (NH 4 )+; 1,5 < рН < 14) формируются нанодисперсные труднорастворимые соединения железа [1 - 4], нашедшие широкое применение в науке и технике в качестве ионообменных и магнитных материалов, катализаторов химических реакций, неорганических пигментов и др. Фазовый, химический и дисперсный состав образующегося осадка зависит от многочисленных параметров синтеза: температуры и pH реакционной среды [2 - 11], концентрации ионов железа (II) в растворе или Fe(OH) 2 в суспензии [2, 8, 9], природы аниона соли и катиона щелочного агента [2, 4, 11], скорости подачи окислителя и его активности [6 - 8] и т. д.
Отметим противоречивость данных [2, 5 - 7] о том, какие из этих факторов оказывают определяющее влияние на фазовый и дисперсный составы формирующегося продукта, что обусловлено с одной стороны большим различием в значениях параметров, при которых проводились эксперименты, а с другой - существенным отклонением режимов окисления от стационарных условий. Целью данной работы являлось уточнение закономерностей фазо- и кристаллообразования при окислении водных растворов FeSO 4 и (или) суспензий Fe(OH) 2 при квазипостоянных значениях температуры и рН реакционной среды с использованием в качестве щелочного и окисляющего агентов NaOH и Н2О2, соответственно (система FeSO4–H2O–NaOH–H2O2).
Экспериментальная часть
Исходными реагентами служили водные растворы сульфата железа (II) (раствор предварительно восстанавливали железным порошком), гидроксида натрия и пероксида водорода с концентрациями 1,0; 4,8 и 1,2 моль/л, соответственно. Все реактивы имели квалификацию «х.ч.». Окисление растворов сульфата железа (II) и (или) суспензий гидроксида железа (II) проводили в цилиндрическом реакторе объемом 1 дм3, снабженном перемешивающим устройством, системами электронагрева и термостатирования ( ± 2 °С), дозирования в непрерывном режиме растворов NaOH и H 2 O 2 и измерения рН среды.
В реактор заливали расчетное количество раствора FeSO 4 , нагревали до заданной температуры и подачей раствора NaOH достигали необходимого значения рН реакционной среды1 (pH=4,0; 5,5; 7,0; 8,5; 9,0; 10,5; 13,0). После этого в реактор начинали с постоянной скоростью дозировать раствор H 2 O 2 , а в интервале 4,0 ≤ рН ≤ 9,0 для поддержания квазипостоянного значения рН
( ± 0,25 ед.) и раствор NaOH. В некоторых опытах, проведенных при рН > 5,5, делали отборы исходной (гидроксид железа (II)) и промежуточных суспензий, из которых фильтрацией выделяли твердую фазу. Средняя скорость окисления ионов железа (II) составляла (12,5 ± 0,5) ммоль/л ⋅ мин, суммарная концентрация Fe(II) и Fe(III) в окисленной суспензии – (0,50 ± 0,02) моль/л; температуру и величину рН реакционной среды варьировали от 20 °С до 85 °С и от 4,0 до 13,0 единиц, соответственно. По окончании процесса окисления осадок отделяли на воронке Бюхнера от маточного раствора, отмывали водой до отсутствия в фильтрате сульфат-ионов, высушивали до постоянной массы при 50 °С и измельчали.
Фазовый и дисперсный состав образцов контролировали методами рентгенофазового анали-за2 (РФА; рентгеновский аппарат ДРОН–4М, фильтрованное Сu K α – излучение) и трансмиссионной электронной микроскопии (ТЭМ; электронный микроскоп УЭВМ-100К), химический состав – методами объемного химического анализа и термогравиметрии (прибор синхронного термического анализа Netzsch 449C “Jupiter”. Средний размер кристаллов d образующегося осадка рассчитывали по формуле Селякова–Шерера [12], исходя из физического уширения дифракционных максимумов Δ 2 Θ .
Результаты исследования и обсуждение
Выпадение осадка гидроксида железа (II) визуально фиксировалось при рН ≥ 5,5, что согласуется с результатами [13]. С ростом величины рН от 5,5 до 9,0 в суспензии увеличивалась массовая доля Fe(OH) 2 , а ее цвет изменялся от светло-голубого до темно-синего. По данным РФА и ТЭМ, исходные образцы Fe(OH) 2 были рентгеноаморфны и представляли собой плотные агрегаты размером до 5 мкм (рис. 1, а).

а)
б)

в) г)
Рис. 1. Микрофотографии образцов Fe(OH) 2 (7,5; 85) (а), «зеленой ржавчины II» (7,5; 85) (б), а также конечных продуктов окисления α -FeOOH (7,5; 50) (в) и Fe 3 O 4 (9,0; 50) (г). В скобках указаны условия получения образцов (рН; t, °C)
При окислении сразу же после начала подачи Н 2 О 2 наблюдалось образование осадка (рН = 4,0), либо изменение цвета суспензии Fe(OH) 2 (рН ≥ 5,5). Следует отметить характерный темно-зеленый цвет промежуточных отборов суспензий, полученных в интервале значений рН от 5,5 до 8,5.
Клещева Р.Р., Жеребцов Д.А., Влияние температуры и рН на фазообразование Мирасов В.Ш., Клещев Д.Г. в системе FeSO 4 –H 2 O–NaOH–H 2 O 2
По данным РФА и ТЭМ в данном интервале рН, соответствующем частичному осаждению железа (II) из раствора FeSO 4 , в процессе окисления формируется промежуточное соединение c пластинчатой формой кристаллов (рис. 1, б), которое из сопоставления полученных рентгенографических данных с [2, 14, 15], можно идентифицировать как «зеленая ржавчина II», представляющее собой сульфат-окси-гидроксид железа (II, III).
Из данных РФА конечных продуктов окисления можно сделать вывод о том, что в данной системе в зависимости от температуры и величины рН могут образовываться (в индивидуальном виде, или смеси фаз) достаточно хорошо кристаллизованные оксигидроксиды железа (III) α -, γ - и δ -модификаций, оксид железа (II, III) состава Fe 3 O 4 , а также практически рентгеноаморфная фаза (на рентгенограммах присутствует один, а в лучшем случае, три сильно уширенных рефлекса с межплоскостными расстояниями 0,253; 0,223; 0,1475 нм), которую по данным [2] можно идентифицировать как «ферригидрит», характеризующийся, согласно [16], эмпирическим составом Fe 2 O 3 ⋅ 0,42SO 3 ⋅ 2H 2 O. Зависимость фазового состава осадка от параметров окисления представлена на рис. 2, на котором в координатах температура - рН отражены области преимущественного формирования вышеуказанных фаз. Полученные нами данные во многом близки с опубликованными в [5], однако, отличаются от них наличием областей формирования фаз δ -FeOOH и «ферри-гидрит». По-видимому, это объясняется тем, что в наших опытах за счет применения пероксида водорода достигались более высокие средние скорости окисления растворов (суспензий) железа (II), чем в [5], где в качестве окислителя использовался кислород воздуха.
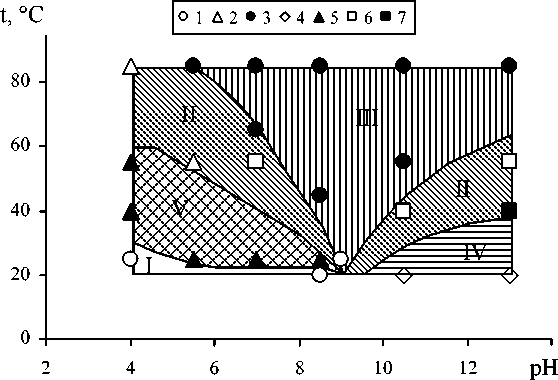
Рис. 2. Зависимость фазового состава осадка, образующегося в системе FeSO 4 –H 2 O–NaOH–H 2 O 2 , от температуры t и величины pH реакционной среды: 1 – «ферригидрит», 2 – α -FeOOH, 3 – Fe 3 O 4 , 4 – δ -FeOOH, 5 – α - + γ -FeOOH, 6 – α -FeOOH+Fe 3 O 4 , 7 – α - + δ -FeOOH. I–V – области формирования фаз «ферригидрит», α -FeOOH, Fe 3 O 4 , δ - и γ -FeOOH соответственно
Из рис. 2 следует, что фаза α -FeOOH образуется во всем исследованном интервале рН; Fe 3 O 4 – при рН ≥ 5,5; «ферригидрит» - при рН < 9,0; δ -FeOOH - при рН > 9,0; фаза γ -FeOOH - в интервале рН от 4,0 до 9,0. С ростом температуры наблюдается следующие закономерные изменения фазового состава осадка:
4,0 < рН <5,5 - «ферригидрит» → γ -FeOOH → α -FeOOH;
5,5 < рН <9,0 - «ферригидрит» → γ -FeOOH → α -FeOOH → Fe 3 O 4 ;
9,0 < рН <13 - δ -FeOOH → α -FeOOH → Fe 3 O 4 .
По данным ТЭМ для каждой из вышеуказанных фаз присуща определенная морфология кристаллов, средний размер которых зависит от параметров проведения процесса окисления. В частности, образцы «ферригидрита» имеют ярко выраженную глобулярную структуру с размером глобул 2–3 нм, которые связаны друг с другом в плотные агрегаты размером до 5 мкм. Фазы Fe 3 O 4 (рис. 1, г) и δ -FeOOH имеют изометричную (близкую к сферической) форму кристаллов. Для кристаллов α - и γ -FeOOH характерны соответственно игольчатая (рис. 1, в) и пластинчатая
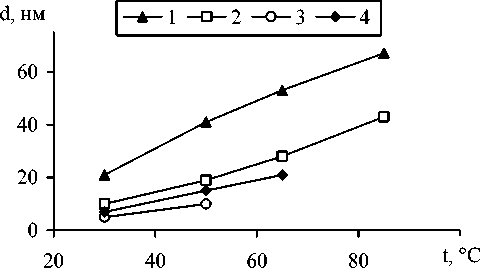
Рис. 3. Зависимость среднего размера кристаллов d , образующихся в системе FeSO 4 –H 2 O–NaOH–H 2 O 2 при фиксированной величине pH реакционной среды от температуры t : 1 – Fe 3 O 4 (pH = 9,0), 2 - α -FeOOH (pH = 5,5), 3 – γ -FeOOH (pH=5,5), 4 – δ -FeOOH (pH=5,5)
ростовые формы. На дифрактограммах образцов, полученных при фиксированной величине рН, с ростом температуры наблюдалось уменьшение полуширины Δ 2 Θ рефлексов соответствующих фаз, свидетельствующее об увеличении среднего размера d их кристаллов (рис. 3), что подтверждается и результатами ТЭМ-исследований.
Обнаруженные зависимости фазового состава и среднего размера кристаллов осадка, формирующегося в системе FeSO4–H2O– NaOH–H2O2, от параметров процесса окисления согласуется с результатами исследований [2, 4, 5, 8, 11] и свидетельствуют о том, что рост кристаллов при окислении водных растворов солей железа (II) и (или) суспензий гидроксида железа (II) протекает в условиях высоких пересыщений. Следствием этого является малый размер кристаллов, их высокая дефектность, образование фаз с неупорядоченной кристаллической структурой: δ-FeOOH и «ферригидрита».
Из сопоставления зависимости фазового состава формирующегося осадка от величины рН реакционной среды (горизонтальные сечения на рис. 2) с литературными данными о состоянии ионов железа (II) и железа (III) в растворе [13, 17] следует, что экспериментально установленные границы диапазонов рН не случайны и связаны с изменением степени гидролиза, а, следовательно, и реакционной способности гидроксоаквакомплексов железа (II, III). Действительно, по данным [13, 17], ионы железа (II) в водных растворах в зависимости от величины рН присутствуют в виде гидроксоаквакомплексов (ГАК) общего состава {[Fe(OH)
n
]
aq
}
2–
n
, причем ГАК с
n
=0 образуется в интервале 1,5
Вышеуказанные зависимости концентрации ГАК от величины рН позволяют объяснить наблюдающийся эффект резкого снижения температуры образования фазы Fe 3 O 4 вблизи рН = 9,0. В этом случае ионы железа (II) в растворе преимущественно присутствуют в виде гидроксо-аквакомплексов {[Fe(OH) 2 ] aq }0, при окислении которых, как показано в [4, 6], могут образовываться биядерные кристаллообразующие комплексы (КОК){Fe(III) 2 (OH) 6– 4H 2 O}0(КОК-1) и {Fe(II)Fe(III)(OH) 5– 6H 2 O}0(КОК-2). При поликонденсации КОК-1 и КОК-2 в соотношении 1 : 2 формируется структурный мотив кристаллической решетки фазы Fe 3 O 4 [6].
Поскольку образование тех или иных форм ГАК железа (III) определяется полнотой (величиной n ) протекания реакции гидролиза:
[Fe3+]aq + n H2O → {[Fe(OH)n]aq}3–n + n H+, а величина n симбатно изменяется с ростом температуры и рН [17], то при низких значениях температур и (или) рН реакционной среды следует ожидать присутствия в растворе наряду с электронейтральными {[Fe(OH)3]aq}0 и положительно заряженных гидроксоаквакомплексов железа (III) составов {[Fe(OH)]aq}2+ или {[Fe(OH)2]aq}+. Переход этих комплексов из раствора в конденсированное состояние в силу электронейтральности образующихся кристаллов должен сопровождаться одновременным встраиванием в кристаллическую решетку и анионов раствора (сульфат-ионов), что и предопределяет формирование сульфат-оксигидроксида железа (III) – «ферри-гидрита».
Выводы
Уточнены зависимости фазового состава и размера кристаллов осадка, формирующегося в системе FeSO 4 –H 2 O–NaOH–H 2 O 2 от температуры и величины рН реакционной среды. Выявлены области значений параметров, при которых преимущественно образуются фазы «ферригидрит», Fe 3 O 4 , α -, γ - и δ -FeOOH. Установлена взаимосвязь между химическим составом формирующегося осадка и состоянием ионов железа (II, III) в растворе.
Список литературы Влияние температуры и рН на фазообразование в системе FeSO 4-H 2O-NaOH-H 2O 2
- Реми, Г. Неорганическая химия/Г. Реми. -М.: Мир, 1974. -Т. 2. -775 с.
- Гипергенные окислы железа/под ред. Н.В. Петровской. -М.: Наука, 1975. -206 с.
- Domingo, C. Morphological Properties of α-FeOOH, γ-FeOOH and Fe3O4 Obtained by Oxidation of Aqueous Fe (II) Solutions/C. Domingo, R. Rodriguez-Chemente, M. Bleza//J. Colloid and Interface Sci. -1994. -Vol. 165, № 1. -P. 244-252.
- Клещев, Д.Г. Влияние среды на фазовые и химические превращения в дисперсных системах/Д.Г. Клещев, А.И. Шейнкман, Р.Н. Плетнев. -Свердловск: УрО АН СССР, 1990. -248 с.
- Kijama, M. Conditions for the formation of Fe3O4 by the air oxidation of Fe(OH)2 suspensions/M. Kijama//Bull. Chem. Soc. Japan. -1974. -Vol. 47, № 7. -P. 1646.
- Закономерности фазообразования в системе Fe(OH)2-H2O-O2/Н.Г. Краснобай, Ю.Г. Распопов, Д.Г. Клещев и др.//Журн. неорган. химии. -1986. -Т. 31, № 9. -С. 2215.
- Feitknecht, W. Uber die Oxidation von festen Hydroxyverbindungen des Eisens in wabrigen Lossungen/W. Feitknecht//Zs. Electrochem. -1959. -Bd. 63, № 1. -S. 64.
- Влияние параметров синтеза на фазообразование в системе FeSO4-H2O-H+/OH-O2 (3,5≤pH ≤13,0)/Р.Р. Клещева, А.В. Толчев, Д.Г. Клещев и др.//Журн. прикл. химии. -2003. -Т. 76, № 9. -С. 1419-1423.
- Datta, N.C. Chemistry of iron (III) oxides and oxihydroxides/N.C. Datta//J. Sci. Industr. Res. -1981. -Vol. 40, № 9. -P. 571.
- Detourney, V. Etude de l’oxydation par aeration de Fe(OH)2 en milieu chlorure/V. Detourney, R. Derie, M. Chodsi//Zs. anorg. allgem. Chem. -1976. -Bd. 427, № 3-4. -S. 265.
- Kijama, M. Iron compounds formed by the aerial oxidation of of ferrous salt solutions/M. Kijama, T. Takada//Bull. Chem. Soc. Japan. -1972. -Vol. 45, № 10. -P. 1923.
- Кристаллография, рентгенография и электронная микроскопия/Я.С. Уманский, Ю.А. Скаков, А.Н. Иванов, Л.Н. Расторгуев. -М.: Металлургия, 1982. -632 с.
- Инцкирвели, Л.Н. Изучение гидролиза железа (II) методом ионного обмена/Л.Н. Инцкирвели, И.В. Колосов, Г.М. Варшал//Журн. неорган. химии. -1975. -Т. 20, № 9. -С. 2388.
- Misawa, T. The mechanism of formation of iron oxides and oxyhydroxides in aqueous solutions at room temperatures/T. Misawa, K. Hashimoto, S. Shimodaria//Corrosion Sci. -1974. -Vol. 4, № 2. -P. 131.
- Bernal, J.D. The oxides and hydroxides of iron and their structural interrelationships/J.D. Bernal, D.R. Dasgupta, A.S. Mackay//Clay Miner. Bull. -1959. -Vol. 4, № 21. -P. 15.
- Temperature and pH effect on composition of a precipitate formed in FeSO4-H2O-H+/OH-H2O2 system/A.V. Tolchev, R.R. Bagautdinova, D.G. Kleschev, V.Yu. Pervushin//Materials Chem. Phys. -2002. -Vol. 74, № 1. -P. 336-339.
- Назаренко, В.А. Гидролиз ионов металлов в разбавленных растворах/В.А. Назаренко, В.П. Антонович, Е.М. Невская. -М.: Атомиздат, 1979. -192 с.
- Багаутдинова, Р.Р. Физико-химические процессы в неорганических системах: сб. науч. тр./Р.Р. Багаутдинова, Д.Г. Клещев, А.Л. Ивановский. -Екатеринбург: УрО РАН, 1996. -С. 35.


