Влияние трансфизарного интрамедуллярного стержня на формирование дистракционного регенерата голени и ее последующий рост у ягнят
Автор: Кононович Н.А., Леончук С.С., Горбач Е.С., Горбач Е.Н., Попков Д.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.30, 2024 года.
Бесплатный доступ
Введение. При удлинении конечностей у детей сочетание эластичного интрамедуллярного армирования и внешней фиксации имеет преимущества перед стандартными методиками, но требует удаления эластичных стержней и не предусматривает возможности блокирования, что могло бы существенно сократить период фиксации наружными конструкциями.Цель работы - определить особенности формирования дистракционного регенерата большеберцовой кости и резидуального роста удлиненного сегмента у ягнят в условиях внешнего остеосинтеза с использованием трансфизарного ригидного титанового стержня.Материалы и методы. Выполнили эксперименты in vivo на ягнятах (n = 7) в периоде роста. В контрольной группе удлиняли правую большеберцовую кость методом чрескостного дистракционного остеосинтеза 28 сут. В основной группе сегмент дополнительно армировали интрамедуллярным ригидным стержнем. На рентгенограммах измеряли высоту диастаза между отломками, поперечные размеры дистракционного регенерата, высоту костных отделов регенерата и зоны роста, длину большеберцовых костей; рентгенанатомические углы проксимального суставного конца большеберцовой кости. Для определения собственной динамики роста оперированного сегмента из значений длины большеберцовой кости вычитали величину дистракционного регенерата.Результаты. В основной группе поперечные размеры дистракционного регенерата были больше, а высота зоны роста - меньше, чем в контрольной группе. Консолидация регенерата в основной группе происходила через 30 сут., а в контрольной - через 60 сут. после прекращения удлинения. Не отмечено замедления продольного роста удлиненного сегмента в сравнении с контралатеральным, не изменялись углы ориентации наклона проксимальных суставных поверхностей.Обсуждение. Трансфизарные имплантаты для снижения риска эпифизиодезов должны располагаться центрально, их площадь не должна превышать 7 % ростковой зоны. Эти условия соблюдены в выполненном исследовании. Сокращение сроков кортикализации дистракционного регенерата и раннего прекращения наружной фиксации связано с выраженным периостальным остеогенезом и повышенной стабильностью положения костных фрагментов. Расположение стержня в пластинке роста не приводит к эпифизеодезу и не препятствует нормальному росту сегмента.Заключение. Выраженный периостальный остеогенез и дополнительная стабилизация положения костных фрагментов при использовании трансфизарного ригидного титанового стержня способствуют быстрейшему формированию и созреванию костного регенерата. Отсутствуют признаки угнетения спонтанного роста удлиняемого сегмента и формирования рентгеновских признаков эпифизиодеза на уровне расположения трансфизарной конструкции. Центральное расположение трансфизарного стержня относительно плоскости ростковой зоны и его площади сечения менее 5 % площади физиса можно считать условиями, при которых эпифизиодез не развивается.
Ростковый хрящ, интрамедуллярный стержень, удлинение конечности
Короткий адрес: https://sciup.org/142243869
IDR: 142243869 | УДК: 616.718.5/.6-001.5-089.227.84]-003.93-092.9 | DOI: 10.18019/1028-4427-2024-30-6-863-872
Текст научной статьи Влияние трансфизарного интрамедуллярного стержня на формирование дистракционного регенерата голени и ее последующий рост у ягнят
Удлинение конечностей у детей рекомендовано начинать в раннем детском возрасте, что обусловлено значительной величиной укорочения и сопутствующих деформаций и настоятельным требованием родителей [1, 2]. Удлинение классическими методиками требует длительного периода внешней фиксации, что сопряжено как с повышенным риском осложнений, так и с психологической нагрузкой на пациента и его семью [3, 4]. Применение полностью имплантируемых удлиняющих интрамедуллярных конструкций у детей невозможно вследствие малого диаметра кости и открытых зон роста [5]. Использование эластичного интрамедуллярного армирования показало свои преимущества: сокращение времени ношения аппарата внешней фиксации (АВФ), снижение частоты осложнений, возможности применения методики при малых диаметрах костномозгового канала [6, 7]. Однако применение этого способа подразумевает дополнительную операцию по удалению эластичных стержней [8]. Кроме того, эластичные титановые стержни не обеспечивают возможности выполнения блокируемого остеосинтеза, что теоретически позволило бы ускорить снятие АВФ. Наши недавние экспериментальные исследования показали, что трансфизарный титановый ригидный стержень с резьбовыми частями, введенными в эпифизы, и гладкой частью на уровне зон роста метафизарных и диафизарных отделов большеберцовой кости в условиях эксперимента не ведет к замедлению роста оперированного сегмента [9].
Цель работы — определить особенности формирования дистракционного регенерата большеберцовой кости и резидуального роста удлиненного сегмента у ягнят в условиях внешнего остеосинтеза с использованием трансфизарного ригидного титанового стержня.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Выполнено проспективное, рандомизированное, контролируемое моноцентровое экспериментальное исследование in vivo на ягнятах в периоде роста, разделенных на две группы: контрольную ( n = 3) и основную ( n = 5). Всем животным осуществляли удлинение правой большеберцовой кости методом чрескостного дистракционного остеосинтеза с темпом 1,0 мм/сут. за 4 перемещения в течение 28 сут. В основной группе дополнительно выполняли армирование сегмента интрамедуллярным ригидным стержнем. Преддистракционный период составлял 7 сут.
Критерии соответствия
В эксперименте использовали клинически здоровых овец обоего пола, у которых диаметр костномозгового канала большеберцовой кости был не менее 5 мм, а биологический возраст варьировал в диапазоне 4,5–5 мес. (критерии включения). Критериями исключения были: гибель животных или патологические состояния, не связанные с условиями эксперимента.
Периоды исследования
Перед началом эксперимента определены контрольные этапы исследования: непосредственно перед оперативным вмешательством; окончание периода удлинения; 30 сут. фиксации после прекращения периода удлинения; окончание фиксации АВФ; 30 сут. после прекращения аппаратной фиксации.
Описание оперативного вмешательства
Все оперативные вмешательства выполняли в условиях операционной одной хирургической бригадой. Животным контрольной группы на правую голень монтировали аппарат Илизарова, состоящий из четырех опор, образующих две подсистемы, — проксимальную и дистальную (рис. 1, а). Подсистемы соединяли между собой резьбовыми стержнями с возможностью последующего продольного перемещения. Через продольный разрез мягких тканей выполняли поперечную остеотомию диафиза большеберцовой кости при помощи пилы Джигли. После этого на мягкие ткани накладывали узловые швы.
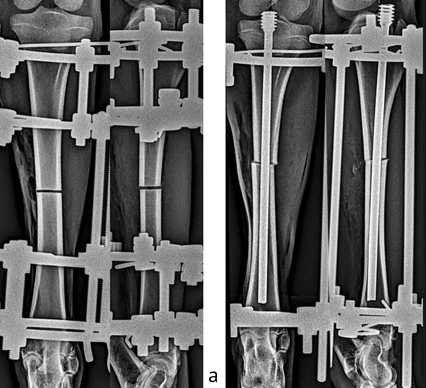
Рис. 1. Рентгенограммы голени, выполненные в день оперативного вмешательства: а — пример из контрольной группы; б — пример из опытной группы
У животных основной группы использовали две опоры, — проксимальную и дистальную. Перед выполнением остеотомии осуществляли армирование большеберцовой кости интрамедуллярным ригидным титановым стержнем (сплав Ti6AI4V) (рис. 1, б). Диаметр стержня (4,5 мм или 5,0 мм) зависел от диаметра костномозгового канала. Стер- жень подбирали так, чтобы диаметр канала в самой узкой части превышал диаметр стержня на 2–3 мм. Костномозговой канал не рассверливали. Длину стержня определяли для каждого животного индивидуально. Стержень устанавливали через парапателлярный доступ. В межмыщелковом пространстве большеберцовой кости канюлированным сверлом по спице-направителю на медленных оборотах рассверливали канал в проксимальном эпифизе, проходя до костномозгового канала. Через сформированный канал вводили ригидный стержень, вкручивая при этом его резьбовую часть под рентгеновским контролем. Высота резьбовой части не превышала высоты эпифиза и не заходила в зону росткового хряща. Диаметр резьбовой части соответствовал 11 мм. Через продольный разрез мягких тканей выполняли поперечную остеотомию диафиза большеберцовой кости при помощи пилы Джигли с последующим послойным ушиванием раны.
Всем животным ежедневно в течение 5 дней после выполнения оперативного вмешательства назначали инъекции кетопрофена (50 мг/мл) для внутримышечного введения по 0,5 мл в сут. Кожу вокруг спиц и швы обрабатывали 3 % раствором перекиси водорода.
Всем животным осуществляли рентгенографию опытного и контралатерального сегмента с помощью рентгеновской системы Premium VET (TOSHIBA (Rotanode) Model E7239. N: 10G749, Япония) и системы цифровой рентгенографии c плоскопанельным детектором CANON CXDI-401C COMPACT (Canon Inc. Medical Equipment Group, Япония).
Животных содержали в условиях вивария в соответствии с требованиями ГОСТ Р 33044-2014 «Принципы надлежащей лабораторной практики», ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», ГОСТ 34088-2017 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за сельскохозяйственными животными». При выполнении экспериментов соблюдали требования Европейской конвенции по защите позвоночных животных, используемых для экспериментов и других научных целей, и Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях.
Основной исход исследования
Для определения особенностей формирования дистракционного костного регенерата на рентгенограммах отмечали структуру его теней, его форму, зональность строения, наличие и выраженность срединной зоны просветления (зоны роста).
Для количественной оценки на цифровых рентгеновских изображениях измеряли: высоту диастаза между костными отломками (см), поперечные размеры дистракционного костного регенерата, высоту его костных отделов и высоту зоны роста (см).
Дополнительно изучали особенности роста сегмента в созданных условиях и формирование проксимального суставного конца. Для этого измеряли: длину большеберцовых костей в боковой проекции (см), механический медиальный проксимальный угол большеберцовой кости ( англ .: mecanical medial proximal tibial angle, mMPTA), механический задний проксимальный большеберцовый угол ( англ .: mechanical posteroir proximal tibial angle, mPPTA). Собственную динамику роста оперированного сегмента рассчитывали вычитанием величины дистракционного регенерата из длины большеберцовой кости.
Статистический анализ проводили с использованием надстройки AtteStat версии 13.1 к электронным таблицам Excel (2016, 16.0.5278.1000). Использовали методы описательной статистики: средние значения (М) и стандартное отклонение (SD). Сравнительные исследования производили с применением критерия Манна – Уитни. Различия показателей считали статистически значимыми при р ≤ 0,05.
РЕЗУЛЬТАТЫ
Полностью полноценно период дистракции, фиксации и период после снятия АВФ протекал у семи животных. В одном случае основной группы произошла преждевременная костная консолидация на второй неделе дистракции, что заставило нас исключить этот случай из анализа.
Во всех случаях результаты остеометрии большеберцовых костей ягнят перед началом эксперимента не выявили достоверной разницы ( р = 0,7) между длиной опытного и интактного сегментов. В контрольной группе эти показатели составляли (20,07 ± 0,3) см и (20,03 ± 0,31) см, а в основной группе (19,81 ± 1,05) см и (19,83 ± 1,05) см соответственно.
При оценке рентгенологических особенностей дистракционного регенерата определили, что у животных контрольной группы к окончанию периода удлинения контуры концов отломков были ровные, четкие. Диастаз между костными отломками составлял в среднем (3,1 ± 0,1) см, (12,3 ± 1,8) %. В его полости определялись тени дистракционного костного регенерата продольно-исчерченной структуры и зонального строения. Как правило, высота проксимального костного отдела регенерата
((1,74 ± 0,29) см) была больше высоты дистального костного отдела ((0,9 ± 0,21) см) более чем на 90 %. Протяженность срединной зоны просветления варьировала от 0,41 см до 1,68 см, в среднем — (0,85 ± 0,35) см. Эти значения составляли 27,42 % от высоты диастаза. Зону роста на отдельных участках перекрывали тени костных трабекул. Поперечные размеры регенерата превышали диаметр концов отломков более чем на 35 %. Их значения были в диапазоне от 1,61 см до 2,36 см и составляли в среднем (1,87 ± 0,27) см (диаметр материнской кости — (1,36 ± 0,1) см).
К 30 суткам фиксации у животных этой группы контуры концов отломков становились менее четкими в сравнении с предыдущим периодом обследования. Тени костного регенерата приобретали гомогенную структуру. Его костные отделы (проксимальный и дистальный) на отдельных участках объединялись между собой. Диаметр регенерата в проекции зоны роста составлял (1,99 ± 0,4) см. Зона роста была представлена отдельными участками просветления либо была в виде зигзагообразной линии. Ее высота резко уменьшалась по отношению к предыдущему этапу и составляла в среднем (0,25 ± 0,14) см.
В созданных условиях формирование опороспособного костного регенерата происходило к 60 сут. фиксации после прекращения периода удлинения. На данном этапе контуры концов отломков становились еще менее четкими. Зональное строение новообразованного костного дистракционного регенерата полностью утрачивалась. Его представляли непрерывные гомогенные тени. Зона роста выявлялась чаще в проекции периферической части регенерата в виде единичных участков просветления с одной или двух сторон. Была сформирована тонкая непрерывная корковая пластинка.
В этот период при выполнении клинической пробы патологической подвижности и болезненности в области удлинения не выявляли, что позволяло прекратить фиксацию аппаратом Илизарова.
Через 30 сут. после прекращения фиксации аппаратом Илизарова контуры концов отломков были размыты. Новообразованный участок диафиза был представлен однородными тенями. Его высота не изменялась в сравнении с величиной, достигнутой в периоде окончания удлинения, а поперечные размеры в среднем составляли (1,83 ± 0,16) см. Определялись признаки формирования костномозгового канала.
Рентгенологическая динамика формирования дистракционного костного регенерата у животных контрольной группы представлена на рис. 2.
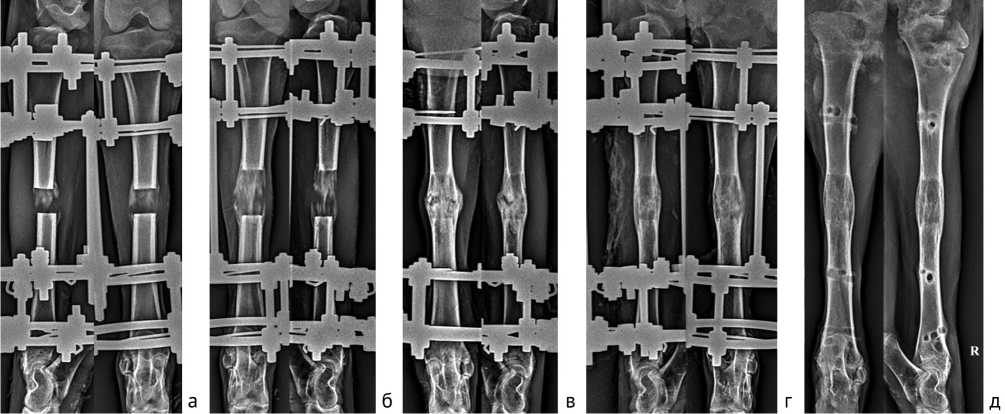
Рис. 2. Рентгенограммы голени в процессе удлинения классической методикой, контрольная группа: а — 14 дн. дистракции; б — 28 дн. дистракции (окончание удлинения); в — 30 дн. периода фиксации; г — 60 дн. периода фиксации, костное сращение, день снятия аппарата; д — 30 дн. после демонтажа аппарата внешней фиксации
При оценке рентгенологических особенностей дистракционного регенерата определили, что у животных основной группы диастаз между костными отломками в момент окончания дистракции составлял в среднем (2,75 ± 0,14) см, (12,1 ± 1,5) %. В полости диастаза определяли тени костного дистракционного регенерата зонального строения. Поперечные размеры регенерата были в среднем (2,32 ± 0,38) см и превышали диаметр материнской кости на 51,6 %. Высота проксимального костного отдела регенерата варьировала от 0,75 до 2,75 см и в среднем составляла (1,56 ± 0,69) см. Протяженность дистального отдела, также как в контрольной группе, была меньше. Ее значения соответствовали (0,94 ± 0,97) см (от 0,44 см до 1,26 см). Зону роста высотой (0,54 ± 0,22) см чаще определяли по периферии. Ее, как правило, перекрывали тени костных трабекул продольно-исчерченной структуры, более сильно выраженные, чем в группе контроля.
Через 30 сут. фиксации после прекращения периода удлинения на рентгенограммах контуры концов отломков слабо определялись. Дистракционный костный регенерат утрачивал зональное строение. Его поперечные размеры составляли в среднем (2,38 ± 0,42) см. Тени костных отделов регенерата были однородной продольно исчерченной структуры и объединялись между собой. Зона роста была представлена единичными маленькими участками просветления, в среднем (0,43 ± 0,2) см. По периферии начинала формироваться тонкая корковая пластинка.
У животных этой группы в данный период на основании результатов выполненной клинической пробы и рентгенологической картины прекращали фиксацию аппаратом Илизарова.
Через 30 сут. после демонтажа АВФ ось удлиненного сегмента на рентгенограммах была правильная. Контуры концов отломков не определялись. Тени новообразованного дистракционного костного регенерата частично компактизировались в сравнении с предыдущим этапом обследования. Его поперечные размеры незначительно уменьшались и составляли (2,14 ± 0,14) см. Со всех сторон была сформирована непрерывная корковая пластинка. Вдоль поверхности стержня был сформирован единый непрерывный костномозговой канал.
Рентгенологическая динамика формирования дистракционного костного регенерата у животных основной группы представлена на рис. 3.
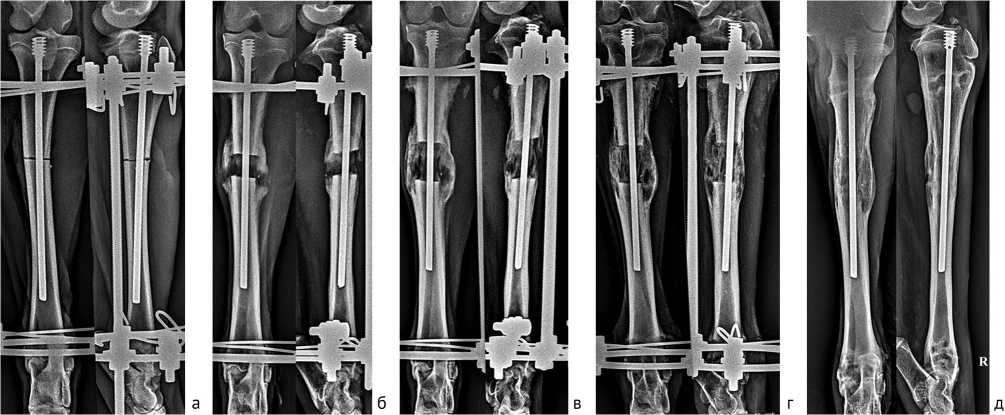
Рис. 3. Рентгенограммы голени в процессе удлинения на титановом стержне, основная группа: а — день операции; б — 14 дн. дистракции; в — 28 дн. дистракции (окончание удлинения); г — 30 дн. периода фиксации, костное сращение, день снятия аппарата; д — 30 дн. после демонтажа АВФ
Измерения показали, что площадь повреждения росткового хряща составила в среднем (4,08 ± 0,32) %. При анализе длины большеберцовой кости, сформированной за счет спонтанного роста (без учета высоты дистракционного регенерата), через 60 дн. после окончания периода фиксации были выявлены показатели, представленные в табл. 1.
Таблица 1
Длина оперированной и интактной большеберцовых костей через 60 дн. после окончания периода фиксации
|
Группы |
Интактная б/б кость; см |
Оперированная б/б кость; см |
Достоверность отличий |
|
Классическое удлинение (контрольная) |
20,9 ± 0,32 |
21,54 ± 0,19 |
Р = 0,045 |
|
Удлинение на титановом стержне (основная) |
21,14 ± 0,41 |
21,31 ± 0,23 |
Р = 0,274 |
Таким образом, не были выявлены нарушения продольного роста удлиняемых большеберцовых костей в сравнении с интактными контралатеральными.
Разница значений рентгеновских углов ориентации наклона проксимальных суставных поверхностей MPTA ( р = 0,51) и PPTA ( р = 0,03) отсутствовала как непосредственно перед оперативным вмешательством, так и в последующем на разных сроках наблюдения в обеих группах по сравнению с контралатеральной (интактной) конечностью (табл. 2).
Отметим также, что ни у одного животного, которому осуществляли удлинение на стержне, не произошло его блокирования в костномозговом канале в процессе дистракции, а также не произошло потери фиксации резьбовой части в проксимальном эпифизе большеберцовой кости.
Таблица 2
Рентгенанатомические углы проксимального суставного конца большеберцовой кости
|
Измеряемый показатель |
Интактная большеберцовая кость |
Опытная большеберцовая кость |
||
|
До операции |
30 дн. после демонтажа аппарата |
До операции |
30 дн. после демонтажа аппарата |
|
|
Контрольная группа |
||||
|
mMPTA; ° |
91,65 ± 0,50 |
95,02 ± 2,25 |
91,15 ± 1,78 |
94,01 ± 2,08 |
|
mPPTA; ° |
62,47 ± 3,02 |
65,07 ± 1,97 |
64,55 ± 5,83 |
71,1 ± 1,08 |
|
Основная группа |
||||
|
mMPTA; ° |
92,4 ± 1,35 |
92,4 ± 1,39 |
92,35 ± 3,02 |
92,5 ± 1,22 |
|
mPPTA; ° |
65,7 ± 1,36 |
69,6 ± 3,1 |
66,92 ± 4,17 |
70,3 ± 0,92 |
ОБСУЖДЕНИЕ
В детской ортопедии и травматологии вопрос о длительном присутствии трансфизарных имплантов наиболее активно обсуждается в трех областях: оперативное лечение переломов длинных трубчатых костей с повреждением зон роста, реконструкция передней крестообразной связки коленного сустава до закрытия зон роста, а также реконструкция и/или превентивное трансфизарное армирование костей при патологии костной ткани, сопровождающейся снижением ее прочностных свойств [10–16].
В экспериментальной хирургии различные модели используют для определения влияния повреждений и имплантов на функцию и структуру росткового хряща и суставного хряща коленного сустава. В большинстве случаев исследования проводят на ягнятах, кроликах и поросятах [17–20]. Признано, что модель операций на коленном суставе и области ростковых зон ягнят в большей степени подходит для трансляции полученных в эксперименте результатов в клиническую практику [21]. Проверка на экспериментальной модели особенностей патологии и эффективности принципов новых методов хирургии остается обязательной с начала существования доказательной медицины [22].
При переломах конечностей у детей в 20 % случаев вовлекается ростковых хрящ [23]. При этом в трети этих травм формируются зоны эпифизиодеза как исход перелома [24]. В травматологической практике мнения авторов о влиянии трансфизарного проведения спиц при фиксации мелких фрагментов при остеоэпифизиолизах на функцию ростковых хрящей и формирование ограниченных эпифизиодезов противоречивы.Например,прилечениипереломовудетейJ.Horneta.lописываличастичныйэпифизиодез и развитие угловой деформации [25]. В свою очередь P.S. Yung et al. и R. Langenhan et al. не нашли влияния трансфизарно проведенных прямых спиц Киршнера на последующий рост оперированной конечности [11, 12]. B.R. Garrett et al. [26] также не выявили статистических корреляций между диафиксацией дистальных эпифизеолизов и остеоэпифизеолизов бедра и частотой эпифизиодезов, в то время как тяжесть травмы и тип перелома по классификации Salter – Harris имели достоверное влияние. В контексте устранения последствий травм в зонах роста методом резекции участков эпифизиодеза экспериментальные исследования сыграли свою роль, показав отсутствие повторного формирования костных сращений между эпифизом и метафизом в случае заполнения зоны резекции аутологичной хрящевой тканью [20]. При заполнении зон жировой тканью или оставлении их пустыми во всех случаях наблюдали костное сращение на месте удаленного росткового хряща. Важность замедления резорбции трансфизарного материала и его инертных свойств для предотвращения формирования зон эпифизиодеза показана в работе южнокорейских исследователей: микродуговое оксидирование тонких имплантов из сплавов Mg-Ca-Zn замедляло резорбцию в зоне физисов и исключало формирование костных сращений между эпифизом и метафизом [27].
Существует мнение, что при реконструкции передней крестообразной связки коленного сустава у детей анатомическая реконструкция возможна лишь при трансфизарном формировании туннелей и расположении аутоимплантов [28, 29]. Однако такой способ выполнения операции повышает риск формирования укорочения и вальгусной деформации вследствие травматизации зон роста [14, 15]. Экспериментальные исследования методик реконструкции передней крестообразной связки выявили факторы, снижающие риски эпифизиодезов: центральное расположение каналов в зонах роста, их малый диаметр (5 мм) и расположение биологически инертного материала (собственных сухожилий). В то время как бóльший диаметр каналов (8 мм), их заднелатеральная локализация и незаполнение сухожилиями вели к формированию эпифизиодезов у ягнят [30]. Важность расположения сухожилий внутри транс-физарного канала для предотвращения эпифизиодеза была также подтверждена экспериментально [31]. Вопрос о влиянии трансфизарных конструкций на рост конечностей при реконструктивных операциях на костях конечностей, используемых в клинической практике лечения детей с генетическими заболеваниями, пока не находит ответа вследствие как отсутствия методов прогноза спонтанного роста при таких патологиях, так и невысокой актуальности данной проблемы до недавнего времени [32–34].
Именно в области реконструктивной ортопедии экспериментальные исследования являются авангардом научного поиска, а не следуют в фарватере расширения показаний к уже состоявшимся клиническим технологиям. При исследовании величины повреждения и длительности диафиксации каким-либо материалом E.A. Mäkelä et al. [35] удалось показать, что трансфизарное нахождение прямых стальных спиц диаметром 2 мм менее 12 нед. не вызвало развития нарушения функции роста, а в периоде 12–24 нед. наблюдали эпифизиодез и укорочение сегмента. Использование спиц диаметром 3,2–3,5 мм, занимающих 7 % от площади зоны роста, неизбежно приводило к эпифизиодезу и укорочению. Данная критичная величина площади повреждения (7–9 %) зоны роста подтверждена другим исследованием, однако расположение в канале собственного сухожилия позволяло избежать формирования костного сращения [31]. В нашем собственном исследовании повреждение 6 % площади физиса при трансфизарном армировании стальными спицами, но и длительном нахождении имплантов in situ (в течение 25 нед.) приводило к потере 5,4 % остаточного роста, а при сочетании армирования с остеотомией — к потере 9,5 % резидуального роста армированной большеберцовой кости [36]. Важно отметить, что телескопический характер трансфизарных имплантов (скользящих один внутри другого) из титановых сплавов, введенных в большеберцовую кость центрально относительно геометрии зон роста и без дополнительных остеотомий кости, не приводил к угнетению функции физисов [9]. В данной дискуссии важны результаты экспериментального исследования ретроградного введения в бедренную кость поросят массивного титанового стержня в периоде 8 нед. (без выполнения дополнительной остеотомии), которое не привело к торможению продольного роста [37]. Данная работа направлена на обоснование возможности применения полностью имплантируемых электромагнитных стержней у детей для удлинения конечностей, но авторы признают, что экспериментальные исследования должны быть продолжены для изучения влияния трансфизарных имплантов на функцию роста в условиях хирургического удлинения сегментов. Таким образом, для снижения рисков эпифизиодезов трансфизарные импланты, потенциально используемые в реконструктивной ортопедии, должны обладать инертными свойствами в отношении окружающих тканей, быть нерезорбируемыми (или с длительным периодом резорбции), располагаться центрально, не превышать площадь 7 % ростковой зоны.
В нашей экспериментальной серии использованы титановые трансфизарные стержни, способ применения которых отвечал вышеуказанным критериям, за исключением того, что они являлись составляющей комбинированной методики удлинения конечностей.
Результаты экспериментальной серии показали не только возможность такого удлинения, но и ускорение созревания и консолидации дистракционного регенерата в условиях применения тонкого ригидного стержня по сравнению со стандартной методикой. Мы видим два объяснения такому феномену: выраженная периостальная реакция и повышенная стабильность положения костных фрагментов [38–42]. Наше исследование подтвердило преимущество удлинения с интрамедуллярными конструкциями, в данном случае с ригидным интрамедуллярным стержнем с возможностью блокирования. Во всех случаях экспериментального удлинения комбинированной методикой костное сращение с полноценной кортика-лизацией дистракционного регенерата достигнуто в течение 30 дн. фиксации.
Что касается влияния на рост постоянно находящегося трансфизарного стержня, многообещающим результатом является отсутствие торможения роста удлиненного сегмента и, тем более, наступления эпифизиодеза. Статистически значимой разницы в длине интактного и удлиненного (за вычетом высоты диастаза) сегмента не обнаружено.
Ограничением данного исследования для клинической интерпретации результатов является его экспериментальный характер, а также величина относительного удлинения в пределах 13 %. Также к ограничениям можно отнести небольшое количество животных, используемых в эксперименте. В последующие годы выполнения НИР запланировано дополнить количество наблюдений в каждой из групп. Тем не менее, очевидно, что соблюдения доказанных требований к трансфизарным имплантам и в условиях удлинения позволяет избежать негативного влияния на функцию вовлеченной зоны роста.
ЗАКЛЮЧЕНИЕ
Выявлена возможность экспериментального удлинения большеберцовой кости в условиях внешнего остеосинтеза с использованием трансфизарного ригидного титанового стержня. Выраженный периостальный остеогенез и дополнительная стабилизация положения костных фрагментов способствуют быстрейшему формированию и созреванию костного регенерата по сравнению с классической методикой. Отсутствуют признаки угнетения спонтанного роста удлиняемого сегмента и формирования рентгеновских признаков эпифизиодеза на уровне расположения трансфизарной конструкции. Центральное расположение трансфизарного стержня относительно плоскости ростковой зоны и его площади сечения менее 5 % площади физиса можно считать условиями, при которых не развивается эпифизиодез при экспериментальном удлинении конечности.
Список литературы Влияние трансфизарного интрамедуллярного стержня на формирование дистракционного регенерата голени и ее последующий рост у ягнят
- Fuller CB, Shannon CE, Paley D. Lengthening Reconstruction Surgery for Fibular Hemimelia: A Review. Children (Basel). 2021;8(6):467. doi: 10.3390/children8060467
- Lazovic M., Леончук С.С., Ducic S. и др. Удлинение и коррекция деформаций конечности у пациентов с тяжелыми формами малоберцовой гемимелии: опыт детской университетской больницы Белграда. Гений ортопедии. 2024;30(1):38-45. doi: 10.18019/1028-4427-2024-30-1-38-45
- Antoci V, Ono CM, Antoci V Jr, Raney EM. Bone lengthening in children: how to predict the complications rate and complexity? JPediatr Orthop. 2006;26(5):634-640. doi: 10.1097/01.bpo.0000229977.31931.69
- Moraal JM, Elzinga-Plomp A, Jongmans MJ, et al. Long-term psychosocial functioning after Ilizarov limb lengthening during childhood. Acta Orthop. 2009;80(6):704-710. doi: 10.3109/17453670903473024
- Popkov A, Foster P, Gubin A, et al. The use of flexible intramedullary nails in limb lengthening. Expert Rev Med Devices. 2017;14(9):741-753. doi: 10.1080/17434440.2017.1367284
- Popkov D, Popkov A, Haumont T, et al. Flexible intramedullary nail use in limb lengthening. J Pediatr Orthop. 2010;30(8):910-918. doi: 10.1097/BP0.0b013e3181f0eaf9
- Launay F, Jouve JL, Guillaume JM, et al. Progressive forearm lengthening in children: 14 cases. Rev Chir Orthop ReparatriceApparMot. 2001;87(8):786-795. (In French.)
- Клышников К.А., Сазонова Н.В., Попков А.В. Комбинированный остеосинтез при лечении диафизарных переломов большеберцовой кости. Гений ортопедии. 2023;29(6):635-639. doi: 10.18019/1028-4427-2023-29-6635-639
- Kononovich N, Mingazov E, Gorbach E, et al. Impact of telescopic intramedullary rodding on the growth of tibia: Comparative experimental study in dogs. Orthop Traumatol Surg Res. 2024;110(6):103645. doi: 10.1016/j. otsr.2023.103645
- Meyers AB. Physeal bridges: causes, diagnosis, characterization and post-treatment imaging. Pediatr Radiol. 2019;49(12):1595-1609. doi: 10.1007/s00247-019-04461-x
- Langenhan R, Baumann M, Hohendorff B, et al. Arthroscopically assisted reduction and internal fixation of a femoral anterior cruciate ligament osteochondral avulsion fracture in a 14-year-old girl via transphyseal inside-out technique. Strategies Trauma Limb Reconstr. 2013;8(3):193-197. doi: 10.1007/s11751-013-0175-6
- Yung PS, Lam CY, Ng BK, et al. Percutaneous transphyseal intramedullary Kirschner wire pinning: a safe and effective procedure for treatment of displaced diaphyseal forearm fracture in children. J Pediatr Orthop. 2004;24(1):7-12. doi: 10.1097/00004694-200401000-00002
- Nicolaou N, Bowe JD, Wilkinson JM, et al. Use of the Sheffield telescopic intramedullary rod system for the management of osteogenesis imperfecta: clinical outcomes at an average follow-up of nineteen years. J Bone Joint Surg Am. 2011;93(21):1994-2000. doi: 10.2106/JBJS.J.01893
- Petersen W, Bierke S, Stohr A, et al. A systematic review of transphyseal ACL reconstruction in children and adolescents: comparing the transtibial and independent femoral tunnel drilling techniques. J Exp Orthop. 2023;10(1):7. doi: 10.1186/ s40634-023-00577-0
- Peterson DC, Ayeni OR. Pediatric anterior cruciate ligament reconstruction outcomes. Curr Rev Musculoskelet Med. 2016;9(4):339-347. doi: 10.1007/s12178-016-9358-3
- Wu C, Zheng G, Wang D, et al. Combination Treatment by Cross-Union of the Tibia and Fibula, Autogenic Iliac Bone Grafting, Reliable Fixation and Bone Morphogenetic Proteins for the Treatment of Refractory Congenital Pseudarthrosis of the Tibia. J Pediatr Orthop. 2022;42(6):e623-e629. doi: 10.1097/BP0.0000000000002138
- Guzzanti V, Falciglia F, Gigante A, Fabbriciani C. The effect of intra-articular ACL reconstruction on the growth plates of rabbits. J Bone Joint Surg Br. 1994;76(6):960-963.
- Ono T, Wada Y, Takahashi K, et al. Tibial deformities and failures of anterior cruciate ligament reconstruction in immature rabbits. J Orthop Sci. 1998;3(3):150-155. doi: 10.1007/s007760050035
- Seil R, Pape D, Kohn D. The risk of growth changes during transphyseal drilling in sheep with open physes. Arthroscopy. 2008;24(7):824-833. doi: 10.1016/j.arthro.2008.02.007
- Abood AA, M0ller-Madsen B, Shiguetomi-Medina JM, et al. Autologous cartilage and fibrin sealant may be superior to conventional fat grafting in preventing physeal bone bridge formation - a pilot study in porcines. J Child Orthop. 2020;14(5):459-465. doi: 10.1302/1863-2548.14.200024
- Madry H, Ochi M, Cucchiarini M, et al. Large animal models in experimental knee sports surgery: focus on clinical translation. JExp_ Orthop. 2015;2(1):9. doi: 10.1186/s40634-015-0025-1
- Bernard C. Experimental Pathology-Rational Principles of Therapeutics: Lecture XII. Delivered at the College of France, during the Winter Session, 1859-60. Chic Med J. 1860;17(8):487-493.
- Mizuta T, Benson WM, Foster BK, et al. Statistical analysis of the incidence of physeal injuries. J Pediatr Orthop. 1987;7(5):518-523. doi: 10.1097/01241398-198709000-00003
- Mann DC, Rajmaira S. Distribution of physeal and nonphyseal fractures in 2,650 long-bone fractures in children aged 0-16 years. J Pediatr Orthop. 1990;10(6):713-716. doi: 10.1097/01241398-199011000-00002
- Horn J, Kristiansen LP, Steen H. Partial physeal arrest after temporary transphyseal pinning--a case report. Acta Orthop. 2008;79(6):867-869. doi: 10.1080/17453670810016975
- Garrett BR, Hoffman EB, Carrara H. The effect of percutaneous pin fixation in the treatment of distal femoral physeal fractures. J Bone Joint Surg Br. 2011;93(5):689-694. doi: 10.1302/0301-620X.93B5.25422
- Song MH, Yoo WJ, Cho TJ, et a;. In Vivo Response of Growth Plate to Biodegradable Mg-Ca-Zn Alloys Depending on the Surface Modification. Int JMol Sci. 2019;20(15):3761. doi: 10.3390/ijms20153761
- van Eck CF, Gravare-Silbernagel K, Samuelsson K, et al. Evidence to support the interpretation and use of the Anatomic Anterior Cruciate Ligament Reconstruction Checklist. J Bone Joint SurgAm. 2013;95(20):e153. doi: 10.2106/JBJS.L.01437
- Zantop T, Wellmann M, Fu FH, Petersen W. Tunnel positioning of anteromedial and posterolateral bundles in anatomic anterior cruciate ligament reconstruction: anatomic and radiographic findings. Am J Sports Med. 2008;36(1):65-72. doi: 10.1177/0363546507308361
- Seil R, Pape D, Kohn D. The risk of growth changes during transphyseal drilling in sheep with open physes. Arthroscopy. 2008;24(7):824-833. doi: 10.1016/j.arthro.2008.02.007
- Janarv PM, Wikstrom B, Hirsch G. The influence of transphyseal drilling and tendon grafting on bone growth: an experimental study in the rabbit. J Pediatr Orthop. 1998;18(2):149-154.
- Nguyen CV, Makarewich CA, Poon SC, et al. Long-term Outcomes of Intramedullary Nails in Osteogenesis Imperfecta: Fewer Surgeries and Longer Survival Times With Telescoping Rods in Patients With Over Ten Years Follow-up. J Pediatr Orthop. 2024. doi: 10.1097/BP0.0000000000002810
- Мингазов Э.Р., Гофман Ф.Ф., Попков А.В. и др. Первый опыт применения титанового телескопического стержня при коррекции деформаций конечностей у детей с несовершенным остеогенезом. Гений ортопедии. 2019;25(3):297-303. doi: 10.18019/1028-4427-2019-25-3-297-303
- Mingazov E, Gvozdev N, Popkov A, et al. Preliminary Results of Bone Lengthening over Telescopic Titanium Intramedullary Rod. Case Rep Orthop. 2023;2023:4796006. doi: 10.1155/2023/4796006
- Makela EA, Vainionpaa S, Vihtonen K, et al. The effect of trauma to the lower femoral epiphyseal plate. An experimental study in rabbits. J Bone Joint Surg Br. 1988;70(2):187-191. doi: 10.1302/0301-620X.70B2.3346285
- Попков Д.А., Кононович Н.А., Мингазов Э.Р. и др. Интрамедуллярный эластичный трансфизарный остеосинтез большеберцовой кости и его влияние на рост сегмента. Вестник Российской академии медицинских наук. 2015;70(4):441-449. doi: 10.15690/vramn.v70.i4.1410
- Abood AA, Rahbek O, Olesen ML, et al. Does Retrograde Femoral Nailing through a Normal Physis Impair Growth? An Experimental Porcine Model. Strategies Trauma Limb Reconstr. 2021;16(1):8-13. doi: 10.5005/jp-journals-10080-1515
- Caton J, Rubini J, Panisset JC, et al. Progressive limb lengthening with a centromedullary nail versus an external fixator: experimental study in sheep. Rev Chir Orthop Reparatrice Appar Mot. 2001;87(3):237-247. (In French.)
- Lin CC, Huang SC, Liu TK, Chapman MW. Limb lengthening over an intramedullary nail. An animal study and clinical report. Clin Orthop_RelatRes. 1996;(330):208-216. doi: 10.1097/00003086-199609000-00028
- Kojimoto H, Yasui N, Goto T, et al. Bone lengthening in rabbits by callus distraction. The role of periosteum and endosteum. J Bone Joint Surg Br. 1988;70(4):543-549. doi: 10.1302/0301-620X.70B4.3403595
- Popkov DA, Popkov AV, Kononovich NA, et al. Experimental study of progressive tibial lengthening in dogs using the Ilizarov technique. Comparison with and without associated intramedullary K-wires. Orthop Traumatol Surg Res. 2014;100(7):809-814. doi: 10.1016/j.otsr.2014.06.021
- Черкашин А. Механические способы стимуляции дистракционного регенерата: мини-обзор современных концепций. Гений ортопедии. 2023;29(6):656-661. doi: 10.18019/1028-4427-2023-29-6-656-661


