Влияние условий подготовки и проведения эксперимента на показатели функционирования изолированной перфузируемой печени крысы
Автор: Шадрин К.В., Пахомова В.Г., Рупенко А.П., Моргулис И.И.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Экология
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
В настоящем исследовании определяли влияние условий перфузии (длительность подготовительного периода, норадреналин и молочная кислота) на показатели функционирования изолированной печени крысы.
Перфузия изолированной печени, метаболизм, норадреналин, глюконеогенез, гипоксия
Короткий адрес: https://sciup.org/14082967
IDR: 14082967 | УДК: 577.359
Текст научной статьи Влияние условий подготовки и проведения эксперимента на показатели функционирования изолированной перфузируемой печени крысы
Введение. Исследование метаболизма печени и нахождение пределов функционирования этого органа – очень важная задача современных исследований в фармакологии, физиологии и медицине. Для решения таких задач подходит метод перфузии изолированных органов [1, 6]. Он позволяет в реальном времени отслеживать реакцию органа на различные воздействия, а также дает уникальную возможность поддерживать его гомеостаз [8]. При этом оценивают содержание различных метаболитов [10, 11], медиаторов [7, 9], факторов, которые регулируют накопление гликогена и выброс глюкозы в среду [4, 5]. Однако не уделено достаточно внимания функционированию печени как самостоятельного целостного органа, в частности тому, как влияет длительность ишемического периода на качество перфузии, как осуществляется метаболизм печени при стимуляции и как этот орган в условиях изолированной перфузии выполняет одну из присущих ему метаболических функций, например производство глюкозы из молочной кислоты [2, 3]. Несо- мненно, параметры функционирования изолированного органа зависят от условий перфузии, в частности, от состава перфузионной среды [12, 13]. При этом технологии самой операции и процессы выделения и размещения органа в термостатируемой камере (т.е. подготовительный период) вызывают в органе состояние гипоксии, что может также отражаться на его функционировании в дальнейшем. Поэтому очень важно знать, как длительность подготовительного периода влияет на метаболизм изолированных органов.
Целью работы было сравнить функционирование изолированной перфузируемой печени при различной длительности подготовительного периода и оценить влияние добавок в перфузионную среду, при использовании которых орган лучше сохраняет функциональную активность. В качестве стресс-воздействия использовали введение в перфузионную систему норадреналина. В качестве функциональной нагрузки на печень использовали лактат.
Методика исследования. Эксперименты проводили на крысах-самках Вистар массой 200–260 г. У наркотизированных (натрий-тиопентал, 100 мг/кг, в/б) животных стабилизировали гемостаз (гепарин, 1000 ед./кг, в/в); канюлировали воротную вену, инфузировали охлажденным раствором (50% – среда199, 50% – солевой раствор Кребса-Хенселейта с добавлением 80 г/л полиглюкина); канюлировали верхнюю полую вену, после чего орган выделяли и помещали в установку для культивирования изолированных органов мелких лабораторных животных «Гомеостат-3М». Печеночную артерию и нижнюю полую вену лигировали. Таким образом, вход перфузионной жидкости в печень осуществлялся через воротную вену, а выход – через верхнюю полую вену.
Перфузию печени крыс проводили в нормотермических условиях при постоянной скорости тока перфузата ( ~ 3-3,5 млтъ мин -1 ).
По длительности подготовительного периода животных разделили на три группы: 1-я группа – 25–35 мин, 2-я группа – 36–45, 3-я группа – 46–55 мин. Всего в эксперименте использовано 30 животных (по 10 в каждой группе). Длительность перфузии составляла 60 мин.
В экспериментах, где исследовали влияние добавок в перфузионную среду, использовали 22 животных. Все перфузируемые органы были разделены на 3 группы: 1 – контроль (органы 12 животных), без введения норадреналина; 2 – органы, в перфузионную систему которых вводили норадреналин (5) (вводили c 60 по 70 мин перфузии в концентрации 1мкМ); 3 – органы, в перфузионную систему которых добавляли лактат (5) (вводили с 70 по 80 мин перфузии в концентрации 10М). Длительность перфузии составляла 120 мин.
В ходе перфузии определяли следующие показатели жизнедеятельности органа: уровень давления в воротной вене, скорость желчетока, удельные скорости потребления кислорода и выделения углекислого газа, отношение удельной скорости потребления кислорода к удельной скорости выделения углекислого газа, концентрации молочной, пировиноградной кислот, глюкозы, отношение концентраций молочной и пировиноградной кислот в оттекающей от органа жидкости, скорости изменения содержаний молочной и пировиноградной кислот в оттекающей от органа жидкости.
Давление в воротной вене определяли манометрическим методом (см водн. ст.), удельные скорости потребления кислорода и выделения углекислого газа (мл/мин/г) определяли по формуле dVO2 /dt = Qt (Pa — Pv ) - где Qt – минутный объем кровообращения;
( P a — P v ) — разность напряжений кислорода в артериальной и венозной ветвях циркуляции.
Концентрации глюкозы, лактата и пирувата (мМ) определяли спектрофотометрически. Скорости изменения содержаний молочной и пировиноградной кислот (мМ/мин) определяли по формуле dC/dt = (C„1 - C^/At, где C – концентрация в момент i-го измерения;
C i + 1 - концентрация в момент измерения i+1 ;
A t - интервал между забором соответствующих проб, мин.
Результаты были статистически обработаны c использованием t-критерия Стьюдента.
Результаты исследования
Влияние длительности подготовительного периода на показатели жизнедеятельности изолированной перфузируемой печени крысы
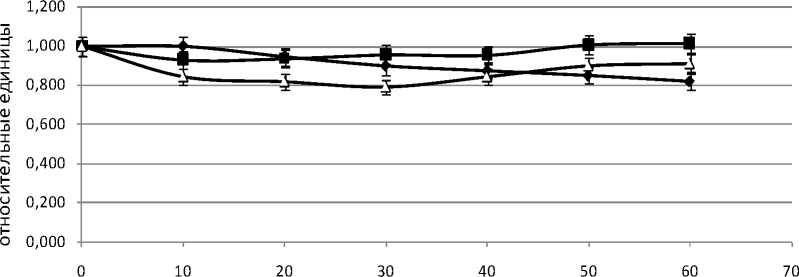
Данные свидетельствуют о сохранении в условиях перфузии функциональной активности печени: во всех экспериментальных группах изолированный орган хорошо выделяет желчь и стабилизирует уровни давления в воротной вене. Наиболее близкий к исходному уровень давления в воротной вене наблюдали для органов животных группы 2 (рис. 1).
время, мин
1 —■— 2 —2s— 3
Рис.1. Динамика давления в воротной вене в системе изолированной перфузируемой печени крыс при различной длительности подготовительного периода (1, 2, 3 – номер экспериментальной группы)
На рисунке 2 представлено изменение скорости продукции желчи для различной длительности подготовительного периода. В группах 1 и 2 скорость выделения желчи остается стабильной в течение всего эксперимента, в то время как в группе 3 после 50 мин она заметно падает.
Для удельной артерио-венозной разницы по кислороду (рис. 3) наиболее стабильными были значения показателя для органов первой группы, а для органов животных второй и третьей групп измеряемые показатели достаточно заметно отклонялись от исходного значения.
—♦— 1 —■— 2 —.J— 3
Рис. 2. Изменение скорости выделения желчи изолированной перфузируемой печенью при различной длительности подготовительного периода (1, 2, 3 – номер экспериментальной группы)
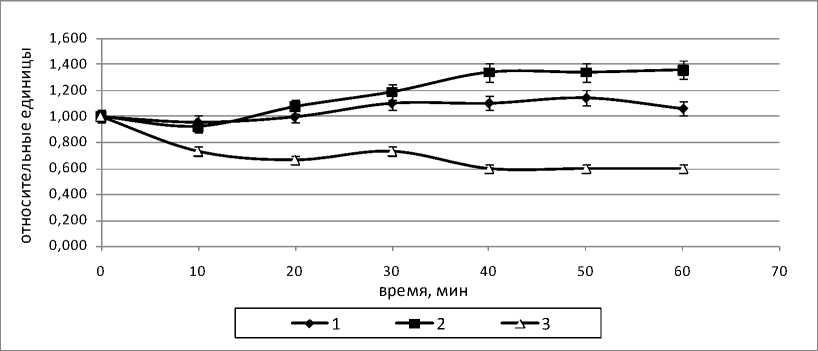
Рис. 3. Динамика удельной артерио-венозной разницы по кислороду для изолированной перфузируемой печени при различной длительности подготовительного периода
(1, 2, 3 – номер экспериментальной группы)
В целом наиболее стабильную по всем показателям динамику наблюдали для органов животных первой группы. Динамика показателей для органов второй и третьей групп была менее стабильной: наблюдались колебания значений исследуемых величин.
Реакция изолированной перфузируемой печени крысы на введение норадреналина
Из таблицы 1 можно видеть, что с момента введения норадреналина уровень давления в воротной вене при перфузии органов животных первой группы начинает отличаться от контроля. В течение 10 мин после введения норадреналина уровень давления в воротной вене для органов группы 2 достоверно ниже, чем в контроле. Начиная с 70 мин, уровень давления в воротной вене для органов группы 2 повышается до контрольных значений и сохраняется таковым до конца перфузии.
Таблица 1
Динамика уровня давления в воротной вене в группах 1 и 2, относительные единицы, в системе изолированной перфузируемой печени крыс при введении норадреналина
|
Время, мин |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
110 |
120 |
|
Группа 1 |
1,000 ±0,050 |
0,982 ±0,049 |
0,994 ±0,050 |
1,113 ±0,056 |
1,029 ±0,051 |
1,064 ±0,053 |
1,072 ±0,054 |
1,119 ±0,056 |
1,164 ±0,058 |
1,226 ±0,061 |
|
Группа 2 |
1,000 ±0,050 |
0,907 ±0,045 |
0,837 ±0,042 |
0,728 ±0,036* |
0,745 ±0,037* |
1,125 ±0,056 |
0,983 ±0,049 |
0,921 ±0,046 |
0,881 ±0,044* |
0,854 ±0,043* |
* Обозначает P<0,05 в сравнении со значениями для группы 1.
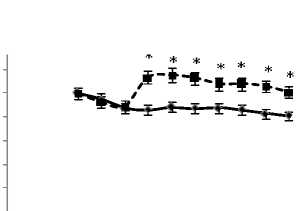
На рисунке 4 представлены изменения скоростей потребления кислорода и выделения углекислого газа, а также отношения скорости выделения углекислого газа к скорости потребления кислорода. Как видно, в группе 1 как скорость потребления кислорода, так и скорость выделения углекислого газа увеличиваются, а в группе 2 уровни этих показателей остаются неизменными. Коэффициент дыхания (рис. 4,в) и в 1, и во 2 группах остается неизменным до последних 20 мин перфузии, после чего в группе 1 заметно понижается, оставаясь прежним при добавлении норадреналина.
0 20 40 60 80 100 120
В емя, мин
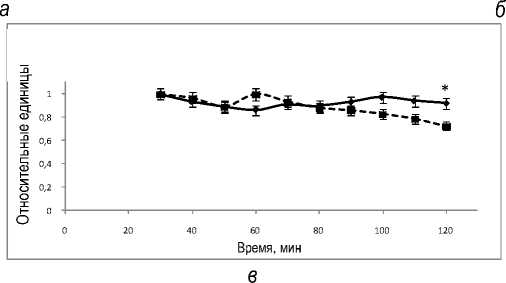
Рис. 4. Изменения скорости потребления кислорода (а) выделения углекислого газа (б) и отношения скорости выделения углекислого газа к скорости потребления кислорода (в) в группах 1 (пунктирная кривая) и 2 (сплошная кривая) в системе изолированной перфузируемой печени крыс при введении норадреналина.* обозначает P<0,05 в сравнении со значениями для группы 1
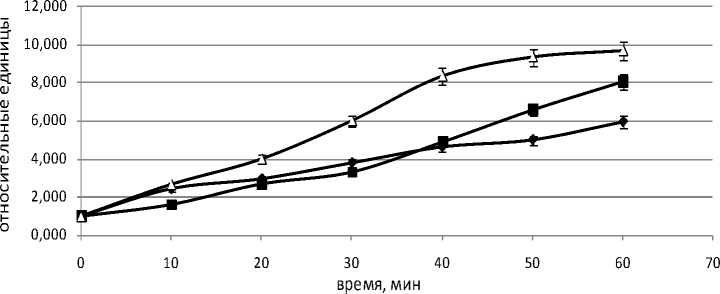
На рисунке 5 представлена динамика уровней лактата, пирувата и отношения лактат/пируват в течение перфузии. Уровень лактата снижается в течение перфузии, в то время как содержание пирувата в оттекающей от органа жидкости остается постоянным. Отношение содержаний лактата и пирувата (рис. 5,в) уменьшается так же, как и снижается уровень лактата, что согласуется с данными рисунка 4,а.
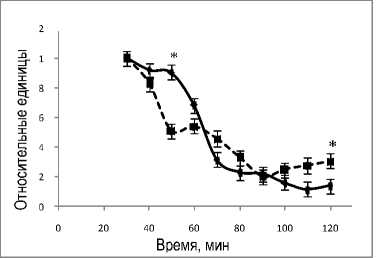
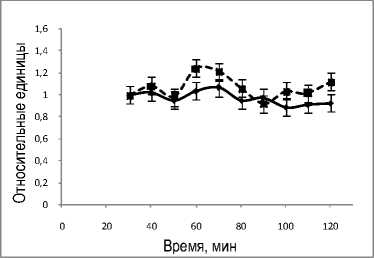
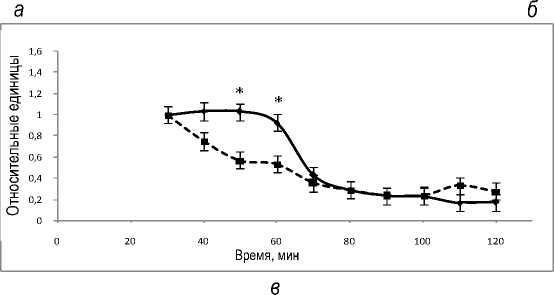
Рис. 5. Динамика уровней лактата (а), пирувата (б) и отношения лактат/пируват (в) в группах 1 (пунктирная кривая) и 2 (сплошная кривая) в системе изолированной перфузируемой печени крыс при введении норадреналина. *обозначает P<0,05 в сравнении со значениями для группы 1
Влияние молочной кислоты на показатели жизнедеятельности изолированной перфузируемой печени крысы
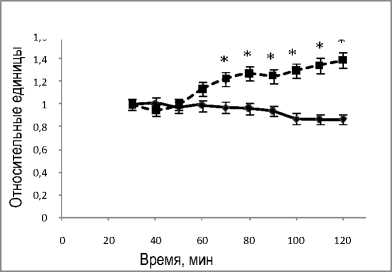
На рисунке 6, а представлена динамика содержаний молочной и пировиноградной кислот в венозной ветви циркуляции. В контроле – перфузия без введения пирувата и лактата в среду.
Из рис. 6, б следует, что введение молочной кислоты приводит к повышению содержания глюкозы, в то время как в контроле содержание глюкозы относительно стабильно. Увеличение содержания глюкозы в этих условиях, возможно, означает участие лактата в метаболическом пути глюконеогенеза.
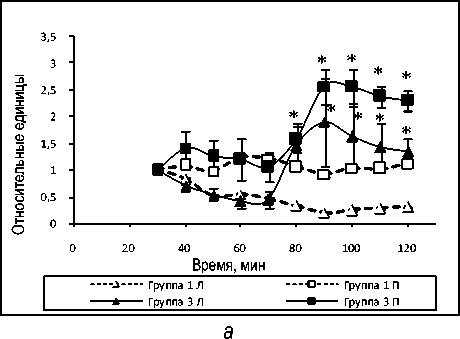
Рис.6. Динамика содержаний молочной и пировиноградной кислот (а) и глюкозы (б) в венозной ветви циркуляции при перфузии изолированной печени крысы: * обозначает P<0,05 в сравнении со значениями для группы 1
Исходя из данных, представленных в таблице 1, можно считать, что изолированный орган адекватно реагирует на введение норадреналина повышением уровня давления в воротной вене. Полученные данные также могут свидетельствовать о том, что в системе изолированной перфузируемой печени идет нормальный кислородный метаболизм.
По полученным данным можно судить также о том, что изолированная перфузируемая печень может продолжать выполнять одну из своих уникальных метаболических функций – превращение лактата в глюкозу.
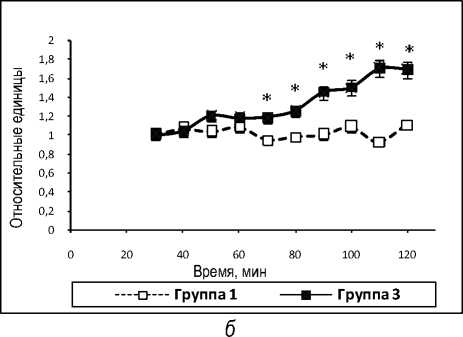
Представленные данные свидетельствуют о том, что во время подъема содержания молочной кислоты и пирувата скорость прироста содержания молочной кислоты меньше скорости прироста пировиноградной (табл. 2). Это может означать, что активируется не только кислородный метаболизм, например, цикл Кребса, дыхание в митохондриях, но и другой путь метаболизма лактата, присущий интактной печени, глюконеогенез.
Таблица 2
Динамика скорости изменения содержаний лактата и пирувата в группах 1 и 3, относительные единицы, в системе изолированной перфузируемой печени крыс при введении лактата
|
Время, мин |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
110 |
120 |
|
Лактат |
||||||||||
|
Группа 1 |
1,000 ±0,050 |
-1,843 ±0,092 |
0,188 ±0,009 |
0,502 ±0,025 |
0,751 ±0,038 |
0,751 ±0,038 |
-0,260 ±0,013 |
-0,182 ±0,009 |
-0,177 ±0,009 |
-0,184 ±0,009 |
|
Группа 3 |
1,000 ±0,050 |
-1,448 ±0,072 |
-0,704 ±0,035* |
-0,128 ±0,006* |
6,472 ±0,324* |
3,864 ±0,193* |
-2,080 ±0,104* |
-1,544 ±0,077* |
-1,160 ±0,058* |
-0,584 ±0,029* |
|
Пируват |
||||||||||
|
Группа 1 |
1,000 ±0,050 |
-1,259 ±0,063 |
3,250 ±0,163 |
-0,345 ±0,017 |
-1,905 ±0,095 |
-1,741 ±0,087 |
1,405 ±0,070 |
-0,241 ±0,012 |
1,310 ±0,066 |
-0,655 ±0,033 |
|
Группа 3 |
1,000 ±0,050 |
-1,360 ±0,068 |
-1,800 ±0,090* |
-0,200 ±0,010* |
6,740 ±0,337* |
16,700 ±0,835* |
-0,360 ±0,018* |
-3,200 ±0,160* |
-2,320 ±0,116* |
-1,320 ±0,066* |
* Обозначает P<0,05 в сравнении со значениями для группы 1.
Выводы
Таким образом, результаты исследования свидетельствуют о том, что норадреналин нормализует физиологическую и метаболическую активности изолированной печени при перфузии и может быть использован для стабилизации параметров гомеостаза органа.
Протекание глюконеогенеза в изолированной перфузируемой печени наряду с обычным аэробным метаболизмом углеводов может свидетельствовать о том, что функционирование органа в условиях искусственного гомеостаза протекает адекватно условиям in vivo. Нагрузка молочной кислотой, в свою очередь, может служить удобным и надежным тестом на адекватность перфузии.
Результаты исследования свидетельствуют также о том, что жизнеспособность изолированной перфузируемой печени зависит от длительности подготовительного периода, во время которого орган находится в состоянии гипоксии. Чем короче период между выделением органа и подсоединением к системе искусственного жизнеобеспечения, тем стабильнее его функционирование.


