Влияние васкулярного эндотелиального фактора роста на сперматогенез после облучения электронами дозой 2 гр
Автор: Демяшкин Григорий Александрович, Бондурко Любовь Николаевна, Фомина Наталья Константиновна, Севанькаева Лариса Евгеньевна, Михина Людмила Николаевна, Глушак Валентина Вадимовна, Щекин Владимир Иванович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2022 года.
Бесплатный доступ
Плазма, обогащенная тромбоцитами (PRP), потенциально влияет на восстановление тканей за счет стимуляции пролиферации и дифференцировки клеток-предшественников. Цель исследования - оценка влияния васкулярного эндотелиального фактора роста (VEGF) на сперматогенез после облучения электронами дозой 2 Гр. Материалы и методы. Семенники экспериментальных животных 5 групп (I - контроль (n=10), II - 2IR (n=35; доза - 2 Гр), III - 2IR+LP-PRP+IGF-1 (n=30), IV - 2IR+LP-PRP (n=30), V - LP-PRP (n=30)) были изучены методом световой микроскопии и с помощью иммуногистохимических реакций с антителами к VEGF. Результаты. После облучения обнаружили уменьшение количества VEGF-позитивных клеток, которое восстанавливалось на фоне введения PRP. Выводы. Облучение электронами дозой 2 Гр в семенниках приводит к уменьшению VEGF-позитивных клеток, а введение PRP, содержащей в т.ч. васкулярный эндотелиальный фактор роста, усиливает репаративные процессы, восстанавливая сперматогенез.
Сперматогенез, апоптоз, бесплодие, семенные канальцы, бета-излучение
Короткий адрес: https://sciup.org/14123513
IDR: 14123513 | УДК: 591.463.12
Текст научной статьи Влияние васкулярного эндотелиального фактора роста на сперматогенез после облучения электронами дозой 2 гр
Введение. Одной из наиболее частых причин снижения фертильности у мужчин, затрагивающего около 7 % населения, является ионизирующее излучение, используемое для лечения злокачественных опухолей яичек [1]. Некоторые авторы сообщают о том, что под действием облучения наблюдается снижение количества сперматозоидов, изменение их морфологии и подвижности, что связано с нарушением репликации ДНК и транскрипции РНК [2].
Регуляция сперматогенеза на всех стадиях осуществляется одним из паракринных факторов местного действия – васкулярным эндотелиальным фактором роста (VEGF), который продуцируется в т.ч. тромбоцитами [3]. VEGF способствует пролиферации и дифференцировке сперматогоний, влияет на микросреду яичка и, следовательно, на формирование сперматозоидов [4].
В последнее время васкулярный эндотелиальный фактор роста используют в различ-
ных областях медицины, в т.ч. и для коррекции сниженной фертильности у мужчин, но его влияние на сперматогенез остается малоизученным.
Цель исследования. Оценка влияния васкулярного эндотелиального фактора роста на сперматогенез после облучения электронами дозой 2 Гр.
Материалы и методы. Исследование проводили на базах Медицинского радиологического научного центра им. А.Ф. Цыба и Сеченовского Университета. Использовали самцов половозрелых крыс линии Wistar. Все манипуляции выполняли согласно Международным рекомендациям по проведению медикобиологических исследований с использованием животных (ЕЭС, Страсбург, 1985) и Хельсинкской декларации Всемирной медицинской ассоциации.
Экспериментальные животные (n=135) были поделены на 5 групп: I – контрольные крысы (n=10), которым внутрибрюшинно вво-
дили физиологический раствор (0,9 % раствор NaCl, 33,6 мл/кг); II (n=35), III (n=30), IV (n=30) группы – однократное локальное облучение семенников электронами (доза 2 Гр, мощность дозы 1 Гр/мин, энергия 10 МэВ, частота 9 Гц, диаметр поля 100 мм, использован линейный акселератор NOVAC-11). Кроме того, в III группе крысам вводили плазму, обогащенную тромбоцитами, с низким содержанием лейкоцитов (LP-PRP) и рекомбинантный инсулиноподобный фактор роста (IGF-1); в IV и V группах – LP-PRP. Длительность эксперимента – 84 сут – выбрана в соответствии с продолжительностью двух циклов сперматогенеза крыс. Животных всех групп выводили из эксперимента путем введения высоких доз анестетика. Извлеченные семенники взвешивали, фиксировали в растворе Буэна, заливали в парафиновые блоки, срезы толщиной 3–4 мкм окрашивали гематоксилином и эозином и готовили для иммуногистохимического исследования.
Микроскопический анализ выполняли с помощью системы видеомикроскопии (микроскоп Leica DM2000, Германия; камера Leica ICC50 HD; компьютер Platrun LG), морфометрические данные получали с использованием программного обеспечения для обработки и
анализа изображений Leica Application Suite, Version 4.9.0.
Для иммуногистохимического исследования в качестве первичных использовали кроличьи поликлональные антитела к VEGF-A (Millipore; клон ABS82; 1:50), вторичных – универсальные антитела (HiDef Detection™ HRP Polymer system, Cell Marque, США). Ядра клеток докрашивали гематоксилином Майера. Подсчет клеток (в %) проводили в 10 случайно отобранных полях зрения при увеличении ×400.
Полученные в результате подсчета данные обрабатывали с использованием компьютерной программы SPSS 12 for Windows statistical software package (IBM Analytics, США). Сравнение между группами проводили с использованием однофакторного дисперсионного анализа ANOVA со значимостью p<0,01.
Результаты и обсуждение. В семенниках контрольной группы отмечали умеренную положительную цитоплазматичекую ИГХ-реак-цию с антителами к VEGF во всех половых клетках на разных стадиях сперматогенеза (22,1 ± 3,4 %), особенно в сперматогониях, а также в клетках Сертоли и Лейдига (табл. 1, рис. 1).
Таблица 1
Table 1
Доля VEGF-позитивных клеток в семенниках групп животных, %
The proportion of VEGF-positive cells in testes of the experimental and control animals, %
|
Группа Group |
Половые клетки Germ cells |
Клетки Сертоли Sertoli cells |
Клетки Лейдига Leydig cells |
|
Контроль Control |
89,2 ± 1,1 |
84,1 ± 2,1 |
76,2 ± 2,4 |
|
2IR 84-е сут 2IR 84th day |
12,2 ± 1,1 |
83,2 ± 1,3 |
74,1 ± 1,5 |
|
2IR+LP-PRP+IGF-1 84-е сут 2IR+LP-PRP+IGF-1 84th day |
76,4 ± 2,3 |
84,1 ± 1,1 |
76,6 ± 2,1 |
|
2IR+LP-PRP 84-е сут 2IR+LP-PRP 84th day |
71,1 ± 1,3 |
83,3 ± 1,5 |
75,2 ± 1,3 |
|
LP-PRP 84-е сут LP-PRP 84th day |
88,2 ± 1,0 |
83,7 ± 0,7 |
75,7 ± 1,3 |
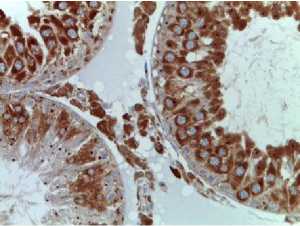
Контрольная группа Control group
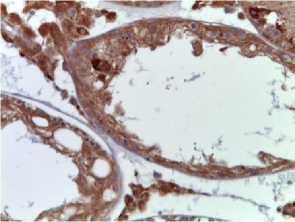
II группа Group II (2IR)
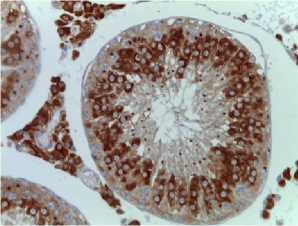
III группа Group III (2IR+LP-PRO+IGP-1)
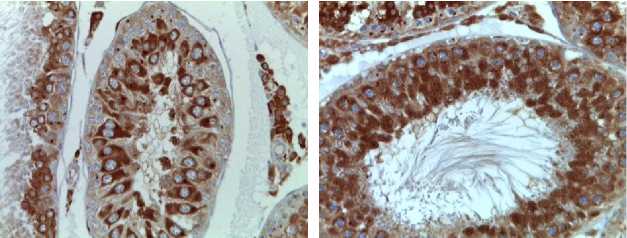
IV группа V группа
Group IV (2IR+LP-PRP)
V group (LP-PRP)
Рис. 1. Семенные канальцы крыс после локального облучения электронами дозой 2 Гр. Иммуногистохимические реакции с антителами к VEGF-A, докрашивание гематоксилином, ×400
Fig. 1. Seminiferous tubules of rats after local electron irradiation (2 Gy).
Immunohistochemical reactions with antibodies to VEGF-A, stained with hematoxylin, magnification ×400
Через 2 нед. после локального облучения у животных II, III, IV групп обнаружили нарушение гистоархитектоники семенников, проявляющееся гипосперматогенезом. Данные патоморфологические изменения сохранялись во II группе весь период эксперимента.
После облучения наблюдали снижение числа ИГХ-позитивных половых клеток в 2,0 раза (10,2 ± 1,2 %) по сравнению с группой контроля.
У животных III и IV групп на фоне введения LP-PRP, содержащей в т.ч. васкулярный эндотелиальный фактор роста, обнаружили постепенное увеличение VEGF-окрашенных половых клеток в 2,0 раза (18,2 ± 1,2 %) и 1,5 раза (16,1 ± 1,1 %) соответственно, в первую очередь пула сперматогенных стволовых клеток, сперматогоний, что, вероятно, связано с действием VEGF. При этом в III группе репаративные процессы произошли с опереже-
нием на 3–4 нед. за счет того, что животным дополнительно вводили рекомбинантный IGF-1.
В V группе, не подвергавшейся облучению, после введения LP-PRP значительных изменений по сравнению с контролем не выявлено.
Члены семейства VEGF (VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E) являются лигандами трансмембранных рецепторов VEGFR-1, VEGFR-2 и VEGFR-3 [5], которые экспрессируются в т.ч. в сперматогони-альных стволовых клетках. Реализация положительных эффектов происходит при связывании VEGF с его рецептором после аутофосфорилирования и последующей активации PI3K/AKT- и Ras/MAPK-путей [6, 7, 9, 10]. В результате активации данных путей наблюдаются неоваскулогенез и увеличение площади кровеносных сосудов в семенниках, что улучшает трофику и проницаемость гематоте-
стикулярного барьера для транспорта биологически активных веществ [8], тем самым стимулируя пролиферацию и дифференцировку половых клеток, способствуя восстановлению сперматогенеза и спермиогенеза, усиливая эффекты других факторов роста [9].
Заключение. Облучение электронами дозой 2 Гр в семенниках приводит к уменьшению VEGF-позитивных клеток, а введение PRP, содержащей в т.ч. васкулярный эндотелиальный фактор роста, усиливает репаративные процессы, восстанавливая сперматогенез.
Список литературы Влияние васкулярного эндотелиального фактора роста на сперматогенез после облучения электронами дозой 2 гр
- Serdarogullari M. Causes of Male Infertility. Experimed. 2020; 10 (3): 144-147.
- Kesari K.K, Agarwal A., Henkel R. Radiations and male fertility. Reproductive Biology and Endocrinology. 2018; 16 (1): 118.
- EDN: WXBBXX
- Kubatiev A.A., Borovaya T.G., Zhukhovitskii V.G., Shevlyagina N. V., Andreevskaya S.G. Platelets: a modern view on the structure and function. Patogenez (Pathogenesis). 2016; 14 (1): 4-13.
- EDN: XIPZEJ
- Ntemou E., Kadam P., Laere S. V., Saen D. V., Vicini E., Goossens E. Effect of recombinant human vascular endothelial growth factor on testis tissue xenotransplants from prepubertal boys: a three-case study. Reprod. Biomed. Online. 2019; 39 (1): 119-133.
- DOI: 10.1016/j.rbmo.2019.02.012
- Cross M., Dixelius J., Matsumoto T., Claesson-Welsh L. VEGF-receptor signal transduction. Trends in Biochemical Sciences. 2003; 28 (9): 488-494.
- DOI: 10.1016/S0968-0004(03)00193-2
- Pandey A., Singhi E., Arroyo J.P., Ikizler T.A., Gould E., Brown J., Beckman J., Harrison D., Moslehi J. Mechanisms of VEGF (Vascular Endothelial Growth Factor) Inhibitor-Associated Hypertension and Vascular Disease. Hypertension. 2018; 71 (2): e1-e8.
- DOI: 10.1161/HYPERTENSIONAHA.117.10271 EDN: GSHTVT
- Nakatsu M., Samson R., Perez-del-Pulgar S., Aoto J., Aitkenhead M., Taylor K., Carpenter P., Hughes C. VEGF121 and VEGF165 Regulate Blood Vessel Diameter Through Vascular Endothelial Growth Factor Receptor 2 in an in vitro Angiogenesis Model. Laboratory investigation. 2003; 83 (12): 1873-1885.
- DOI: 10.1097/01.lab.0000107160.81875.33
- Elmi A., Zannoni A., Govoni N., Bertocchi M., Forni M., Ventrella D., Bacci M.L. Uncovering the Physiological Mechanisms Underlying the Roe Deer (Capreolus capreolus) Testicular Cycle: Analyses of Gelatinases and VEGF Patterns and Correlation with Testes Weight and Testosterone. Animals. 2020; 10 (3): 444.
- DOI: 10.3390/ani10030444
- Santos T., Cavariani M.M., Pereira D.N., Schimming B.C., Chuffa L.G., Domeniconi R.F. Maternal Protein Restriction Modulates Angiogenesis and AQP9 Expression Leading to a Delay in Postnatal Epidid-ymal Development in Rat. Cells. 2019; 8 (9): 1094.
- DOI: 10.3390/cells8091094
- Leung D. W., Cachianes G., Kuang W.J., Goeddel D.V., Ferrara N. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science. 1989; 246 (4935): 1306-1309.
- DOI: 10.1126/science.2479986 EDN: HIVMRP


