Влияние внеклеточных везикул фолликулярного происхождения в среде созревания на способность ооцитов коров к эмбриональному развитию in vitro после старения и экстракорпорального оплодотворения
Автор: Шедова Е.Н., Сингина Г.Н., Узбекова Светлана, Узбеков Рустем, Луканина В.А., Цындрина Е.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Вспомогательные репродуктивные технологии, эмбриогенез
Статья в выпуске: 6 т.57, 2022 года.
Бесплатный доступ
Внеклеточные везикулы (extracellular vesicles, EVs), выделенные из фолликулярной жидкости (ФЖ) яичников, вовлечены in vivo в регуляцию мейоза в женских половых клетках, в связи с чем в последние годы EVs активно изучаются как потенциальные регуляторы качества ооцитов с целью повышения эффективности технологии получения эмбрионов in vitro (in vitro embryo production, IVP). В представленной работе мы впервые исследовали компетенцию к эмбриональному развитию у ооцитов коров ( Bos taurus ) при культивировании в присутствии EVs в процессе созревания и старении in vitro перед экстракорпоральным оплодотворением. Цель представленной работы заключалась в изучении влияния тестируемых условий на возрастные трансформации в зрелых ооцитах в процессе созревания in vitro (in vitro maturation, IVM) с точки зрения их способности после оплодотворения развиваться до стадии бластоцисты, а также качества получаемых IVP эмбрионов. EVs из ФЖ выделяли методом дифференциального ступенчатого центрифугирования и ультрацентрифугирования при 100 000 g. В полученной везикулярной фракции содержание общего белка составляло 37,5 мкг/мл ФЖ. Образцы проанализировали с использованием трансмиссионной электронной микроскопии, которая подтвердила наличие EVs, соответствующих по размерам экзосомам, в выделенных препаратах. Для функциональных экспериментов ооцит-кумулюсные комплексы (ОКК) культивировали с целью созревания в среде ТС-199, содержащей бычий сывороточный альбумин (3 мг/мл), пируват натрия (0,5 мМ) и эпидермальный фактор роста (EGF, 100 нг/мл) в отсутствие (контроль) или в присутствии EVs. Везикулярный белок добавляли в среду IVM в физиологической концентрации (на 1 мл среды количество EVs, выделенное из 1 мл ФЖ). Через 24 ч созревания ОКК переносили в среду старения и культивировали еще в течение 12 ч, после чего подвергали экстракорпоральному оплодотворению и культивированию для эмбрионального развития. На 3-и сут после оплодотворения изучали морфологию раздробившихся оплодотворенных ооцитов, на 7-е сут культивирования определяли число эмбрионов, развившихся до стадии бластоцисты, и их качество. Последнее оценивали на основании общего числа ядер в эмбрионах, которое подсчитывали с помощью цитологического анализа. Всего было проведено четыре независимых эксперимента. Число ОКК в каждой экспериментальной группе варьировало от 116 до 121. Доля раздробившихся после оплодотворения ооцитов в контроле была ниже, чем в опыте (53,5±2,9 против 63,8±2,9 %, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Фолликулярная жидкость, внеклеточные везикулы, ооциты, in vitro созревание, старение, эмбриональное развитие, крупный рогатый скот
Короткий адрес: https://sciup.org/142237382
IDR: 142237382 | УДК: 636.2:591.39 | DOI: 10.15389/agrobiology.2022.6.1178rus
Текст научной статьи Влияние внеклеточных везикул фолликулярного происхождения в среде созревания на способность ооцитов коров к эмбриональному развитию in vitro после старения и экстракорпорального оплодотворения
Биотехнология получения эмбрионов in vitro (in vitro embryo production, IVP), имеет широкие перспективы применения в научных исследованиях, а также служит одним из эффективных способов увеличения темпов генетического прогресса в селекции домашних животных, в том числе крупного рогатого скота (1). К настоящему времени достигнут существенный прогресс в совершенствовании этой технологии, однако качество эмбрионов, развившихся in vitro, по-прежнему значительно ниже, чем in vivo (2, 3). Один из лимитирующих факторов, влияющих на полноценность IVP
∗ Работа выполнена при финансовой поддержке Российского научного фонда (проект ¹ 19-16-00115-П).
эмбрионов, — качество ооцитов, приобретаемое в процессе их созревания in vitro (in vitro maturation, IVM) (4, 5). При этом условия IVM все еще остаются субоптимальными и требуют детализации.
В стандартной практике модернизация систем созревания направлена в первую очередь на моделирование условий, имеющих место in vivo внутри овариальных фолликулов (5, 6). В среды культивирования ооцитов для улучшения их созревания добавляют разнообразные молекулярные факторы — гормоны, стероиды, ростовые факторы, жирные кислоты и различные метаболиты (7). Интерес к описанным веществам обусловлен их присутствием в фолликулярной жидкости (ФЖ) антральных фолликулов яичника, которая, в свою очередь, обеспечивает оптимальную среду для роста ооцитов, мейотического созревания и приобретения ооцитами компетентности для последующего эмбрионального развития (8). Воздействие перечисленных факторов проявляется в фолликулах яичника при тесной двунаправленной связи между ооцитом и окружающими их фолликулярными клетками (9, 10).
Недавние фундаментальные исследования выявили внеклеточные секреторные гранулы — внеклеточные везикулы (extracellular vesicles, EVs), включающие экзосомы и микропузырьки, в качестве новых участников межклеточных коммуникаций, которые секретируются клетками и переносят разные регуляторные факторы в другие клетки, способные поглощать эти EVs (11, 12). В фолликулах яичников коров EVs присутствуют в ФЖ (13). Они участвуют в переносе различных РНК, белков и липидов (14) и задействованы в регуляции мейоза в яйцеклетке и раннего развития эмбриона (15, 16). Таких участников межклеточных коммуникаций рассматривают как потенциальных регуляторов качества ооцитов и их компетенции к эмбриональному развитию в условиях in vitro и активно изучают в этом аспекте (17-19).
Следует также отметить, что существующие современные подходы к повышению эффективности технологии IVP эмбрионов учитывают изменения в функциональном состоянии ооцит-кумулюсных комплексов (ОКК) в основном в процессе созревания ооцитов. Тем не менее у разных видов, включая Bos taurus, вслед за завершением первого деления мейоза в ооцитах инициируются процессы старения, которые негативно влияют на качество созревших яйцеклеток и их компетенцию к дальнейшему эмбриональному развитию (20, 21). В условиях in vitro яйцеклетки, выделенные из разных фолликулов яичника и от различных коров-доноров, представляют собой гетерогенную популяцию, которая неоднородна по потенциалу к развитию в процессе созревания in vitro. В результате культивирования in vitro часть ооцитов может созревать (достигать стадии метафазы II мейоза) значительно раньше, чем наступает период оплодотворения in vitro, что приводит к их более раннему старению, а также потере качества по сравнению с остальной популяцией созревающих клеток (22). При этом известно, что любая задержка в оплодотворении ооцитов может приводить к низкой жизнеспособности эмбрионов, а в случае рождения потомства — к ослаблению его фертильности и сокращению продолжительности жизни (20, 21, 23). При этом ассоциированные с ооцитом соматические клетки кумулюса, подвергающиеся апоптотической дегенерации при завершении созревания женских гамет, могут ускорять определенные негативные изменения, связанные со старением (23). На проблему быстрого старения ооцитов, которое происходит, в первую очередь, на молекулярно-цитоплазматическом уровне, все чаще обращают внимание при разработке научных подходов к модификации систем созревания ооцитов in vitro (24-26). Тем не менее участие EVs в регуляции процессов старения до сих пор не установлено.
В представленной работе мы впервые исследовали компетенцию к эмбриональному развитию у ооцитов коров ( Bos taurus ) при культивировании в присутствии EVs в процессе созревания и старении in vitro перед экстракорпоральным оплодотворением.
Цель работы заключалась в изучении влияния тестируемых условий на возрастные трансформации в зрелых ооцитах в процессе IVM с точки зрения их последующей способности развиваться до стадии бластоцисты, а также качество полученных эмбрионов.
Методика . Во всех экспериментах, кроме специально указанных случаев, использовали реагенты фирмы «Sigma-Aldrich» (США).
Для получения EVs из ФЖ выделенные post mortem яичники коров доставляли в лабораторию на льду, освобождали от окружающих тканей и многократно отмывали в стерильном охлажденном до +4 ° С физиологическом растворе, содержащем 100 МЕ/мл пенициллина и 50 мкг/мл стрептомицина («БиоФармГарант», Россия). ФЖ аспирировали из антральных фолликулов диаметром 3-6 мм. По 2 мл ФЖ центрифугировали по при 300 g (комнатная температура) в течение 15 мин, полученный супернатант, свободный от соматических клеток, переносили в новые стерильные пробирки. На следующем этапе ФЖ освобождали от апоптотических телец (размером 1-5 мкм) и крупных микровезикул (размером 200-1000 нм) центрифугированием соответственно при 2000 и 12000 g в течение 15 мин. EVs выделяли из очищенной ФЖ ультрацентрифугированием (центрифуга CS 150 NX, «Hitachi», Япония) в течение 90 мин при 100 000 g, после отбора супернатант разводили стерильным фосфатно-солевым буфером (ФСБ) (pH 7,4) и повторно ультрацентрифугировали при том же режиме. Осадки объединяли, разводили в 100 мкл ФБС и хранили при - 80 ° С до использования, предварительно отобрав от полученного объема две аликвоты по 5 мкл, которые использовали соответственно для определения количества EVs по концентрации белка и для ультраструктурного анализа препарата частиц с помощью трансмиссионной электронной микроскопии (ТЭМ).
Концентрацию белка измеряли на приборе Qubit 4 Fluorometer с использованием набора Qubit Protein Assay Kit («Thermo Fisher Scientific», США) и белкового стандарта Qubit с концентрацией от 0,125 до 5 мг/мл.
Для морфологического исследования 5 мкл суспензии EVs смешивали с 5 мкл 2 % раствора глутарового альдегида, предназначенного для электронной микроскопии (ЭМ) («Agar Scientific, Ltd.», Великобритания), и выдерживали в течение 1 ч при комнатной температуре. По 2 мкл суспензий фиксированных таким образом EVs наносили на никелевые ЭМ сеточки («Agar Scientific, Ltd.», Великобритания), покрытые формваровой пленкой с углеродным напылением, и инкубировали 60 мин во влажной камере, после чего сеточку промывали дистиллированной водой (3 раза по 10 с), нанося на поверхность каплю объемом 10 мкл и удаляя ее, касаясь краем сеточки фильтровальной бумаги. Далее проводили негативное контрастирование 2 % водным раствором уранилацетата («Electron Microscopy Science», США). Для этого на сеточку с препаратом EVs наносили каплю (10 мкл) уранилацетата, процедуру повторяли трижды с интервалом 10 с, после удаления последней капли сеточку сушили на воздухе. Препараты изучали с применением трансмиссионного электронного микроскопа JEOL 1011 («JEOL, Ltd.», Япония) и фотографировали (камера GATAN RIO 9, программа DigitalMicrograph3, «Gatan, Inc.», США). По результатам трансмиссионной электронной микроскопии устанавливали присутствие EVs в выделенных образцах и оценивали их морфологию.
Для экспериментов по получению IVP эмбрионов выделенные post mortem яичники коров доставляли с мясокомбината в лабораторию в теплом физиологическом растворе и препарировали, как описано выше. Оо-цит-кумулюсные комплексы (ОКК) выделяли из яичников, рассекая стенки фолликулов лезвием, промывали в среде ТС-199, содержащей 5 % фетальной бычьей сыворотки (ФБС), гепарин (10 мкг/мл) и гентамицин (50 мкг/мл) и проводили морфологическую оценку извлеченных ОКК. Для дальнейшего культивирования использовали ооциты округлой формы, с гомогенной цитоплазмой, равномерной по ширине зоной пеллюцида, окруженные несколькими компактными слоями клеток кумалюса.
Отобранные по качеству ОКК для in vitro созревания культивировали в 4-луночных планшетах («Биомедикал», Россия) группами (примерно 30 ооцитов) в 500 мкл среды ТС-199, содержащей 3 мг/мл бычьего сывороточного альбумина (БСА), 0,5 мМ пирувата натрия, 100 нг/мл э пидермаль-ногофактора ростаа EGF («Thermo Fisher Scientific», США) и 50 мкг/мл гентамицина в отсутствие (контроль) или в присутствии EVs. Везикулярный белок добавляли к среде созревания в физиологической концентрации (на 1 мл количество EVs, выделенное из 1 мл ФЖ). Капли среды покрывали 500 мкл легкого минерального масла. Культивирование проводили в инкубаторе при 38,5 ° С и 5 % СО 2 в атмосфере. После 24 ч согласно процедуре IVM созревшие ОКК переносили в среду старения и культивировали еще в течение 10 ч. При пролонгированном культивировании применяли среду аналогичного состава, но без EVs.
После периода старения ОКК переносили в среду BO-IVF («IVF Bioscience», Великобритания) для in vitro оплодотворения. Активные сперматозоиды, полученные методом swim-up, как описано ранее (26), добавляли в лунки с ооцитами (конечная концентрация 1½106 сперматозои-дов/мл). Во всех экспериментах для оплодотворения использовали заморо-жено-оттаянную сперму одного и того же быка. Оплодотворение ооцитов in vitro происходило в 4-луночных планшетах («Биомедикал», Россия) в каплях среды объемом 500 мкл, покрытых 500 мкл минерального масла. Половые клетки совместно культивировали в течение 15-16 ч, затем ооциты освобождали от клеток кумулюса и налипших сперматозоидов, предполагаемые зиготы переносили в среду для развития эмбрионов (коммерческая среда BO-IVC, «IVF Bioscience», Великобритания), капли полностью покрывали минеральным маслом и культивировали в инкубаторе при температуре 38,5 ° С в присутствии 5 % СО 2 , 5 % О 2 и 90 % N 2 в атмосфере. Через 3-е сут после оплодотворения заменяли среду на свежую и проводили морфологическую оценку раздробившихся зигот, на 7-е сут культивирования оценивали число эмбрионов, развившихся до стадии бластоцисты.
Качество эмбрионов оценивали цитологически по общему числу ядер. Для этого 7-суточные эмбрионы фиксировали 4 % раствором параформальдегида в натрий-фосфатном буфере в течение 60 мин при комнатной температуре. После фиксации эмбрионы пермеабилизировали в течение 30 мин в 0,1 % растворе цитрата натрия, содержащем 0,5 % Тритона Х-100, затем окрашивали в течение 20 мин раствором DAPI (1 мкг/мл) с целью локализации ядер, переносили на сухое обезжиренное стекло и заключали в среду Vectashield («Vector Laboratories», Великобритания). Для микрофотографирования и оценки препаратов использовали моторизованный микроскоп Axio Imager M2 («Carl Zeiss», Германия) с флуоресцентной приставкой и программу ZEN 2 pro («Carl Zeiss», Германия).
Статистическую обработку данных проводили методом ANOVA при помощи компьютерной программы SigmaStat («Systat Software, Inc.», США).
Результаты экспериментов представлены в виде средних значений ( М ) и стандартных ошибок (±SEM). Для оценки достоверности различий между сравниваемыми средними использовали критерий Тьюки. Различия считали статистически значимыми при р < 0,05.
Результаты . Экстракорпоральное созревание представляет собой важный этап IVP технологии. Тем не менее компетенция к эмбриональному развитию ооцитов, созревающих in vitro, по-прежнему остается значительно более низкой, чем при созревании in vivo (4, 5). Изучение характера и механизмов влияния физиологических факторов, в первую очередь естественного фолликулярного происхождения, в регуляции качества ооцитов в период их созревания in vitro может способствовать решению этой проблемы (5-7).
Ранее многими авторами, а также в наших собственных исследованиях было показано, что присутствие EVs, выделенных из ФЖ (которая in vivo служит естественным окружением женских половых клеток) в среде созревания ооцитов in vitro увеличивает их способность к эмбриональному развитию до стадии бластоцисты после оплодотворения (27, 28), ускоряет развитие эмбрионов (17), а также улучшает их качество, в том числе за счет снижения частоты апоптоза в бластомерах (27-29). Возможным механизмом такого позитивного эффекта могло быть увеличение устойчивости созревших яйцеклеток к возрастным изменениям, возникающим в период, который предшествует активации ооцитов спермием, и снижающим способность оплодотворенных ооцитов к эмбриональному развитию (22).
Для проверки этого предположения в представленной работе выделенные post mortem ооциты коров культивировали в среде IVM в отсутствие (контроль) или в присутствии физиологической концентрации EVs фолликулярного происхождения (экспериментальная группа EVs) и провели сравнительную оценку влияния исследуемых условий на возрастные трансформации в зрелых ооцитах в процессе их созревания in vitro с точки зрения способности после последующего старения и экстракорпорального оплодотворения достигать доимплантационных стадий развития. Для изучения изменений, связанных со старением ооцитов, мы использовали модель пролонгированного культивирования (20, 21), согласно которой в контрольной и экспериментальной группах ОКК после периода созревания in vitro (24 ч) перед оплодотворением in vitro дополнительно культивировали еще в течение 10 ч. Для чистоты эксперимента ОКК как в период созревания, так и в течение последующего старения культивировали в среде ТСМ-199, дополненной 3 мг/мл БСА, 0,5 мМ пируватом натрия и 100 нг/мл EGF, то есть не содержащей гонадотропных гормонов и сыворотки.
В эксперименте мы провели выделение EVs из фолликулов сорока коровьих яичников и охарактеризовали препараты по содержанию в них везикулярного белка с подтверждением присутствия в образцах EVs с помощью ТЭМ. Методология выделения EVs из жидкости фолликулов коров была основана на дифференциальном ступенчатом центрифугировании и ультрацентрифугировании при 100 000 g. Как показывает практика (17, 19), эта методология эффективна при получении фракции EVs, представляющей собой в основном экзосомы размером от 30 до 150 нм. Описанная методика была впервые предложена для выделения EVs из жидкости яйцевода (30, 31) и использована нами в частичной модификации (19).
В результате на 1 мл ФЖ мы выделили 37,5 мкг везикулярного белка. Общий пул, собранный со всего объема ФЖ, был проанализирован с использованием ТЭМ, которая подтвердила наличие везикул типа экзосом в образце, что обусловило возможность его использования в функциональных экспериментах. На рисунке 1 представлен типичный вид везикул, полученных из ФЖ яичников коров (диаметр фолликулов 3-6 мм). Наблюдаются как единичные, так и агрегированные везикулы.
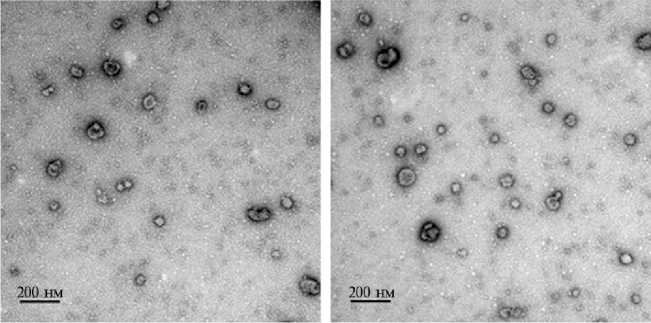
Рис. 1. Ультраструктура внеклеточных везикул (EVs) из фолликулярной жидкости яичников коров ( Bos taurus ) (трансмиссионная электронная микроскопия, JEOL 1011, «JEOL, Ltd.», Япония; камера GATAN RIO 9, «Gatan, Inc.», США; программа DigitalMicrograph3, «Gatan, Inc.», США).
Для оценки влияния EVs в период IVM на компетенцию ооцитов к эмбриональному развитию после старения in vitro мы провели четыре независимых эксперимента с использованием везикулярного белка, полученного за одно выделение. Результаты оценки представлены в таблице 1. Доля раздробившихся зигот (рис. 2, А, Г), определяемая на 3-и сут после оплодотворения in vitro в контроле была ниже, чем в опыте (53,5±2,9 против 63,8±2,9 %, p < 0,05). Также для созревших и стареющих in vitro ооцитов обнаружено положительное влияние EVs на развитие до стадии бластоцисты (табл. 1, рис. 2, Б, Д). В контроле выход бластоцист составлял 17,3±1,6 % (см. табл. 1, рис. 2, Б). Присутствие в среде созревания EVs повышало этот показатель до 20,2±2,5 % (p < 0,05) (табл. 1, рис. 2, Д). Тенденция сохранялась и в случае расчета данного показателя от общего числа образовавшихся эмбрионов (41,8±1,2 против 32,3±1,9, p < 0,05).
1. Развитие эмбрионов, полученных по технологии IVP (in vitro production) после созревания ооцитов коров ( Bos taurus ) в отсутствие (контроль) и в присутствии внеклеточных везикул из фолликулярной жидкости (EVs) и старения в течение 10 ч ( M ±SEM)
|
Группа |
Ооциты |
Ооциты, развившиеся до стадии бластоцисты, % |
||
|
общее число |
раздробившиеся после оплодотворения, % |
от общего числа |
от числа раздробившихся |
|
|
Контроль 116 53,5±2,9 17,3±1,6 32,3±1,9 Evs 121 63,8±2,9* 26,5±0,7* 41,8±1,2* * Различия с контролем статистически значимы при р < 0,05. |
||||
2. Результаты цитологического анализа бластоцист после экстракорпорального оплодотворения ооцитов коров ( Bos taurus ), созревавших в отсутствие (контроль) и в присутствии внеклеточных везикул из фолликулярной жидкости (EVs) , при старении в течение 10 ч ( M ±SEM)
|
Группа |
Число |
Среднее число ядер в бластоцистах |
|
|
экспериментов |
бластоцист |
||
|
Контроль |
4 |
20 |
78,9±3,3 |
|
Evs |
4 |
32 |
86,5±2,1 |
Использование EVs существенно не изменяло качества IVP эмбрионов на стадии бластоцисты, которое оценивали по числу ядер на 7-е сут после оплодотворения (табл. 2, см. рис. 2, В, Е). Согласно результатам цитологического анализа, этот показатель в сравниваемых группах был одинаковым и соответствовал исследуемой стадии развития (32).
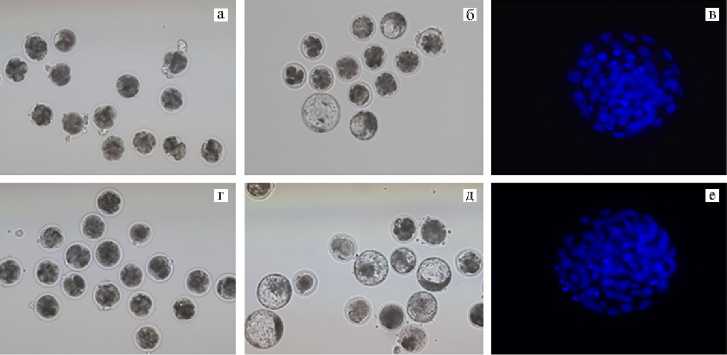
Рис. 2. Микрофотографии эмбрионов крупного рогатого скота ( Bos taurus ) после in vitro оплодотворения ооцитов, созревших в отсутствие (а-в) и в присутствии (г-е) внеклеточных везикул из фолликулярной жидкости (EVs) , при старении в течение 10 ч: а, г — раздробившиеся зиготы (увеличение ½100), б, д — эмбрионы, развившиеся до стадии бластоцисты (увеличение ½100, микроскоп Eclipse Ti-U, «Nikon», Япония); в, е — окрашивание ядер в бластоцисте с помощью DAPI (синий цвет; цитологический препарат) (увеличение ½400, микроскоп Axio Imager M2, «Carl Zeiss», Германия).
Старение ооцитов представляет собой сложный биологический процесс, который может привести к ряду изменений в структуре и функциональном состоянии ооцитов млекопитающих, включая повреждение ДНК, уменьшение скорости оплодотворения, нарушение структуры митохондрий, ранний апоптоз ооцитов и снижение способности к эмбриональному развитию (22, 26, 33, 34). В условиях in vitro изменения в ооцитах, связанные со старением, могут протекать как в период их созревания, так и в процессе оплодотворения, что может негативно влиять на развитие и качество IVP эмбрионов (25, 26, 34). Тем не менее, несмотря на необходимость решения проблемы старения ооцитов в условиях in vitro, исследований, направленных на поиск регуляторов, снижающих возрастные трансформации яйцеклеток, очень мало. К настоящему времени показана возможность торможения, по крайней мере частичного, процессов старения при воздействии на ооциты коров L-карнитина. Внесение этого вещества в среду созревания снижает уровень окислительного стресса и апоптоза в зрелых ооцитах в период их старения, а также увеличивает выход бластоцист с 20,9 (контроль) до 29,2 % (25). Кроме того, установлено, что гипофизарный гормон пролактин (ПРЛ) может специфически воздействовать на зрелый ооцит и повышать его устойчивость к процессам старения, в том числе связанным с потерей ооцитами компетенции к последующему эмбриональному развитию (26). При воздействии ПРЛ доля ооцитов, достигших стадии бластоцисты, увеличивалась по сравнению с контролем в 1,9 раза (соответственно 15,2 против 8,2 %). В представленной работе мы продемонстрировали, что EVs из ФЖ яичников коров во время созревания ооцитов могут также повышать их резистентность к возрастным изменениям и улучшать развитие эмбрионов in vitro. При этом, в отличие от L-карнитина и ПРЛ, присутствие EVs не только способствовало сходному повышению выхода бластоцист (с 17,3 до 26,5 %), но и улучшало результативность оплодотворения, увеличивая долю раздробившихся ооцитов с 53,5 до 63,8 %.
Таким образом, полученные данные позволяют сделать вывод, что применение внеклеточных везикул (extracellular vesicles, EVs), выделенных из фолликулярной жидкости яичников коров, в процедуре in vitro созревания повышает устойчивость яйцеклеток к возрастным трансформациям и, как следствие, их компетенцию к эмбриональному развитию после старения in vitro и оплодотворения. Также очевидно, что EVs на этапе экстракорпорального созревания могут использоваться для повышения эффективности технологии получения IVP эмбрионов у крупного рогатого скота.
Список литературы Влияние внеклеточных везикул фолликулярного происхождения в среде созревания на способность ооцитов коров к эмбриональному развитию in vitro после старения и экстракорпорального оплодотворения
- Зиновьева Н.А., Позябин С.В., Чинаров Р.Ю. Вспомогательные репродуктивные технологии: история становления и роль в развитии генетических технологий в скотоводстве (обзор). Сельскохозяйственная биология, 2020, 55(2): 225-242 (doi: 10.15389/agrobiology.2020.2.225rus).
- Sirard M.A. 40 years of bovine IVF in the new genomic selection context. Reproduction, 2018, 156(1): 1-7 (doi: 10.1530/REP-18-0008.).
- Ferré L.B., Kjelland M.E., Taiyeb A.M., Campos-Chillon F., Ross P.J. Recent progress in bovine in vitro-derived embryo cryotolerance: impact of in vitro culture systems, advances in cryopres-ervation and future considerations. Reproduction in Domestic Animals, 2020, 55(6): 659-676 (doi: 10.1111/rda.13667).
- Thompson J.G., Lane M., Gilchrist R.B. Metabolism of the bovine cumulus-oocyte complex and influence on subsequent developmental competence. Society of Reproduction and Fertility supple-ment, 2007, 64: 179-190 (doi: 10.5661/rdr-vi-179).
- Wrenzycki C., Stinshoff H. Maturation environment and impact on subsequent developmental competence of bovine oocytes. Reproduction in Domestic Animals, 2013, 48(1): 38-43 (doi: 10.1111/rda.12204).
- Stroebech L., Mazzoni G., Pedersen H.S., Freude K.K., Kadarmideen H.N., Callesen H., Hyt-tel P. In vitro production of bovine embryos: revisiting oocyte development and application of systems biology. Animal Reproduction, 2015, 12(3): 465-472.
- Mermillod P., Dalbiès-Tran R., Uzbekova S., Thélie A., Traverso J.M., Perreau C., Papillier P., Monget P. Factors affecting oocyte quality: who is driving the follicle? Reproduction in Domestic Animals, 2008, 43(2): 393-400 (doi: 10.1111/j.1439-0531.2008.01190.x).
- Dalbies-Tran R., Cadoret V., Desmarchais A., Elis S., Maillard V., Monget P., Monniaux D., Reynaud K., Saint-Dizier M., Uzbekova S. A comparative analysis of oocyte development in mammals. Cells, 2020, 9(4): 1002 (doi: 10.3390/cells9041002).
- Matzuk M.M., Burns K.H., Viveiros M.M., Eppig J.J. Intercellular communication in the mam-malian ovary: oocytes carry the conversation. Science, 2002, 296(5576): 2178-2180 (doi: 10.1126/science.1071965).
- Hsueh A.J., Kawamura K., Cheng Y., Fauser B.C. Intraovarian control of early folliculogenesis. Endocrine Reviews, 2015, 36(1): 1-24 (doi: 10.1210/er.2014-1020).
- Raposo G., Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends. Journal of Cell Biology, 2013, 200(4): 373-383 (doi: 10.1083/jcb.201211138).
- Record M., Carayon K., Poirot M., Silvente-Poirot S. Exosomes as new vesicular lipid transport-ers involved in cell-cell communication and various pathophysiologies. Biochimica et Biophysica Acta, 2014, 1841(1): 108-120 (doi: 10.1016/j.bbalip.2013.10.004).
- Di Pietro C. Exosome-mediated communication in the ovarian follicle. Journal of Assisted Repro-duction and Genetics, 2016, 33(3): 303-311 (doi: 10.1007/s10815-016-0657-9).
- Tesfaye D., Hailay T., Salilew-Wondim D., Hoelker M., Bitseha S., Gebremedhn S. Extracellular vesicle mediated molecular signaling in ovarian follicle: Implication for oocyte developmental competence. Theriogenology, 2020, 150: 70-74 (doi: 10.1016/j.theriogenology.2020.01.075).
- Machtinger R., Laurent L.C., Baccarelli A.A. Extracellular vesicles: roles in gamete maturation, fertilization and embryo implantation. Human Reproduction Update, 2016, 22(2): 182-193 (doi: 10.1093/humupd/dmv055).
- da Silveira J.C., de Ávila A.C.F.C.M., Garrett H.L., Bruemmer J.E., Winger Q.A., Bouma G.J. Cell-secreted vesicles containing microRNAs as regulators of gamete maturation. Journal of En-docrinology, 2018, 236(1): 15-27 (doi: 10.1530/JOE-17-0200).
- da Silveira J.C., Andrade G.M., Del Collado M., Sampaio R.V., Sangalli J.R., Silva L.A., Pin-affi F.V.L., Jardim I.B., Cesar M.C., Nogueira M.F.G., Cesar A.S.M., Coutinho L.L., Pe-reira R.W., Perecin F., Meirelles F.V. Supplementation with small-extracellular vesicles from ovarian follicular fluid during in vitro production modulates bovine embryo development. PLoS ONE, 2017, 12(6): e0179451 (doi: 10.1371/journal.pone.0179451).
- Giacomini E., Makieva S., Murdica V., Vago R., Viganó P. Extracellular vesicles as a potential diagnostic tool in assisted reproduction. Current Opinion in Obstetrics and Gynecology, 2020, 32(3): 179-184 (doi: 10.1097/GCO.0000000000000621).
- Uzbekova S., Almiñana C., Labas V., Teixeira-Gomes A.P., Combes-Soia L., Tsikis G., Car-valho A.V., Uzbekov R., Singina G. Protein cargo of extracellular vesicles from bovine follicular fluid and analysis of their origin from different ovarian cells. Frontiers in Veterinary Science, 2020, 7: 584948 (doi: 10.3389/fvets.2020.584948).
- Lebedeva I.Y., Singina G.N., Lopukhov A.V., Zinovieva N.A. Dynamics of morphofunctional changes in aging bovine ova during prolonged culture in vitro. Cell and Tissue Biology, 2014, 8(3): 258-266 (doi: 10.1134/S1990519X14030080).
- Miao Y.L., Kikuchi K., Sun Q.Y., Schatten H. Oocyte aging: cellular and molecular changes, developmental potential and reversal possibility. Human Reproduction Update, 2009, 15(5): 573-585 (doi: 10.1093/humupd/dmp014).
- Takahashi T., Igarashi H., Amita M., Hara S., Matsuo K., Kurachi H. Molecular mechanism of poor embryo development in postovulatory aged oocytes: mini review. The Journal of Obstetrics and Gynaecology Research, 2013, 39(10): 1431-1439 (doi: 10.1111/jog.12111).
- Ahmed T.A., Ahmed S.M., El-Gammal Z., Shouman S., Ahmed A., Mansour R., El-Badri N. Oocyte aging: the role of cellular and environmental factors and impact on female fertility. Ad-vances in Experimental Medicine and Biology, 2020, 1247: 109-123 (doi: 10.1007/5584_2019_456).
- Tarín J.J., Pérez-Albalá S., Pérez-Hoyos S., Cano A. Postovulatory aging of oocytes decreases reproductive fitness and longevity of offspring. Biology of Reproduction, 2002, 66(2): 495-499 (doi: 10.1095/biolreprod66.2.495).
- Jiang W.J., Yao X.R., Zhao Y.H., Gao Q.S., Jin Q.G., Li Y.H., Yan A.G., Xu Y.N. L-carnitine prevents bovine oocyte aging and promotes subsequent embryonic development. The Journal of Reproduction and Development, 2019, 65(6): 499-506 (doi: 10.1262/jrd.2019-046).
- Singina G.N., Shedova E.N., Lopukhov A.V., Mityashova O.S., Lebedeva I.Y. Delaying effects of prolactin and growth hormone on aging processes in bovine oocytes matured in vitro. Phar-maceuticals, 2021, 14(7): 684 (doi: 10.3390/ph14070684).
- Singina G.N., Shedova E.N., Uzbekov R.E., Uzbekova S. 135 Effect of different concentrations of follicular fluid exosome-like extracellular vesicles on in vitro oocyte maturation and embryo development in cattle. Reproduction Fertility and Development, 2021, 34(2): 305-306 (doi: 10.1071/RDv34n2Ab135).
- Asaadi A/, Dolatabad N.A., Atashi H., Raes A., Van Damme P., Hoelker M., Hendrix A., Pascottini O.B., Van Soom A., Kafi M., Pavani K.C. Extracellular vesicles from follicular and ampullary fluid isolated by density gradient ultracentrifugation improve bovine embryo develop-ment and quality. International Journal of Molecular Sciences, 2021, 22(2): 578 (doi: 10.3390/ijms22020578).
- Godakumara K., Dissanayake K., Hasan M.M., Kodithuwakku S.P., Fazeli A. Role of extracel-lular vesicles in intercellular communication during reproduction. Reproduction in Domestic Ani-mals, 2022, 57(5): 14-21 (doi: 10.1111/rda.14205).
- Almiñana C., Corbin E., Tsikis G., Alcântara-Neto A.S., Labas V., Reynaud K., Galio L., Uz-bekov R., Garanina A.S., Druart X., Mermillod P. Oviduct extracellular vesicles protein content and their role during oviduct-embryo cross-talk. Reproduction, 2017, 154(3): 153-168 (doi: 10.1530/REP-17-0054).
- Alcântara-Neto A.S., Schmaltz L., Caldas E., Blache M.C., Mermillod P., Almiñana C. Porcine oviductal extracellular vesicles interact with gametes and regulate sperm motility and survival. Theriogenology, 2020, 155: 240-255 (doi: 10.1016/j.theriogenology.2020.05.043).
- Bó G.A., Mapletoft R.J. Evaluation and classification of bovine embryos. Animal Reproduction, 2013, 10(3): 344-348.
- Prasad S., Tiwari M., Koch B., Chaube S.K. Morphological, cellular and molecular changes during postovulatory egg aging in mammals. Journal of Biomedical Science, 2015, 22(1): 36 (doi: 10.1186/s12929-015-0143-1).
- Di Nisio V., Antonouli S., Damdimopoulou P., Salumets A., Cecconi S., SIERR. In vivo and in vitro postovulatory aging: when time works against oocyte quality? Journal of Assisted Reproduction and Genetics, 2022, 39(4): 905-918 (doi: 10.1007/s10815-022-02418-y).


