Влияние внутрисосудистого лазерного облучения крови на липидный метаболизм в ткани головного мозга при перитониальном эндотоксикозе
Автор: Спирина Мария Александровна, Бойнова Ирина Владиславовна, Зеленцов Павел Викторович
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Молодые ученые
Статья в выпуске: 1-2, 2014 года.
Бесплатный доступ
Эндогенная интоксикация является пусковым фактором в развитии полиорганной и полисистемной недостаточности. В ходе эксперимента исследовано антиоксидант-ное действие гелий-неонового лазерного облучения. Установлена способность вну-трисосудистого лазерного облучения крови нивелировать дисметаболические нарушения в тканевых структурах головного мозга. Зарегистрировано снижение концентрации токсических субстанций в церебральной ткани и мембраностабилизирующее действие лазеротерапии.
Эндогенная интоксикация, перитонит, перекисное окисление липи-дов, лазерное облучение крови, головной мозг
Короткий адрес: https://sciup.org/14720065
IDR: 14720065 | УДК: 612.014.469:001.895
Текст научной статьи Влияние внутрисосудистого лазерного облучения крови на липидный метаболизм в ткани головного мозга при перитониальном эндотоксикозе
Синдром эндогенной интоксикации (СЭИ) в силу широкой распространенности в клинической практике в настоящее время привлекает внимание специалистов различного профиля [1; 3]. Выраженность эндотоксемии влияет как на прогноз заболевания, так и на его исход [2].
Характерная при эндотоксемии гипоксия запускает ряд патологических модификаций на системном и регионарном уровнях. В результате формируется полиорганная и полисистемная недоста-
peritonitis, lipid peroxidation, laser irradiation of точность, существенно увеличивающая риск летального исхода.
Ткань головного мозга весьма уязвима к снижению оксигенации. Причиной тому являются особенности метаболизма органа: несовершенство собственных систем антиоксидантной защиты, специфическая структурная организация нейрональной ткани, значительная концентрация легко окисляемых липидов, высокая интенсивность метаболических реакций. Рациональным с целью эффективной церебропротекции пред
ВЕСТНИК Мордовского университета | 2014 | № 1-2
ставляется применение в комплексной терапии способов лечения, обладающих антиоксидантным действием [4; 5].
Экспериментальное исследование проводилось на взрослых беспородных собаках (n=46). Животным под тиопен-тал-натриевым наркозом моделировали острый каловый перитонит по способу А. П. Власова (1991). В контрольные сроки (на 1-е, 3-и, 5-е сутки после релапаротомии) фиксировались показатели, характеризующие липидный метаболизм в нейрональной ткани. После проведения санации брюшной полости применялась стандартная инфузионная и антибактериальная терапия (внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела; внутривенно 1 раз в сутки инфузии 5%-ного раствора глюкозы и 0,89%-ного раствора хлорида натрия из расчета 50 мл/кг массы тела животного).
Собаки были разделены на две равные группы методом случайной выборки. Изучались выраженность эндотоксикоза, показатели липопероксидации, липидный спектр в тканевых структурах головного мозга. В опытной группе наряду со стандартным комплексом лечения проводилось гелий-неоновое внутрисосудистое лазерное облучение крови с мощностью излучения на выходе световода 5 мВт и временем воздействия 15 мин (доза 0,1 Дж/см2).
В результате эксперимента у исследуемых животных было зафиксировано формирование СЭИ, что верифицировало адекватность модели острого перитонита. Существенно возрастала концентрация гидрофильных и гидрофобных токсинов в плазме крови. Так, титр молекул средней массы (λ = 254 нм и λ = 280 нм) достоверно увеличивался на 77,04–136,54 % и 54,66–137,05 % соответственно (р<0,05). Отмечено статистически значимое снижение общей и эффективной концентрации альбумина – на 18,96–30,73 % и 34,11–52,60 % (р<0,05) соответственно, а также резерва связывания альбумина на 21,21–50,00 % (р<0,05) относительно нормальных зна- чений исследуемых показателей. Повышение индекса токсичности плазмы крови составляло 158,18–336,36 % (р<0,05) по сравнению с исходными цифрами.
СЭИ приводил к значительной интенсификации процессов перекисного окисления липидов. Экспериментальный перитонит сопровождался статистически значимым ростом спонтанного (на 28,14–188,33 %) и индуцированного (на 21,35–72,99 %) малонового диальдегида (р<0,05). Фосфолиполитическая активность повысилась на 92,31–117,95% (р<0,05), параллельно зарегистрировано уменьшение энзимного потенциала су-пероксиддисмутазы на 31,90–59,05 % (р<0,05) относительно физиологических значений изучаемых показателей.
Формирование СЭИ приводило к метаболическим перестойкам и модификации фосфолипидного спектра мембран нервных клеток (рис. 1).
Анализ полученных данных показал изменение нормального соотношения фосфолипидных фракций в спектре – значительное повышение доли лизо-фосфолипидов и свободных жирных кислот. Вместе с тем процент легко-окисляемых суммарных фосфолипидов, холестерола и фосфатидилхолина снижался относительно нормы.
Высокое содержание свободных жирных кислот и лизофосфолипидов способствует дезорганизации и дестабилизации мембранных структур клеток. Таким образом, выявленные в ходе исследования дислипидные трансформации в церебральной ткани верифицируют значительную деструкцию биомембран нейроцитов при эндотоксикозе. Данные изменения являются одним из определяющих патогенетических механизмов при эндотоксическом повреждении головного мозга.
Включение низкоинтенсивного лазерного облучения в комплексное лечение приводило к снижению выраженности СЭИ, вызванного воспалением брюшины. В опытной группе зафиксировано уменьшение содержания гидрофильных и гидрофобных токсических субстанций в плазме крови животных на 14,54–31,49 % и 3,93-24,96 % (р<0,05) соответственно по сравнению с данными контроля. В группе, получавшей лазеротерапию, существенно снижался индекс токсичности плазмы крови – на 23,08–52,89 % (р<0,05) по сравнению с животными, проходившими стандартное лечение. Следует отметить, что на заключительном этапе эксперимента с применением гелий-неонового внутрисосудистого лазерного облучения крови индекс токсичности возвращался к начальному значению.
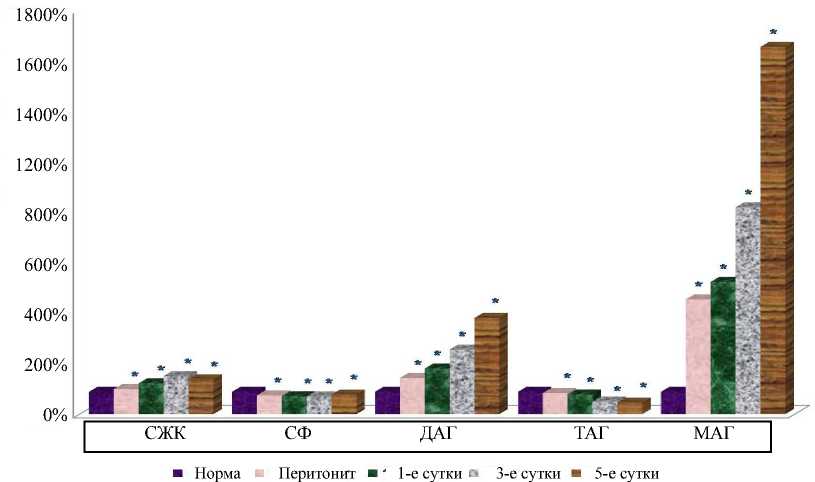
* – достоверность отличия по отношению к исходу при p<0,05; СЖК – свободные жирные кислоты; СФ – сфингомиелин; ДАГ – диацилглицеролы; ТАГ – триацилглицеролы; МАГ – моноацилглицеролы.
Серия «Естественные и технические науки»
Р и с . 1 . Модификация липидного спектра в ткани головного мозга при токсическом поражении органа
В опытной группе отмечалось уменьшение титра ТБК-активных продуктов в церебральной ткани. Титр спонтанного малонового диальдегида был на 43,96 % (р<0,05) ниже контрольных показателей в финале эксперимента. На 5-е сутки после санации брюшной полости содержание индуцированного малонового диальдегида также статистически значимо уменьшалось по сравнению с группой контроля на 9,48 % (р<0,05).
Внутрисосудистое лазерное облучение крови снижало интенсивность процессов липопероксидации при перитоните. На фоне комплексного лечения на 5-е сутки послеоперационного периода зарегистри- ровано снижение энзимного потенциала фосфолипазы А2 в тканевых структурах головного мозга на 21,05% (р<0,05) по сравнению с контрольными показателями. Также отмечалось увеличение ферментативной активности супероксиддисмута-зы на 3-и и 5-е сутки исследования – на 27,76 и 24,48% (р<0,05) соответственно. Приведенные данные демонстрируют увеличение собственного антиоксидантного потенциала нейрональной ткани в группе животных, получавших лазеротерапию.
Под воздействием лазеротерапии в ходе эксперимента отмечена тенденция к нормализации липидного спектра мембранных структур клеток головного мозга.
Применение гелий-неонового лазерного облучения крови снижало содержание свободных жирных кислот, моно- и диаци-лглицеролов в церебральной ткани относительно значений идентичных показателей в контрольной группе на 19,48, 22,18 и 42,21% (р<0,05) на 5-е сутки проводимого лечения. Отмечалось достоверное нарастание титра суммарных фосфолипидов в ткани головного мозга на 16,85% (р<0,05) вместе с уменьшением содержания фракций лизофосфолипидов и фосфатидилино-зита на 19,48 и 12,44 % (р<0,05) на заключительном этапе эксперимента (рис. 2).
300%
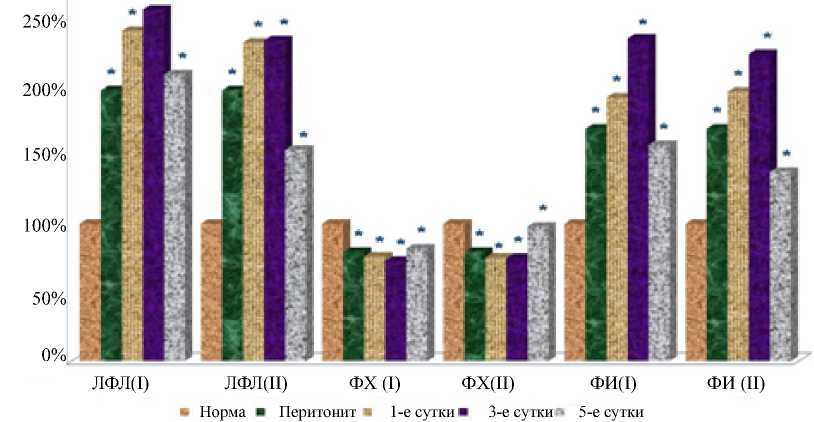
* – достоверность отличия по отношению к исходу при p<0,05; I – контрольная группа; II – опытная группа; ЛФЛ – лизофосфолипиды; ФХ – фосфатидилхолин; ФИ – фосфатидилинозит.
Рис. 2. Динамика соотношения фосфолипидных фракций на фоне применения лазеротерапии
ВЕСТНИК Мордовского университета | 2014 | № 1-2
На 5-е сутки послеоперационного периода доля фосфатидилхолина была выше контрольных значений на 19,69 % (р<0,05), достоверно не отличаясь от нормальных значений.
Таким образом, полученные в результате исследования данные показали, что низкоэнергетическое гелий-неоновое лазерное облучение крови при эндотоксикозе способствует снижению содержания токсичных продуктов перекисного окисления липидов в церебральной ткани за счет своего антиоксидантного действия.
Внедрение лазеротерапии в комплексное лечение на раннем послеоперационном периоде уменьшает интенсивность фосфолиполитических реакций в тканевых структурах изучаемого органа, корригируя возникающие при СЭИ дисметаболические нарушения.
Полученные в ходе эксперимента показатели верифицировали благоприятное действие внутрисосудистого лазерного облучения крови на липидный метаболизм нейрональных мембран, ингибируя также мембранодеструктивные процессы в клетках головного мозга.
Список литературы Влияние внутрисосудистого лазерного облучения крови на липидный метаболизм в ткани головного мозга при перитониальном эндотоксикозе
- Арбулиев, К. М. Местная сорбционная терапия и ее эффективность в коррекции эндогенной интоксикации у больных острым гнойным пиелонефритом паранефритом/К. М. Арбулиев [и др.]//Урология. -2013. -№ 2. -С. 28-34.
- Власов, А. П. Взаимосвязь функционально-метаболического статуса миокарда и печени при эндоксикозе/А. П. Власов [и др.]//Фундаментальные исследования. -2012. -№ 5. -Ч. 2. -С. 168.
- Матвеев, С. Б. Эндогенная интоксикация в раннем послеоперационном периоде у больных сочетанной травмой живота и массивной кровопотерей/С. Б. Матвеев [и др.]//Клиническая лабораторная диагностика. -2012. -№ 6. -С. 27-29.
- Gasparova, Z. Effect of antioxidants on functional recovery after in vitro-induced ischemia and longterm potentiation recorded in the pyramidal layer of the CA1 area of rat hippocampus/Z. Gasparova, V. Stara, S. Stolc//General Physiology and Biophysics. -2013. -August 12.
- Perrone, S. Oxidative stress and antioxidant strategies in newborns/S. Perrone [et al.]//Journal of Maternal-Fetal and Neonatal Medicine. -Oct. 2010. -Vol. 23. -№ S3. -P. 63-65.


