Влияние воспаления дыхательных путей на качество жизни у курящих больных персистирующей бронхиальной астмой
Автор: Гноевых Валерий Викторович, Генинг Татьяна Петровна, Смирнова Анна Юрьевна, Портнова Юлия Анатольевна, Чувалов Леонид Леонидович, Шацкова Татьяна Анатольевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Индивидуальное и общественное здоровье
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
Установлено повышение уровня матриксной металопротеиназы-9 в сыворотке крови у курящих больных персистирующей бронхиальной астмой (БА). Интенсификация воспаления при табакокурении дополнительно ухудшает вентиляционную способность легких и кислородтранспортную функцию крови, снижает качество жизни больных БА.
Качество жизни, воспаление, бронхиальная астма, табакокурение
Короткий адрес: https://sciup.org/14113035
IDR: 14113035 | УДК: 616.248
Текст научной статьи Влияние воспаления дыхательных путей на качество жизни у курящих больных персистирующей бронхиальной астмой
Введение. Табакокурение является важным дополнительным экзогенным фактором формирования воспаления и гиперреактивности дыхательных путей, играющих ключевую роль в патогенезе бронхиальной астмы [1, 6]. Повреждение матрикса в том числе связано с действием матриксных металлопротеиназ, вырабатываемых эпителиальными и воспалительными клетками в ответ на табачный дым [3, 4].
Цель исследования. Оценить влияние воспаления дыхательных путей на качество жизни курящих больных персистирующей бронхиальной астмой (БА).
Материалы и методы. Обследована выборка из 128 лиц молодого возраста: 93 больных персистирующей бронхиальной астмой и 35 некурящих здоровых лиц в возрасте 20,80±2,49 года, составивших контрольную группу (КГ). Влияние табакокурения на функциональное состояние пульмокардиаль-ной системы оценивали, разделив больных БА на группу курящих (основная группа (ОГ), n=46) в возрасте 30,30±4,18 года и группу некурящих (группа сравнения (ГС), n=47) в возрасте 27,09±3,12 года. Диагноз бронхиальной астмы ставился в соответствии с положениями Глобальной стратегии лечения и профилактики бронхиальной астмы [1].
Статус табакокурения изучали согласно рекомендациям Практического руководства по лечению табачной зависимости [5].
Качество жизни в выборке исследовали с помощью русской версии опросника SF-36 [2, 7].
Оценку степени контроля бронхиальной астмы проводили двумя основными способами: с помощью АСТ-теста (Asthma Control Test) [1] и шкалы контроля над бронхиальной астмой (Asthma Control Scoring System, ACSS), разработанной Boulet et al., учитывающей как субъективные данные (количество приступов, использование короткодействующих β2-агонистов, ограничение физической нагрузки), так и объективные показатели лабораторно-инструментальных и функциональных исследований (объем форсированного выдоха за 1 с (ОФВ1), вариабельность пиковой скорости выдоха (ПСВ) при пикфлоуметрии, количество эозинофилов в индуцированной мокроте). ACSS включает клиническую и функциональную оценки, а также оценку выраженности воспаления (по выраженности эозинофилии мокроты).
Результаты и обсуждение. Распространенность табакокурения среди больных бронхиальной астмой составила 51 %. Оказалось, что систематически курят 49 % лиц, а эпизодически – еще 2 %.
Мониторинг потребления табака у больных персистирующей БА выявил существенное преобладание категории курящих, составивших 59 % от общего числа пациентов основной группы. Малокурящие и интенсивно курящие больные встретились в основной группе с одинаковой относительной частотой – 21 % (рис. 1).
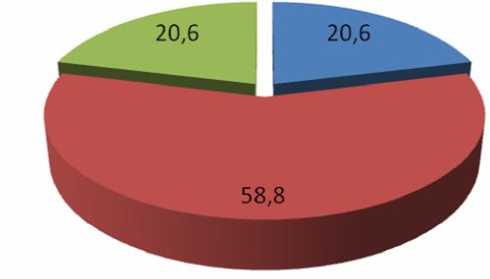
Рис. 1. Структура интенсивности табакокурения среди больных персистирующей БА
-
■ Малокурящие больные БА, %
-
■ Курящие больные БА, %
-
■ Интенсивно курящие больные БА, %
Статус табакокурения характеризовался умеренной (11,6±10,0 года) продолжительностью, различной, чаще повышенной (индекс курения ИК=177,90±75,46 балла), интенсивностью и умеренной (5,40±2,93 балла) привычкой к курению.
По результатам АСТ-теста полный контроль (25 баллов) над симптомами бронхиальной астмы был достигнут у 35,1 % некурящих и лишь у 11,1 % курящих больных, частичный контроль (20–24 балла) – у 21,6 % некурящих и лишь у 15,6 % курящих пациентов, а неконтролируемая БА (<20 баллов) была выявлена у 43,2 % некурящих и 73,3 % курящих больных.
Структурный анализ с использованием Asthma Control Scoring System of Boulet et al. показал, что курение негативно влияет в первую очередь на функциональную составляющую общего контроля в сочетании с тенденцией к ухудшению клинического контроля над астмой (рис. 2).
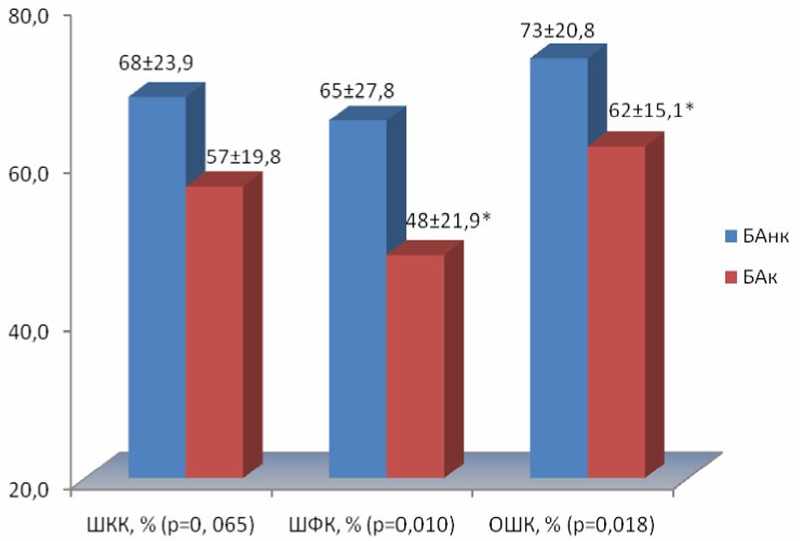
Рис. 2. Влияние табакокурения на контроль над персистирующей БА (Asthma Control Scoring System of Boulet et al.):
БАнк – некурящие больные персистирующей БА; БАк – курящие больные персистирующей БА; ШКК – шкала клинического контроля; ШФК – шкала функционального контроля; ОШК – общая шкала контроля над бронхиальной астмой; * – достоверное (р<0,05) отличие показателей при сравнении групп БАнк и БАк; р – вероятность α-ошибки
Проведение СО-метрии выдыхаемого воздуха (для оценки интенсивности воспаления дыхательных путей у некурящих больных БА) позволило выявить достоверное (р=0,000) увеличение уровня СО в выдыхаемом воздухе (FeCO) с 2,20±1,21 ppm у здоровых некурящих лиц до 3,4±1,0 ppm у некурящих больных персистирующей бронхиальной астмой. Подобный рост FeCO – результат усиления эндогенной выработки СО (с образованием эндогенного карбоксигемоглобина), что, по мнению международных экспертов, является одним из важнейших маркеров воспаления дыхательных путей у больных БА.
Об интенсификации воспаления дыхательных путей свидетельствует выявленный нами рост (р<0,05) уровня ММП-9 в основной группе (с 1,20±0,19 в КГ до 2,9±0,7 нг/мл). Уровень ММП-2 в основной группе (34,50±1,38 нг/мл) достоверно (р=0,06) не отличался от значения данного показателя в контрольной группе (30,80±1,58 нг/мл) курильщиков.
В основной группе мы выявили зависимость между уровнем ММП-9 и такими важнейшими характеристиками статуса курения, как ИК (r=0,60; p<0,05) и показатель пач-ка/лет (r=0,53; p<0,05). Таким образом, более интенсивное и продолжительное курение способствует возникновению и поддержанию воспаления дыхательных путей, о котором свидетельствует рост уровня ММП-9 в сыворотке крови курильщиков с БА.
Табакокурение за счет образования большого количества карбоксигемоглобина оказало негативное влияние на насыщение гемоглобина кислородом (SpO 2 ), что привело к достоверному дополнительному снижению корригированного по окиси углерода SpO 2 в основной группе как по сравнению с контрольной группой, так и по сравнению с некурящими больными бронхиальной астмой (табл. 1).
У больных персистирующей бронхиальной астмой выявлены преимущественно об- структивные нарушения вентиляционной способности легких. У курящих больных БА дополнительно снизились жизненная емкость легких (ЖЕЛ), форсированная жизненная емкость легких (ФЖЕЛ), ОФВ1, ПСВ, ОФВ1/ЖЕЛ, ОФВ1/ФЖЕЛ, мгновенная объемная скорость воздуха на уровне выдоха 25 % (МОС25), МОС50 и МОС75 по сравнению с некурящими пациентами.
Проведенный нами кластерный анализ с правилом объединения по принципу полной связи (complete linkage) выявил тесную взаимосвязь интенсивности потребления табака и ассоциированного с ним воспаления дыхательных путей с целым комплексом важней- ших физиологических и клинических характеристик функционирования пульмокарди-альной системы: выраженностью обструкции бронхиального дерева, уровнем корригированной по карбоксигемоглобину оксигенации крови, степенью функционального и клинического контроля персистирующей бронхиальной астмы.
Качество жизни (КЖ) как некурящих, так и курящих больных бронхиальной астмой достоверно ухудшилось по сравнению с контрольной группой. В частности, регрессировали (р<0,05) все показатели физического компонента здоровья и большинство составляющих психологического компонента здоровья.
Таблица 1
|
Параметры |
КГ |
БАнк |
БАк |
р |
|||
|
M |
SD |
M |
SD |
M |
SD |
БАнк – БАк |
|
|
FeCO, ppm |
2,2 |
1,21 |
3,4* |
1,00 |
14,5* |
4,88 |
0,000 |
|
COHb, % |
0,4 |
0,19 |
0,54* |
0,160 |
2,3* |
0,78 |
0,000 |
|
SpO 2кор , % |
98,0 |
1,03 |
97,0* |
1,87 |
96,0* |
1,40 |
0,000 |
Примечание. SpO2кор – уровень насыщения гемоглобина кислородом, корригированный по карбоксигемоглобину; M – среднее значение; SD – стандартное отклонение; * – достоверное (р<0,05) отличие показателей от их уровня в контрольной группе; р – вероятность α-ошибки при сравнении БАнк и БАк (тест Манна–Уитни).
Влияние табакокурения на оксигенацию крови у больных персистирующей БА
Детализация негативного влияния нарушений оксигенации на качество жизни, проведенная в основной группе, позволила выявить корреляционные взаимосвязи между выраженностью обструктивных нарушений, снижением корригированной по карбоксигемоглобину оксигенации крови (в т.ч. в восстановительный период после пробы с произвольной задержкой дыхания) и важнейшими характеристиками физического и психологического компонентов здоровья у курящих больных персистирующей БА (табл. 2).
Потеря контроля над заболеванием оказывает негативное влияние на основные составляющие качества жизни при бронхиальной астме. Оказалось, что низкий уровень контроля ухудшает физическое функциони- рование (r=0,54; p=0,000), психологическое здоровье (r=0,46; p=0,008), физический (r=0,49; p=0,001) и психологический компоненты здоровья (r=0,45; p= 0,024).
Заключение. Таким образом, персистирующее воспаление дыхательных путей и связанные с ним обструктивные нарушения вентиляционной способности легких c закономерным ухудшением оксигенации крови у больных персистирующей БА приводят к потере контроля над заболеванием, в первую очередь влияя на функциональную составляющую общего контроля в сочетании с тенденцией к ухудшению клинического контроля над астмой, и оказывают отрицательное влияние на качество жизни пациентов.
Таблица 2
|
Корреляции по Спирмену |
n |
r |
p |
|
ОФВ 1 и ФФ |
42 |
0,49 |
0,001 |
|
ОФВ 1 и жизнеспособность |
42 |
0,40 |
0,008 |
|
ОФВ 1 и ПКЗ |
42 |
0,37 |
0,016 |
|
ОФВ 1 и ФКЗ |
42 |
0,36 |
0,019 |
|
ОФВ 1 и ПКЗ |
40 |
0,49 |
0,001 |
|
SpO 2кор и ФФ |
43 |
0,33 |
0,033 |
|
SpO 2кор и боль |
43 |
0,38 |
0,012 |
|
SpO 2кор и РЭФ |
40 |
0,41 |
0,008 |
|
SpO 2кор и ФКЗ |
43 |
0,32 |
0,036 |
|
SpO 2кор и ПКЗ |
41 |
0,32 |
0,039 |
|
SpO 2восст-кор и ФФ |
43 |
0,40 |
0,007 |
Примечание. ФФ, РЭФ – физическое функционирование, ролевое физическое функционирование, ролевое эмоциональное функционирование и социальное функционирование; ФКЗ и ПКЗ – физический и психологический компоненты здоровья; SpO2восст-кор – уровень насыщения гемоглобина кислородом, корригированный по карбоксигемоглобину в восстановительный период после пробы с произвольной задержкой дыхания на вдохе; р – вероятность α-ошибки.
Нарушения вентиляционной функции легких, нарушения оксигенации крови и качество жизни больных БА
-
1. Глобальная стратегия лечения и профилактики бронхиальной астмы (Global Initiative for Asthma, GINA). Пересмотр 2010–2013 гг. – URL: http://www.ginasthma.org .
-
2. Новик А. А. Руководство по исследованию качества жизни в медицине : практическое пособие / А. А. Новик, Т. И. Ионова. – М. : Нева, 2007. – 320 с.
-
3. Роль матриксных металлопротеиназ в формировании морфофункционального дисбаланса воздухоносных путей при хронической обструктивной болезни легких / В. А. Невзорова [и др.] // Тихоокенский медицинский журн. – 2011. – № 2. – С. 9–13.
-
4. Фомина В. В. Роль системы матриксных металлопротеиназ в патогенезе профессиональных заболеваний органов дыхания : автореф. дис.... канд. мед. наук / В. В. Фомина. – М., 2010. – 24 с.
-
5. Чучалин А. Г. Практическое руководство по лечению табачной зависимости / А. Г. Чуча-лин, Г. М. Сахарова, К. Ю. Новиков // РМЖ. – 2001. – Т. 9, № 21. – С. 904–911.
-
6. Thomson N. C. Asthma and cigarette smoking / N. C. Thomson, R. Chaudhuri, E. Livingston
-
// Eur 7 . . Re W sp a i r . e J. J – . 2 E 0 . 0S4F. -–3V6 oHl.e2a4lt.h– PSu. r8v2e2y–. 83M3a. nual and interpretation guide / J. E. Ware, K. K. Snow, M. Kosinski. – Boston, Mass. : The Health Institute ; New England Medical Center, 1993. – P. 1124–1132.
-
INFLUENCE OF THE INFLAMMATION ON QUALITY OF LIFE AT SMOKERS WITH BRONCHIAL ASTHMA
V.V. Gnoyevykh, T.P. Gening, A.Yu. Smirnovа, Yu.A. Portnova, L.L. Chuvalov, T.A. Shatskova
Ulyanovsk State University
Список литературы Влияние воспаления дыхательных путей на качество жизни у курящих больных персистирующей бронхиальной астмой
- Глобальная стратегия лечения и профилактики бронхиальной астмы (Global Initiative for Asthma, GINA). Пересмотр 2010-2013 гг. -URL: http://www.ginasthma.org.
- Новик А. А. Руководство по исследованию качества жизни в медицине: практическое пособие/А. А. Новик, Т. И. Ионова. -М.: Нева, 2007. -320 с.
- Роль матриксных металлопротеиназ в формировании морфофункционального дисбаланса воздухоносных путей при хронической обструктивной болезни легких/В. А. Невзорова //Тихоокенский медицинский журн. -2011. -№ 2. -С. 9-13.
- Фомина В. В. Роль системы матриксных металлопротеиназ в патогенезе профессиональных заболеваний органов дыхания: автореф. дис.. канд. мед. наук/В. В. Фомина. -М., 2010. -24 с.
- Чучалин А. Г. Практическое руководство по лечению табачной зависимости/А. Г. Чучалин, Г. М. Сахарова, К. Ю. Новиков//РМЖ. -2001. -Т. 9, № 21. -С. 904-911.
- Thomson N. C. Asthma and cigarette smoking/N. C. Thomson, R. Chaudhuri, E. Livingston//Eur. Respir. J. -2004. -Vol. 24. -P. 822-833.
- Ware J. E. SF-36 Health Survey. Manual and interpretation guide/J. E. Ware, K. K. Snow, M. Kosinski. -Boston, Mass.: The Health Institute; New England Medical Center, 1993. -P. 1124-1132.


