Влияние введения имунофана на морфометрические параметры и гистологическое строение Пейеровых бляшек тонкой кишки крыс на фоне иммуносупрессии, вызванной введением циклофосфана
Автор: Морозова Е.Н., Морозов В.Н., Тверская А.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 3, 2021 года.
Бесплатный доступ
Цель исследования - изучение морфометрических параметров и гистологического строения пейеровых бляшек тонкой кишки крыс после введения имунофана на фоне иммуносупрессии, вызванной ц иклофосфаном. Материалы и методы. Исследование проводилось на 36 белых крысах-самцах массой 210-250 г. Животные были разделены на две группы. В I группе крысам в 1-е сут эксперимента вводился циклофосфан в дозе 200 мг/кг, на 2, 4, 6, 8,10-е сут имунофан в дозе 0,7мкг/кг массы тела; II группу составили интактные крысы. Животные выводились из эксперимента на 7, 30, 90-е сут после завершения введения имунофана. Измерялись длина и ширина пейеровых бляшек, а также расстояние от илеоцекального угла до первой из них, а на гистологических срезах - высота и ширина их лимфатических узелков и межузелковых зон. Результаты. У половозрелых животных на 7-е и 30-е сут наблюдения длина и ширина пейеровых бляшек увеличивалась на 18,71 и 16,94 % и 3,56 и 24,22 % соответственно по сравнению с данными интактных крыс, а расстояние от илеоцекального угла до первой из них уменьшалось на 6,15 и 19,80 %. При микроскопическом исследовании высота и ширина лимфатических узелков пейеровых бляшек были больше по сравнению с данными интактных крыс на 29,79 и 12,73 % (7-е сут), 10,49 и 12,46 % (30-е сут), а линейные размеры межузелковых зон - на 39,35 и 10,33 % (7-е сут), 4,77 и 4,25 % (30-е сут). К 90-м сут макроскопические параметры пейеровых бляшек, а также высота и ширина их лимфатических узелков и межузелковых зон приближались к данным интактных животных. Выводы. При использовании имунофана на фоне экспериментальной иммуносупрессии значения исследуемых макро- и микроморфометрических параметров пейеровых бляшек тонкой кишки половозрелых крыс в ходе эксперимента постепенно приближались к аналогичным показателям интактных крыс, что свидетельствует о нивелировании иммуносупрессивного эффекта циклофосфана.
Крысы, тонкая кишка, пейеровы бляшки, имунофан, циклофосфан
Короткий адрес: https://sciup.org/14122861
IDR: 14122861 | УДК: 612.017.1:616-092.9 | DOI: 10.34014/2227-1848-2021-3-141-152
Текст научной статьи Влияние введения имунофана на морфометрические параметры и гистологическое строение Пейеровых бляшек тонкой кишки крыс на фоне иммуносупрессии, вызванной введением циклофосфана
Введение. В связи с ухудшением экологической ситуации на планете за последние годы усилилось влияние различных экзогенных факторов на организм человека [1, 2]. Слизистая оболочка пищеварительной трубки является одной из наиболее значительных по площади поверхностей организма, которые находятся в постоянном взаимодействии с внешней средой [3]. Тонкая кишка подвергается длительному воздействию экзогенных антигенов, а контакт с ними при длительном прохождении пищи через пищеварительный тракт является очень тесным, что объясняет наличие в тонкой кишке лимфоидной ткани, которая во многом определяет степень здоровья человека и его адаптационные возможности [4].
При попадании чужеродных веществ в организм человека и животных функции лимфоидной ткани тонкой кишки могут нарушаться. Это приводит к возникновению аллергических реакций, иммунодефицитных состояний, а также аутоиммунных заболеваний [5].
В практической медицине с целью коррекции выявленных нарушений используются как иммуномодуляторы, так и иммунодепрессанты [6, 7]. В целях обеспечения безопасно- сти для здоровья человека препараты каждой группы должны применяться по строгим показаниям, а эффективность их использования должна подтверждаться изучением состояния органов-мишеней на макроскопическом и микроскопическом уровнях [6].
Среди препаратов иммунодепрессивного действия широкое распространение получил циклофосфан, который входит во многие схемы противоопухолевой терапии, используется для профилактики отторжения трансплантатов, а также для лечения аутоиммунных заболеваний. Ингибирование функциональной активности клеток иммунной системы является одной из главных причин токсического действия циклофосфана, поэтому проблема снижения его побочных действий является весьма актуальной [8, 9].
Одним из препаратов нового поколения, который используется в качестве иммуномодулятора с профилактической или лечебной целью в России и Украине, является имуно-фан [10–12]. Однако данные, касающиеся влияния имунофана на лимфоидную ткань тонкой кишки, в доступной литературе практически отсутствуют.
Цель исследования. Изучение морфометрических параметров и гистологического строения пейеровых бляшек тонкой кишки крыс после введения имунофана на фоне иммуносупрессии, вызванной циклофосфаном.
Материалы и методы. Поскольку строение и функционирование иммунной системы человека и крысы имеют много общего [4], в качестве подопытных животных в эксперименте были использованы крысы. Исследование проводили на 36 белых половозрелых крысах-самцах массой 210–250 г. Животные были разделены на две группы по 18 животных в каждой. В I группу входили крысы, которым в 1-е сут эксперимента вводили циклофосфан в дозе 200 мг/кг, на 2, 4, 6, 8, 10-е сут – имунофан в дозе 0,7 мкг/кг массы тела; II группу составили интактные крысы. Содержание и манипуляции над животными осуществляли в соответствии с правилами содержания экспериментальных животных, установленными Ди- рективой 2010/63/EU Европейского парламента и Совета Европейского союза [13].
Животных выводили из эксперимента под эфирным наркозом на 7, 30, 90-е сут после завершения введения имунофана. Выделяли тонкую кишку при помощи специального инструмента [14], определяли ее длину. При помощи штангенциркуля измеряли длину и ширину пейеровых бляшек, а также расстояние от илеоцекального угла до первой из них. Затем тонкую кишку фиксировали в 10 % растворе формалина, после чего подвергали стандартной гистологической проводке. Срезы толщиной 5–6 мкм окрашивали гематокси-лин-эозином. При помощи автоматизированного морфометрического комплекса, включающего световой микроскоп Olympus CX41, цифровую фотокамеру и персональный компьютер с набором прикладных программ, измеряли высоту и ширину лимфатических узелков и межузелковых зон в каждом скоплении лимфоидной ткани [15].
Обработку цифровых данных проводили с помощью программы Statistica (определяли t-критерий Стьюдента; достоверными считали отличия с уровнем значимости p≤0,05).
Результаты и обсуждение. Макроскопически пейеровы бляшки у крыс имеют одинаковую окраску с окружающими тканями, овальную, округлую, реже неправильную форму, выступают над поверхностью слизистой оболочки тонкой кишки со стороны свободного края органа (рис. 1). Первое скопление лимфоидной ткани определялось, как правило, в дистальном отделе двенадцатиперстной кишки, последнее – в области илеоцекального угла со стороны подвздошной кишки.
Длина органа у экспериментальных животных достоверно не отличалась от таковой у контрольных крыс во все сроки наблюдения (рис. 2).
У половозрелых животных на 7-е сут наблюдения длина и ширина групповых лимфатических узелков увеличивались на 18,71 и 16,94 % по сравнению с данными интактных крыс, а расстояние от илеоцекального угла до первого из них уменьшалось на 6,15 % (табл. 1).
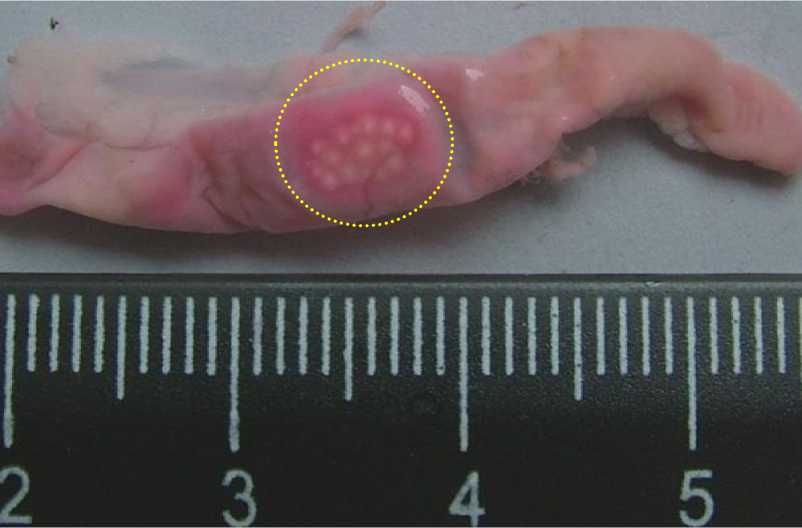
Рис. 1. Пейерова бляшка тонкой кишки половозрелой крысы-самца на 30-е сут наблюдения после применения специального метода визуализации по С.А. Кащенко [16]
Fig. 1. Peyer’s patch of the small intestine in a mature male rat on the 30th day of observation after using a special imaging method according to S.A. Kashchenko [16]
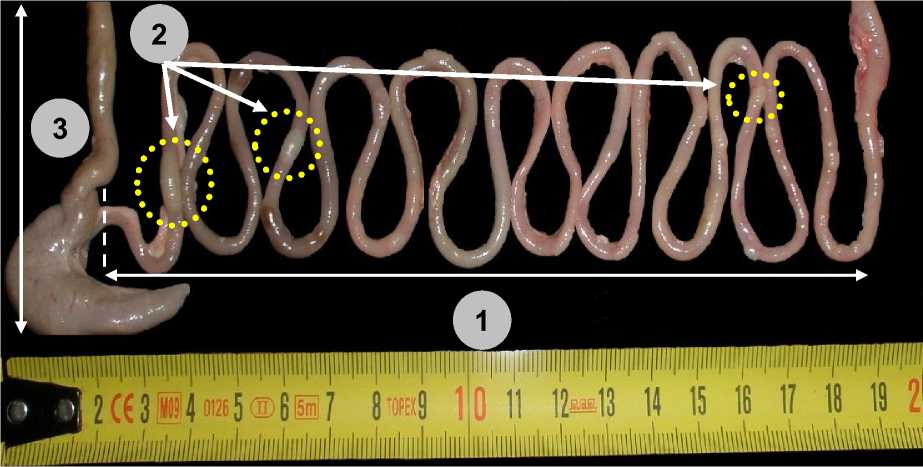
Рис. 2. Тонкая кишка (1) с пейеровыми бляшками (2) и участок толстой кишки (3) половозрелых крыс-самцов на 30-е сут наблюдения после коррекции имунофаном циклофосфаниндуцированной иммуносупрессии
Fig. 2. Small intestine (1) with Peyer's patches (2) and a part of the large intestine (3) of mature male rats on the 30th day of observation after treatment of cyclophosphamide-induced immunosuppression with imunofan
К 30-м сут линейные размеры пейеровых бляшек возрастали на 3,56 и 24,22 %. При этом расстояние от илеоцекального угла до первой из них уменьшалось на 19,80 % по сравнению с данными интактных крыс. К 90-м сут наблюдения экспериментальные данные приближались к контрольным параметрам.
На гистологических препаратах (рис. 3) пейеровы бляшки половозрелых крыс-самцов состоят из скоплений лимфатических узелков (от 4 до 15). Поверхность их гладкая и обращена в просвет кишки, а прилежащие участки межузелковой зоны покрыты ворсинками, которые частично прикрывают поверхность лимфатических узелков. Лимфатические узелки залегают в собственной пластинке слизистой оболочки и подслизистой основе, располагаясь в один ряд.
Таблица 1
Table 1
Линейные параметры тонкой кишки половозрелых животных подопытной и интактной групп в разные сроки наблюдения после коррекции экспериментальной иммуносупрессии с помощью имунофана (M±m)
Linear parameters of the small intestine in mature rats in the experimental and intact groups at different stages after treatment of experimental immunosuppression with imunofan (M±m)
|
Линейные параметры, мм Linear parameters, mm |
7-е сут Day 7 |
Контроль Control |
30-е сут Day 30 |
Контроль Control |
90-е сут Day 90 |
Контроль Control |
|
Длина тонкой кишки Small intestine length |
842,50±25,00 |
836,00±26,60 |
915,30±31,00 |
900,00±24,40 |
1105,00±30,40 |
1100,00±30,00 |
|
Длина пейеровой бляшки Peyer’s patch length |
5,33±0,32* |
4,49±0,20 |
5,23±0,17* |
5,05±0,08 |
4,90±0,17 |
4,87±0,15 |
|
Ширина пейеровой бляшки Peyer’s patch width |
2,83±0,15* |
2,42±0,09 |
2,77±0,12* |
2,23±0,05 |
2,25±0,12 |
2,24±0,05 |
|
Расстояние от илеоцекального угла до первой пейеровой бляшки Distance from ileocecal angle to the first Peyer’s patch |
48,80±1,73 |
52,00±2,58 |
39,70±2,81* |
49,50±1,07 |
49,00±1,20 |
49,50±1,07 |
Примечание. * – различия достоверны по сравнению с контрольной группой (р≤0,05).
Note. * – the differences are significant compared with the control group (p≤0.05).
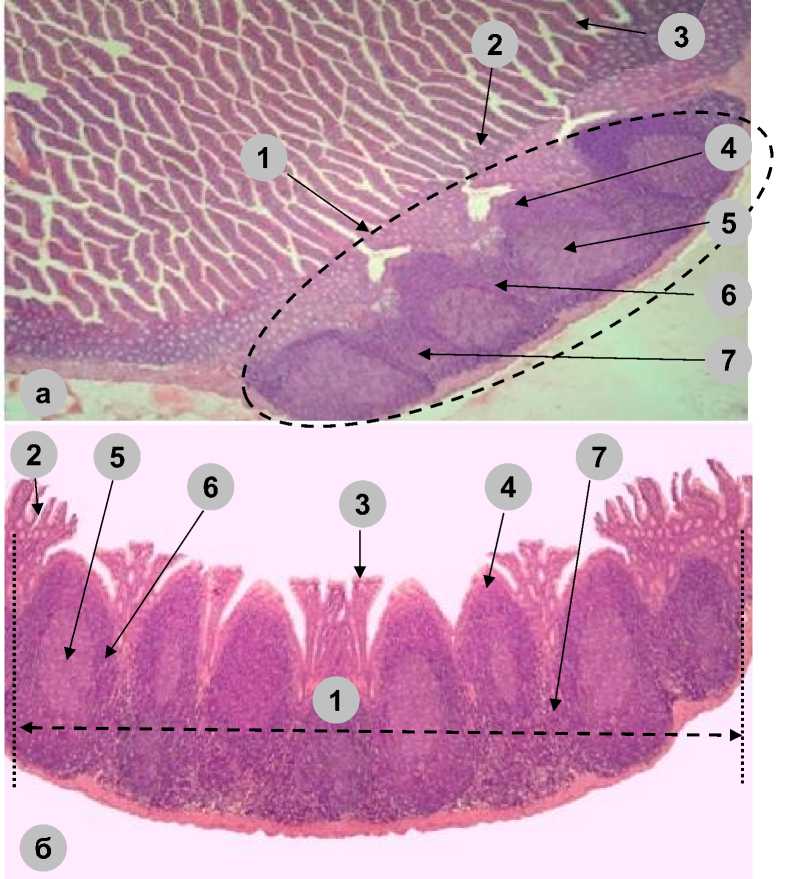
Рис. 3. Пейеровы бляшки в стенке тонкой кишки половозрелых крыс:
а) интактные; б) на 30-е сут после коррекции имунофаном циклофосфаниндуцированной иммуносупрессии (1 – пейерова бляшка; 2 – крипта; 3 – ворсинка; 4 – купол;
5 – герминативный центр; 6 – периферическая зона; 7 – межузелковая зона.
Окраска: гематоксилин-эозин. Приближение: Zoom 162. Объектив: Plan C N 4x/0.25∞/-/FN22)
-
Fig. 3. Peyer's patches in the small intestine wall in mature rats:
-
a) intact, b) on the 30th day after treatment of cyclophosphamide-induced immunosuppression with imunofan (1 – Peyer's patch, 2 – crypt, 3 – villus, 4 – dome, 5 – germinal center, 6 – peripheral zone, 7 – internodular zone.
Staining: hematoxylin-eosin. Magnification: Zoom 162. Lens: Plan C N 4x/0.25∞/-/FN22)
У половозрелых животных экспериментальной группы высота и ширина лимфатических узелков были больше по сравнению с данными интактных крыс на 29,79 и 12,73 % (7-е сут), на 10,49 и 12,46 % (30-е сут); линейные размеры межузелковых зон возрастали на 39,35 и 10,33 % (7-е сут), на 4,77 и 4,25 % (30-е сут). К 90-м сут высота и ширина лимфа- тических узелков и межузелковых зон приближались к данным интактных животных (табл. 2).
Микроскопически каждый лимфатический узелок в скоплении лимфоидной ткани состоит из купола, периферической зоны, герминативного центра и отграничен от соседних узелков межузелковой зоной.
Таблица 2
Table 2
Морфометрические параметры пейеровых бляшек в тонкой кишке половозрелых животных экспериментальной и интактной групп в разные сроки наблюдения после коррекции имунофаном циклофосфаниндуцированной иммуносупрессии (M±m)
Morphometric parameters of Peyer’s patches in the small intestine of mature rats of experimental and intact groups at different stages of observation after treatment of cyclophosphamide-induced immunosuppression with imunofan, M±m (n=36)
|
Линейные параметры, мкм Linear parameters (mcm) |
7-е cут Day 7 |
Контроль Control |
30-е cут Day 30 |
Контроль Control |
90-е cут Day 90 |
Контроль Control |
|
Высота лимфатического узелка Lymphatic nodule height |
1393,00± 56,30* |
978,00± 31,50 |
1115,00± 32,30* |
998,00± 38,30 |
998,00± 13,10 |
1000,00± 33,60 |
|
Ширина лимфатического узелка Lymphatic nodule width |
1100,00± 27,00* |
960,00± 41,60 |
859,00± 42,00* |
752,00± 30,00 |
973,00± 13,90 |
970,00± 48,20 |
|
Высота межузелковой зоны Internodular zone height |
709,00± 28,00* |
430,00± 18,40 |
398,00± 25,50* |
379,00± 17,60 |
288,00± 17,80 |
285,00± 13,40 |
|
Ширина межузелковой зоны Internodular zone width |
455,00± 12,70* |
408,00± 19,20 |
400,00± 29,60* |
383,00± 17,00 |
516,00± 6,13 |
511,00± 25,20 |
Примечание. * – различия достоверны по сравнению с контрольной группой (р≤0,05).
Note. * – the differences are significant compared with the control group (p≤0.05).
Купол лимфатических узелков обращен в просвет тонкой кишки, покрыт эпителиоцитами и содержит малые и средние лимфоциты, реже – макрофаги и плазмоциты. В периферической зоне клетки расположены более компактно и представлены преимущественно малыми лимфоцитами. Изредка встречаются макрофаги, ретикулоциты и единичные плазмоциты. В герминативном центре выявляются клетки с картинами митоза, большие лимфоциты, плазмоциты, макрофаги, ретикулоциты, реже – средние и малые лимфоциты (рис. 4).
Межузелковая зона хорошо выражена и отличается более низкой, чем в узелках, плотностью расположения клеток. На гистологических срезах в ней выявляется умеренное количество сосудов микроциркуляторного русла, малые, средние и большие лимфоциты, макрофаги и ретикулоциты.
Анализ результатов показал, что длина тонкой кишки у половозрелых белых крыс-самцов экспериментальной группы достоверно не превышает контрольные параметры (p>0,05). Таким образом, использование иму- нофана на фоне иммуносупрессивного состояния не оказывает влияния на длину органа.
Исследование линейных параметров (длины и ширины) пейеровых бляшек крыс-самцов показало достоверное их увеличение, по сравнению с данными контрольной группы, в течение месяца (p<0,05). А.Г. Кварацхе-лией и соавт. (2016) также было установлено, что использование имунофана на фоне иммуносупрессии восстанавливает линейные размеры тимуса до контрольных параметров в течение месяца [17]. При этом, по данным С.А. Кащенко и соавт. (2014), за данный промежуток времени в лимфатических узлах крыс при использовании иммунокорректора происходит не только нивелирование линейных параметров, но и их увеличение по сравнению с интактной группой [18], что соответствует вышеизложенным изменениям, полученным при исследовании пейеровых бляшек тонкой кишки. Таким образом, применение имунофана изменяет линейные размеры скоплений лимфоидной ткани тонкой кишки.
Микроскопическое исследование показало, что высота и ширина лимфатических узелков и межузелковых зон превышают показатели контрольной группы на 7-е и 30-е сут после коррекции иммунофаном циклофосфа-ниндуцированной иммуносупрессии (p<0,05). К 90-м сут различия с контрольными параметрами нивелируются. Аналогичные изменения наблюдали S. Nor-Satinati et al. (2006) при оральном введении P. Multicida B2 крысам по- роды Spraque-Dawley массой 200–250 г [19]. Полученные данные могут свидетельствовать о выраженной реакции пейеровых бляшек тонкой кишки на введение имунофана на фоне иммуносупрессивного состояния в течение месяца, при этом после трех месяцев происходит восстановление линейных размеров и структуры органа.
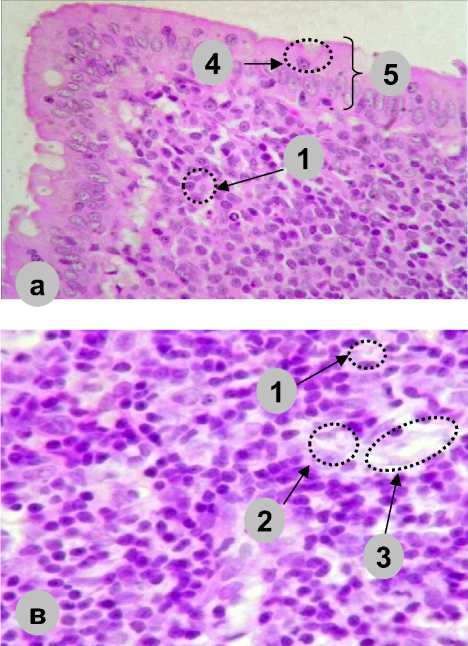
Рис. 4. Зоны лимфатического узелка в пейеровой бляшке тонкой кишки половозрелых крыс экспериментальной группы на 30-е сут: а) купол; б) герминативный центр; в) периферическая зона; г) межузелковая зона (1 – лимфоцит; 2 – макрофаги; 3 – ретикулоцит; 4 – интраэпителиальный лимфоцит;
5 – эпителий слизистой оболочки; 6 – сосуд.
Окраска: гематоксилин-эозин. Приближение: Zoom 162. Объектив: Plan C N 4x/0.25∞/-/FN22)
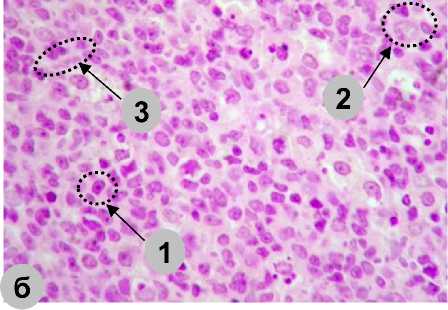
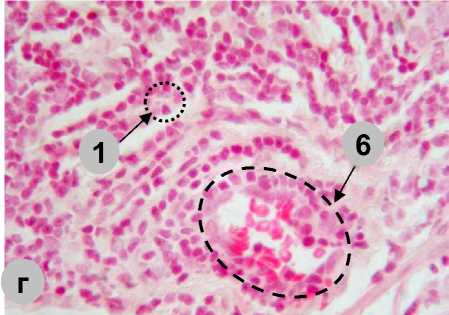
Fig. 4. Lymphatic nodule in the Peyer’s patch of the small intestine of mature rats, experimental group, Day 30: a) dome, b) germinal center, c) peripheral zone, d) internodular zone:
(1 – lymphocyte, 2 – macrophages, 3 – reticulocyte,
-
4 – intraepithelial lymphocyte, 5 – mucosal epithelium, 6 – vessel.
Staining: hematoxylin-eosin. Magnification: Zoom 162. Lens: Plan C N 4x/0.25∞/-/FN22)
По данным Г.Ю. Стручко и соавт. (2010), фармакологическое действие пептидного им-муноксидредуктанта основано на достижении коррекции иммунной и окислительно-восстановительной систем организма [20]. И.В. Боб- рышева (2016) утверждает, что на 7-е сут проявляется иммунорегуляторное действие препарата – восстановление нарушенных показателей клеточного и гуморального иммунитета [21]. Данное фармакологическое действие
Е.Г. Пухаева и соавт. (2019) объясняют способностью препарата восстанавливать продукцию тимического гормона тимулина до нормальных значений [22]. Это приводит к увеличению популяции Т-лимфоцитов, что И.В. Бобрышева (2016) подтверждает при исследовании тимуса крыс [21]. Вышеуказанное позволяет объяснить увеличение линейных размеров межузелковых зон (Т-зависимые зоны) пейеровых бляшек тонкой кишки, по сравнению с контрольными параметрами, в течение месяца. По данным Ryo Inoue et al. (2013), активность лимфоцитов в пейеровых бляшках тонкой кишки во многом зависит от антигенной нагрузки, которая стимулирует синтез лимфоцитами фактора некроза опухоли, а он в свою очередь позволяет поддерживать активную пролиферацию иммунокомпетентных клеток в герминативном центре [23]. Необходимо также отметить, что действие препарата направлено на восстановление поврежденных клеток [10], что способ- ствует сохранению популяции лимфоцитов в органе и приводит к увеличению линейных размеров (длины и ширины) не только межузелковых зон, но и лимфатических узелков. Основываясь на данных И.В. Бобрышевой (2016) о том, что действие препарата длится до 3–4 мес., можно объяснить нивелирование различий между экспериментальными и контрольными показателями на 90-е сут наблюдения [21].
Заключение. Использование имунофана после экспериментальной иммуносупрессии не оказывало влияния на длину тонкой кишки. При этом наблюдалось достоверное изменение морфометрических размеров пейеровых бляшек тонкой кишки (увеличение лимфатических узелков и межузелковых зон, а также размеров последних в целом, уменьшение расстояния от илеоцекального угла до первой из них) на 7-й и 30-е сут эксперимента по сравнению с контролем. К 90-м сут наблюдения данные изменения параметров нивелировались.
Список литературы Влияние введения имунофана на морфометрические параметры и гистологическое строение Пейеровых бляшек тонкой кишки крыс на фоне иммуносупрессии, вызванной введением циклофосфана
- Данилова З.А. Экологическая ситуация и риски для здоровья населения. Международный научно-исследовательский журнал. 2019; 3 (81): 176-179.
- Colao A., Muscogiuri G., Piscitelli P. Environment and Health: Not Only Cancer. Int. J. Environ. Res. Public Health. 2016; 13 (7): 724.
- Hryn V.H., Kostylenko Y.P., Bilash V.P., Ryabushko O.B. Microscopic structure of albino rats' small intestine. Wiadomosci Lekarskie. 2019; LXXII (5): 733-738.
- Haley P.J. The lymphoid system: a review of species differences. J. Toxicol. Pathol. 2017; 30 (2): 111-123.
- Reboldi A., Cyster J.G. Peyer's patches: Organizing B cell responses at the intestinal frontier. Immunol. Rev. 2016; 271 (1): 230-245.
- Хаитов Р.М. Иммуномодуляторы: мифы и реальность. Иммунология. 2020; 41 (2): 101-106.
- Kim W.H., Lillehoj H.S. Immunity, immunomodulation, and antibiotic alternatives tomaximize the genetic potential of poultry for growth and disease response. Anumal feed Science and Technology. 2019; 250: 41-50.
- Ahlmann M., Hempel G. The effect of cyclophosphamide on the immune system: implications for clinical cancer therapy. Cancer Chemother. Pharmacol. 2016; 78 (4): 661-671. DOI: 10.1007/s00280-016-3152-1.
- Teles K.A., Medeiros-Souzaa P., Aires Correa Limac F. Cyclophosphamide administration routine in autoimmune rheumatic diseases: a review. Rev. Bras. Reumatol. Engl. Ed. 2017; 57 (6): 596-604.
- Кащенко С.А., Петизина О.Н. Ультрамикроскопическое исследование правых подмышечных лимфатических узлов крыс в эксперименте. Матерiали I Всеукрансько! науково-практично! конфе-ренци «Морфолопя людини та тварин». 9-10 вересня 2011. Микола!в; 2011: 80-82.
- Мухамадеева О.Р., Хисматуллина З.Р., Медведев Ю.А. Эффективность применения иммуномоду-лятора «имунофан» при комплексном лечении больных зооантропонозной трихофитией. Вестник современной клинической медицины. 2014; 7 (1): 31-34.
- Sawicka J., DzierzynskaM., Wardowska A. Imunofan-RDKVYR Peptide-Stimulates Skin Cell Proliferation and Promotes Tissue Repair. Molecules. 2020; 25 (12): 2884.
- Directive 2010/63/EU of the European Parliament and of the Council of the European Union on the protection of animals used for scientific purposes, complying with the requirements of the European Economic Area. St. Petersburg; 2012.
- Кащенко С.А., Морозова О.М., Петiзiна О.М., Морозов В.М., Андросова М.С. Патент Укра!на № 59906; 2011.
- Сапин М.Р. Иммунные структуры пищеварительных органов (функциональная анатомия). М.; 1987. 217.
- Кащенко С.А., Морозова О.М., ПетЫна О.М., ЗолотаревськаМ.В., Андросова М.С. Патент Укра-!на № 97894; 2010.
- Кварацхелия А.Г., Клочкова С.В., НикитюкД.Б., АлексееваН.Т. Морфологическая характеристика тимуса и селезенки при воздействии факторов различного происхождения. Журнал анатомии и гистопатологии. 2016; 5 (3): 77-83.
- Кащенко С.А., Петизина О.Н., Морозова Е.Н. Корреляционная зависимость между параметрами лимфатических узлов крыс после коррекции иммунодефицитного состояния. Украшський морфо-лопчний альманах. 2014; 12 (3): 34-37.
- Nor-Satinati S., Zuki A.B.Z., Zamri-Saad M. The response of gut-associated Lymphoid tissue (GALT) following oral administration of P. Multicida B2 in rat. Journal of animal and veterinary advances. 2006; 5 (11): 1029-1034.
- Стручко Г.Ю., Меркулова Л.М., МихайловаМ.Н., ЗахидМ. Т-зависимые иммунорегуляторные эффекты полиоксидония и имунофана (обзор литературы). Вестник Чувашского университета. 2010; 3: 140-145.
- Бобрышева И.В. Иммуномодулятор «Имунофан» влияет на клеточный состав морфофункциональ-ных зон тимуса крыс и замедляет его возрастную инволюцию. Вестник РГМУ. 2016; 3: 38-42.
- Пухаева Е.Г., Скупневский С.В., Руруа Ф.К., Фарниева Ж.Г., Бадтиев А.К. Антимутагенный эффект имунофана при сочетанном воздействии ионов CD(II), PB(II) и антибиотика цефтриаксона. Медицинская экология. 2019; 7: 49-58.
- Inoue R., Tsukahara T., Matsukawa N., Watanabe T., Bukawa W., Nakayama K. Rapid Induction of an Immune Response in Rat Peyer's Patch after Oral Administration of Enterococcus faecalis Strain EC-12. Biosci. Biotechnol. Biochem. 2013; 77 (4): 863-866.


