Влияние высокоуглеводной высокожировой диеты на морфологию печени у молодых и старых крыс
Автор: Л.Р. Мустафина, С.В. Логвинов, Л.И. Богданова, Б.К. Курбатов
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Печень является сложным метаболическим органом, который посредством регуляции энергетического обмена обеспечивает поддержание гомеостаза всего организма. Цель исследования: установить морфологические изменения гепатоцитов и экспрессию фактора роста эндотелия сосудов при высокоуглеводной высокожировой диете (ВУВЖД) в зависимости от возраста. Материал и методы. Проведено гистологическое исследование печени в четырех группах крыс-самцов линии Вистар: группа 1 – 5-месячные животные, содержавшиеся на стандартном рационе; группа 2 – 5-месячные, содержавшиеся на ВУВЖД в течение 90 сут (с 2-месячного возраста); группа 3 – 18-месячные, содержавшиеся на стандартном рационе; группа 4 – 18-месячные, содержавшиеся на ВУВЖД в течение 90 сут (с 15-месячного возраста). С помощью мор- фометрических методов определяли удельные объемы (%) неизмененных и двуядерных гепатоцитов, синусоидных капилляров, воспалительных инфильтратов и очагов фиброза в печени. Иммуногистохимическим методом оценивали экспрессию VEGF в эндотелиальных клетках и в гепатоцитах. Ферментативным колориметрическим методом в сыворотке крови и в печени определяли концентрацию холестерина и триглицеридов. Результаты. Морфологическое исследование выявило значительное расширение синусоидных капилляров в группах 2 и 4. Статистически значимое увеличение удельных объемов гепатоцитов с вакуолярными включениями, двуядерных гепатоцитов, фиброзных очагов и мелких воспалительных инфильтратов было установлено в группе 4. Экспрессия VEGF возрастала в гепатоцитах групп 2 и 4. Биохимическое исследование выявило увеличение концентрации триглицеридов в печени крыс группы 4. Таким образом, ВУВЖД, несмотря на выраженные признаки регенерации, усугубляла возрастные изменения в печени старых крыс.
Возрастные изменения печени, высокоуглеводная высокожировая диета, эндотелиальный сосудистый фактор, неалкогольная жировая болезнь печени
Короткий адрес: https://sciup.org/149141590
IDR: 149141590 | УДК: 612.359.2:613.25.038:613.263:613.288]-092.9 | DOI: 10.29001/2073-8552-2023-38-1-126-132
Текст научной статьи Влияние высокоуглеводной высокожировой диеты на морфологию печени у молодых и старых крыс
Так называемая «фаст-фуд диета» («диета кафетерия», «западная диета»), ставшая популярной в последние десятилетия, включает большое количество натрия [1, 2], насыщенных жиров, трансжиров и быстроусваива-емых углеводов [1]. Такие продукты быстро насыщают, они относительно дешевы, но при регулярном их употреблении приводят к ожирению, развитию метаболических нарушений, вызывая серьезные проблемы со здоровьем [3]. Печень играет центральную роль в регулировании системного ответа на питание, поэтому возрастные изменения в печени могут иметь существенные системные эффекты [4, 5]. При этом страдают практически все жизненно важные органы: сердце, сетчатка, почки и т. д. Поражение печени при высоком употреблении жиров и сахара приводит к накоплению липидов в гепатоцитах, развитию стеатоза, инсулинорезистентности, а в последующем к циррозу и раку печени [6].
Цель исследования: установить морфологические изменения гепатоцитов и экспресси ю фактора роста эндотелия сосудов при высокоуглеводной высокожировой диете (ВУВЖД) в зависимости от возраста.
Материал и методы
Исследование проводили на крысах-самцах линии Вистар в возрасте 60 и 450 дней. Все процедуры соответствовали Директиве Европейского парламента 2010/63/ EU и заявлению FASEB о принципах использования животных в исследованиях и образовании (исследование одобрено этическим комитетом НИИ кардиологии Томского НИМЦ, протокол № 201 от 30.07.2020 г.).
Экспериментальные группы формировали следующим образом: группа 1 ( n = 14) – интактные 5-месячные крысы, содержавшиеся на стандартном рационе; группа 2 ( n = 14) – 5-месячные крысы, с 2-месячного возраста в течение 90 сут содержавшиеся на ВУВЖД (16% белков,
21% жиров, 46% углеводов, в том числе 17% фруктозы, 0,125% холестерина); группа 3 ( n = 14) – интактные 18-месячные крысы, содержавшиеся на стандартном рационе; группа 4 ( n = 14) – 18-месячные крысы, с 15-месячного возраста в течение 90 сут содержавшиеся на ВУВЖД. Воду заменяли 20%-м раствором фруктозы. Крысам групп 1 и 3 (интактным животным) давали стандартный корм для грызунов (белки 24%, жиры 6%, углеводы 44%) и чистую воду ad libitum .
Из эксперимента животных выводили путем декапитации с предварительной анестезией хлоралозой (100 мг/кг внутрибрюшинно). Перед декапитацией забирали образцы крови, которые центрифугировали (15 мин 3000 об/ мин), образцы сыворотки хранили в морозильной камере при -70 °C. Концентрацию холестерина и триглицеридов в биоптате печени определяли ферментативным колориметрическим методом (наборы «Вектор-бест», Россия). Для гистологического исследования образцы печени фиксировали в 10%-м растворе забуференного формалина (ООО «БиоВитрум», Россия) и заливали в парафин по стандартной методике. Полученные срезы окрашивали гематоксилином и эозином, гематоксилином и пикро-фуксином по Ван Гизону, проводили ШИК-реакцию (все красители от ООО «БиоВитрум», Россия). Иммуногистохимическую реакцию проводили с использованием моноклональных антител к фактору роста эндотелия сосудов (Vascular endothelial growth factor, VEGF), согласно протоколу фирмы производителя (Abcam, США). Просмотр и фотографирование микропрепаратов осуществляли на световом микроскопе «Axiostar plus» (Carl Zeiss, Германия) при увеличении в 400 и 1000 раз. Морфометрический анализ осуществляли с помощью сетки Автандилова. При увеличении в 400 раз подсчитывали удельные объемы (%) неизмененных и двуядерных гепатоцитов, синусоидных капилляров, фиброзных изменений. Количество VEGF-позитивных клеток оценивали в 1 мм2 среза.
Статистическую обработку данных проводили с использованием программы STATISTICA 13.0 (StatSoft Inc., США). Полученные количественные данные проверяли на согласие распределения с нормальным законом с помощью критерия Шапиро – Уилка. Данные, соответствовавшие нормальному распределению, представляли в виде среднего и стандартной ошибки ( M ± SEM ); при распределении, отличающемся от нормального, – в виде медианы и межквартильного интервала ( Ме ( Q 1; Q3 )). Проверку на гомогенность дисперсий в группах проводили с использованием критерия Левене. При сравнении нескольких независимых, нормально распределенных выборок количественных данных использовали однофакторный дисперсионный анализ (one-way ANOVA) с последующим применением критерия Стьюдента с поправками Бонферрони для апостериорных сравнений или непараметрический критерий Краскела – Уоллиса – для сравнения показателей в группах 1–4 и критерий Манна – Уитни – для попарных апостериорных межгрупповых сравнений показателей, распределение которых отличалось от нормального. За пороговое значение уровня значимости p принимали 0,05.
Результаты
Гистологическое исследование печени интактной группы 1 установило типичное балочное строение долек (рис. 1a), с умеренно полнокровными синусоидными капиллярами и сосудами портальных трактов, а также центральных вен. Гепатоциты группы 1 содержали, как правило, одно ядро с хорошо заметным ядрышком. Цитоплазма клеток содержала равномерно распределенные гранулы гликогена, что выявлялось при постановке ШИК-реакции (рис. 1b).
В группе 2 наблюдались единичные мелкие очаги лимфо-моноцитарных инфильтратов, расположенных, как правило, в перисинусоидальном пространстве (рис. 1c). Центральные вены долек отличались полнокровием, перицентральные синусоиды – заметным расширением просвета. Гепатоциты в гранулярной цитоплазме содержали по одному ядру, встречались единичные двуядерные клетки.
В группе 3 отмечалось умеренное полнокровие сосудов портальных трактов, неравномерно выраженное полнокровие центральных вен и синусоидальных капилляров перицентральных зон. При этом ширина просвета синусоидов оставалась обычной. Вокруг центральных вен наблюдались прослойки соединительной ткани.
Гепатоциты сохраняли зернистую цитоплазму за счет накопления в ней гранул гликогена (рис. 1d), содержали чаще одно ядро с одним или двумя ядрышками, встречались также единичные двуядерные клетки. Небольшая доля гепатоцитов подвергалась деструктивным изменениям, содержала пикнотичные ядра в светлой гомогенной цитоплазме, изредка обнаруживались мелкие прозрачные вакуоли, которые могли появиться из-за развития дистрофических изменений гепатоцитов. Подобная морфологическая картина характерна либо для гидропической (вакуолярной), либо для жировой дистрофии [7, 8]. При окраске криостатных срезов печени суданом черным В лишь в единичных клетках выявлялись мелкие капли жира (рис. 1e).
В срезах печени группы 4 наблюдались существенные морфологические изменения со стороны сосудистого русла: синусоидные капилляры характеризовались значительным расширением и полнокровием, особенно выраженным в перицентральных и частично в промежуточных зонах печеночных ацинусов (рис. 1f). В венозных сосудах портальных трактов и в центральных венах часто отмечались признаки лейкостаза. Разрастание довольно широких прослоек соединительной ткани выявлялось как перицентрально, так и вокруг триад (рис. 1g). В печеночной паренхиме, а также в перицентральной зоне и перипортально встречались очаги лимфо-моноцитарной инфильтрации. В цитоплазме гепатоцитов у крыс группы 4 обнаруживались многочисленные вакуоли разной степени выраженности: в единичных клетках ядра подвергались пикнозу, а цитоплазма полностью была выполнена крупными вакуолями (рис. 1h). Некоторая часть гепатоцитов вокруг портальных трактов уменьшалась в размерах, имела гомогенную темную цитоплазму и сморщенное ядро. При этом довольно часто встречались и двуядерные гепатоциты с гранулами гликогена в цитоплазме.
При количественном исследовании наиболее значимые изменения печеночной ткани отмечались в группах 2 и 4 (табл. 1).
Удельные объемы гепатоцитов, содержащих в цитоплазме вакуолярные включения, были наиболее выражены в группе 4 и значимо превышали показатели других исследованных групп. Гидропическая дистрофия чаще наблюдается при нарушении белкового метаболизма в печени в результате вирусного воздействия или кратковременной гипертермии [7].
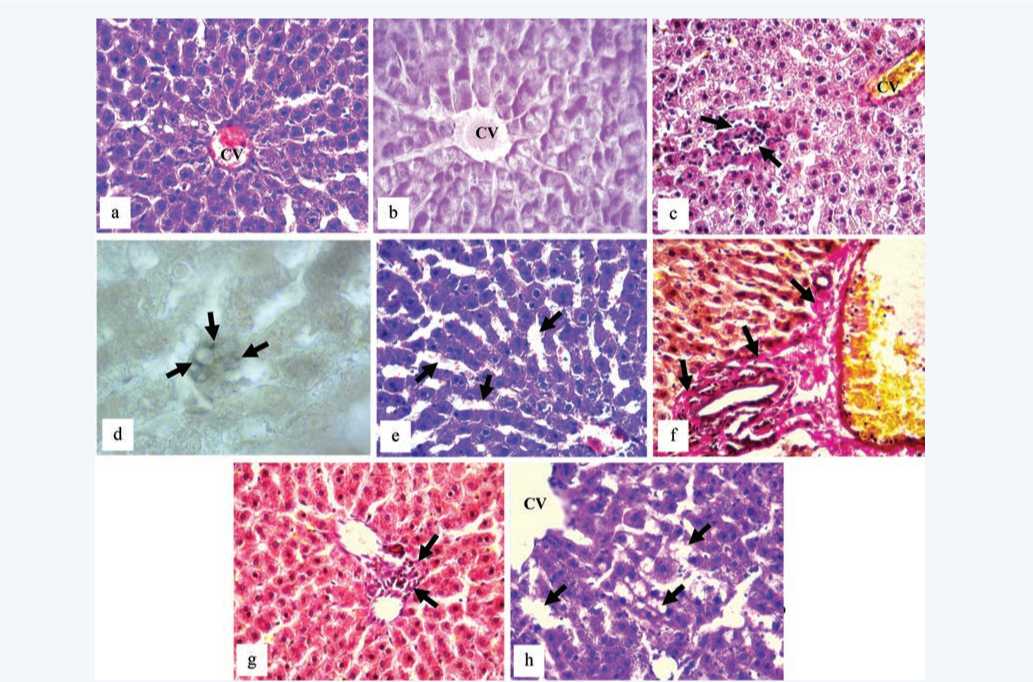
Рис. 1. Гистологические изменения печени крыс, связанные с высокоуглеводной высокожировой диетой (ЦВ – центральная вена): a – обычное строение печени, группа 1, b – равномерное распределение гранул гликогена в цитоплазме гепатоцитов, группа 1, c – мелкоочаговая лимфо-моноцитарная инфильтрация паренхимы печени, группа 2, d – мелкие липидные капли рядом с крупными судан-негативными вакуолями в цитоплазме гепатоцита (стрелки), группа 3, e – расширение синусоидальных капилляров (стрелки), группа 4, f – мелкоочаговая лимфо-моноцитарная инфильтрация вокруг портального тракта, группа 3, g – выраженные фиброзные изменения вокруг портального тракта (стрелки), группа 4, h – мелкие и крупные вакуоли в цитоплазме гепатоцитов (стрелки), группа 4. Окраска: a, e, h – гематоксилином и эозином; b – ШИК-реакция и гематоксилин; d – суданом черным В; c, f, g – по Ван Гизону. Увеличение: a, b, c, e, f, g, h – × 400; d – × 1000
Fig. 1. Histological changes in the liver of rats associated with a high-carbohydrate high-fat diet (CV – central vein): a – normal structure of the liver, group 1, b – equal distribution of glycogen granules in the cytoplasm of hepatocytes, group 1, c – small focal lympho-monocytic infi tration of the liver parenchyma, group 2, d – small lipid droplets next to large Sudan-negative vacuoles in the cytoplasm of hepatocytes (arrows), group 3, e – expansion of sinusoidal capillaries (arrows), group 4, f – small-focal lympho-monocytic infiltration around the portal tract, group 3, g – fibrous ch ges around the portal tract (arrows), group 4, h – small and large vacuoles in the cytoplasm of hepatocytes (arrows), group 4. Staining: a, e, h – with hematoxylin and eosin; b – PAS-reaction and hematoxylin; d – Sudan black B; c, f, g – stain by Van Gieson. Magnification: a, b, c, e, f, g, h – × 400; d – × 10 0
Таблица 1. Удельные объемы различных структур печеночной ткани в норме и после высокоуглеводной высокожировой диеты ( Ме ( Q1–Q3 )), %
Table 1. Specific volumes of various structures of the liver tissue in t e norm and after the high-carbohydrate high-fat diet ( Me ( Q1–Q3 )), %
|
Группы Groups Показатели, % Indicators, % |
Крысы 5 мес. без ВУВЖД 5-month-old rats without HCHFD |
Крысы 5 мес. на ВУВЖД 5-month-old rats at HCHFD |
Крысы 18 мес. без ВУВЖД 18-month-old rats without HCHFD |
Крысы 18 мес. на ВУВЖД 18-month-old rats at HCHCD |
|
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
|
|
Гепатоциты с вакуолями в цитоплазме Hepatocytes with vacuoles in the cytoplasm |
0,004 |
0,154 (0,00–0,15) |
0,464 (0,15–0,46) |
3,571,2,3 (2,38–4,76) |
|
Двуядерные гепатоциты Binuclear hepatocytes |
9,52 (4,76–14,29) |
7,144 (4,76–10,71) |
5,95 (5,95–11,90) |
11,902 (5,52–14,29) |
|
Синусоидные капилляры Sinusoidal capillaries |
16,672 (11,90–21,43) |
26,191 (23,81–30,95) |
14,294 (14,29–26,19) |
30,953 (23,81–38,10) |
|
Очаги фиброза (периваскулярные) Foci of fibrosis (perivascular |
2,383 (2,38–2,38) |
2,384 (2,38–2,38) |
3,571 (3,57–9,52) |
9,522 (5,95–25,00) |
|
Очаги клеточной инфильтрации Foci of cellular infiltratio |
0,004 |
0,014 (0,00–0,01) |
0,034 (0,00–0,03) |
2,38 1, 2, 3 (2,38–2,38) |
Примечание: ВУВЖД – высокоуглеводная высокожировая диета, 1 – статистическая значимость различий по сравнению с группой 1, 2 – по сравнению с группой 2, 3 – по сравнению с группой 3; 4 – по сравнению с группой 4 при р ≤ 0,05.
Note: HCHFD - high-carbohydrate high-fat diet, 1 – statistical significance of differ nces in comparison with the 1st group; 2 – compared with the 2nd group; 3 – compared with the 3rd group; 4 – compared with the 4th group at p ≤ 0.05.
Жировая дистрофия может быть реакцией печени на различные токсические воздействия, метаболический синдром или может отражать возрастные изменения печени. Так, в экспериментах на стареющих мышах накопление липидных капель в цитоплазме гепатоцитов связывалось авторами с возрастным уменьшением синтеза сосудорасширяющих факторов и провоспалительным состоянием [8].
Удельные объемы двуядерных гепатоцитов значимо повышались в группе 4, где также выявлялись клетки, подверженные вакуольной дистрофии (см. табл. 1). Это свидетельствует о высокой регенераторной способности печени, несмотря на выраженные дистрофические явления в гепатоцитах на фоне ВУВЖД. Известно, что пло-идность гепатоцитов резко увеличивается во время регенерации [9]. Показано также, что при старении печени естественным образом уменьшается количество одноядерных гепатоцитов с обычными ядрами из-за снижения скорости синтеза и репарации ДНК, что сопровождается увеличением количества полиплоидных гепатоцитов [4].
Оценка фиброзных изменений установила статистически значимое разрастание соединительной ткани вокруг сосудов у интактных крыс с увеличением их возраста (см. табл. 1), тогда как у животных, находящихся на ВУВЖД, склерозу подвергались бόльшие объемы печеночной стромы, их показатели в группе 4 увеличивались в четыре раза по сравнению с таковыми в группе 3. Среди показателей, отражающих удельные объемы кле- точной инфильтрации, преобладали значения в группе 4. Ключевым фактором, способствующим возникновению и прогрессированию фиброза печени, является гипоксия, в свою очередь фиброз печени может еще больше усугубить степень гипоксии [10].
Значимое увеличение удельных объемов клеточной инфильтрации в группе 4 могло быть связано как с процессом старения крыс, так и с метаболическими нарушениями, вызванными назначением ВУВЖД (см. табл. 1), что не противоречит данным других исследователей. Так, при исследовании естественного старения у крыс было отмечено увеличение набора провоспалительных клеток с сопутствующим увеличением маркеров воспаления, что способствовало умеренно выраженному воспалительному процессу в печени [8].
Удельные объемы синусоидных капилляров после назначения ВУВЖД увеличивались в 1,5 раза у молодых (группа 2) и вдвое у старых крыс (группа 4) по сравнению с животными, содержавшимися на обычном пищевом рационе (см. табл. 1). Полученные результаты свидетельствуют о нарушении венозного оттока из печеночной дольки, что описано другими исследователями при изучении печени у стареющих крыс [8]. Очевидно, что назначение ВУВЖД усугубляет выявленные изменения.
Проведение иммуногистохимического исследования для выявления экспрессии VEGF позволило заметить некоторую тенденцию к ее увеличению в эндотелиальных клетках сосудов у старых крыс в группах 3 и 4 (рис. 2a, b).
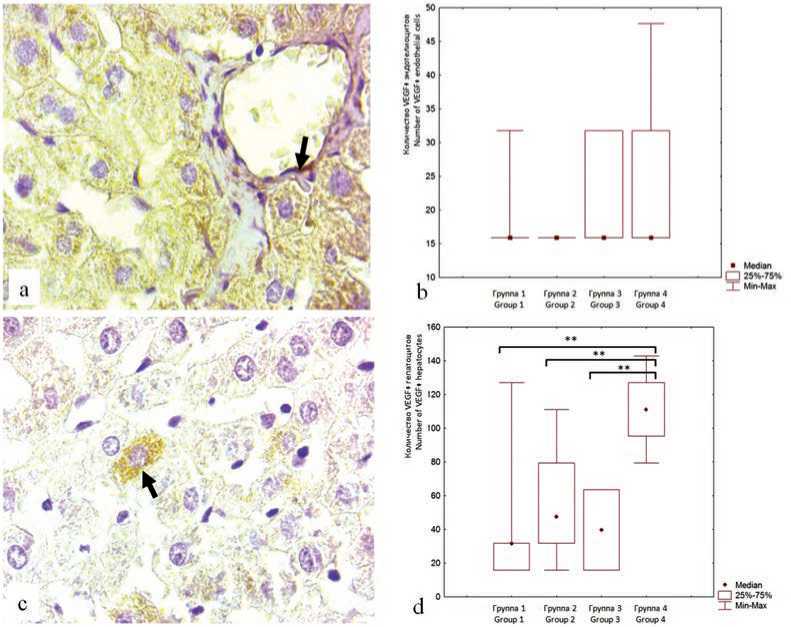
Рис. 2. Экспрессия VEGF в печени крыс: a – VEGF-позитивный эндотелиоцит, группа 4 (стрелка), b – количественное содержание VEGF-позитивных эндотелиоцитов в 1 мм2, c – выраженная экспрессия VEGF в цитоплазме гепатоцита, группа 4 (стрелка), d – количественное содержание VEGF-позитивных гепатоцитов в 1 мм2, ** – обозначены отличия между группами. a, c – иммуногистохимическое окрашивание моноклональными антителами к VEGF, гематоксилин. Увеличение × 1000
Fig. 2. VEGE expression in the liver of rats: a – VEGF-positive endothelial cells (arrow), group 4, b – quantitative content of VEGF-positive endothelial cells in 1 mm2, c – VEGF-positive expression in the hepatocyte cytoplasm (arrow), group 4, d – quantitative content of VEGF-positive hepatocytes per 1 mm2, ** – differences between groups are indicated. a, c – immunohistochemical staining with monoclonal antibodies to VEGF, hematoxylin. Magnification × 1000 Note: VEGF – vascular endothelial growth factor.
Эндотелиальные клетки, выстилающие печеночные синусоиды, выполняют ряд важных физиологических функций, включая содействие двунаправленному переносу субстратов между кровью и гепатоцитами, эндоцитоз циркулирующих белков, регуляцию иммунотолерантности и поддержание синусоидального микроокружения [4]. С возрастом происходят существенные изменения в структуре и функции эндотелиальных клеток, которые влияют как на нормальное функционирование печени, так и на системный риск кардиометаболических заболеваний [11].
При исследовании экспрессии VEGF в эндотелиальных клетках у грызунов зрелого и старческого возраста после экспериментальной резекции 70% печени с целью оценки степени ее регенерации была выявлена более низкая экспрессия VEGF у старых животных с меньшим количеством фенестр в эндотелии сосудов [12]. Существуют также литературные данные, согласно которым никаких изменений в экспрессии VEGF в эндотелиоцитах с возрастом не наблюдается [13].
Хотя эффекты VEGF изучаются в основном в контексте физиологии сосудов, они не ограничиваются только эндотелиальными клетками. К настоящему времени выявлено несколько типов клеток (макрофаги, нейтрофилы, перициты, холангиоциты, гепатоциты), активно экспресси- рующих VEGF при возникновении гипоксии и участвующих в репаративных процессах в печени [14]. В проведенном нами исследовании экспрессия VEGF в гепатоцитах значимо возрастала в группе 4 и проявляла явную тенденцию к увеличению в группе 2, что указывает на повреждающее влияние назначения ВУВЖД на гепатоциты (рис. 2c, d). Согласно литературным данным, гепатоциты контролируют рост и восстановление печени после повреждения посредством высвобождения различных факторов роста, в частности VEGF [4, 15–17]. Так, в исследовании экспериментального фиброза и цирроза была установлена повышенная экспрессия VEGF в гепатоцитах, которые находились в состоянии регенерации [17]. Таким образом, полученные нами результаты еще раз подтверждают активную регенерацию печени у крыс, находившихся на ВУВЖД. Кроме того, VEGF также связан с генерацией патологического ответа, что вызывает прогрессирующее накопление компонентов внеклеточного матрикса и образование новой фиброваскулярной стромы [14], которая выявлялась в гистологической картине печени у старых крыс после назначения ВУВЖД (группа 4).
Биохимическое исследование биоптатов печени не выявило отличий в концентрации триглицеридов и холестерина между сравниваемыми группами (табл. 2).
Таблица 2. Концентрация триглицеридов и холестерина в биоптате печени белых крыс, M ± SEM
Table 2. The concentration of triglycerides and cholesterol in the liver biopsy of albino rats, M ± SEM
|
Группы Groups Показатели Indicators |
Крысы 5 мес. без ВУВЖД 5-month-old rats without HCHFD |
Крысы 5 мес. на ВУВЖД 5-month-old rats at HCHFD |
Крысы 18 мес. без ВУВЖД 18-month-old rats without HCHFD |
Крысы 18 мес. на ВУВЖД 18-month-old rats at HCHCD |
|
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
|
|
Триглицериды, мг/г Triglycerides, mg/g |
8,4 ± 0,4 |
19,2 ± 2,21 |
12,9 ± 0,9 |
21,3 ± 3,81, 3 |
|
Холестерин, мг/г Cholesterol, mg/g |
15,59 ± 0,3 |
18,0 ± 1,4 |
15,1 ± 0,4 |
17,3 ± 1,1 |
Примечание: ВУВЖД – высокоуглеводная высокожировая диета, 1 – значимость различий по сравнению с группой 1, 2 – по сравнению с группой 2, 3 – по сравнению с группой 3, 4 – по сравнению с группой 4, при р ≤ 0,05.
Note: HCHFD - high-carbohydrate high-fat diet, 1 – statistical significance of differ nces in comparison with the 1st group; 2 – compared with the 2nd group; 3 – compared with the 3rd group; 4 – compared with the 4th group, at p ≤ 0.05
Исследование аналогичных показателей в печени крыс позволило установить увеличение концентрации триглицеридов более чем вдвое в группе 2 и в полтора раза в группе 4 по сравнению с показателями крыс в группах 1 и 3 (см. табл. 2). Концентрация холестерина в печени у животных всех исследованных групп не изменялась.
Полученные биохимические данные не противоречат таковым, представленным в литературных источниках. Так, экспериментальное назначение свиньям диеты с высоким содержанием жиров приводило к нарушениям липидного обмена, накоплению липидов в печени (более высокие концентрации холестерина и триглециридов), нарушению функции печени (более высокие уровни АЛТ и АСТ в сыворотке крови), окислительному стрессу и, как следствие, повышению уровня перекисного окисления липидов, что связывалось с апоптозом гепатоцитов и, по мнению исследователей, соответствовало клиническими симптомам неалкогольной жировой болезни печени человека [18].
Заключение
Полученные в настоящем исследовании результаты свидетельствуют не только о возрастных изменениях функции печени, но также и о ее нарушениях при назначении ВУВЖД, что вызывает значительное повреждение как стромы, так и паренхимы печени, способствуя развитию дистрофических, фиброзных и воспалительных изменений. Менее выраженные морфологические изменения печени после назначения ВУВЖД молодым крысам, вероятно, связаны с ее высокой регенераторной способностью.
Список литературы Влияние высокоуглеводной высокожировой диеты на морфологию печени у молодых и старых крыс
- Tapsell L.C., Neale E.P., Satija A., Hu F.B. Foods, Nutrients, and dietary patterns: interconnections and implications for dietary guidelines. Adv. Nutr. 2016;7(3):445–454. DOI: 10.3945/an.115.011718.
- GBD 2017 Diet Collaborators. Health effects of dietary risks in 195 countries, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019;393(10184):1958–1972. DOI: 10.1016/S0140-6736(19)30041-8.
- Elizabeth L., Machado P., Zinöcker M., Baker P., Lawrence M. Ultra-processed foods and health outcomes: A narrative review. Nutrients. 2020;12(7):1955. DOI: 10.3390/nu12071955.
- Hunt N.J., Kang S.W.S., Lockwood G.P., Le Couteur D.G., Cogger V.C. Hallmarks of aging in the liver. Comput. Struct. Biotechnol. J. 2019;17:1151–1161. DOI: 10.1016/j.csbj.2019.07.021.
- Drożdż K., Nabrdalik K., Hajzler W., Kwiendacz H., Gumprecht J., Lip G.Y.H. Metabolic-associated fatty liver disease (MAFLD), diabetes, and cardiovascular disease: associations with fructose metabolism and gut microbiota. Nutrients. 2021;14(1):103. DOI: 10.3390/nu14010103.
- Ipsen D.H., Lykkesfeldt J., Tveden-Nyborg P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cell. Mol. Life Sci. 2018;75(18):3313–3327. DOI: 10.1007/s00018-018-2860-6.
- Vlad M., Ionescu N., Ispas A.T., Giuvărăşteanu I., Ungureanu E., Stoica C. Morphological changes during acute experimental short-term hyperthermia. Rom. J. Morphol. Embryol. 2010;51(4):739–744.
- Maeso-Díaz R., Ortega-Ribera M., Fernández-Iglesias A., Hide D., Muñoz L., Hessheimer A.J. et al. Eff ects of aging on liver microcirculatory function and sinusoidal phenotype. Aging Cell. 2018;17(6):e12829. DOI: 10.1111/acel.12829.
- Miyaoka Y., Ebato K., Kato H., Arakawa S., Shimizu S., Miyajima A. Hypertrophy and unconventional cell division of hepatocytes underlie liver regeneration. Curr. Biol. 2012;22(13):1166–1175. DOI: 10.1016/j.cub.2012.05.016.
- Cai J., Hu M., Chen Z., Ling Z. The roles and mechanisms of hypoxia in liver fi brosis. J. Transl. Med. 2021;19(1):186. DOI: 10.1186/s12967-021-02854-x.
- Le Couteur D.G., Lakatta E.G. A vascular theory of aging. J. Gerontol. A Biol. Sci. Med. Sci. 2010;65(10):1025–1027. DOI: 10.1093/gerona/glq135.
- Wang W.L., Zheng X.L., Li Q.S., Liu W.Y., Hu L.S., Sha H.C. et al. The effect of aging on VEGF/VEGFR2 signal pathway genes expression in rat liver sinusoidal endothelial cell. Mol. Cell. Biochem. 2021;476(1):269–277. DOI: 10.1007/s11010-020-03903-7.
- Cheluvappa R., Hilmer S.N., Kwun S.Y., Jamieson H.A., O’Reilly J.N., Muller M. et al. The eff ect of old age on liver oxygenation and the hepatic expression of VEGF and VEGFR2. Exp. Gerontol. 2007;42(10):1012–1019. DOI: 10.1016/j.exger.2007.06.001.
- Mariotti V., Fiorotto R., Cadamuro M., Fabris L., Strazzabosco M. New insights on the role of vascular endothelial growth factor in biliary pathophysiology. JHEP Rep. 2021;3(3):100251. DOI: 10.1016/j.jhepr.2021.100251.
- Adas G., Koc B., Adas M., Duruksu G., Subasi C., Kemik O. et al. Eff ects of mesenchymal stem cells and VEGF on liver regeneration following major resection. Langenbecks Arch. Surg. 2016;401(5):725–740. DOI: 10.1007/s00423-016-1380-9.
- Kambakamba P., Linecker M., Schneider M., Kron P., Limani P., Tschuor C. et al. Novel benefi ts of remote ischemic preconditioning through VEGF-dependent protection from resection-induced liver failure in the mouse. Ann. Surg. 2018;268(5):885–893. DOI: 10.1097/SLA.0000000000002891.
- Lee A.R., Baek S.M., Lee S.W., Kim T.U., Han J.E., Bae S. et al. Nuclear VEGFR-2 expression of hepatocytes is involved in hepatocyte proliferation and liver regeneration during chronic liver injury. In Vivo. 2021;35(3):1473–1483. DOI: 10.21873/invivo.12400.
- Wang P., Lu Z., He M., Shi B., Lei X., Shan A. The eff ects of endoplasmic-reticulum-resident selenoproteins in a nonalcoholic fatty liver disease pig model induced by a high-fat diet. Nutrients. 2020;12(3):692. DOI: 10.3390/nu12030692.


