Влияние Xanthomonas campestris pv. campestris на рост этиолированных и фотосинтезирующих проростков Brassica oleracea
Автор: Ушаков Александр Анатольевич, Козарь Елена Георгиевна, Енгалычева Ирина Александровна
Журнал: Овощи России @vegetables
Рубрика: Защита растений
Статья в выпуске: 6 (50), 2019 года.
Бесплатный доступ
Актуальность. В последние годы большой интерес у физиологов вызывает изучение особенностей роста и развития проростков в условиях этиоляции. Этиолированные проростки, как модельный объект, интересен при изучении ответных реакций растительного организма на воздействие разнообразных биотических факторов среды. В связи с этим, всестороннее изучение особенностей влияния Xanthomonas campestris pv. campestris (Хсс) на ростовые процессы на ранних стадиях развития растений капусты белокочанной в зависимости от расового состава возбудителя весьма актуально. Материал и методика. Исследование проводили на базе лаборатории иммунитета и защиты растений ФГБНУ «Федерального научного центра овощеводства» (ФНЦО). Материалом исследований служили семена двух сортов капусты белокочанной с различной устойчивостью к сосудистому бактериозу и четыре расы Xanthomonas campestris pv campestris (Хсс1, Хсс3, Хсс4 и Хсс6). Стерильные семена каждого сорта раскладывали в чашки Петри. Заражение разными расами Хсс проводили путем внесения в каждую чашку Петри по 1 мл бактериальной суспензии двухсуточной культуры в концентрации 106 кл/мл...
Капуста белокочанная, сосудистый бактериоз, xanthomonas campestris pv. сampestris, этиолированные проростки, свет, xanthomonas campestris pv. сэmpestris
Короткий адрес: https://sciup.org/140245802
IDR: 140245802 | УДК: 632.342:579.841.12 | DOI: 10.18619/2072-9146-2019-6-133-140
Текст научной статьи Влияние Xanthomonas campestris pv. campestris на рост этиолированных и фотосинтезирующих проростков Brassica oleracea
Р астения и в природных условиях, и в агробиоценозах постоянно подвергаются воздействию неблагоприятных факторов окружающей среды. И если кратковременные изменения этих факторов не приводят к существенным нарушениям физиологических функций, то результатом резких или длительных воздействий может быть или нарушение физиологических процессов, поддерживающих устойчивое состояние организма, или гибель растения [1].
Исключительно важную роль в жизни растений играет свет. Интенсивность, качество света, продолжительность светового периода служат внешними сигналами, приводящими к изменениям в структуре и функциональной активности фотосинтетического аппарата, росте и развитии растений. Но регуляторная роль света проявляется не только в контроле роста и развития, а также и в защитных реакциях растений в ответ на проникновение патогенных микроорганизмов, так как развитие патогенеза – это результат взаимодействия триединой системы: «растение-хозяин – патоген – окружающая среда» [2,3]. В ряде исследований показано, что его взаимодействие с фоторецепторами оказывает сильное влияние на восприимчивость растений и проявление симптомов. Например, в зависимости от уровня сигнала «возмущения» при сборе света и интенсивности фотосинтеза наблюдали сдерживание или распространение тканевого хлороза или некроза листьев как при резистентных, так и при восприимчивых взаимодействиях «растение – патоген» [4,5,6]. На свету в листьях устойчивого сорта риса при искусственной инокуляции Xanthomonas oryzae pv. oryzae инициировалась реакция сверхчувствительности, накопление пероксидазных и лигниноподобных соединений. При его отсутствии в течение восьми часов после заражения развивались типичные симптомы бактериоза, характерные для совместимого ответа [7].
Баланс эндогенных фитогормонов, уровень которых контролируется светом, также опосредованно может влиять на скорость ростовых процессов и патологических изменений в инфицированном растении [2,8,9,10]. При этом эффекты действия света и гормонов могут перекрываться – фитогормоны могут инициировать реакции, запускаемые светом, и наоборот [11,12]. В модельной патосистеме «контрастные по устойчивости растения томата – ВТМ» показана роль спектрального состава в формировании индуцированной светом устойчивости за счет изменения уровня эндогенных фитогормонов (цитокининов и абсцизовой кислоты), которые являются участниками сигнальных систем растений, что отражается в изменении ростовых реакций и титра вируса в пораженных тканях [13].
Одним из критических периодов жизни растения, когда оно особенно подвержено влиянию негативных факторов окружающей среды, является стадия проростка или сеянца. В условиях действия того или иного стресса у проростков происходят различные изменения во взаимодействии внутриклеточных сигнальных систем, приводящие к формированию определенного метаболического ответа клетки и всего организма в целом.
К настоящему времени в исследованиях используются различные лабораторные методы определения устойчивости растений к различным стрессовым факторам, в основе которых лежит учет всхожести семян при неблагоприятных воздействиях, скорость роста первичного корня, время наступления плазмолиза, активность ферментов и др. В последние годы большой интерес у физиологов вызывает изучение особенностей роста и развития проростков в условиях этиоляции [14,15,16,17]. По мнению ряда авторов, этиолированное растение – это структурно-функциональная модельная единица, способная реализовать возможную модель развития различных физиологических ответных реакций на различные стрессовые факторы [18].
Этиоляция в природе часто целесообразна. Прорастание семян в почве происходит в отсутствии света, поэтому считается, что способность к усилению роста путем вытягивания, выработанная в процессе эволюции, позволяет проростку пробиваться через слой почвы, особенно в неблагоприятных условиях, а при недостатке света обеспечивает его конкурентоспособность в агроценозе [19,1,20]. Этиолированные проростки, как модельный объект, интересен и при изучении ответных реакций растительного организма (ростовых, физиологических, биохимических) на воздействие разнообразных биотических факторов среды. Так, экспериментально установлено, что в этиолированных проростках пшеницы и ячменя, инфицированных возбудителем, содержание хлорофилла и интенсивность фотосинтеза при их переносе на свет существенно ниже, чем в контрольных «здоровых» проростках. При этом показано, что величина этих различий связана с устойчивостью сорта к патогену [21]. Тем не менее, многие вопросы о влиянии света на процесс патогенеза и проявление устойчивости еще остаются открытыми, поскольку и растения, и возбудители обладают способностью к адаптации в меняющихся условиях внешней среды, в пределах, обусловленных их генотипами.
Селекция капусты белокочанной на устойчивость к сосудистому бактериозу, возбудитель – Xanthomonas campestris pv. campestris
( Хсс ), затруднена в связи с наличием у патогена физиологических рас, против каждой из которых существует свой ген устойчивости. Известны девять рас патогена, из них расы Хсс 1, Хсс 3 и Хсс 4 были наиболее распространены на территории России до 2012 года. В настоящее время зафиксировано изменение расового состава возбудителя, при этом возросла доля более вирулентных для белокочанной капусты рас Хсс 5 и Хсс 6 [22,23,24]. Одним из основных источников заражения сосудистым бактериозом, помимо растительных остатков, являются зараженные семена. В связи с этим, всестороннее изучение особенностей влияния X. campestris pv. campestris на ростовые процессы на самых ранних стадиях развития растений в зависимости от расового состава возбудителя и поиск новых источников устойчивости как к отдельным расам сосудистого бактериоза, так и их комплексу остается до сих пор актуальной задачей для фитопатологов и селекционеров.
Цель исследования: изучить особенности реакции проростков образцов капусты белокочанной с разной устойчивостью к сосудистому бактериозу на воздействие абиотических и биотических стрессовых факторов (темнота и заражение Хсс ).
Материалы и методы
Исследование проводили на базе лаборатории иммунитета и защиты растений ФГБНУ «Федерального научного центра овощеводства» (ФНЦО).
Материал исследований: семена коммерческих партий двух сортов капусты белокочанной с различной устойчивостью к сосудистому бактериозу – Слава 1305 (восприимчивый) и СБ-3 F 1 (относительно устойчивый); различные по агрессивности расы Xanthomonas campestris pv. campestris ( Хсс 1, Хсс 3, Хсс 4 и Хсс 6) из рабочей коллекции ООО ИЦ «ФитоИнженерия», любезно предоставленные д.б.н. А.Н. Игнатовым. Изоляты культивировали на LB среде.
Методика опыта. Стерилизацию семян проводили 1% раствором гипохлорида натрия в течение 5 минут, с последующим трехкратным промыванием стерильной водой и подсушиванием в течение 30 минут. В первом рекогносцировочном опыте обработанные семена каждого сорта раскладывали в чашки Петри по 25 штук на увлажненную водой фильтровальную бумагу (повторность трехкратная). В следующей серии экспериментов (опыты 2 и 3) обработанные семена предварительно проращивали в кюветах с увлажненной стерильной фильтровальной бумагой (по 500 штук) в термостате при 20 ° С в течение 3-4 суток. Затем из общей партии отбирали наклюнувшиеся семена с длиной корешка 1-2 мм без признаков поражения и раскладывали по 10 штук на одну повторность каждого варианта опыта в стерильные чашки Петри с увлажненной стерильной фильтровальной бумагой.
Заражение различными расами Хсс проводили путем внесения в каждую чашку Петри по 1 мл бактериальной суспензии двухсуточной культуры в концентрации 106 кл/мл. Половину чашек Петри помещали в термостат без освещения (темнота), другую – выставляли на свет при 16-часовом режиме освещения рассеянным светом (свет). Общая схема исследований представлена на рисунке 1.
При появлении семядольных листочков чашки Петри открывали и помещали в высокие пластиковые контейнеры с крышкой, что обеспечивало оптимальные условия, особенно для развития этиолированных (темновых) проростков (рис.2). В ходе работы соблюдали относительно стерильные условия, что позволяет избегать внешнего микробного заражения и проявления возможного антагонизма в отношении изучаемых бактериальных изолятов [14].
Наблюдения за развитием проростков после заражения проводили в динамике в течение двух недель, измеряя их биометрические параметры и учитывая число зараженных проростков путем визуального осмотра под бинокулярной лупой марки MICROS MC900. Величину и направленность биологических эффектов воздействия (депрессия/стимуляция) изучаемых факторов на разные параметры проростков в каждой серии опытов оценивали по относительному отклонению разницы между показателями опытных (О) и соответствующих контрольных (К) вариантов по общепринятой формуле БЭ=(О-К)/К*100%. Обработка экспериментальных данных проводили с помощью программы MS EXCEL 2010 с использованием общепринятых методов математического и дисперсионного анализов [25,26].
Результаты и обсуждение
Исследования по влиянию различных стресс-факторов на прорастание семян и рост проростков ведутся широко и во многих направлениях. Хорошо известно, что этиолированные проростки, выросшие в темноте, характеризуются рядом анатомических и морфологических особенностей, имеют желтоватый оттенок. Они всегда длиннее световых за счет ускорения роста клеток растяжением, которое в темноте идет очень интенсивно, тогда как накопление биомассы путем деления практически не происходит. В клетках этиолированных проростков образуется много гормонов ауксинов, но вытягивание стебля в отсутствии света может быть и следствием
Образцы: Слава 1305 СБ-3 F1
- семена сразу после обработки (опыт!)
- наклюнувшиеся семена (опыт 2 и 3)

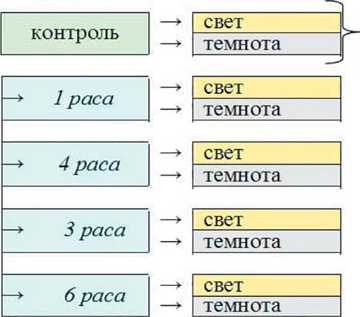
Рис.1. Общая схема проведения исследований в трех сериях опытов: первый опыт включал четыре варианта; второй опыт –12 вариантов в трехкратной повторности, третий опыт – 20 вариантов в четырехкратной повторности
Fig. 1. The general scheme of research in three series of experiments: the first experiment included four options; the second experiment – 12 options in triplicate, the third experience – 20 options in four repetition отсутствия ингибиторов роста. Нарушение соотношения ауксинов и ингибиторов и вызывает несбалансированный рост отдельных органов проростка, при этом у разных культур чувствительность к отсутствию света может существенно отличаться даже между сортами [27,28,12,10,29].
Анализ динамики прорастания (всхожесть) и изменения линейных параметров проростков (длина корешка и гипокотиля) в целом выявил схожую реакцию изучаемых образцов капусты белокочанной на отсутствие света, хотя отмечалась и определенная сортовая специфика (рис. 3 и 4). Так, у сорта Слава 1305 в течение первых десяти суток скорость роста зародышевого корешка на свету и в темноте была сопоставима, а на 14 сутки отмечена депрессия его развития в темноте. При этом у сорта Слава 1305 прослеживалось более выраженное ингибирование процесса прорастания семян в темноте.
У гибрида СБ-3 достоверное отличие по длине корешка этиолированных и фотосинтезирующих проростков отмечалась только на седьмые сутки проращивания, тогда как в дальнейшем при определенной депрессии, эта разница была в пределах ошибки опыта. Существенное удлинение гипокотиля в темноте регистрировали уже на седьмые сутки проращивания обоих образцов и на 14 сутки гипокотиль этиолированных проростков был почти в два раза длиннее относительно световых (рис.3, 4).
Следует отметить, что по данным рекогносцировочного опыта 1, в используемых в работе коммерческих партиях была выявлена достаточно высокая разнокачественность семян. Они различались по способности и времени прорастания, скорости роста проростков, часть из них при визуальном осмотре имели различные симптомы поражения, что свидетельствует о внутреннем инфицировании. Доля таких семян в сорте Слава 1305 в зависимости от повторности составляла от 20% до 40% при проращивании на свету и от 35% до 50% в темноте; у гибрида БС-3 F 1 в среднем 5% и 40%, соответственно.
В связи с этим, для изучения ростовых процессов под воздействием изучаемых факторов (свет/темнота, расы Хсс ) в дальнейшей работе использовали только внешне здоровые наклюнувшиеся семена, предварительно проращивая их в стерильных условиях (опыты 2 и 3). Предпочтительность использования в подобных лабораторных исследованиях уже проросших семян и условий относительной стерильности отмечают и другие авторы, поскольку это существенно снижает экспериментальные погрешности, позволяет сократить объем анализируемой выборки, максимально снизить вероятность присутствия в ней уже инфицированных семян и т.д. [14,20].
Установлено, что реакция проростков на внесение в чашки Петри бактериальной суспензии X.campestris pv. campestris существенно различается в зависимости от условий освещения и устойчивости образцов. Как и в предыдущем опыте, наиболее значимые различия были отмечены на 14 сутки проращивания (табл.1).
Под влиянием Xсс у восприимчивого сорта Слава 1305 на свету отмечено значительное ингибирование роста корешка, а в темноте – наоборот, стимулирование его развития. У проростков устойчивого гибрида СБ-3, хотя и были отмечены определенные отклонения по данному параметру от контроля в ту или иную сторону, но они были в пределах ошибки опыта.
По длине гипокотиля отмечена иная реакция на заражение бактериальной суспензией относительно соответствующих контрольных вариантов, при этом проявляются не только межсортовые отличия, но и расоспецифичность действия изолятов Xсс . У сорта Слава 1305 наблюдали ингибирование роста гипокотиля на свету, более

Рис.2. Проращивание семян в кюветах и размещение чашек Петри с проросшими семенами в контейнеры
Fig. 2. Germination of seeds in ditches and placement of Petri cups with sprouted seeds in containers
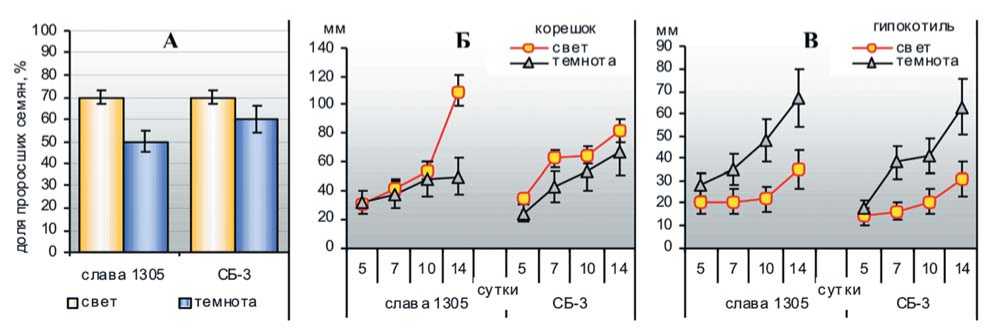
Рис.3. Доля наклюнувшихся семян на 10 сутки прорастания на свету и в темноте (А) и динамика роста корешка (Б) и гипокотиля (В) фотосинтезирующих и этиолированных проростков образцов капусты белокочанной (опыт 1)
Fig. 3. The percentage of seeds that were stuck on the 10th day of germination in the light and in the dark (A) and the growth dynamics of the root (Б) and hypocotyl (В) of photosynthetic and etiolated seedlings of white cabbage samples (experiment 1)
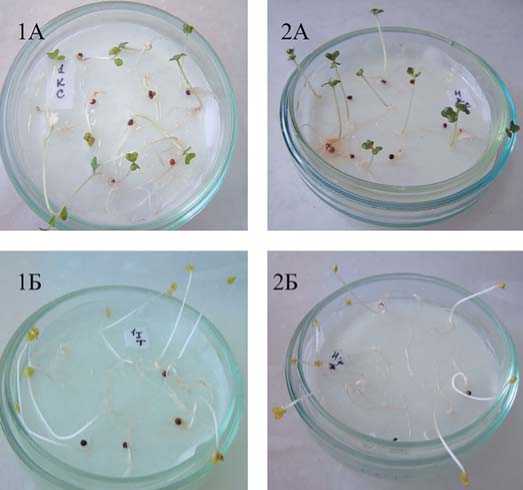
Рис. 4. Двухнедельные проростки капусты белокочанной сорта Слава 1305 (1) и гибрида БС-3 (2):
на свету (А) и в темноте (Б)
Fig. 4. Two-week-old seedlings of white cabbage Slava 1305 (1) and BS-3 hybrid (2): on the light (A) and in the dark (Б)
выраженное в варианте с Хсс 4, и стимулирование его удлинения у этиолированных проростков, особенно в варианте с Хсс 1. У гибрида СБ-3 независимо от освещения отмечен ускоренный рост гипокотиля на фоне заражения Хсс 4 (более существенно в темноте), тогда как на фоне заражения Хсс 1 – только у фотосинтезирующих проростков.
Сортовую специфику эффектов действия X.campestris pv. campestris на рост отдельных частей проростков при разных условиях выращивания (свет/темнота) более четко характеризуют относительные показатели БЭ% анализируемых признаков. Как видно на рисунке 5, восприимчивый сорт характеризуется резкой сменой их направленности при изменении условий выращивания – депрессия ростовых процессов на свету и стимуляция удлинения всех частей этиолированных проростков в темноте.
У относительно устойчивого к сосудистому бактериозу гибрида БС-3 внесение бактериальной суспензии возбудителя вызвало более интенсивный рост гипокотиля при проращивании семян на свету, при этом рост зародышевого корешка ингибировался незначительно. Эффекты реакции этиолированных проростков этого образца на присутствие в среде бактерий отличались и зависели от расы возбудителя. В варианте с внесением Хсс 1 отмечали слабое ингибирование процессов растяжения корешка и гипокотиля, а в варианте с внесением Хсс 4 – их стимулирование.
Для подтверждения выявленных эффектов сорто- и расоспецифичного действия X.campestris pv. campestris на развитие проростков капусты белокочанной был заложен третий опыт с более широким набором рас патогена. В результате были выявлены схожие тенденции смены направленности эффектов, хотя величины БЭ% несколько отличались от предыдущего опыта (рис. 6), что может быть связано как с разнокачественностью исходных семян,
Таблица 1. Влияние X.campestris pv. campestris на линейные размеры и пораженность проростков образцов капусты белокочанной при выращивании на свету и в темноте Table 1. Effect of X.campestris pv. campestris on linear sizes and affection of seedlings of specimens of white cabbage when grown on the light and in the dark
В отношении действия на рост гипокотиля проростков сорта Слава 1305 также выделяются варианты с Хсс 6, в которых отмечен наиболее высокий стимулирующий эффект как в темноте, так и на свету – длина гипокотиля превысила контроль на 58% и 10% соответственно. В вариантах с Хсс 3 и Хсс 4 наблюдалось незначительное ингибирование роста гипокотиля на свету (БЭ = -10…-13%), а в темноте – стимулирование его растяжения в вариантах с Хсс 1 и Хсс 3 (БЭ = +25…+31%).
У гибрида СБ-3 по депрессии роста корешка световых проростков три расы расположились аналогичным с сортом Слава 1305 образом ( Хсс 3< Хсс 1< Хсс 4), но ее абсолютная величина была существенно ниже (БЭ= -16%...-25%). В варианте с Хсс 6 на свету отмечен слабый стимулирующий эффект (БЭ= +12%). На рост гипокотиля световых проростков гибрида все расы оказали положительный эффект, по величине которого их можно расположить в следующем порядке: Хсс 3< Хсс 4 < Хсс 6< Хсс 1 (БЭ от +28% до +57%).
Реакция корешка этиолированных проростков гибрида СБ-3 на внесение X.campestris pv. campestris имела более выраженную расоспецифичность, чем у сорта Слава 1305. У рас Хсс 6 и Хсс 1 – это слабая и средняя степень ингибирования (БЭ= -8% и -30% соответственно), у Хсс 3 и Хсс 4 – слабое стимулирование роста корешка (БЭ= +10% и +13% соответственно). При этом интересно, что в пределах этих выделенных пар отмечены существенные отличия по реакции роста гипокотиля, а именно в паре Хсс 6 и Хсс 1 – эффект стимуляции у этиолированных проростков был в два и восемь раз ниже, чем у световых, тогда как в паре Хсс 3 и Хсс 4 – величина отмеченных положительных эффектов была сопоставима и в среднем БЭ составила +26% и +35% соответственно.
Сводный анализ всей совокупности полученных в ходе исследований данных по эффектам действия патогена на ростовые процессы проростков капусты белокочанной в зависимости от условий освещения представлен в таблице 2 в виде условных обозначений направления и достоверности отклонений от контроля без заражения.
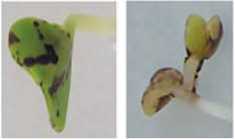
Симптомы поражения световых и темновых проростков X.campestris pv. campestris внешне схожи и в основном были типичны для данного возбудителя [30], но различались по степени выраженности (рис. 7). На семядольных листочках – от маслянистых точек, отличимых от здоровой ткани растения в проходящем свете или четко выраженных некротических зон по краю листа, до полного загнивания верхушки проростка. На гипокотиле – от появления мелких маслянистых пятен в виде штрихов до полного его потемнения, которое чаще отмечали у этиолированных проростков. Проявление карликовости с четкими симптомами системного поражения всех органов проростка и появление бактериального экссудата на пораженных участках, которое преимущественно регистрировали у световых проростков. Число проростков с симптомами поражения в каждом варианте опыта по повторностям существенно варьировало от 40 до100% (V>42%), в связи с чем, достоверность различий между вариантами опыта статистически не подтвердилась.
Однако было отмечено, что полную гибель части проростков у обоих сортов чаще наблюдали в вариантах с внесением расы Хсс 4, которая считается более агрессивной, чем Хсс 1, что подтверждают и данные опыта 2 (табл.1). Известная высокая вирулентность Хсс 6 к растениям с генами устойчивости Brassica oleracea косвенно может объяснить эффект стимуляции роста гипокотиля у зараженных проростков обоих образцов на свету. Так, А.Н. Игнатовым [31] ранее было показано, что усиление роста стебля капустных культур на стадии рассады при заражении вирулентными расами характерно восприимчивым растениям, а замедление роста стебля свойственно растениям, проявляющим устойчивость к системному распространению патогена при несовместимой комбинации. С другой стороны он выявил наличие отрицательной корреляции между скоростью суточного роста листьев и развитием симптомов (г=-0,83), но наиболее адекватным параметром измерения устойчивости растений, по его мнению,
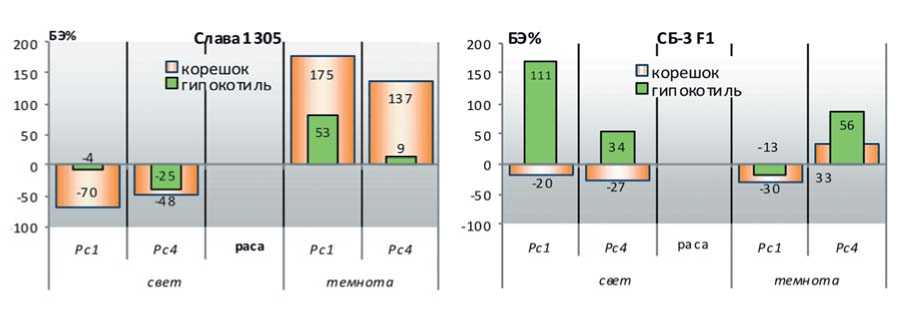
Рис 5. Эффекты действия X.campestris pv. campestris (расы Хсс1 и Хсс4) относительно контролей без заражения (БЭ%) на рост отдельных частей фотосинтезирующих (свет) и этиолированных (темнота) проростков капусты белокочанной у образцов с разной устойчивостью к сосудистому бактериозу (опыт2)
Figure 5. Effects of X.campestris pv. campestris (races Xcc1 and Xcc4) relative to the control without infection (BA%) for the growth of individual parts of photosynthetic (light) and etiolated (dark) white cabbage seedlings in samples with different resistance to vascular bacteriosis (experiment 2)
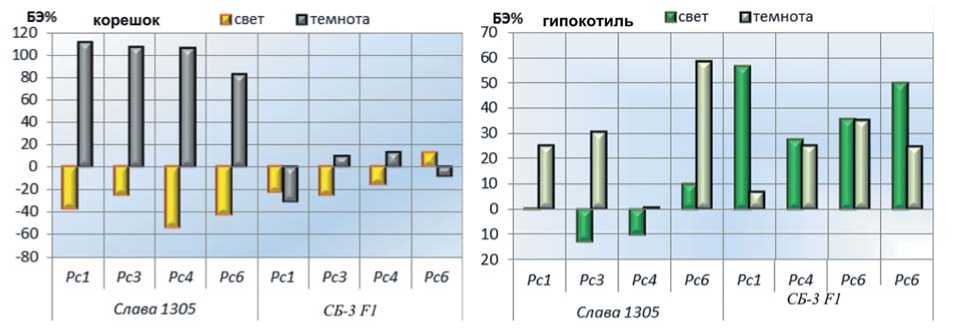
Рис 6. Эффекты действия различных рас X.campestris pv. campestris (БЭ%) на рост отдельных частей фотосинтезирующих (свет) и этиолированных (темнота) проростков капусты белокочанной у образцов с разной устойчивостью к сосудистому бактериозу (опыт 3)
Fig 6. Effects of action of various races of X.campestris pv. campestris (BA%) for the growth of individual parts of photosynthetic (light) and etiolated (darkness) white cabbage seedlings in samples with different resistance to vascular bacteriosis (experiment 3)
Таблица 2. Общая направленность эффектов действия рас X. campestris pv. campestris на ростовые процессы проростков при выращивании на свету (С) и в темноте (Т) у образцов капусты белокочанной с разной устойчивостью к сосудистому бактериозу
Table 2. General orientation of the effects of the effects of races X.campestris pv. campestris on the growth processes of seedlings when grown in the light (L) and in the dark (D) in samples of white cabbage with different resistance to vascular bacteriosis
|
Признак |
Образец |
Расы X.campestris pv. campestris |
|||||||
|
Хсс 1 |
Хсс 4 |
Хсс 3 |
Хсс 6 |
||||||
|
С |
Т |
С |
Т |
С |
Т |
С |
Т |
||
|
Длина корня |
Слава 1305 |
--- |
++ |
--- |
++ |
- |
++ |
--- |
++ |
|
СБ-3 |
- |
-/+ |
- |
+ |
- |
+ |
-/+ |
- |
|
|
Длина гипокотил я |
Слава 1305 |
- |
++ |
- |
+ |
- |
++ |
+ |
++ |
|
СБ-3 |
+ |
-/+ |
++ |
++ |
++ |
+ |
++ |
+ |
|
*«
А
Б
Условные обозначения:
-
--- ингибирование на статистически достоверном уровне (БЭ< -25%);
++ стимулирование на статистически достоверном уровне (БЭ>+25%);
-
- незначительное ингибирование;
+ незначительное стимулирование;
+/- эффекты нестабильны
является оценка системного распространения болезни [31]. Поэтому в дальнейшем, для более полного объяснения полученных результатов и понимания особенностей характера взаимодействия изученных рас патогена и испытуемых растений будет проведен сравнительный анализ расово-специфической реакции фотосинтезирующих и этиолированных проростков с данными, полученными стандартными методами заражения зеленых вегетирующих растений на разных стадиях развития.
Заключение
Известно, что разные органы растения растут с разной скоростью и под влиянием различных сочетаний внешних факторов параметры роста могут изменяться прямо противоположным образом [32,1], что и было отмечено в наших исследованиях на примере капусты белокочанной. Реакция проростков на заражение возбудителем сосудистого бактериоза прямо противоположна у фотосинтезирующих и этиолированных проростков, что наиболее четко проявляется у восприимчивого сорта. Ускорение роста корешка и гипокотиля проростков, подвергшихся двойному стрессу (отсутствие света и заражение Хсс ), как и торможение этих процессов, на свету, исходя из литературных данных, можно связать с целым рядом причин.
Патогены в процессе инфицирования вырабатывают в большом количестве разнообразные биологически активные соединения. Ряд из них, являясь детерминантой патогенности и вирулентности, используются патогеном для атаки (токсины, гидролитические ферменты, ингибиторы и пр.). С другой стороны, некоторые из них могут оказывать влияние на гормональный статус, ингибировать и стимулировать процессы роста или деления клеток растения-хозяина, вызывая в ходе патогенеза различные отклонения в его развитии. В свою очередь, растения, распознавая эти сигнальные соединения, в ответ активируют свои защитные механизмы, стремясь заблокировать развитие патогена и сбалансировать нарушенный обмен веществ [13,33]. В зависимости от ситуации индуктором ответных реакций растений могут служить соединения, исходно продуцируемые патогеном в ходе жизнедеятельности или активно секретируемое им при взаимодействии с системой защиты хозяина. Индукторами изменения ростовых процессов также могут выступать вещества, образуемые клетками самого растения в ответ на действие патогена. При этом различные типы элиситоров могут вырабатываться при одном и том же взаимодействии [34,35,36].
Так, во многих работах выявлена способность фитопатогенных бактерий, в частности родов Xanthomonas и Pseudomonas , продуцировать в жидких средах различные соединения индола, включая растительный гормон индол-3-уксусную кислоту (ИУК) и N-ацетилтриптофана, который был обнаружен только в фильтратах культур ксантомонад. Причем количество ауксина, продуцируемого штаммами Xanthomonas, было ниже по сравнению с другими видами бактерий, но существенно увеличивалось при добавлении экстрактов листьев растений-хозяев [37,38]. Установлено, что патогены могут использовать несколько стратегий для манипулирования физиологией растения для стимулирования патогенеза, включая синтез собственных гормонов и продукцию факторов вирулентности, которые изменяют реакции фитогормонов у растения-хозяина. Например, у Arabidopsis thaliana ИУК микробного происхождения может выступать как реципрокная сигнальная молекула при взаимодействии с растением и являться фактором вирулентности патогена, который способствует
г*

Рис 7. Симптомы поражения проростков капусты белокочанной X.campestris pv. campestris на свету (А) и в темноте (Б). На верхних фото – контрольные проростки.
Fig. 7. Symptoms of defeat of seedlings of white cabbage X.campestris pv. campestris in the light (A) and in the dark (Б). Control seedlings – on the upper photo развитию болезни путем подавления защитных реакций. Поэтому экзогенное применение ауксина, продуцируемого патогеном, повышает восприимчивость растения [39,40,41,42]. В ответ на инфекцию изменяются также уровни других гормонов, регулирующих синтез защитных белков. Например, салициловая кислота играет важную роль в активации генов, защитного ответа путем ингибирования распространения PVY (Potato virus Y) в тканях паренхимы у картофеля и повышенному накоплению у Withania somnifera вторичных метаболитов витанолидов, обладающих противоопухолевым и бактериостатическим действием [43,44]. Показано, что Xanthomonas axonopodis pv. citri (Хас) усиливает транскрипцию генов сладкого апельсина (Citrus sinensis), участвующих в синтезе, мобилизации и передаче сигналов гиббереллина, модулируют экспрессию гидролитических ферментов клеточной стенки и белков, связанных с клеточным делением и растяжением. Причем ингибитор синтеза гиббереллина, как и ингибитор транспорта ауксина, значительно снижает ауксин-индуцированную транскрипцию и проявление симптомов поражения раком [45].
Знание сигнальных путей гормональной регуляции у растений, по мнению ряда исследователей, дает возможность использовать пато-ген-чувствительные промоторы для индукции гормон-зависимого иммунного ответа и снижения вирулентности некоторых фитопатогенов [46,47].
Таким образом, фитопатогены, вызывая нарушение уровня гормонального баланса у растения, перестраивают работу транскриптома хозяина в выгодном для себя направлении. С другой стороны, ход процессов патогенеза тесно связан с условиями, в которых протекает взаимодействие партнеров патосистемы. Для поддержания необходимого баланса эндогенных фитогормонов для правильного развития, как и формирования и функционирования индуцированных механизмов устойчивости к патогену, растению нужна солнечная энергия. Эти процессы тесно связаны с процессами фотосинтеза. Световая среда, влияя на скорость фотосинтеза, влияет и на прогрессирование болезни у зараженных растений. Нарушение фотосинтеза и, соответственно углеводного обмена, может приводить к индукции экспрессии генов защиты растений, а также к изменению соотношения гормонов при инфицировании патогенами. При этом, как уже отмечалось выше, эффекты действия света и гормонов на фоне влияния других различных стрессовых факторов могут перекрываться [11,12, 48].
В клетках этиолированного проростка содержится много фитогормонов, особенно ауксинов, синтез которых в присутствии бактерий
X.campestris pv. campestris может активироваться, в результате чего стимулируется растяжение клеток при заражении. Этим, например, можно объяснить, отмечаемое в ряде случаев более быстрое прорастание и ранее появление больных всходов. Проростки, выращенные на свету, обладают более высокой способностью адаптироваться к стрессирующим воздействиям, в том числе и более высоким концентрациям гормонов, выделяемых патогенами [49,50]. Нельзя также исключать влияние света непосредственно на биохимическую активность и агрессивность самих возбудителей, а также на взаимную приспособленность растения и патогена, поскольку эти взаимо-
Об авторах:
Alexander А. Ushakov – Cand. Sci. (agriculture), senior researcher of the laboratory of of immunity and plant,
Еlena G. Kozar – Cand. Sci. (agriculture), leading researcher head of the laboratory of immunity and plant protection,
Irina A. Engalycheva – Cand. Sci. (agriculture),, head of the laboratory of immunity and plant protection,
Список литературы Влияние Xanthomonas campestris pv. campestris на рост этиолированных и фотосинтезирующих проростков Brassica oleracea
- Федулов Ю.П., Котляров В.В., Доценко К.А. Устойчивость растений к неблагоприятным факторам среды. Издательство Краснодар: Куб ГАУ. 2015.
- Кефели В.И. Действие света на рост и морфогенез высших растений. Фоторегуляция метаболизма и морфогенеза растений. Издательство М.: Наука.1975:209-227.
- Шатило В.И., Бочарникова Н.И., Музыкантов В.П., Балашова H.H. Патосистема: "хлорофилльные мутанты томата-ВТМ" как модель для изучения механизмов толерантности к вирусам. С.-х. биология. 1997;3:116-124.
- Pennazio S., Roggero P. Endogenous changes in cytokinin activity in systemically virus-infected plants. Microbiologica. 1998; 21:419-426.
- Jameson P.E., Cytokinins and auxins in plant-pathogen interactions. An overview. Plant Growth Regulation. 2002;32:369-380.
- Berger S., Papadopoulos M., Schreiber U., Kaiser W. & Roitsch T. Complex regulation of gene expression, photosynthesis and sugar levels by pathogen infection in tomato.Physiologia Plantarum. 2004; 122:419-428.
- Guo, A., Reimers, P.J., and Leach, J.E. Effect of light on incompatible interactions between Xanthomonas oryzae pv. oryzae and rice. Physiol. Mol. Plant Pathol. 1993;42:413-425.
- Карначук P.A., Головацкая И.Ф. Гормональный статус, рост и фотосинтез растений, выращенных на свету разного спектрального состава. Физиол. раст.1998;45(6):925-934.
- Jenkins G.I., Christie J.M., Fuglevand G., Long J.C., Jackson J.A. Plant responses to UV and blue light: biochemical and genetic approaches. Plant Science.1995;112:117-138.
- Ahmad M. Seeing the world in red and blue: insight into plant vision and photoreceptors. Current Opinion in Plant Biology. 1999; 2(3):230-235.
- Evans M.L., The action of auxin on plant cell elongation. Crit. Rev. Plant Sci.1985; 2:213-265.
- Su W.P., Howwell S.H. The effects of cytokinin and light on hypocotyl elongation in arabidopsis seedlings are independent and additive. Plant Physiol. 1995; 108:1423-1430.
- Кузнецова Е.Н. Роль света в устойчивости растений томата к вирусу табачной мозаики.Дис.канд.биол.наук.Томск;2004.Доступно по: https://search.rsl.ru/ru/record/01002660607.
- Рябушкина Н.А. Биотесты для скрининга аллелопатического потенциала диких и культурных видов растений. Биотехнология. Теория и практика. 2005; 5:5- 15.
- Yu L., Zhang C., Shang H., Wang X., Wei M., Yang F., Shi Q. Exogenous hydrogen sulfide enhanced antioxidant capacity, amylase activities and salt tolerance of cucumber hypocotyls and radicles. J. Integr. Agricult. 2013;12:445-456.
- Chen J., Shang Y.T., Wang W.H. Chen X.Y., He E.M., Zheng H.L., Shangguan Z. Hydrogen sulfide-mediated polyamines and sugar changes are involved in hydrogen sulfide-induced drought tolerance in Spinacia oleracea seedlings. Front. Plant Sci. 2016;7:1173.
- DOI: 10.3389/fpls.2016.01173
- Janicka M., Reda M., Czyzewska K., Kabafa K. Involvement of signalling molecules NO, H2O2 and H2S in modification of plasma membrane proton pump in cucumber roots subjected to salt or low temperature stress. Funct. Plant Biol. 2018;45:428-439.
- Шевлягина О.Ф., Коробков В.В. Особенности роста этиолированных проростков в аспекте реализации донорно-акцепторных отношений. Известия Саратовского университета.2019;19(2):170-176.
- DOI: 10.18500/1816-9775-201919-2-170-176
- Кефели В.И. Фотоморфогенез, фотосинтез и рост как основа продуктивности растений. Издательство Пущино;1991.
- Демина О.С. Роль корневых выделений в аллелопатической активности подсолнечника (Helianthusannus), ржи (Secale cereale) и люпина (Lupinus spp.). Дис. канд.биол.наук. М; 2017. Доступно:https://search.rsl.ru/ru/record/0100870727з.
- Удовенко Г. В. Диагностика устойчивости растений к стрессовым воздействиям. Л.: ВИР. 1988:10-25.
- Игнатов А.Н. Распространение возбудителей опасных бактериозов растений в Российской Федерации. Защита картофеля. 2014;2:53-57.
- Джалилов Ф.С., Во Тхи Нгок Ха. Защита капусты от болезней в период вегетации. Картофель и овощи.2014;1:20-23.
- Лазарев А.М. Ареал и зона вредоносности сосудистого бактериоза капусты. Вестник защиты растений. 2017; 1(91):52-55.
- Доспехов Б.А. Методика опытного дела. М: Колос; 1985.
- Сорокин О.Д. Прикладная статистика на компьютере. Краснообск. ГУП РПО СО РАСХН. 2009.
- Либберт Э. Физиология растений. М. 1976.
- Кефели В.И. Рост растений и фотоморфогенез. Физиол. расте-ний.1987;34(4):685-697.
- Sharma, A., Sharma, B., Hayes, S. et al. UVR8 disrupts stabilisation of PIF5 by COP1 to inhibit plant stem elongation in sunlight. Nat Commun.2019.10.р.4417
- DOI: 10.1038/s41467-019-12369
- Джалилов Ф.С. Диагностика зараженности семян капусты сосудистым бактериозом. М.1995.
- Игнатов А.Н. Генетическое разнообразие фитопатогенных бактерий Xanthomonas campestris и устойчивость к ним растений семейства Brassicaceae. Дис.доктор биол.наук. 2006:80-87. Доступно: http://diss.rsl.ru/diss/07/0286/070286014.pdf.
- Якушин Н.И. Физиология растений. М.1980.
- Чесноков Ю.В. Устойчивость растений к патогенам. С.-х. биология. 2007;1:16- 35.
- Ebel J., Cosio E.G. Elicitors of plant defence responses. Int. Rev. Cytol.1994;148:1- 36.
- Murphy A.M., Holcombe L.J., Carr J.P. Characteristics of salicylic acid-induced delay in disease caused by a necrotrophic fungal pathogen in tobacco. Physiol. and Molec. Plant Pathol. 2000;57.2:47-54.
- Jameson PE. Cytokinins and auxins in plant-pathogen interactions -An overview. Plant Growth Reg2000; 32:369-380.
- William F. Fett, Stanley F. Osman, and Michael F. Dunn. "Auxin production by plant-pathogenic pseudomonads and xanthomonads". Appl. Environ. Microbiol. 1987; 53(8):1839-1845.
- Costacurta A., Mazzafera P., Rosato Y.B. Indole-3-acetic acid biosynthesis by Xanthomonas axonopodis pv. citri is increased in the presence of plant leaf extracts. Cold Spring Harb Perspect Biol.2006; 5:223. https://doi.org/10.111Vj.1574- 6968.1998.tb12863.x
- Chen ZY, Agnew JL, Cohen JD, He P, Shan LB, Sheen J, Kunkel BN. Pseudomonas syringae type III effector AvrRpt2 alters Arabidopsis thaliana auxin physiology. Proc Natl Acad Sci 104: 2007: 20131-20136.
- Chalupowicz L,Barash I, Panijel M, Sessa G, Manulis-Sasson S 2009. Regulatory interactions between quorum-sensing, auxin, cytokinin, and the Hrp regulon in relation to gall formation and epiphytic fitness of Pantoea agglomerans pv gypsophilae. 2009;22:849-856.
- Spaepen S., Vanderleyden J. Auxin and Plant-Microbe Interactions. Cold Spring Harb Perspect Biol. 2011; 3(4): a001438. 10.1101/cshperspect.a001438. PMID: 21084388.
- DOI: 10.1101/cshperspect.a001438.PMID
- McClerklin S.A., Lee S.G., Harper C.P., Nwumeh R., Jez J.M., et al. Indole-3-acetaldehyde dehydrogenase-dependent auxin synthesis contributes to virulence of Pseudomonas syringae strain.DC3000.PLOSPathogens.2018;14(1):1006811. https:doi.org.10.1371.journal.ppat.1006811.
- Baebler Щ., Witek K., Petek M. et al. Salicylic acid is an indispensable component of the Ny-1 resistance-gene-mediated response against Potato virus Y infection in potato. J. Exp. Bot. 2014; 65:1095-1109.
- Ghosh Dasgupta M., George B.S., Bhatia A., Sidhu O.P. Characterization of Withania somnifera leaf transcriptome and expression analysis of pathogenesis-related genes during salicylic acid signaling. PLoS One. 2014; 9:94803.
- Cernadas, Raul Andrés, and Celso Eduardo Benedetti. "Role of auxin and gibberellin in citrus canker development and in the transcriptional control of cell-wall remodeling genes modulated by Xanthomonas axonopodis pv. Citri. Plant science 2009;177(3):190-195.
- Grant M.R., Kazan K., Manners J.M. Exploiting pathogens' tricks of the trade for engineering of plant disease resistance: challenges and opportunities. Microb. Biotechnol. 2013; 6:212-222.
- Смирнова О.Г., Кочетов А.В. Промоторы генов растений, участвующих в защите от патогенов. Вавиловский журнал генетики и селекции. 2014;18(4/1):765-769.
- Fujita, M., Fujita, Y., Noutoshi, Y., Takahashi, F., Narusaka, Y., YamaguchiShinozaki, K., Shinozaki, K. Crosstalk between abiotic and biotic stress responses: a current view from the points of convergence in the stress signaling networks. Curr. Opin. Plant Biol. 2006; 9: 436-442.
- Passardi F., Penel C., Dunand C. Performing paradoxical: how plant peroxidases modify the cell wall.Trends in Plant Science. 2004; 9:534-540.
- Graskova I.A., Antipina I.V., Potapenko O.Y., Voinikov V.K. Pathogen impact on the activity dynamics of potato suspension cells extra-cellular peroxidase.J. Stress Physiol. & Biochem. 2005;1:15-20.


