Влияние засоления почвы на мезоструктуру фотосинтетического аппарата галофитов, различающихся по жизненной форме
Автор: Ахмадуллина Э.Б.
Журнал: Самарская Лука: проблемы региональной и глобальной экологии @ssc-sl
Рубрика: Научные сообщения
Статья в выпуске: 2 т.26, 2017 года.
Бесплатный доступ
В статье приводятся результаты влияния засоления почвы на мезоструктурные показатели у представителей галафитной флоры озера Эльтон в Палласовском районе Волгоградской области. Получены данные сравнительного анализа параметров мезоструктуры галофитов, различающихся по жизненной форме. Результаты исследования позволяют судить о том, что засоление почвы влияет на фотосинтетическую способность, на скорость газообмена и на водозапасающую функцию растений.
Галофиты, мезофилл, палисадная ткань, губчатая ткань, мезоструктура, засоление почвы
Короткий адрес: https://sciup.org/148313536
IDR: 148313536 | УДК: 581.1
Текст краткого сообщения Влияние засоления почвы на мезоструктуру фотосинтетического аппарата галофитов, различающихся по жизненной форме
Одним из главных экологических факторов, который лимитирует рост и продуктивность многих растения является засоление почв. Основными компонентами, определяющими характер засоления почв, являются соли натрия. Наряду с ними, в почве присутствуют соли К, Ca, Mg и другие (Шамсутдинов и др., 2000).
Негативное действие солей на растения можно дифференцировать на три составляющих: 1) осмотическое действие проявляется в возникновении определенных затруднений процессу поглощения воды растением, а также в нарушении водно-солевого баланса в клетках и тканях растений; 2) токсическое действие проявляется в виде некрозов на листьях и стеблях; 3) специфическое действие проявляется в виде анионной разнокачественности (Строгонов, 1962).
Основным фактором, оказывающим негативное воздействие на растения в условиях засоления, является осмотический фактор. Наиболее общий эффект за-
соления – остановка роста растения. Когда концентрация солей превышает пороговый уровень, происходит торможение скорости ростовых процессов, что приводит к уменьшению их биомассы, изменению соотношения между органами растения. Избыток солей нарушает нормальное течение процессов фотосинтеза и дыхания, синтеза белков, транспорт ассимилянтов, гормональный баланс, нарушают углеводный, фосфорный и нуклеиновый обмен, ассимиляцию азота и серы. Нарушаются также мембранная проницаемость и функционирование органелл (Строгонов, 1970). Засоление оказывает существенное влияние на структурно-функциональное состояние хлоропластов, оно угнетает синтез хлорофиллов, процесс циклического фотофосфорилирования и способствует деградации рибосом хлоропластов (Строгонов, 1967).
Способность растений выживать и осуществлять полный цикл своего развития при неблагоприятных концентрациях солей принято называть солеустой-чивостью. Солеустойчивые растения объединяют в группу галофитов, для которых предельные концентрации содержания солей в среде колеблются в очень широких пределах – от 10 до 300 г/л. Основная масса поглощенных растением солей аккумулируется в надземных органах, причем в листьях заметно больше, чем в стеблях (Строгонов, 1962).
Галофиты защищаются от избыточной концентрации солей тремя способами:
-
1) поглощением большого количества солей и концентрированием их в ва-куолярном соке, что приводит к созданию высокого осмотического давления;
-
2) выведением поглощаемых солей из клеток вместе с водой с помощью специализированных солевых железок и удалением избытка солей с опавшими листьями; одна из разновидностей этого способа – локализация поглощаемых солей в вакуолях клеток – головок специализированных волосков, которые впоследствии обламываются;
-
3) ограниченным поглощением солей клетками корней [8].
Цель настоящей работы – изучить влияние засоления почвы на особенности мезоструктуры листа у разных типов галофитов.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве объектов исследования выбраны два вида растений-галофитов, различающихся по жизненной форме: однолетнее травянистое растение Солерос солончаковый (Salicornia perennans) и полукустарник Сарсазан шишковатый (Halocnеmum strobilаceum), собранные на территории бассейна соленого оз. Эльтон (Волгоградская область). Солерос европейский - это сочное, суккулентное растение, чешуевидные листья которого срослись со стеблем. Функцию фотосинтеза выполняет вся зеленая поверхность побегов. В соответствии с этой функцией стебель имеет строение, напоминающее световой лист: тонкий эпидермис с устьицами, двухслойная палисадная паренхима, крупноклеточная внутренняя паренхима с большим содержанием воды, в центре – центральный проводящий пучок (Чудина, Орлова, 2006). Сарсазан шишковатый – сильноветвистый полукустарник, с раскинутыми деревянистыми ветвями и сочными членистыми однолетними веточками. Листья неразвиты, вместо них в узлах супротивные чешуйки. Цветковые колоски цилиндрические, плотные, членистые. Цветки сидят как бы в кармашке. Околоцветник состоит из продолговатых, беловатых, на верхушке сходящихся листочков. Семена вертикальные, сжатые, по одному из краев пузырчатые (Красная книга…, 2008). Такие виды, как Salicornia perennans и Halocnemum strobilaceum, проявляют солевую толерантность – процесс, который вовлекает физиологическую и биохимическую адаптации для поддержания протоплазматической жизнеспособности через накапливание электролитов клетками. Поэтому они способны поглощать воду даже из сильнозасоленных почв, не страдая при этом от физиологической сухости. Происходит связывание солей клетками протоплазмы и вовлечение их в состав различных органических веществ. Такие растения эволюционировали, приспосабливаясь структурно, фенологически, физиологически и биохимически к солевой устойчивости. Находясь в виде поваренной соли в тканях таких растений солончаков, как Salicornia perennans и Halocnemum strobilaceum, натрий способствует накоплению и удержанию воды в клетках этих растений, увеличению мясистости и, следовательно, их засухоустойчивости (Моренко, 2006; Nesterov et al., 2016).
Сбор растений происходил в июне 2016 г., в первой половине дня. Параметры мезоструктуры фотосинтетического аппарата определяли согласно методике мезоструктурного анализа А.Т. Мокроносова (1978). Материалом служили высечки из листьев растений, известной площади. Для подсчета клеток готовили мацерат, используя 20%-й раствор KOH при нагревании над спиртовкой. Затем проводили дифференцированный подсчет клеток палисадной и губчатой паренхимы в 225 квадратах камеры Горяева с 20-кратной повторностью. Для подсчета количества хлоропластов в клетке готовили мацерат, используя 1 N HCl. Число хлоропластов в клетках определяли на давленных препаратах отдельно для клеток палисадной и губчатой ткани с 20-кратной повторностью. Число повторностей определяемых показателей брали в соответствии с требованиями методики, в этом случае стандартная ошибка не превышает 10% (Борзенкова, Храмцова, 2006). Исходя из экспериментальных показателей, согласно той же методике, получали расчетные: количество клеток и хлоропластов в единице площади листа (тыс. в см2); КОХ – объем клетки, соответствующий одному хлоропласту (мкм3); индексы поверхностей наружных мембран клеток и хлоропластов (ИМК, ИМХ).
Вычисления производились при помощи модулей JMicroVision и Excel для Windows.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Salicornia perennans – типичный эугалофит, встречающийся на побережье соленых озер и лиманов. Анализ размеров клеток мезофилла листа показал, что для Salicornia perennans характерны относительно крупные клетки и хлоропласты. Длина клеток палисадного мезофилла (76,8 мкм) в 3 раза превышает их ширину (25,5 мкм). Длина клеток губчатого мезофилла – 35,7 мкм, ширина клеток – 28,1 мкм (табл. 1).
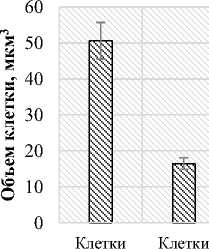
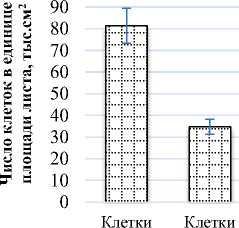
Площадь поверхности клетки палисадного мезофилла равна 7,81 тыс.мкм2, а губчатого мезофилла – 3,21 тыс.мкм2. Число клеток палисадного мезофилла в единице площади листа (81,3 тыс.см2) в 2 раза больше числа клеток губчатого мезофилла (34,7 тыс.см2). Объем клеток палисадного мезофилла составил 50,58 тыс.мкм3, объем клеток губчатого мезофилла – 16,46 тыс.мкм3 (рис. 1).
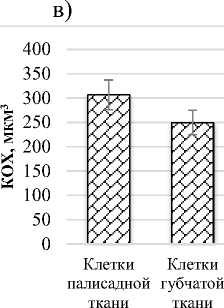
Число хлоропластов в клетках палисадного мезофилла составляет 165 шт., губчатого мезофилла - 66 шт. А число хлоропластов в единице площади листа у клеток палисадного мезофилла равно 21,7 млн.см2, у клеток губчатого мезофилла – 13,4 млн.см2. Объем клетки, соответствующий одному хлоропласту (КОХ) в клетках палисадного мезофилла равен 306,5 мкм3, а в клетках губчатого мезофилла – 249,4 мкм3 (рис. 2).
в)
палисадной губчатой ткани ткани
Таблица 1. Показатели мезоструктуры фотосинтетического аппарата
Salicornia perennans
|
Показатель |
Salicornia perennans |
|
|
Клетки палисадной ткани |
Клетки губчатой ткани |
|
|
Длина, мкм |
76,8 |
35,7 |
|
Ширина, мкм |
25,5 |
28,1 |
|
Объем клетки, мкм3 |
50,58 |
16,46 |
|
Площадь поверхности клетки, тыс.мкм2 |
7,81 |
3,21 |
|
Число клеток в единице площади листа, тыс.см2 |
81,3 |
34,7 |
|
Число хлоропластов в клетке, шт |
165 |
66 |
|
Число хлоропластов в единице площади листа, млн.см2 |
21,7 |
13,4 |
|
Индекс мембран клеток (ИМК), см2/см2 |
6,3 |
1,1 |
|
Индекс мембран хлоропластов (ИМХ), см2/см2 |
2,9 |
0,5 |
|
КОХ, мкм3 |
306,5 |
249,4 |
а)
б)

Клетки палисадной ткани

Клетки губчатой ткани
палисадной губчатой ткани ткани
Рис. 1. Показатели мезоструктуры фотосинтетического аппарата Salicornia perennans : а) площадь поверхности клетки, тыс.мкм2;
б) число клеток в единице площади листа, тыс.см2; в) объем клетки, мкм3
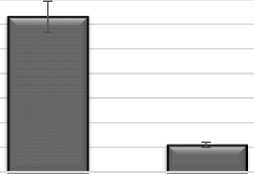
Индекс мембран клеток палисадного мезофилла (6,3 см2/см2) больше почти в 6 раз клеток губчатого мезофилла (1,1 см2/см2). А индекс мембран хлоропластов в клетках палисадного мезофилла составляет 2,9 см2/см2, в клетках губчатого мезофилла – 0,5 см2/см2 (рис. 3).
Halocnemum strobilaceum – сильно ветвистый кустарничек. В основном это обитатель солончаков или солончаковых участков засоленных комплексов. Анализ размеров клеток мезофилла листа показал, что длина клеток палисадного мезофилла 48,7 мкм, ширина клеток 15,6 мкм. Длина клеток губчатого мезофилла – 22,0 мкм, ширина клеток – 15,3 мкм (табл. 2).
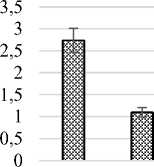
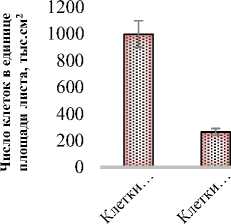
Площадь поверхности клеток палисадного мезофилла (2,74 тыс.мкм2) в 1,5 раза больше площади клеток губчатого мезофилла (1,1 тыс.мкм2). Число клеток палисадного мезофилла в единице площади листа составляет 997,6 тыс.см2, чис- ло клеток губчатого мезофилла – 263,5 тыс.см2. Объем клеток палисадного мезофилла составил 9,79 тыс.мкм3, объем клеток губчатого мезофилла – 3,26 тыс.мкм3 (рис. 4).
а)
б)
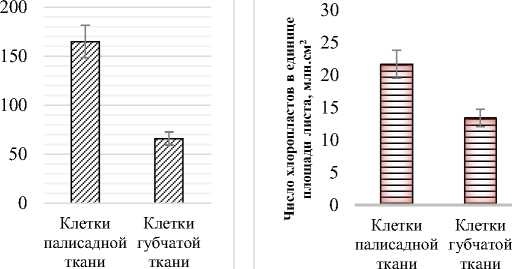
Рис.2. Показатели мезоструктуры фотосинтетического аппарата Salicornia perennans :
-
а) число хлоропластов в клетках, шт;
-
б) число хлоропластов в единице площади листа, млн.см2;
-
в) объем клетки, соответствующие одному хлоропласту (КОХ), мкм3
s
s
S s
а)
Клетки палисадной Клетки губчатой
ткани
ткани
б)
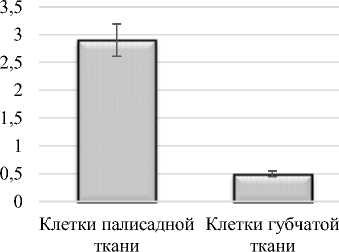
Рис. 3. Показатели мезоструктуры фотосинтетического аппарата Salicornia perennans :
-
а) индекс поверхности наружных мембран клеток (ИМК), см2/см2;
-
б) индекс поверхности наружных мембран хлоропластов (ИМХ), см2/см2
Таблица 2. Показатели мезоструктуры фотосинтетического аппарата Halocnemum strobilaceum
|
Показатель |
Halocnеmum strobilаceum |
|
|
Клетки палисадной ткани |
Клетки губчатой ткани |
|
|
Длина, мкм |
48,7 |
22,0 |
|
Ширина, мкм |
15,6 |
15,3 |
|
Объем клетки, мкм3 |
9,79 |
3,26 |
|
Площадь поверхности клетки, тыс.мкм2 |
2,74 |
1,1 |
|
Число клеток в единице площади листа, тыс.см2 |
997,6 |
263,5 |
|
Число хлоропластов в клетке, шт |
42,85 |
29,25 |
|
Число хлоропластов в единице площади листа, 2 млн.см |
42,7 |
7,7 |
|
Индекс мембран клеток (ИМК), см2/см2 |
27,3 |
2,9 |
|
Индекс мембран хлоропластов (ИМХ), см2/см2 |
6,1 |
1,1 |
|
КОХ, мкм3 |
228,5 |
111,5 |
а)
б)
в)
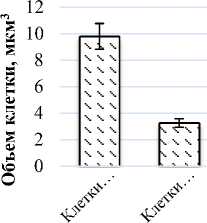
Рис. 4. Показатели мезоструктуры фотосинтетического аппарата Halocnemum strobilaceum : а) площадь поверхности клетки, тыс.мкм2;
-
б) число клеток в единице площади листа, тыс.см2; в) объем клетки, мкм3
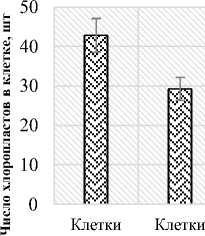
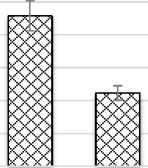
Число хлоропластов в клетках палисадного мезофилла составляет 42,85 шт., губчатого мезофилла – 29,25 шт. А число хлоропластов в единице площади листа у клеток палисадного мезофилла (42,7 млн.см2) в 5,5 раз больше клеток губчатого мезофилла (7,7 млн.см2). Объем клетки, соответствующий одному хлоропласту (КОХ) в клетках палисадного мезофилла равен 228,5 мкм3, а в клетках губчатого мезофилла – 111,5 мкм3 (рис. 5).
а)
палисадной губчатой ткани ткани
б)

Клетки Клетки палисадной губчатой ткани ткани
в)
^ 200
5 150
о у 100
Клетки Клетки палисадной губчатой ткани ткани
Рис. 5. Показатели мезоструктуры фотосинтетического аппарата Halocnemum strobilaceum :
-
а) число хлоропластов в клетках, шт;
-
б) число хлоропластов в единице площади листа, млн.см2; в) объем клетки, соответствующие одному хлоропласту (КОХ), мкм3
Индекс мембран клеток палисадного мезофилла составляет 27,3 см2/см2, в клетках губчатого мезофилла – 2,9 см2/см2. А индекс мембран хлоропластов в клетках палисадного мезофилла (6,1 см2/см2) в 5,5 раз больше клеток губчатого мезофилла (1,1 см2/см2) (рис. 6).
Сравнительный анализ мезоструктуры фотосинтетических аппаратов исследуемых галофитов показал, что отличительной чертой мезоструктуры фотосинтетического аппарата Salicornia perennans является существенно более низкое количество клеток мезофилла в единице площади листа – 116 тыс. на см2 по сравнению с Halocnеmum strobilаceum. Суммарное количество клеток в единице площади листа у Halocnеmum strobilаceum выше, что, по-видимому, объясняется более плотным сложением мезофилла листа, чем у Salicornia perennans (рис. 7).
а)
б)

Рис. 6. Показатели мезоструктуры фотосинтетического аппарата Halocnemum strobilaceum :
а) индекс поверхности наружных мембран клеток (ИМК), см2/см2;
б) индекс поверхности наружных мембран хлоропластов (ИМХ), см2/см2
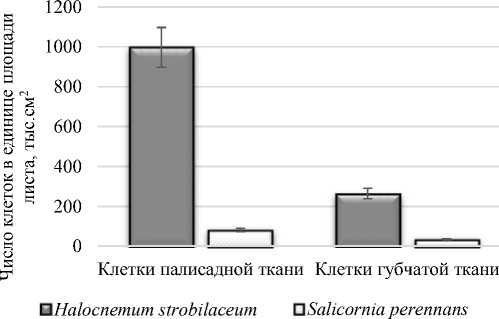
Рис.7. Число клеток в единице площади листа в клетках палисадной и губчатой тканях Halocnеmum strobilаceum и Salicornia perennans
Клетки палисадного мезофилла содержат больше хлоропластов, чем клетки губчатого мезофилла как у Salicornia perennans , так и у Halocnеmum strobilаceum . В клетках палисадного мезофилла Halocnеmum strobilаceum хлоропластов больше в 1,5 раза, чем в клетках губчатого мезофилла. Эти различия небольшие, что свидетельствует о близкой фотосинтетической активности двух типов мезофилла. Свет, проникающий вглубь мезофилла до губчатого мезофилла, имеет сильно измененный спектральный состав, и хлоропласты, по-видимому, хорошо адаптированы к этим изменениям. Близкое содержание хлоропластов свидетельствует о существенном вкладе как палисадной, так и губчатой паренхимы в общую продуктивность фотосинтеза (рис. 8).
Анализ количественных показателей ассимиляционного аппарата, показал, что объем клеток палисадного и губчатого мезофилла, а также число хлоропластов в листьях Salicornia perennans больше, что обеспечивает более высокую фотосинтетическую способность этого вида в данных условиях произрастания (рис. 9).
В губчатых тканях исследуемых растений значения КОХ выше, чем в палисадной, что свидетельствует о ее водозапасающей функции, вызванной засолением субстрата (рис. 10).
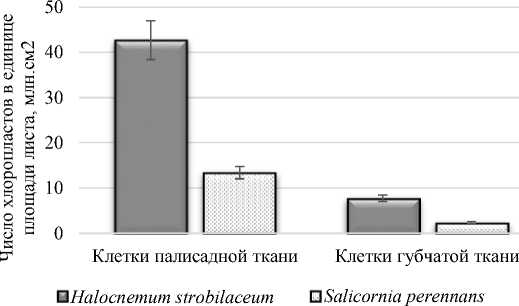
Рис. 8. Число хлоропластов в единице площади листа в клетках палисадной и губчатой тканях Halocnеmum strobilаceum и Salicornia perennans
а) б)

□Halocnеmum strobilаceum □Halocnеmum strobilаceum
□Salicornia perennans
□Salicornia perennans
Рис. 9. Показатели мезоструктуры фотосинтетического аппарата Halocnеmum strobilаceum и Salicornia perennans в клетках палисадной и губчатой тканях: а) объем клетки, тыс.мкм3;
б) число хлоропластов в клетке, шт
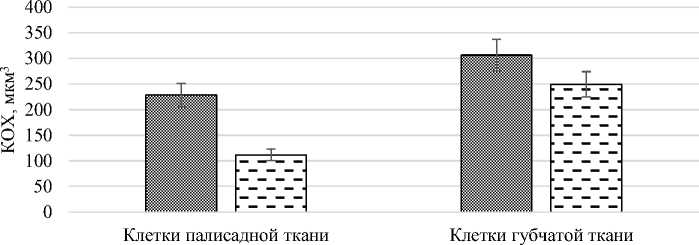
0 Halocnеmum strobilаceum □ Salicornia perennans
Рис. 10. Объем клетки, соответствующий одному хлоропласту палисадной и губчатой тканях Halocnеmum strobilаceum и Salicornia perennans
Показатель ИМК имеет важное функциональное значение, поскольку характеризует развитие наружных мембран клеток. Сравнительный анализ показал, что показатель ИМК Halocnеmum strobilаceum в 2–5 раз больше, чем у Sali-cornia perennans . Это объясняется тем, что у Salicornia perennans низкая концентрация числа клеток и хлоропластов в единице площади листа (рис. 11).

Клетки палисадной ткани
□ Halocnеmum strobilаceum
в ^^
Клетки губчатой ткани
□ Salicornia perennans
ъ 25 о
^ 20 о
ш
К 10
Рис. 11. Индекс поверхности наружных мембран клеток палисадной и губчатой тканях Halocnеmum strobilаceum и Salicornia perennans
ИМК и ИМХ тесно взаимосвязаны и положительно коррелируют между собой. При сравнении значений показатель ИМХ у Salicornia perennans примерно вдвое меньше, чем у Halocnеmum strobilаceum , что позволяет предположить у этого вида большее мезофильное сопротивление диффузии углекислоты и меньшие скорости фотосинтеза в расчете на единицу поверхности листа (рис. 12).
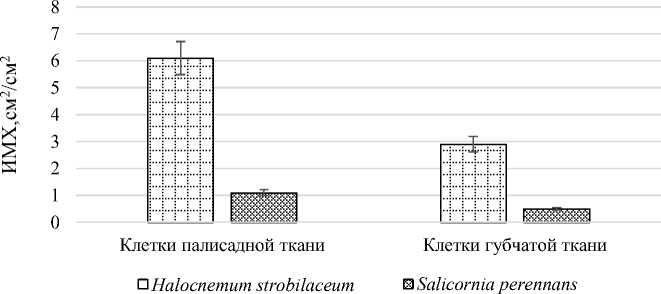
Рис. 12. Индекс поверхности наружных мембран хлоропластов в клетках палисадной и губчатой тканях Halocnеmum strobilаceum и Salicornia perennans
Низкие значения этих показателей могут ограничивать скорость газообмена растений.
ВЫВОДЫ
-
1. У Salicornia perennans высокая фотосинтетическая способность в данных условиях произрастания, чем у Halocnemum strobilaceum . Это обеспечивается большим объемом клеток мезофилла, а также числом хлоропластов в листьях. У Halocnemum strobilaceum наблюдалась близкая фотосинтетическая активность
-
2. У исследуемых галофитов выявлены низкие показатели ИМК и ИМХ, что свидетельствует об ограничении скорости газообмена растений.
-
3. У Salicornia perennans и Halocnemum strobilaceum клеточный объем хлоропласта в клетках губчатых тканей больше, что свидетельствует о ее водозапасающей функции, вызванной засолением субстрата.
двух типов мезофилла, так как у этого вида близкое содержание хлоропластов в клетках палисадной и губчатой тканях.
Список литературы Влияние засоления почвы на мезоструктуру фотосинтетического аппарата галофитов, различающихся по жизненной форме
- Борзенкова Р.А., Храмцова Е.В. Определение мезоструктурных характеристик фотосинтетического аппарата растений. Екатеринбург: Уральский государственный университет, 2006. 25 с.
- Красная книга Новосибирской области. Новосибирск: Арта, 2008. 528 с.
- Мокроносов А.Т. Мезоструктура и функциональная активность фотосинтетического аппарата. Свердловск. 1978. С. 5-30.
- Моренко М.О. Галофиты Алтайской горной системы на примере семейства Маревые (Chenopodiaceae). Томск: Биологические науки, 2006. С. 222-223.
- Строгонов Б.П. Физиологические основы солеустойчивости растений при разнокачественном засолении. М.: АН СССР, 1962. 366 с.
- Строгонов Б.П. Солеустойчивость растений. М.: АН СССР, 1967. С. 270-325.
- Строгонов Б.П. Структура и функция клеток растений при засолении. М.: Наука, 1970. - 315 с.
- Чудина Л.А., Орлова Н.В. Физиология устойчивости растений. Пермь: Пермский университет, 2006. 124 с.
- Шамсутдинов З.Ш., Савченко И.В., Шамсутдинов Н.З. Галофиты России, их экологическая оценка и использование. М.: РАСХН, 2000 391 c.
- Nesterov V.N., Bogdanova E.S., Rozentsvet O A. Biochemical Aspects of Ecology of Endemic Species Suaeda Eltonica Iljin // Internet: http://www.auris-verlag.de 2016. P. 6-11.


