Внеклеточные пептидазы алкалитермофильных бактерий, выделенных из горячих источников Бурятии
Автор: Лаврентьева Елена Владимировна, Раднагуруева Арюна Арсалановна, Дунаевский Яков Ефимович, Намсараев Баир Бадмабазарович
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Изучена внеклеточная протеолитическая активность пяти штаммов алкало-, термофильных бактерий, выделенных из горячих источников Бурятии. Установлено, что субтилизиноподобный фермент наиболее активен в щелочном диапазоне рН, термостабилен и характеризуется широким температурным оптимумом действия. По характеру гидролиза специфических синтетических субстратов и типу ингибирования ферменты классифицированы как сериновые пептидазы субтилизиноподобного типа.
Протеолитическая активность, термофильные бактерии, сериновые пептидазы
Короткий адрес: https://sciup.org/148181829
IDR: 148181829 | УДК: 577.151.01
Текст научной статьи Внеклеточные пептидазы алкалитермофильных бактерий, выделенных из горячих источников Бурятии
Благодаря широкому спектру выполняемых функций, пептидазы играют исключительно важную роль в обмене веществ у всех живых организмов. В течение миллиардов лет физиологическая и молекулярная адаптация прокариотных микроорганизмов обеспечила им возможность выживания в любой экологической нише. Изучение пептидаз бактерий, выделенных из экстремальных мест обитания, предоставляет уникальную возможность исследовать стратегии отдельных регуляторных процессов прокариотной клетки и границы функционирования бактерий, т.к. известно, что усиленный синтез гидролитических ферментов является одним из способов адаптации бактерий к экстремальным условиям окружающей среды [1, 2, 3]. Бурятия, где широко распространены щелочные гидротермы с резко градиентными физико-химическими характеристиками (температура, рН), является уникальным объектом для выделения экстремофильных микроорганизмов. Ферменты экстремофилов проявляют повышенную устойчивость не к одному, а к нескольким факторам среды, что в перспективе делает возможным их широкое использование при разработке промышленных биотехнологий [4].
Целью работы было изучение внеклеточных пептидаз, алкалотермофильных бактерий, выделенных из щелочных гидротерм Бурятии.
Методика
В работе использовали штаммы пяти алкалотермофильных культур Ur-6, Br-2-2, Ga-9-2, Al-9-1 и Se-1, выделенные из микробных матов и донных осадков горячих источников Бурятии (коллекция лаборатории микробиологии ИОЭБ СО РАН г. Улан-Удэ). Краткая характеристика выделенных культур представлена в табл. 1.
Таблица 1
Характеристика изученных штаммов
|
Штамм |
Место выделения/источник выделения |
Таксономическая принадлежность |
lim/оС опт |
lim /рН опт |
|
Ur-6 |
Уро/микробный мат |
Bacillus hemicellulosolyticum C-11 (99%) |
35-70/50 |
6,5-8,5/8,0 |
|
Br-2-2 |
Большая речка/микробный мат |
B. licheniformis BBDC6 (97 %) |
35-70 /50 |
6,8-9,0/8,2 |
|
Ga-9-2 |
Гарга/микробный мат |
Anoxybacillus flavithermus DSM 2641 (Z26932) 95% |
37-75/57 |
6,8-9,0/8,5 |
|
Al-9-1 |
Алла/донные осадки |
A. pushchinoensis AT-2 (AB234214) (96%) |
35-67 /50 |
6,5-9,0/8,0 |
|
Se-1 |
Сея/донные осадки |
A. pushchinoensis AT-2 (AB234214) (95%) |
35-70 /50 |
6,5-9,5/8,2 |
Культуры инкубировались при 50 оС на комплексной среде в течение 12–96 ч. После инкубации клетки осаждали центрифугированием (12000 g, 15 мин), полученный супернатант использовали для определения активности пептидаз. Общую активность измеряли по гидролизу 0,5% раствора азоказеина (рН 8). Специфическую активность секретируемых пептидаз определяли, используя в качестве субстратов 5 мМ п -нитроанилиды: BAPA, GlpAAL p NA, GlpF p NA, GlpFA p NA иT p NA, A p NA, L p NA.
Определение оптимума pH-активности и pH-стабильности фермента. При определении оптимума pH действия секретируемой пептидазы по отношению к синтетическим субстратам были использованы следующие буферные растворы (0,02 М): цитратно-фосфатный, трис-HCl и глицин-NaOH, имеющие рН в диапазоне от 2,9 до 11,6.
Определение температурного оптимума и температурной стабильности . Температурный оптимум фермента определяли, измеряя активность фермента при температурах от 30 до 80 оС.
Ингибиторный анализ . Для выяснения природы функциональных групп активного центра использовали ингибиторы сериновых протеиназ – ФМСФ, ТЛХК, ТФХК, ЭДТА и ЙАА.
Результаты и их обсуждение
Общая протеолитическая активность, измеренная по азоказеину. Исследовали динамику накопления общей протеолитической активности, измеренной по азоказеину у культур, растущих в течение 48 ч на среде с различными источниками азота (триптон, пептон, казеин). Установлено, что максимальная активность у культуры Ur-6 проявляется на среде с триптоном при 12 ч культивирования, тогда как другие культуры достигают максимального значения при 36 ч культивирования.
Отмечено, что при добавлении в среду казеина в качестве источника азота активность была минимальной (до 0,04 ед/мг). В отличие от других культур Se-1 показала более высокую активность на среде с казеином, которая доходила до 0,3 ед/мг при 36 ч культивирования. Активность культур Br-2-2 и Ga-9-2 была низкой вне зависимости от источника азота и времени культивирования.
Субстратная специфичность. Результаты исследования зависимости активности пептидаз от температуры культивирования показали, что наиболее высокая активность на субстрате для субтили-зиноподобных ферментов обнаружена при 50 oС. При этой температуре максимальная удельная активность у культуры Ur-6 обнаружена при 12 ч культивирования и составила 3,24 ед/мг. Показано, что температура 60 oС у данной культуры является наиболее благоприятной для развития аминопептидазной активности (рис. 1).
Интересен факт, что культуры Ur-6, Br-2-2, Ga-9-2, выделенные из микробных матов горячих источников, кроме субтилизиноподобной, обладают также высокой аминопептидазной активностью.
Определение температурной стабильности фермента. Внеклеточная пептидаза штамма Ur-6 имела оптимум активности при 60oС и сохраняла до 31% активности при 70 оС. Температурная стабильность фермента находилась в интервале температур 23–60 оС (рис. 2).
Анализ литературы показывает, что субтилизиноподобные пептидазы характеризуются широким интервалом температурного оптимума и стабильности. Высокая стабильность пептидаз бацилл обеспечивается гидрофобными и ионными взаимодействиями, а также водородными связями и дисульфидными мостиками в белковой глобуле субтилаз [1, 7, 9]. Культура Ga-9-2 показала оптимум активности внеклеточной пептидазы при 50 oС, тогда как культура Br-2-2 при 40 oС (рис. 3).
Стабильность ферментов данных штаммов сохраняется до 60 0С. Данные культуры не отличались высокой активностью, что может быть обусловлено отсутствием дисульфидных связей стабилизирующих структуру белка при высоких температурах [1, 10].
Определение рН-оптимума и стабильности фермента. Изученные ферменты штаммов Ga-9-2 и Br-2-2 активны в относительно узком щелочном диапазоне рН, с максимумом при рН 9,6 и 9,0 соответственно. Исследуемые ферменты были стабильны при рН 7,5–11,8 (рис. 4). Напротив, пептидаза культуры Ur-6 активна в широком интервале рН – значения активности более 50% от максимальной были выявлены на отрезке рН 8,2-12, с максимумом при рН 10. Фермент сохранял стабильность в интервале рН 7,8-12 (рис. 5).
Литературные данные свидетельствуют, что субтилизиноподобные пептидазы являются высокощелочными ферментами с рН оптимумом больше 8, за счет высокого числа гидрофобных и заряженных аминокислот на поверхностной области белковой глобулы субтилизинов [6, 7, 9]. Можно предположить, что высокая щелочеустойчивость изученных белков служит адаптационным, а может и жизненно необходимым свойством бактерий, позволяющим им функционировать в экстремальных условиях щелочных гидротерм.
Анализ природы функциональных групп активного центра
Проведенный нами анализ функциональных групп активного центра показал, что активность внеклеточных пептидаз по субстрату GlpAAL p NA у изученных штаммов Ur-6, Ga-9-2 и Br-2-2 подавляется специфическим ингибитором сериновых протеиназ – ФМСФ. Представленные данные вместе с данными о предпочтительном субстрате исследуемых ферментов позволяют отнести их к классу сериновых протеиназ субтилизиноподобного типа.
В заключение необходимо отметить, что бактерии, выделенные из щелочных гидротерм Бурятии, характеризуются высокой и активной продукцией внеклеточных пептидаз. Этот факт может свиде- тельствовать об их участии в гидролизе экзогенных белковых макромолекул и снабжении клеток мономерами, которые впоследствии потребляются клетками и используются для их функционирования в естественных условиях обитания. Внеклеточные пептидазы вынуждены работать в более жестких условиях внешней среды и, следовательно, должны иметь более высокую стабильность. Показана широкая вариабельность температурного
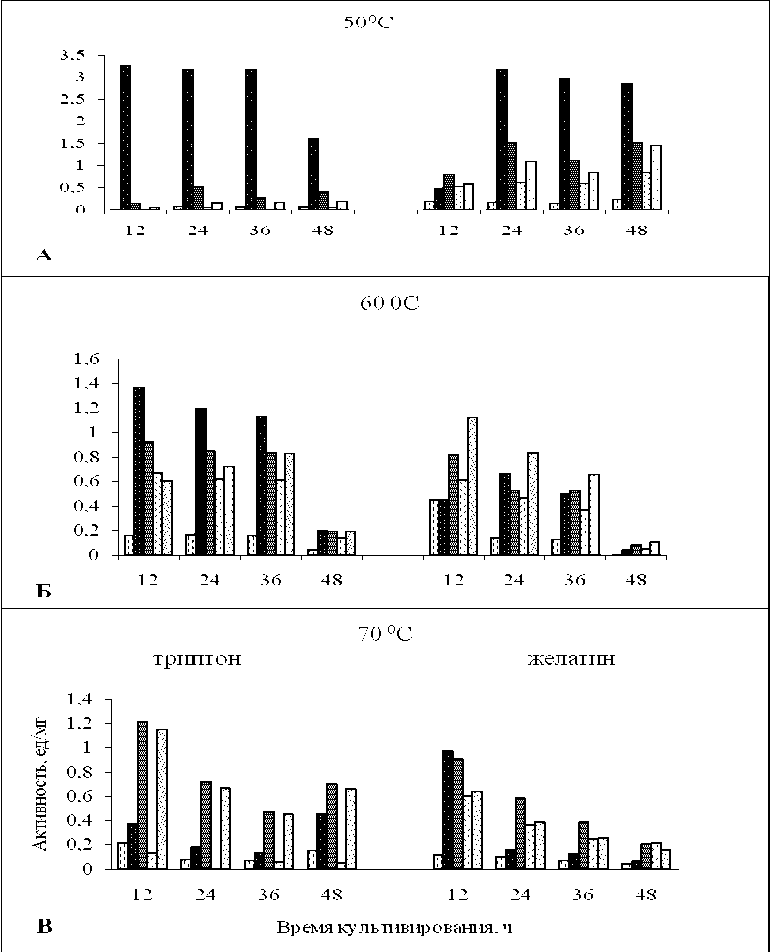
Рис. 1. Динамика активности субтилизиноподобной пептидазы штамма Ur-6 при различных температурах культивирования
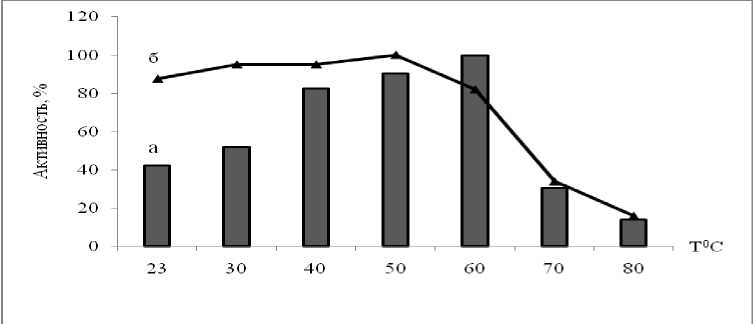
Рис. 2. Температурные оптимум (а) и стабильность (б) внеклеточной пептидазы культуры Ur-6
120 120
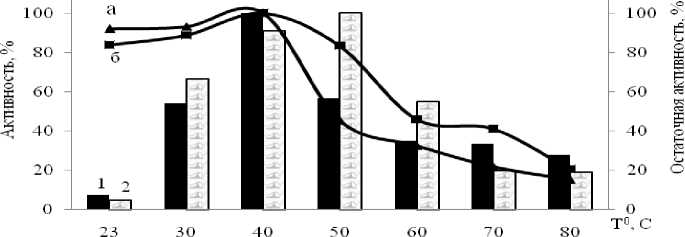
Рис. 3. Температурные оптимум и стабильность внеклеточных пептидаз культур Br-2-2 (I, а) и Ga-9-2 (II, б)
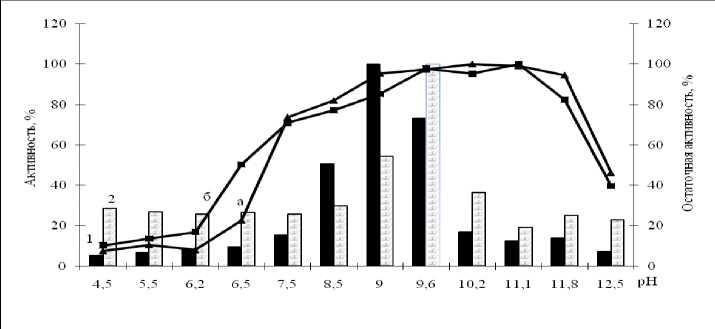
Рис. 4. рН-оптимум и стабильность внеклеточных пептидаз культур Br-2-2 (1, а), Ga-9-2(2, б)
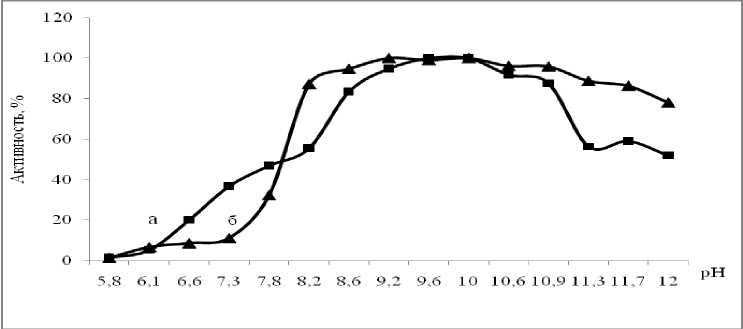
Рис. 5. рН – оптимум (а) и стабильность (б) внеклеточной пептидазы Ur-6
оптимума и стабильности. Полученные результаты показали границы приспособляемости и функционирования выделенных бактерий в экстремальных условиях гидротерм Бурятии.


