Внеклеточные везикулы, в том числе экзосомы, из мезенхимных стволовых/стромальных клеток животных
Автор: Савченкова И.П., Надточей Г.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры клеток in vitro
Статья в выпуске: 6 т.58, 2023 года.
Бесплатный доступ
Мезенхимные стволовые/стромальные клетки (МСК) млекопитающих продуцируют внеклеточные везикулы (ВВ), связанные с плазматической клеточной мембраной, в которых могут присутствовать факторы роста, хемокины, цитокины, микроРНК. В настоящее время ВВ широко используются для разработки новых регенеративных стратегий в лечении многочисленных заболеваний, поскольку передают большую часть терапевтических свойств МСК. В исследовании впервые показано, что из кондиционированных сред (КС) МСК пяти разных видов животных можно выделить обогащенные экзосомами ВВ методом дифференциального центрифугирования (ДЦ) с последующим ультрацентрифугированием (УЦ). Цель работы - получить внеклеточные везикулы из кондиционированных сред мезенхимных стволовых/стромальных клеток костного мозга, пуповинной крови и жировой ткани сельскохозяйственных (крупный рогатый скот, овцы, лошади) и мелких домашних (собаки, кошки) животных. В работе использовали МСК, полученные нами ранее из костного мозга (КМ) крупного рогатого скота (КРС) и овец, пуповинной крови (ПК) лошадей, жировой ткани (ЖТ) овец, КРС, лошадей, собак и кошек. МСК размораживали и засевали в матрасы с площадью роста 25 см2, через 48 ч пересевали в матрасы с площадью роста 175 см2 в соотношении 1:7 и инкубировали в течение 10 сут до достижения клеткам полного монослоя. Затем КС из всех образцов МСК сливали в стерильные центрифужные пробирки объемом 50 мл и выделяли ВВ. Для этого использовали метод дифференциального центрифугирования (ДЦ) с последующим ультрацентрифугированием (УЦ). Во всех образцах с помощью электронной микроскопии были выявлены округлые или не совсем правильной формы микрочастицы разного размера. Диаметры отдельных ВВ у разных видов животных статистически не различались (p = 0,1). При сравнении числа частиц, выделенных из 50 мл КС МСК разных видов животных, статистически значимых различий не выявили (р = 0,1). Так, на одной сетке МСК (КМ) и МСК (ЖТ) КРС обнаружили соответственно 3±0,1 и 6±0,07 частицы размером 50-100 нм, 7±0,02 и 4±0,03 частицы 100-150 нм, а также 3±0,4 и 2±0,06 частицы размером более 150 нм. ВВ из КС МСК (ЖТ) собак были наиболее гомогенными и по форме (округлые), и по размеру (основная часть имела размер 50-100 нм; 12±0,02 частиц). В образцах, выделенных из КС МСК (ЖТ) овец, кошек, лошадей и ПК лошадей, число частиц с диаметром 50-100 нм составляло 7±0,2; 7±0,01; 5±0,7 и 8±0,02. Анализ полученных электронограмм показал, что более 70 % ВВ имели диаметр от 50 до 100 нм, то есть классифицировались как экзосомы. ВВ, выделенные из КС МСК (ЖТ) собак, положительно окрашивались при использовании антител против антигена TSG101 (цитоплазматический белок, маркер экзосом). Полученные результаты демонстрируют, что КС МСК животных, выделенных из КМ, ЖТ и ПК, содержит ВВ, в том числе экзосомы. Метод ДЦ не исключает, что в препарате присутствуют другие частицы, поэтому мы предлагаем обозначить его как микро-ВВ, обогащенные экзосомами. Получение ВВ определенного состава из КС МСК сельскохозяйственных и домашних животных открывает широкие перспективы для применения экзосом в диагностике и лечении заболеваний.
Мезенхимные стволовые/стромальные клетки, костный мозг, жировая ткань, пуповинная кровь, лошади, крупный рогатый скот, овцы, собаки, кошки, внеклеточные везикулы, экзосомы, выделение, дифференциальное центрифугирование, идентификация
Короткий адрес: https://sciup.org/142240682
IDR: 142240682 | УДК: 619:57.085.23 | DOI: 10.15389/agrobiology.2023.6.1112rus
Текст научной статьи Внеклеточные везикулы, в том числе экзосомы, из мезенхимных стволовых/стромальных клеток животных
Мезенхимные стволовые/стромальные клетки (МСК) животных на протяжении нескольких десятилетий привлекают внимание в качестве перспективного клеточного материала в регенеративной медицине благодаря их адаптации к условиям и размножению in vitro, способности к дифференцировке, мощным иммуномодулирующим и противовоспалительным свойствам (1, 2). Возможно, регенеративные способности МСК обусловлены плейотропными эффектами, опосредованными секрецией растворимых паракринных факторов и внеклеточных везикул (ВВ) (3, 4). ВВ — это наночастицы, произведенные естественным путем. Они представляют собой важный компонент секретомов различных клеток, обеспечивают комплексную передачу биологически активных молекул и осуществляют горизонтальный перенос генетической информации (5, 6). ВВ присутствуют во всех биологических жидкостях организма, состоят из двойных слоев фосфолипидов и различаются по происхождению, составу и функциям. В зависимости от того, как образуются внеклеточные пузырьки и какой они величины, их называют апоптозными тельцами, эктосомами или экзосомами.
Апоптозные тельца, они же апотельца, — это ограниченные плазматической мембраной фрагменты клетки, образующиеся в результате апоптоза. Они имеют размер около 50-5000 нм в диаметре и могут содержать органеллы или даже фрагменты ядра погибшей клетки. Эктосомы, или почкующиеся микровезикулы, образуются посредством выпячивания плазматической мембраны из клетки наружу; выпуклость отшнуровывается от мембраны клетки и превращается в пузырьки размером от 50 до 200 нм (иногда до 1000 нм) в диаметре. Экзосомы — небольшие пузырьки (обычно от 40 до 100 нм), которые образуются внутри клетки и почкуются в полость, называемую эндосомой. Когда в этой полости накапливается достаточно много экзосом, ее дальнейшая судьба зависит от того, из каких липидов состоит ее мембрана. Если эндосома помечена лизобисфосфатидиловой кислотой (фосфатидилинозитол-3-фосфат) и содержит убиквитинированные белки, то ее содержимое будет уничтожено: она сольется с лизосомой — мембранным пузырьком, наполненным ферментами, которые расщепляют белки, углеводы, липиды и нуклеиновые кислоты. Если мембрана эндосомы содержит церамиды, то эндосома сливается с поверхностной мембраной клетки, и множество экзосом выталкиваются наружу, во внеклеточную среду (7).
Значительный интерес представляют экзосомы, секретируемые МСК (3, 8). В настоящее время они широко используются для разработки новых регенеративных стратегий в лечении многочисленных заболеваний, поскольку передают большую часть терапевтических свойств этих клеток. Использование экзосом из МСК служит альтернативой клеточной терапии и может свести к минимуму проблемы безопасности при введении жизнеспособных клеток (9).
Функция экзосом легко регулируется с помощью предварительной обработки культуры MСК, например посредством добавления химических факторов или цитокинов, создания гипоксических условий и введения модификаций генов (10). Однако механизмы регенерационных способностей экзосом МСК в клетках-мишенях до сих пор недостаточно изучены. Кроме того, существует несколько нерешенных проблем: отсутствие установленных стандартов и руководящих принципов в отношении размера ВВ, их чистоты, экспрессии определенных поверхностных биомаркеров (например, CD9, CD63, CD81) на их поверхности и приемлемых уровней загрязнения для идентификации и контроля качества выделенных экзосом (11). Использование экзосом МСК в клинических условиях также ограничено из-за отсутствия стандартизированных условий культивирования клеток и оптимальных единых протоколов для выделения и хранения экзосом, оптимальной терапевтической дозы и графика введения, а также надежных анализов для оценки эффективности терапии ВВ.
Совершенствование методов получения ВВ определенного состава открывает широкие перспективы их использования в клинической практике ветеринарной медицины (12). Инфекционные болезни и зоонозы — одни из основных проблем содержания сельскохозяйственных животных. Развитие современных представлений о биологии инфекционных агентов имеет решающее значение для обеспечения здоровья и благополучия животных, поддержания их высокой продуктивности и безопасности пищевых продуктов. Считается, что ВВ человека могут переносить вирусные элементы, участвуя как в распространении инфекционных заболеваний, так и в индукции иммунного ответа против инфекционного агента и представляют перспективный материал в качестве диагностических биомаркеров для лучшего понимания патогенного механизма заболевания (13). Так, ВВ, которые высвобождаются клетками HeLa, инфицированными вирусом болезни Ньюкасла (БНВ, Newcastle disease virus, NDV), или клетками почки крупного рогатого скота (Мadin-Darby bovine kidney cells, MDBK), инфицированными вирусом парагриппа коз типа 3 (ВПК3, сaprine parainfluenza virus type 3, CPIV3), несут микроРНК, РНК или белки, усиливающие цито-патическую активность вируса. Кроме того, ВВ были способны подавлять экспрессию гена интерферона (IFN-β) в клетках HeLa после инфекции NDV и ингибировать аутофагию во время инфекций CPIV3, что свидетельствует о значительной роли ВВ в распространении вируса (14, 15). ВВ секретируются различными клетками и при адаптации в условиях in vitro высвобождаются в ростовую среду, достигая максимального количества, когда среда становится кондиционированной.
В настоящей работе впервые показано, что методом дифференциального центрифугирования (ДЦ) с последующим ультрацентрифугированием (УЦ) из кондиционированных сред (КС) МСК пяти видов животных можно выделить ВВ, обогащенные экзосомами.
Цель работы — получить внеклеточные везикулы из кондиционированных сред мезенхимных стволовых/стромальных клеток костного мозга, пуповинной крови и жировой ткани сельскохозяйственных (крупный рогатый скот, овцы, лошади) и мелких домашних (собаки, кошки) животных.
Методика. Эксперименты проводили в ФНЦ Всероссийский НИИ экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко РАН в 2023 году. Использовали МСК, полученные нами ранее (16-19) из костного мозга (КМ) крупного рогатого скота (КРС) и овец, пуповинной крови (ПК) лошадей, жировой ткани (ЖТ) овец, КРС, лошадей, собак и кошек, которые были охарактеризованы, стандартизированы и депонированы в Специализированную коллекцию перевиваемых соматических культур сельскохозяйственных и промысловых животных РККК (П) (СХЖ РАН) при ФГБНУ ФНЦ ВИЭВ РАН. МСК размораживали и засевали в матрасы с площадью роста 25 см2, через 48 ч пересевали в матрасы с площадью роста 175 см2 в соотношении 1:7 и инкубировали в течение 10 сут.
Основной средой для культивирования МСК была среда DМЕМ с низким содержанием глюкозы (1 г/л) («ПанЭко», Россия), дополненная 10 % сыворотки крови плодов коров (СКПК) («HyClone», США), однократным раствором незаменимых аминокислот и антибиотиками («ПанЭко», Россия). Конечная концентрация стрептомицина в среде составляла 50 мкг/мл, пенициллина — 50 Ед/мл. СКПК перед использованием предварительно очищали от возможного присутствия экзосом (ультрацентрифуга L7 Ultracentrifuge, «Beckman», США; 100000 g в течение 60 мин).
Сбор кондиционированных сред из МСК осуществляли после достижения ими 100 % монослоя в матрасах с площадью роста 175 см2. При этом объем КС с одного матраса составлял 50 мл. Морфологический анализ клеток проводили визуально с помощью фазово-контрастного микроскопа («Carl Zeiss», Германия), используя для измерений программное обеспечение
AxioVision Rel. 4.8 («Carl Zeiss», Германия).
ВВ выделяли методом дифференциального центрифугирования (ДЦ). КС собирали в 50 мл стерильные центрифужные пробирки («SPL Life Sciences Co», Корея) и осаждали низкоскоростным (500 g, 20 мин) центрифугированием (центрифуга CM-6M, SIA «ELMI», Латвия). Такое центрифугирование использовали для удаления мертвых клеток, их распавшихся компонентов и других частиц внеклеточного матрикса, которые присутствуют в КС и выпадают в осадок. Надосадочную жидкость сливали в другую стерильную пробирку и пропускали через фильтры (размер пор 0,22 мкм; «GE Osmonics», США). Профильтрованную КС вновь центрифугировали (CM-6M, CM-6M, SIA «ELMI», Латвия) при 2300 g 30 мин для удаления апоптотических телец, которые были в осадке, а надосадочную жидкость подвергали высокоскоростному центрифугированию при 13000 g в течение 30 мин (центрифуга Eppendorf 5804, «Eppendorf», Германия). Наконец, ВВ извлекали с помощью УЦ при 100000 g в течение 60 мин (ультрацентрифуга Beckman L7 Ultracentrifuge). Надосадочную жидкость сливали, к осадку добавляли 100 мкл фостатно-солевого буфера (ФСБ) («ПанЭко», Россия) и тщательно ресуспендировали пипетированием.
Полученные ВВ исследовали методом негативного контрастирования (20). Для этого 30 мкл суспензии ВВ в ФСБ наносили на покрытую бутваровой пленкой медную сетку 150 меш, через 1 мин избыток жидкости удаляли с сетки касанием ее ребра фильтровальной бумаги. Затем на сетку наносили 30 мкл 2 % раствора фосфорно-вольфрамовой кислоты, нейтрализованного 1 М раствором NaOH до рH 6,5. Избыток жидкости удаляли аналогичным образом через 10 с. Подсушивали на воздухе в течение 10 мин, полученный препарат анализировали на электронном микроскопе (JEM-100CXII «JEOL», Япония) при инструментальном увеличении ½27000, ½40000 и ½50000. Проводили измерения экзосом, выделенных из 50 мл КС МСК животных, учитывали размер (диаметр) и число (не менее чем в 10 спонтанно выбранных полях зрения в микроскопе на один препарате в трех повторностях).
Образцы ВВ из КС МСК (ЖТ) собак, МСК (ЖТ) собак, эмбриональных фибробластов мыши линии STO и МСК (КМ) КРС (отрицательный контроль) лизировали (буфер RIPA, «Wuhan Servicebio Technology, Ltd.», Китай). Концентрацию белка в лизатах измеряли с использованием набора для анализа белка (Pierce BCA Protein Assay Kit, «Thermo Fisher Scientific, Inc.», США). К равным объемам лизатов добавляли в 4 раза меньший объем 5½ буфера (10 % SDS, 250 мМ Tris-HCl, pH 6,8, 0,5 % бромфеноловый синий, 50 % глицерин, 5 % в -меркаптоэтанол) и нагревали при 95 ° C в течение 10 мин для восстановления и денатурации образцов. Белки разделяли с помощью электрофореза в 10 % полиакриламидном геле с 1 % SDS (SDS-PAGE) и затем переносили на поливинилиденфторидные мембраны («Merck Millipore», США). Мембраны блокировали 5 % обезжиренным молоком в ФСБ, содержащем 0,1 % Tween-20, в течение 1 ч при комнатной температуре. Затем инкубировали при той же температуре в течение 1 ч с антителами (АТ) против TSG101 (sc-7964, 1, «Santa Cruz Biotenology», США; разведение 1:1000) с последующей инкубацией при комнатной температуре в течение 1 ч со вторыми козьими АТ против антигенов (АГ) мыши, меченными пероксидазой хрена («Аксиома БИО», Россия).
Статистическую обработку результатов проводили в программе Microsoft Excel. Результаты выражали как средние арифметические ( M ) и стандартные ошибки средних (±SEM). Достоверность различий оценивали по t -критерию Стьюдента при р < 0,05.
Результаты . ВВ выделяли из КС МСК пяти видов животных, при этом для КРС и овцы клеточные популяции были представлены двумя типами — МСК (ЖТ) и МСК (КМ). Клетки имели схожие свойства in vitro.
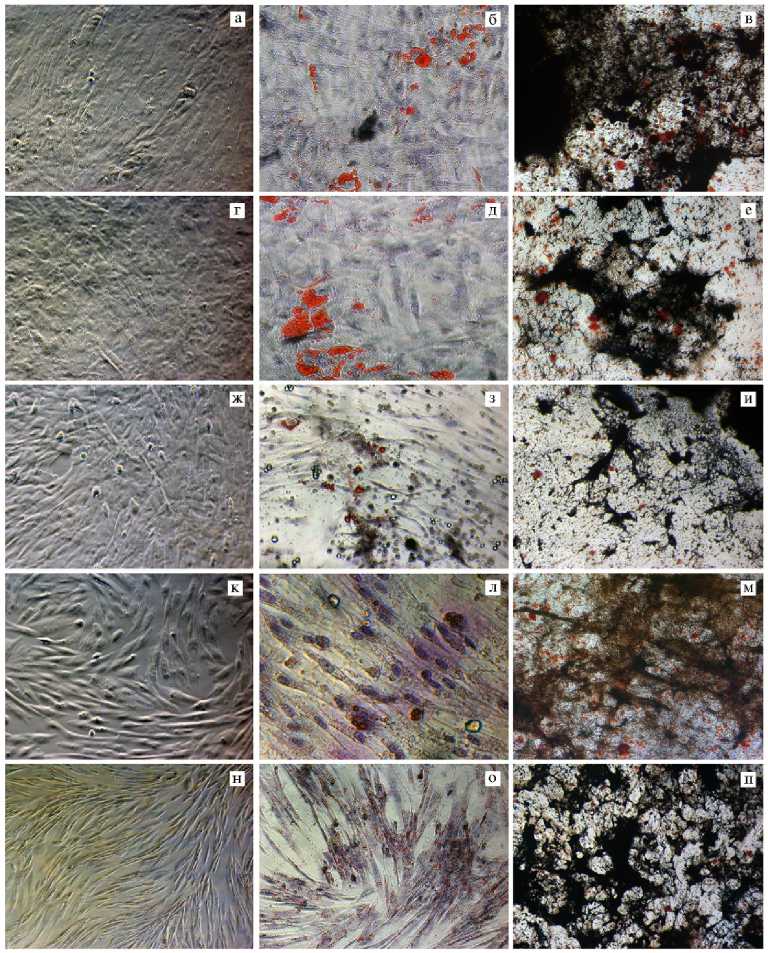
Рис. 1. Микрофотографии мезенхимных стволовых/стромальных клеток (МСК) перед сбором кондиционной среды для выделения экзосом (слева, монослой) и их способность при индукции к адипо- (окрашивание жировым красным O, по центру) и остеогенной (окрашивание серебрением по von Kossa, справа) дифференцировке: а, б, в — МСК из костного мозга (КМ) крупного рогатого скота (КРС), г, д, е — МСК из жировой ткани (ЖТ) КРС, ж, з, и — МСК (КМ) овец, к, л, м — МСК из пуповинной крови лошади; н, о, п — МСК (ЖТ) собаки (микроскоп «Carl Zeiss», Германия, увеличение *100; б, д, к, л — *200).
На рисунке 1 видна фибробластоподобная морфология МСК, выделенных из КМ КРС (а) и овец (ж), из ЖТ КРС (г) и собак (н), а также ПК лошадей (к). Из-за отсутствия специфических АТ против АГ сельскохозяйственных животных фенотип МСК был подтвержден по функции: способности формировать при индукции клетки жировой и костной тканей. После индукции адипогенной средой в течение 21 сут МСК постепенно превращались из фибробластоподобных клеток в уплощенные клетки, и в цитоплазме появлялись липидные капли разного размера, которые окрашивались жировым красным O в красный цвет (см. рис. 1, б, д, з, л, о). После инкубации с остеогенной средой в течение 21 сут во всех популяциях МСК обнаруживались морфологические изменения, а при обработке серебрением по von Kossa фосфаты и карбонаты окрашивались в черный цвет (см. рис. 1, в, е, и, м, п).
Каждый образец выделенных ВВ был ресуспендирован в 100 мкл ФСБ (3-кратная повторность). Электронно-микроскопический анализ выявил во всех образцах округлые или не совсем правильной формы микрочастицы разного размера, а также скопления волокнистых структур. Последние, вероятно, представляли собой высохшие вещества, содержавшиеся в части ВВ, которые разрушились при приготовлении препарата, поскольку не были фиксированы.
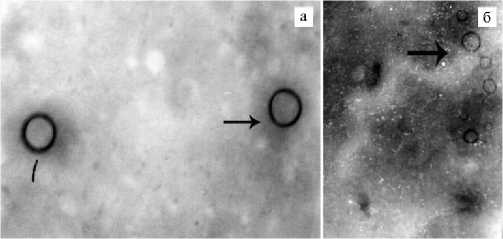
Рис. 2. Микрофотография внеклеточных везикул, выделенных из кондиционированных сред мезенхимных стволовых/стромальных клеток костного мозга крупного рогатого скота (а) и овец (б) . Стрелками указаны экзосомы (электронограмма, микроскоп JEM-100CXII, «JEOL», Япония, увеличение: а — ½54000, б — ½50000).
Анализ полученных электронограмм показал, что во всех образцах более 70 % сохранившихся ВВ имели размеры от 50 до 100 нм, то есть классифицировались как экзосомы (рис. 2). Диаметры ВВ у разных видов животных статистически не различались (p = 0,1). При сравнении числа частиц, выделенных из 50 мл КС МСК от разных видов животных, статистически значимых различий не обнаружили (р = 0,1). Так, на одной сетке МСК (КМ) и МСК (ЖТ) КРС находились соответственно 3±0,1 и 6±0,07 частицы размером 50-100 нм, 7±0,02 и 4±0,03 частицы размером 100-150 нм, а также 3±0,4 и 2±0,06 частицы размером более 150 нм. ВВ из КС МСК (ЖТ) собак оказались наиболее гомогенными и по форме (округлые), и по размеру, основную часть (12±0,02) составляли частицы размером 50-100 нм. В образцах, выделенных из КС МСК (ЖТ) овец, кошек, лошадей и ПК лошадей, число частиц с диаметром 50-100 нм составляло соответственно 7±0,2; 7±0,01; 5±0,7 и 8±0,02. Из КС МСК (КМ) овец выделили 2±0,1 частицы размером до 50 нм, 5±0,6 частицы — от 50-100 нм, 1±0,03 частицы — от 100-150 нм, 5±0,7 частицы — 150-200 нм, 3±0,01 частицы — свыше 200 нм, две из которых имели неправильную форму, подобную эктосомам, почкующимся микровезикулам.
Для идентификации фенотипа экзосом использовали ВВ, выделенные из КС МСК собак. Этот выбор был обусловлен наличием мышиных моноклональных АТ против TSG101, которые рекомендованы для выявления TSG101 мышиного, крысиного, человеческого и собачьего происхождения. В качестве контроля использовали лизаты МСК (ЖТ) собак, из которых были выделены ВВ, мышиных эмбриональных фибробластов STO и
МСК (КМ) КРС (отрицательный контроль). Для идентификации экзосом использовали белок-маркер клеточных экзосом и вестерн-блот (имму-ноблот) — аналитический метод определения в образце специфичных белков. Вестерн-блот часто используется как контрольный тест для подтверждения выделения экзосом (7). Маркерами экзосом могут служить поверхностные белки CD9, CD 63, CD81. Мы остановились на детекции цитоплазматического белка TSG101 из-за наличия соответствующих АТ. В результате во всех образцах (кроме отрицательного контроля) обнаружили полосы с молекулярной массой 50-55 кДа, окрашенные АТ против АГ TSG101 (рис. 3).

Рис. 3. Белок TSG101 (вестерн-блот) в образцах, выделенных из лизата мезенхимных ство-ловых/стромальных клеток жировой ткани (ЖТ) собак (1) , внеклеточных везикул из кондиционированных сред мезенхимных стромальных клеток ЖТ собак (2) , лизата мышиных эмбриональных фибробластов STO (3) , отрицательный контроль (4) . М — маркер молекулярной массы, 8-195 кДа («Wuhan Servicebio Technology, Ltd.», Китай) .
В нашей работе мы продемонстрировали, что клетки с фенотипом МСК сельскохозяйственных (КРС, овцы, лошадь) и мелких домашних (собака, кошка) животных продуцируют в процессе культивирования ВВ, которые накапливаются в КС, и их можно оттуда извлечь. Ранее экзосомы были получены из МСК лошади (21), собак (22), кошек (23). Для выделения ВВ из КС МСК используется много методов (24-26), среди которых можно выделить дифференциальное центрифугирование, основанное на разнице в размере и плотности между ВВ и другими веществами, присутствующими в КС. Этот метод часто используется для извлечения экзосом из-за простоты и стабильности результата (27). С помощью ДЦ из КС постепенно удаляется ненужный материал. На конечном этапе очищенную КС подвергают УЦ. УЦ — наиболее широко используемый метод выделения экзосом, когда-то его называли «золотым стандартом» для их получения (28).
Мы тоже использовали метод ДЦ для получения экзосом из КС МСК животных. В нашем исследовании ультраструктуру и размер частиц определяли с помощью электронной микроскопии. Результаты показали, что ВВ, выделенные из КС МСК (КМ) и МСК (ЖТ) всех видов животных, представляют собой круглые или эллиптические везикулы с мембранными структурами вокруг везикул, сходными по форме. Более 70 % частиц, выделенных из КС всех МСК, имели размер 50-100 нм.
Экзосомы могут содержать различные белки, состав которых зависит от клетки-хозяина и дополнительно модулируются ее состоянием (например, стрессом или активацией либо ингибированием специфических сигнальных путей). Тетраспанины (CD9, CD63 и CD81) — наиболее распространенные канонические белки-маркеры экзосом, присутствующие на поверхности везикул. Поверхностная локализация тетраспаниновых АГ делает их подходящими мишенями-кандидатами для иммуномаркировки и очистки экзосом из биологических образцов. Следует заметить, что сложности с характеристикой ВВ у животных по сравнению с человеком обусловлены отсутствием специфических маркеров, связанных или не связанных с ВВ, которые можно использовать для характеристики ВВ у разных видов. Кроме того, отсутствуют ткане- или клеточно-специфические маркеры (для выделения субпопуляций ВВ) и гены-маркеры, которые можно было бы использовать при исследовании нуклеиновых кислот, ассоцииро- ванных с ВВ. Экзосомы обогащены белками Tsg101 и Alix, которые служат компонентами комплекса эндосомальной сортировки, необходимыми для их транспорта. В качестве маркера экзосом в выделенных образцах идентифицировали цитоплазматический белок Tsg101 (Тumor Susceptibility Gene 101), который участвует в образовании мультивезикулярных телец экзосомы и считается еще одним важным экзосомным маркером (29). Результаты ве-стерн-блота показали, что все выделенные образцы из КС МСК (ЖТ) собак были положительными по этому белку.
Таким образом, кондиционированные среды мезенхимных стволо-вых/стромальных клеток из костного мозга, жировой ткани и пуповинной крови сельскохозяйственных (крупный рогатый скот, овцы, лошадь) и мелких домашних (собака, кошка) животных содержат внеклеточные везикулы, в том числе экзосомы. Поскольку размер и плотность большинства ВВ и других клеточных компонентов в некоторой степени перекрываются, можно предположить, что метод дифференциального центрифугирования не позволяет выделить только экзосомы, а скорее приводит к обогащению образца экзосомами. В нашей работе мы описали основанный на ДЦ метод выделения микро-ВВ, в которых присутствуют экзосомы, для пяти видов животных. Это позволит создать основу для применения экзосом в диагностике заболеваний и лечении сельскохозяйственных и домашних животных в будущем.
Список литературы Внеклеточные везикулы, в том числе экзосомы, из мезенхимных стволовых/стромальных клеток животных
- Viktorova E.V., Savchenkova I.P. Мultipotent mesenchymal stem cells in clinical veterinary prac-tice. IOP Conference Series: Earth and Environmental Science, 2020, 548: 072072 (doi: 10.1088/1755-1315/548/7/072072).
- Platonova S.A., Korovina D.G., Viktorova E.V., Savchenkova I.P. Еquine tendinopathy therapy using mesenchymal stem cells. KnE Life Sciences, 2021, 6(3): 533-541 (doi: 10.18502/kls.v0i0.8987).
- Hade M.D., Suire C.N., Suo Z. Mesenchymal stem cell-derived exosomes: applications in re-generative medicine. Cells, 2021, 10(8): 1959 (doi: 10.3390/cells10081959).
- Gowen A., Shahjin F., Chand S., Odegaard K.E., Yelamanchili S.V. Mesenchymal stem cell-derived extracellular vesicles: challenges in clinical applications. Frontiers in Cell and Developmen-tal Biology, 2020, 8: 149 (doi: 10.3389/fcell.2020.00149).
- Mathivanan S., Ji H., Simpson R.J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics, 2010, 73(10): 1907-1920 (doi: 10.1016/j.jprot.2010.06.006).
- Bazzan E., Tinè M., Casara A., Biondini D., Semenzato U., Cocconcelli E., Balestro E., Da-min M., Radu C.M., Turato G., Baraldo S., Simioni P., Spagnolo P., Saetta M., Cosio M.G. Critical review of the evolution of extracellular vesicles' knowledge: from 1946 to today. Int. J. Mol. Sci., 2021, 22(12): 6417 (doi: 10.3390/ijms22126417).
- Doyle L.M., Zhuo W.M. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosomeiIsolation and analysis. Cells, 2019, 8(7): 727 (doi: 10.3390/cells8070727).
- Tran P., Xiang D., Tran T., Yin W., Zhang Y., Kong L., Chen K., Sun M., Li Y., Hou Y., Zhu Y., Duan W. Exosomes and nanoengineering: a match made for precision therapeutics. Adv. Mater., 2020, 32(18): e1904040 (doi: 10.1002/adma.201904040).
- Fang Y., Zhang Y., Zhou J., Cao K. Adipose-derived mesenchymal stem cell exosomes: a novel pathway for tissues repair. Cell and Tissue Banking, 2019, 20(2): 153-161 (doi: 10.1007/s10561-019-09761-y).
- Doyle L.M., Wang M.Z. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells, 2019, 8(7): 727 (doi: 10.3390/cells8070727).
- Chen J., Liu R., Huang T., Sun H., Jiang H. Adipose stem cells-released extracellular vesicles as a next-generation cargo delivery vehicles: a survey of minimal information implementation, mass production and functional modification. Stem Cell Res. Ther., 2022, 13(1): 182 (doi: 10.1186/s13287-022-02849-5).
- Moccia V., Sammarco A., Cavicchioli L., Castagnaro M., Bongiovanni L., Zappulli V. Extracel-lular vesicles in veterinary medicine. Animals, 2022, 12(19): 2716 (doi: 10.3390/ani12192716).
- Nahand J.S., Mahjoubin-Tehran M., Moghoofei M., Pourhanifeh M.H., Mirzaei H.R., Asemi Z., Khatami A., Bokharaei-Salim F., Mirzaei H., Hamblin M.R. Exosomal miRNAs: novel players in viral infection. Epigenomics, 2020, 12(4): 353-370 (doi: 10.2217/epi-2019-0192).
- Zhou C., Tan L., Sun Y., Qiu X., Lia Y., Song C., Liu W., Nair V., Ding C. Exosomes carry microRNAs into neighboring cells to promote diffusive infection of newcastle disease virus. Vi-ruses, 2019, 11(6): 527 (doi: 10.3390/v11060527).
- Mao L., Liang P., Li W., Zhang S., Liu M., Yang L., Li J., Li H., Hao F., Sun M., Zhang W., Wang L., Cai X., Luo X. Exosomes promote caprine parainfluenza virus type 3 infection by inhibiting autophagy. Journal of General Virology, 2020; 101: 717-734 (doi: 10.1099/jgv.0.001424).
- Волкова И.М., Викторова Е.В., Савченкова И.П., Гулюкин М.И. Характеристика мезен-химных стволовых клеток, выделенных из костного мозга и жировой ткани крупного ро-гатого скота. Сельскохозяйственная биология, 2012, 47(2): 32-38.
- Коровина Д.Г., Юров К.П., Волкова И.М., Алексеенкова С.В., Васильева С.А., Савчен-кова Е.А., Савченкова И.П. Пуповинная кровь лошадей как источник мультипотентных мезенхимных стволовых клеток. Коневодство и конный спорт, 2015, 6: 31-33.
- Коровина Д.Г., Волкова И.М., Васильева С.А., Гулюкин М.И., Савченкова И.П. Мультипо-тентные мезенхимные стволовые клетки, выделенные из костного мозга овцы: получение и криоконсервирование. Цитология, 2019, 61(1): 35-44 (doi: 10.1134/S0041377119010036).
- Савченкова И.П., Васильева С.А., Коровина Д.Г., Шабейкин А.А., Гулюкин А.М. Мезенхимные стволовые клетки из жировой ткани кошек и собак в культуре. Сельскохозяйственная биология, 2019, 54(2): 395-403 (doi: 10.15389/agrobiology.2019.2.395rus).
- Brenner S., Horne R.W. A negative staining method for high resolution electron microscopy of viruses. Biochimica et Biophysica Acta, 1959, 34: 103-110 (doi: 10.1016/0006-3002(59)90237-9).
- Klymiuk M.C., Balz N., Elashry M.I., Heimann M., Wenisch S., Arnhold S. Exosomes isolation and identification from equine mesenchymal stem cells. BMC Vet. Res., 2019, 5(1): 42 (doi: 10.1186/s12917-019-1789-9).
- Aguilera-Rojas M., Badewien-Rentzsch B., Plendl J., Kohn B., Einspanier R. Exploration of serum- and cell culture-derived exosomes from dogs. BMC Vet. Res., 2018, 14(1): 179 (doi: 10.1186/s12917-018-1509-x).
- Sung S.-E., Seo M.-S., Kang K.-K., Choi J.-H., Lee S., Sung M., Kim K., Lee G.-W., Lim J.-H., Yang S.-Y., Yim S.-G., Kim S.-K., Park S., Kwon Y.S., Yun S. Mesenchymal stem cell exosomes derived from feline adipose tissue enhance the effects of anti-inflammation compared to fibro-blasts-derived exosomes. Vet. Sci., 2021, 8(9): 182 (doi: 10.3390/vetsci8090182).
- Soares M.T., Catita J., Martins R.I., A.B. da e Silva O., Henriques A.G. Exosome isolation from distinct biofluids using precipitation and column-based approaches. PLoS ONE, 2018, 13(6): e0198820 (doi: 10.1371/journal.pone.0198820).
- Huang L.-H., Rau C.-S., Wu S.-C., Wu Y.-C., Wu C.-J., Tsai C.-W., Lin C.-W., Lu T.-H., Hsieh C.- H. Identification and characterization of hADSC-derived exosome proteins from dif-ferent isolation methods. J. Cell. Mol. Med., 2021, 25(15): 7436-7450 (doi: 10.1111/jcmm.16775).
- Helwa I., Cai J., Drewry M.D., Zimmerman A., Dinkins M.B., Khaled M.L., Seremwe M., Dismuke W.M., Bieberich E., Stamer W.D., Hamrick M.W., Liu Y. A comparative study of serum exosome isolation using differential ultracentrifugation and three commercial reagents. PLoS ONE, 2017, 12(1): e170628 (doi: 10.1371/journal.pone.0170628).
- Kurian T.K., Banik S., Gopal D., Chakrabarti S., Mazumder N. Elucidating methods for isolation and quantification of exosomes: a review. Molecular Biotechnology, 2021, 63(4): 249-266 (doi: 10.1007/s12033-021-00300-3).
- Coughlan C., Bruce K.D., Burgy O., Boyd T.D., Michel C.R., Garcia-Perez J.E., Adame V., Anton P., Bettcher B.M., Chial H.J., Königshoff M., Hsieh E.W.Y., Graner M., Potter H. Exo-some isolation by ultracentrifugation and precipitation and techniques for downstream analyses. Current Protocols in Cell Biology, 2020, 88(1): e110 (doi: 10.1002/cpcb.110).
- Koritzinsky E.H., Street J.M., Chari R.R., Glispie D.M., Bellomo T.R., Aponte A.M., Star R.A., Yuen P. Circadian variation in the release of small extracellular vesicles can be normalized by vesicle number or TSG101. American Journal of Physiology-Renal Physiology, 2019, 317(5): F1098-F1110 (doi: 10.1152/ajprenal.00568.2017).


