Внезапная сердечная смерть вследствие надпочечниковой недостаточности под маской синдрома Бругада. Клинический случай
Автор: Кижватова Н.В., Чумаченко Н.В., Головина Г.А., Гордеева Е.В., Космачева Е.Д.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Клинический случай
Статья в выпуске: 3, 2024 года.
Бесплатный доступ
Внезапная сердечная смерть у молодых в 20 % случаев обусловлена кардиомиопатиями и каналопатиями. Одна из форм каналопатий - синдром Бругада - наследственное заболевание, характеризующееся подъемом сегмента ST в правых прекардиальных отведениях (V1-V3) и повышенным риском внезапной сердечной смерти при отсутствии структурного заболевания сердца. Известны и фенокопии Бругада - клинические ситуации, которые проявляются паттернами электрокардиограммы (ЭКГ), идентичными таковым при истинном синдроме Бругада, но вызываются различными клиническими обстоятельствами. Они образуют группу гетерогенных состояний, которые нередко трудно отличить от истинного врожденного синдрома Бругада из-за идентичных паттернов ЭКГ. Формирование фенокопии Бругада вследствие гиперкалиемии представлено в литературе при различных состояниях: при почечной недостаточности, после обширной травмы, при использовании лекарственных препаратов. В статье представлен клинический случай, демонстрирующий редкую причину внезапной остановки сердца у молодого пациента без сердечно-сосудистой патологии в анамнезе: возникновение паттерна Бругада на ЭКГ вследствие тяжелой гиперкалиемии при надпочечниковой недостаточности. Описаны этапы дифференциально-диагностического поиска, позволившие верифицировать окончательный диагноз и назначить эффективную гормонозаместительную терапию. Выполнение провокационной пробы с новоканамидом позволило утвердиться в наличии у пациента фенокопии, а не синдрома Бругада. Дифференциальная диагностика фенокопий синдрома Бругада - ряда зачастую жизнеугрожающих кардиологических и не кардиологических заболеваний и состояний, проявляющихся сходными изменениями ЭКГ в виде своеобразного подъема сегмента ST в отведениях V1-V3, часто является непростой задачей. Этот случай представляет фенокопию Бругада на фоне тяжелой гиперкалиемии с развитием остановки сердца из-за надпочечниковой недостаточности, которая разрешилась при коррекции электролитных нарушений и лечения основного заболевания. Представлены типичные ЭКГ: графика феномена Бругада, гиперкалиемии, синусоидальная кривая при остановке сердца, зарегистрированные в динамике у пациента, разъяснены патогенетические механизмы, обуславливающие формирование паттерна Бругада при надпочечниковой недостаточности.
Фенокопия бругада, гиперкалиемия, внезапная сердечная смерть, надпочечниковая недостаточность, клинический случай
Короткий адрес: https://sciup.org/143183523
IDR: 143183523 | УДК: 616.12-008.1-072.7 | DOI: 10.38109/2225-1685-2024-3-74-80
Текст научной статьи Внезапная сердечная смерть вследствие надпочечниковой недостаточности под маской синдрома Бругада. Клинический случай
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike»/ «Атрибуция-Не-коммерчески-СохранениеУсловий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт: by-nc-sa/4.0/
CASE REPORT
Я Check for updates
*Nataliya V. Kijvatova1,2, Natalya V. Chumachenko1, Galina A. Golovina1, Helen V. Gordeeva1,2, Helen D. Kosmacheva1,2
SUDDEN CARDIAC DEATH DUE TO ADRENAL INSUFFICIENCY MASQUERADING AS BRUGADA SYNDROME. CASE REPORT
1RESEARCH Institute — Ochapovsky Regional Hospital no. 1, 1 May st., 167, Krasnodar 350086, Krasnodar region, Russian Federation;
2KUBAN State Medical University, st. named after Mitrofan Sedin, 4, Krasnodar 350063, Krasnodar region, Russian Federation.
Galina A. Golovina , Cand. Sci. (Med.), Cardiologist, Cardiology Department no. 3, Research Institute — Ochapovsky Regional Hospital no. 1, Krasnodar, Russian Federation, ORCID: 0000-0002-4866-0345
Helen V. Gordeeva , Cand. Sci. (Med.), Cardiologist, Research Institute — Ochapovsky Regional Hospital no. 1; Associate Professor, the Department of Therapy no.
Conflict of interest. The authors declare no conflict of interest.
Funding. The work was carried out without attracting additional funding from third parties.
Authors' contributions. All authors confirm the compliance of their authorship according to the international ICMJE criteria. CRediT author statement: Kijvatova N.V. – patient management at the stage of inpatient treatment, case description, literature search, editorial changes; Chumachenko N.V. – material analysis, editorial corrections; Golovina G.A. – dynamic observation and examination of the patient, performing a pharmacological invasive test; Gordeeva H.V. – literature search and analysis, editorial changes; Kosmacheva H.D. – final examination of the work. All authors have read and approved the final version of the article prior to publication, agree to be accountable for all aspects of the work, and warrant that questions related to the accuracy and integrity of all parts of the work have been appropriately reviewed and resolved by them.
И KIJNAT@YANDEX.RU
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
АКТУАЛЬНОСТЬ
Внезапная сердечная смерть (ВСС) является ведущей причиной смертности в западных странах (около 15-20%), а также наиболее частой причиной летальных исходов при сердечно-сосудистых заболеваниях [1]. На основании статистических данных, полученных в различных исследованиях, в 80% всех случаев основным этиологическим фактором, влекущим за собой ВСС, является ишемическая болезнь сердца. Остальные 20% составляют различные кардиомиопатии и каналопатии [2]. Последние, в свою очередь, вносят значимый вклад в структуру ВСС у молодых.
Одна из форм каналопатий – синдром Бругада – наследственное заболевание, характеризующееся подъемом сегмента ST в правых прекардиальных отведениях (V1-V3) и повышенным риском ВСС при отсутствии структурного заболевания сердца.
Известны и фенокопии Бругада – клинические ситуации, которые проявляются паттернами электрокардиограммы (ЭКГ), идентичными таковым при истинном синдроме Бругада, но вызываются различными клиническими обстоятельствами. Они образуют группу гетерогенных состояний, которые нередко трудно отличить от истинного врожденного синдрома Бругада из-за идентичных паттернов ЭКГ [3].
Мы представляем клинический случай, демонстрирующий редкую причину внезапной остановки сердца у молодого пациента без сердечно-сосудистой патологии в анамнезе: возникновение паттерна Бругада на ЭКГ вследствие тяжелой гиперкалиемии при надпочечниковой недостаточности.
КЛИНИЧЕСКИЙ СЛУЧАЙ
В приемное отделение бригадой скорой медицинской помощи (СМП) транспортирован мужчина 36 лет в крайне тяжелом состоянии, перенесший часом ранее успешные реанимационные мероприятия. Из сопроводительного листа и со слов сотрудников бригады СМП стало известно, что 1 день назад мужчина отмечал изменение самочувствия («будто простудился»), а на следующий день состояние резко ухудшилось: появилась выраженная слабость, по поводу которой он вызвал бригаду СМП. Во время осмотра фельдшерами СМП выявлена выраженная гипотония (80/55 мм рт. ст.), сопровождающаяся рвотой с кровью, угнетением сознания, затем у пациента произошла остановка сердечной деятельности. Зарегистрирована ЭКГ, представленная на рисунке 1 (скорость 25 мм/с, масштаб 10 мм/мВ).
Проведены реанимационные мероприятия с восстановлением синусового ритма, последующей стабилизацией состояния и доставкой в приемное отделение стационара.
При поступлении пациент находился в состоянии сопора, артериальное давление на руках составляло 103/71 мм рт. ст. на фоне инфузии норадреналина 0,8 мкг/кг/мин, сохранялся синусовый ритм с частотой сердечный сокращений 132 ударов в минуту. В связи с тяжестью состояния и отсутствием самостоятельного адекватного дыхания был переведен на искусственную вентиляцию легких. При аускультации выслушивалось жесткое дыхание, сухие низкотембровые хрипы в базальных отделах легких.
В первые часы госпитализации у пациента дважды возникала фибрилляция желудочков, удавалось восстанавливать синусовый ритм (рис. 2).
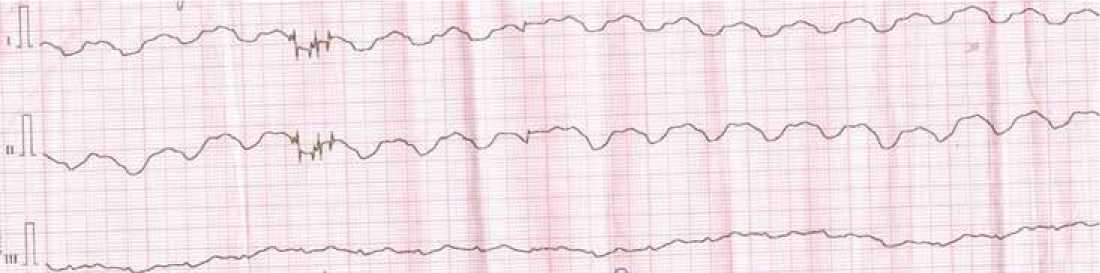
Рисунок 1. Электрокардиограмма пациента при первичном контакте со службой скорой медицинской помощи [составлено авторами] Figure 1. Electrocardiogram of the patient during initial contact with the emergency medical service [compiled by the authors]
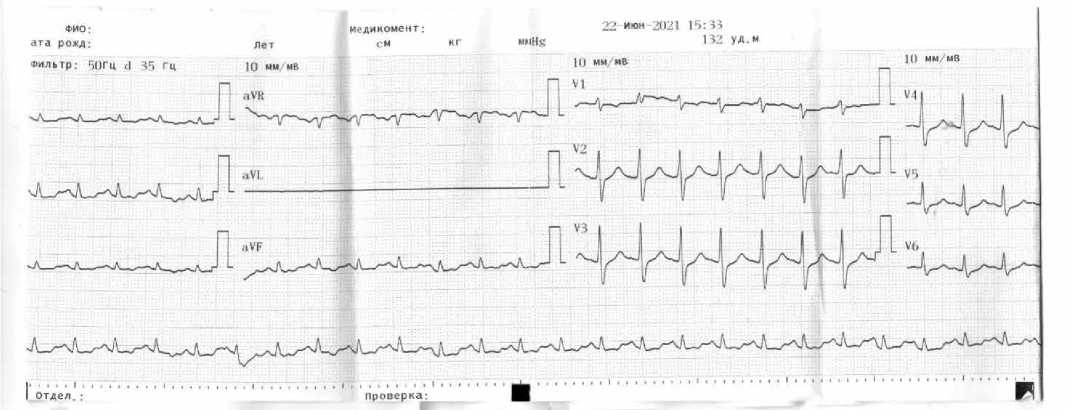
Рисунок 2. Электрокардиограмма пациента после восстановления синусового ритма [составлено авторами]
Figure 2. Electrocardiogram of a patient after restoration of sinus rhythm [compiled by the authors]
76 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 3, 2024
Для установления диагноза было выполнено лабораторное (табл. 1) и инструментальное исследование.
Инструментальная диагностика
Фиброгастродуоденоскопия: недостаточность кардии. Геморрагическая гастропатия.
Фибробронхоскопия: признаки аспирации. Проведена санация.
Компьютерная томография (КТ) («пан-КТ»): очагового и объемного поражения головного мозга не выявлено. Содержимое в бронхах нижних долей, S2 справа. КТ-картина инфильтративных изменений в нижних долях обоих легких, S2 справа более вероятно аспирационного генеза. Патологических изменений в брюшной полости, забрюшинном пространстве не выявлено.
Эхокардиграфия: снижение общей сократимости миокарда левого желудочка (фракция выброса по SIMPSON 46%), дилатация полости левого предсердия.
Было предположено, что состояние пациента обусловлено отравлением неизвестным веществом, диагностирована аспирационная пневмония. Был забран биоматериал на токсины и наркотические вещества, при лечении в реанимационном отделении проводилась гемодинамическая поддержка (норадреналин, кристаллоидные растворы), антибактериальная и антитромботическая терапия.
За время нахождения в отделении реанимации вскоре после поступления была записана еще одна ЭКГ (рис. 3), на которой в отведениях V1-V2 имелись четкие ЭКГ признаки Бругада-паттер-на, однако эти данные не были приняты во внимание.
Таблица 1. Результаты лабораторной диагностики [составлена авторами]
Table 1. Laboratory diagnostic results [compiled by the authors]
|
Показатель |
Значение |
Референсный интервал |
|
Лейкоциты, 10 9 /л |
10,60 |
4,00-9,00 |
|
Эритроциты, 10 12 /л |
3,80 |
4,00-6,00 |
|
Гемоглобин, г/л |
105 |
130-160 |
|
АЛТ, ед/л |
49,0 |
10,0-49,0 |
|
АСТ, ед/л |
49,0 |
4,0-34,0 |
|
Альфа-Амилаза, ед/л |
144,00 |
22,00-100,00 |
|
Билирубин общий, мкмоль/л |
14,60 |
1,70-21,00 |
|
Мочевина, ммоль/л |
18,80 |
2,00-8,30 |
|
Креатинин, мкмоль/л |
175,00 |
44,00-115,00 |
|
Глюкоза, ммоль/л |
14,60 |
3,90-6,40 |
|
Калий, ммоль/л |
5,67 |
3,3-5,5 |
|
Креатинкиназа, ед/л |
222,0 |
<200,0 |
|
Креатинкиназа-МВ, ед/л |
25,79 |
<25,00 |
|
Тропонин I, нг/мл |
0,004 |
0,000-0,040 |
Примечание/ Note: АЛТ – аланинаминотрансфераза (ALT – alanine aminotransferase), АСТ – аспартатаминотрансфераза (AST – aspartate aminotransferase)
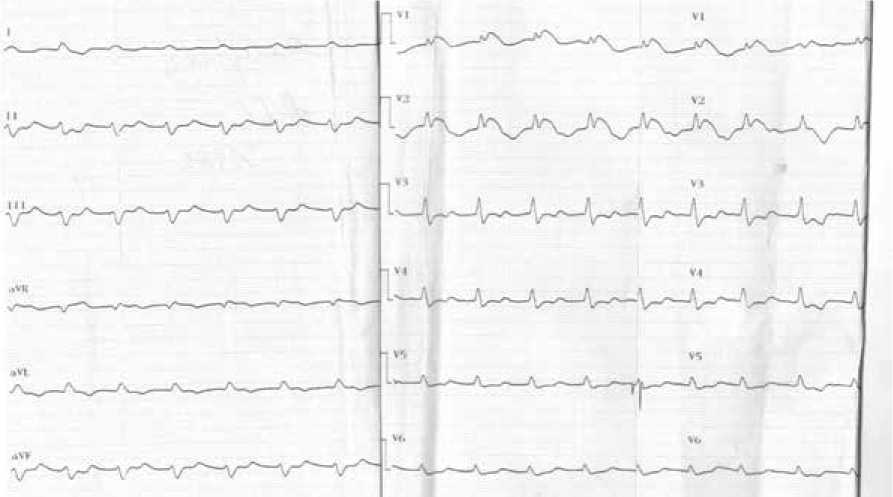
Рисунок 3. Электрокардиограмма пациента при появлении Бругада-паттерна [составлено авторами]
Figure 3. Electrocardiogram of the patient when the Brugada pattern appears [compiled by the authors]
EURASIAN HEART JOURNAL, 3, 2024 77
Спустя сутки фиксировалась отрицательная динамика лабораторных данных (табл. 2). На ЭКГ при этом сохранялась элевация сегмента ST в V1-V2 по типу «щит и меч» (рис. 4). Регистрация ЭКГ, представленных на рисунках 2-4, проводилась со скоростью 25 мм/с, масштаб 10 мм/мВ, применялся режектор-ный фильтр 50 Гц.
В связи с тяжелой гиперкалиемией, которая была расценена как проявление острого повреждения почек, пациенту был проведен гемодиализ. Токсических веществ и наркотиков в крови не было выявлено.
Учитывая ЭКГ-данные, рецидивирующие остановки сердца, был установлен диагноз основного заболевания: Полная форма синдрома Бругада (Бругада-паттерн I типа на ЭКГ). Рецидивирующая фибрилляция желудочков.
Перед кардиологами был поставлен вопрос об определении показаний к установке кардиовертера-дефибриллятора.
На 2 сутки пациент был экстубирован, но сохранялась стойкая гипотония, а попытки снизить дозу получаемых вазопрессорных препаратов были безуспешны. Было высказано предположение о наличии у пациента надпочечниковой недостаточности. Для
Таблица 2. Картина лабораторных данных пациента на 2 сутки после эпизода внезапной остановки сердца [составлено авторами]
Table 2. Patient's laboratory data on day 2 after the episode of sudden cardiac arrest [compiled by the authors]
|
Показатель |
Значение |
Референсный интервал |
|
Лейкоциты, 10 9 /л |
26,36 |
4,00-9,00 |
|
Эритроциты, 10 12 /л |
2,69 |
4,00-6,00 |
|
Гемоглобин, г/л |
79 |
130-160 |
|
Гематокрит, % |
23,10 |
40,00-48,00 |
|
Мочевина, ммоль/л |
16,90 |
2,00-8,30 |
|
Креатинин, мкмоль/л |
155,90 |
44,00-115,00 |
|
Калий, ммоль/л |
7,25 |
3,3-5,5 |
|
Креатинкиназа, ед/л |
1633,0 |
<200,0 |
|
Креатинкиназа-МВ, ед/л |
44,85 |
<25,00 |
|
С-реактивный белок, мг/л |
46,40 |
<8,00 |
|
D-димер, нг/мл |
1880,00 |
<243,00 |
|
Тропонин I, нг/мл |
12,867 |
0,000-0,040 |
Примечание/ Note: АЛТ – аланинаминотрансфераза (ALT – alanine aminotransferase), АСТ – аспартатаминотрансфераза (AST – aspartate aminotransferase)
Таблица 3. Лабораторная диагностика эндокринного статуса пациента [составлено авторами]
Table 3. Laboratory diagnosis of the patient’s endocrine status [compiled by the authors]
|
Показатель |
Значение |
Референсный интервал |
|
Адренокортикотропный гормон, пг/мл |
53,50 |
<46,00 |
|
Тиреотропный гормон, мкМЕ/мл |
11,11 |
0,35-4,50 |
|
Кортизол, нмоль/л |
<13,79 |
85,3-456,6 |
|
Дегидроэпиндростерон-сульфат, мкг/дл |
<15,0 |
80,0-560,0 |
|
Альдостерон, пк/мл |
1,36 |
10,00-160,00 |
|
Ренин, пк/мл |
111,72 |
3,30-31,71 |
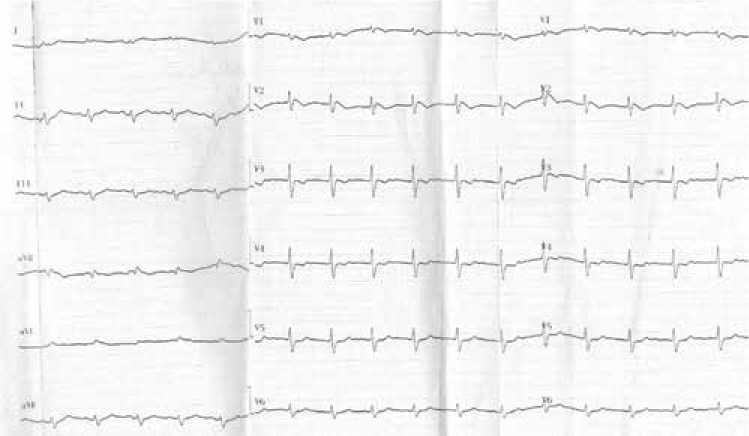
Рисунок 4. Электрокардиограмма пациента на 2 сутки после госпитализации [составлено авторами]
Figure 4. Electrocardiogram of the patient on day 2 after hospitalization [compiled by the authors]
78 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 3, 2024
верификации диагноза изучены уровни кортизола, адренокор-тикотропоного гормона, альдостерона (табл. 3), выполнена КТ надпочечников.
КТ: Надпочечники истончены – тело и ветви до 2-3 мм, переднезадний размер уменьшен до 14 мм.
На основании вышеперечисленных исследований диагноз был изменен: «Впервые выявленная надпочечниковая недостаточность», назначено лечение: гидрокортизон 200 мг в течение суток, затем – преднизолон 90 мг в сутки внутривенно с постепенным переходом на пероральный прием.
На фоне проводимой терапии нормализовались показатели электролитного обмена, постепенно стабилизировалась гемодинамика пациента, удалось снизить дозу вводимых вазопрессорных препаратов. На кардиограммах паттерн Бругада больше не регистрировался, никаких нарушений ритма не наблюдалось. Сформулирован заключительный клинический диагноз:
Основное заболевание: Хроническая надпочечниковая недостаточность, впервые выявленная.
Осложнения заболевания: Бругадоподобный синдром, обусловленный гиперкалиемией. Рецидивирующая фибрилляция желудочков. Острое повреждение почек I ст. (классификация AKIN). Ургентный гемодиализ.
Сопутствующие заболевания: Стресс-индуцированная гипергликемия. Двусторонняя аспирационная пневмония, средней степени тяжести. Геморрагическая гастропатия. Анемия средней степени тяжести, корригированная гемотрансфузией.
Для дальнейшего лечения больной был переведен в отделение эндокринологии, откуда выписался через 5 дней в удовлетворительном состоянии. Было рекомендовано продолжить прием гидрокортизона 10 мг 2 раза в день, флудрокортизона 0,05 мг в сутки.
Через 3 месяца пациенту была выполнена провокационная проба с блокатором натриевых каналов новокаинамидом, при которой не был индуцирован ЭКГ-паттерн 1-го типа, что позволило обоснованно исключить синдром Бругада.
ОБСУЖДЕНИЕ
Нами описан непростой путь диагностики в сложной клинической ситуации. Дебют надпочечниковой недостаточности с остановкой сердца встречается во врачебной практике крайне редко, нам удалось обнаружить лишь единичные публикации [4, 5, 6]. Хорошо известно, что недостаточность надпочечников может оставаться клинически бессимптомной до тех пор, пока не произойдет острая декомпенсация функции надпочечников (надпочечниковый криз) и пациент не умрет внезапно. Существенное, более чем 90% снижение функции коры обоих надпочечников приводит к снижению уровня минерало- и глюкокортикоидов и может послужить причиной внезапной смерти [5]. К смерти может приводить гипонатриемия, дефицит альдостерона, как причина отека головного мозга и легких, а также гиперкалиемия. При умеренной гиперкалиемии клеточная мембрана частично деполяризуется, приближая потенциал покоя к пороговому потенциалу для инициации потенциала действия. Поэтому быстрые натриевые каналы активируются легче, повышая возбудимость и скорость проводимости. На ЭКГ данный электрофизиологический феномен проявляется высокими заостренными зубцами Т, когда масса желудочковых кардиомиоцитов подвергается синхронной ранней реполяризации. На рисунке 2 можно видеть заостренный зубец Т в грудных отведениях. При тяжелой гиперкалиемии потенциал зависимая инактивация каналов Na и активация калиевых каналов приводят к снижению скорости проводимости, что может сделать клетки невосприимчивыми к возбуждению. Это проявляется уширением ЭКГ-комплексов и/или блокадой прово- димости. На ЭКГ при этом формируется типичная синусообразная кривая (рис. 1), клинически проявляющаяся остановкой сердца, также может возникать фибрилляция желудочков.
Особенностью представленного клинического случая явилось формирование вследствие гиперкалиемии фенокопии Бругада. Высокий уровень калия вызывает отсроченную деполяризацию, что приводит к подъему сегмента ST в переднеперегородочной области ЭКГ с преобладанием паттерна Бругада 1 типа. Это относительно новое понятие является клиническим феноменом, при котором ЭКГ-графика идентична истинному синдрому Бругада, но причиной формирования данного паттерна являются различные факторы, как кардиальные, так и некардиальные, они обычно имеют преходящий характер: метаболические состояния, механическое сдавление, ишемия миокарда и легочная эмболия, заболевания миокарда и перикарда и прочие причины [7, 8]. Предложены диагностические критерии для дифференциальной диагностики фенокопии и синдрома Бругада. В нашем клиническом случае в пользу фенокопии свидетельствовали следующие позиции: ЭКГ-паттерн соответствовал типу 1 при синдроме Бругада; было диагностировано основное заболевание- надпочечниковая недостаточность с тяжелой гиперкалиемией; после нормализации уровня калия Бругада-паттерн исчез; у пациента не было личного и семейного анамнеза жизнеугрожающих нарушений ритма и внезапной смерти.
Формирование фенокопии Бругада вследствие гиперкалиемии представлено при различных состояниях: при почечной недостаточности, после обширной травмы, при использовании лекарственных препаратов [9, 10, 11, 12]. Описания фенокопии синдрома Бругада при надпочечниковой недостаточности не являются единичными [13, 14, 15, 16]. В частности, авторы из университета Иллинойса [16] представили аналогичную клиническую ситуацию: госпитализация молодого пациента была обусловлена синкопальным состоянием, с регистрацией на ЭКГ Бругада паттерна с последующей диагностикой надпочечниковой недостаточности.
ЗАКЛЮЧЕНИЕ
Выраженные электролитные нарушения различной этиологии с тяжелой гиперкалиемией могут приводить к внезапной сердечной смерти, при этом возможно формирование фенокопии Бру-гада. Своевременная и точная диагностика с выявлением причины электролитного дисбаланса позволит избежать принятия неверного решения о тактике лечения пациента.
Список литературы Внезапная сердечная смерть вследствие надпочечниковой недостаточности под маской синдрома Бругада. Клинический случай
- Wong C.X., Brown A., Lau D.H. et al. Epidemiology of Sudden Cardiac Death: Global and Regional Perspectives. Heart Lung Circ. 2019 Jan;28(1):6-14. https://doi.org/10.1016/j.hlc.2018.08.026
- Magi S., Lariccia V., Maiolino M. et al. Sudden cardiac death: focus on the genetics of channelopathies and cardiomyopathies. J Biomed Sci. 2017 Aug 15;24(1):56. https://doi.org/10.1186/s12929-017-0364-6
- De Oliveira Neto N.R., de Oliveira W.S., Mastrocola F. et al. Brugada phenocopy: Mechanisms, diagnosis, and implications. J Electrocardiol. 2019 Jul-Aug;55:45-50. https://doi.org/10.1016/j.jelectrocard.2019.04.017
- Krug J.J. Cardiac arrest secondary to Addison's disease. Annals of Emergency Medicine 1986, 15(6):735-737. https://doi.org/10.1016/s0196-0644(86)80438-3
- Visonà S.D., Tajana L., Osculati A. Clinical Management of Adrenal Tumors. Eds. Lew J. USA: BoD, 2017. P 137-157. ISBN: 978-953-51-4798-5. https://doi.org/10.5772/intechopen.69416
- Burke M.P., Opeskin K. Adrenocortical insufficiency. Am J Forensic Med Pathol. 1999 Mar;20(1):60-5. https://doi.org/10.1097/00000433-199903000-00015
- Anselm D., Evans J., Baranchuk A. Brugada phenocopy: A new electrocardiogram phenomenon. World J. Cardiol. 2014 Mar 26,6(3):81-86. https://doi.org/10.4330/wjc.v6.i3.81
- Baranchuk A., Nguyen T., Ryu M.H. et al. Brugada phenocopy: new terminology and proposed classification. Ann Noninvasive Electrocardiol. 2012;17(4):299-314. https://doi.org/10.1111/j.1542-474X.2012.00525.x
- Kurisu S., Inoue I., Kawagoe T. Brugada-like electrocardiographic pattern due to hyperkalemia. Clin Cardiol. 2009 Jul;32(7):E23. https://doi.org/10.1002/clc.20274
- Manne J.R., Garg J. Hyperkalemia induced Brugada phenocopy. J Arrhythmia. 2021;37:249-250. https://doi.org/10.1002/joa3.12498
- Ameen M., Akbar G., Abbas N., Mirrani G. Hyperkalemia Induced Brugada Phenocopy: A Rare ECG Manifestation. Case Rep Cardiol. 2017;2017:9464728. https://doi.org/10.1155/2017/9464728
- Maheshwari A., Von Wald L., Krishnan B. et al. Hyperkalemia-Induced Brugada Phenocopy. JACC Clin Electrophysiol. 2017 Sep, 3(9):1058-1059. https://doi.org/10.1016/j.jacep.2016.12.012
- Iorgoveanu C., Zaghloul A., Desai A. et al. A Case of Brugada Pattern Associated with Adrenal Insufficiency. Cureus. 2018 Jun 6;10(6):e2752. https://doi.org/10.7759/cureus.2752
- Dogan M., Ertem A., Cimen T. et al. Type-1 Brugada-like ECG pattern induced by adrenal crisis. Herz. 2015 Apr;40(2):304-6. https://doi.org/10.1007/s00059-013-3983-z
- Kim A., Valdez C., Alarcon T. et al. A Case of Brugada Phenocopy in Adrenal Insufficiency-Related Pericarditis. Southwest J Pulm Crit Care Sleep. 2022;25(2):25-29. https://doi.org/10.13175/swjpccs033-22
- Amusina O., Mehta S., Nelson M.E. Brugada phenocopy secondary to hyperkalemia and hyponatremia in primary adrenal insufficiency. J Am Coll Emerg Physicians Open. 2022 Aug 10;3(4):e12800. https://doi.org/10.1002/emp2.12800


